Diabetes Mellitus Neonatal Transitoria por duplicación paterna 6q24
Juan Javier Lammoglia, Nancy Unanue, Diego Sacaquirín, Verónica Peña, Ethel Codner.
Transient Neonatal Mellitus Diabetes due to paternal duplication 6q24
Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile. Servicio de Neonatología Hospital San Borja Arriarán y Escuela de Medicina. Universidad de Chile.
Correspondencia a: Dra Ethel Codner. Instituto de Investigaciones Materno Infantil (I.D.I.M.I.). Escuela de Medicina, Universidad de Chile, Casilla 226-3. Santiago. Chile. Telefono: 562-424 82 80 -562 Fax:424 72 40. Email: ecodner@med.uchile.cl
Recibido el 10 de septiembre , 2007.
Aceptado el 16 de octubre, 2007.
Neonatal diabetes mellitus is defined as severe hyperglycemia beginning during the first six months of life, lasting at least one month and needing insulin as a treatment. The incidence is about 1 in 200.000 born alive. We report a preterm female newborn, small for gestational age, whose actual age is 19 months. At the third day of life she became severely ill, with serious shock, losing 20% of her weight at birth. Laboratory work-up showed a blood glucose level of 633 mg/dl, hypernatremia, metabolic acidosis and renal failure. During the initial 4 months she was treated with insulin infusions that were tapered and finally discontinued at four months of age. The molecular study of this patient showed abnormal maternal methylation at chromosome 6 and the novo paternal duplication of 6q24.
(Key words: Diabetes; Neonatal; Manifestation; Insulin; Imprinting)
Introducción
La diabetes mellitus neonatal (DMN) se define como la aparición de hiperglicemia en el transcurso de los primeros 6 meses de vida, la que debe persistir durante al menos un mes y requerir insulina como tratamiento. Su incidencia es de de 1 en 200.000 recién nacidos vivos1. El cuadro clínico se caracteriza por pérdida de peso y deshidratación grave. Frecuentemente existe el antecedente de retraso de crecimiento intrauterino. El laboratorio certifica la hiperglicemia e hipernatremia, ambas de gran magnitud, que no revierten hasta que el paciente es tratado con insulina e hidratación adecuada2,4.
La diabetes neonatal puede presentarse bajo una forma de evolución transitoria y otra de carácter permanente. La forma transitoria (DMNT), en que se logra suspender la insulina en el transcurso del primer año de vida2,4, es la más frecuente y corresponde al 60% de los casos. La mayor parte de los casos de DMNT se debe a alteraciones en el cromosoma 6q24. En los sujetos sanos esta región está metilada en los alelos provenientes de la madre y, por lo tanto, sólo se expresan los genes del cromosoma paterno. En la DMNT asociada a alteraciones del cromosoma 6 existe sobreexpresión del DNA proveniente del alelo paterno, lo que puede ocurrir por duplicación del cromosoma paterno por isodisomía uniparental, en que ambos alelos fueron heredados del padre, o por defectos en la metilación del alelo materno.
Otras formas de DMNT se deben a mutaciones activantes en el gen ABCC8, localizado en el cromosoma 11p15.1 que codifica para el receptor de sulfonilurea (SUR1). Una tercera forma de DMNT es causada por mutaciones en el gen KCNJ11 que codifica para la subunidad Kir6.2 del canal de potasio, también localizado en el cromosoma 11p15.15,6. Estos dos últimos genes forman parte del canal de potasio sensible al ATP presente en la célula B pancreática, regulador clave en la liberación de insulina.
El objetivo de este trabajo es presentar las características clínicas y el manejo con insulina hasta el retiro gradual de ésta en un recién nacido con diabetes neonatal transitoria, en quien se confirmó una duplicación 6q24 de novo.
Caso Clínico
Recién nacido femenino prematuro de 35 semanas y pequeño para la edad gestacional (peso: 1.860g y talla: 43 cm), que al tercer día de vida presentó shock profundo por deshidratación grave con pérdida del 20% de su peso de nacimiento. El laboratorio mostró glicemia de 633 mg/dL; sodio de 180 meq/lL; acidosis metabólica con pH 7,18; bicarbonato 7,1 meq/L y elevación de creatinina a 1,4 mg/dL. Al examen físico destacaba hipotonía importante, pobre conexión con el medio, hernia umbilical, macroglosia con leve anteversión de las narinas y puente nasal deprimido.
Se inició corrección de la deshidratación con suero salino normal y la hiperglicemia con infusión de insulina en goteo (0,1 U/kg/h) que debió aumentarse hasta 0,14 U/kg/h. Luego de 36 horas de tratamiento se logró la estabilización de la paciente, pero presentó como complicación asociada, desde el inicio, insuficiencia renal poliúrica, que hizo difícil el cálculo de aportes de líquidos, de los requerimientos de glucosa, electrolitos e insulina, especialmente en los primeros días.
La paciente requirió insulina endovenosa durante 4 semanas. Durante las dos primeras semanas de vida permaneció en régimen cero y nutrición parenteral por el riesgo de enterocolitis necrosante (riesgo mayor por shock prolongado y prematurez con retardo marcado del crecimiento intrauterino). Posteriormente comenzó con alimentación enteral continua en forma progesiva, hasta suspender la parenteral. Durante el período en que recibió insulina endovenosa (0,001 a 0,02 U/kg/h) existió gran inestabilidad en la glicemia. Se buscaron diferentes formas de mejorar la estabilidad glicérica, tales como cambiar cada 6 horas la mezcla de insulina y lavar todo el equipo de infusión con la mezcla a infundir durante 5 minutos, para saturar con insulina el polivinilo de los equipos7.
La paciente inició alimentación por bolos orales a los dos meses de vida con un peso de 2 kilogramos. En ese momento se cambió a tres dosis diarias de insulina NPH diluida al 5% (Diluyente para Insulina Lilly Pharmaceutical) e insulina cristalina, diluida al 5%, en solución salina normal aportada cada 3 horas antes de la alimentación (0,1 -0,25 U).
Las aplicaciones de NPH debieron repetirse progresivamente hasta ser cada 6 horas para lograr un control adecuado. Sin embargo, con este esquema, se observaron fluctuaciones importantes de la glicemia, por lo que se cambió a insulina glargina. El tratamiento con este análogo basal resultó exitoso con una dosis de 0,5 U subcutáneas c/8h y permitió el alta del servicio de Neonatología a las 10 semanas de vida. La paciente evolucionó satisfactoriamente en su casa sin necesidad de refuerzos de insulina ultrarrápida, manteniendo un muy buen control solamente con insulina glargina.
A los 3 meses de vida presentó episodios leves de hipoglicemia, por lo que se disminuyeron progresivamente las dosis de insulina, permitiendo aumentar el intervalo entre las aplicaciones, hasta que la insulina fue suspendida a los 4 meses de vida. La hemoglobina glicosilada HbA1c fue 6,8% (VN: 4,5% - 5,4%)8,10.
La paciente actualmente tiene 17 meses de vida y ha mostrado crecimiento y desarrollo psicomotor normal. Presenta ocasionalmente episodios de hiperglicemia asociados a cuadros febriles, los cuales se tratan con insulina glargina en dosis de 0,5 U/día, por uno o dos días. Durante este período se ha continuado el control ambulatorio de glicemia capilar una vez al día. La HbA1c a los 9 meses de vida fue 5,1% y la actual es 4,6%.
El estudio molecular por metilación específica por PCR11 mostró disminución de la metilación de DNA materno y una duplicación del cromosoma paterno en la región 6q24, confirmando que la etiología en este caso corresponde a una DMNT por duplicación 6q24. Esta alteración no estaba presente en los padres, confirmando el carácter de novo de la duplicación en este cromosoma. Los estudios por secuenciación de los genes ABCC8 y KCNJ11 resultaron normales.
Discusión
Se comunica el caso de un paciente con DMNT que se presentó con un cuadro grave, de inicio precoz, con alteraciones fenotípicas y remisión a los 4 meses, elementos característicos de las alteraciones del cromosoma 6. Aunque el tratamiento con insulina se suspendió a los pocos meses, el cuadro puede recidivar durante la pubertad o a edad adulta. Por ello, estos pacientes deben ser controlados durante toda su vida y especialmente durante el embarazo.
En 1995 se describieron las alteraciones moleculares responsables de los casos de DMN. En la forma asociada a alteraciones del cromosoma 6 frecuentemente se observa: macroglosia, narinas antevertidas, hernia umbilical, muy bajo peso al nacer, inicio temprano y grave del cuadro con altos requerimientos iniciales de insulina (Tabla 1). La evolución presentada, con suspensión de la insulina a los cuatro meses de vida, confirmó el diagnóstico de DMNT.
El estudio genético confirmó una alteración en la región 6q24. Normalmente en esta zona existe expresión del alelo paterno y silencio del alelo materno por imprinting; este consiste en que los genes tienen diferente expresión según si el alelo proviene de la madre o del padre. La sobreexpresión de genes del alelo paterno, que se produce en la DMNT por alteración de la región 6q24, conduce a un menor número de células beta, afectando negativamente la secreción de insulina (Figura 1). Uno de estos genes, ZAC (asociado a proteínas en dedos de Zinc), participa en la regulación de la apoptosis de las células ß del páncreas y su mayor expresión incrementa la tasa de muerte celular en el páncreas durante el desarrollo fetal. Además, participa directamente en la regulación de la secreción de insulina determinando menor secreción de ella.
Alteraciones en estos genes producen insulinopenia, que en la vida fetal se manifiesta como restricción del crecimiento intrauterino y, después del nacimiento, como DMNT. Posteriormente, durante el transcurso del primer año de vida, aumenta el número total de células ß, aunque no así la secreción de insulina de cada una de ellas, logrando satisfacer los requerimientos de insulina y explicando la característica fase de remisión del cuadro (Figura 1). Aunque haya remisión, la evolución a largo plazo indica que la deficiencia en la secreción de insulina persiste en el tiempo y que la diabetes mellitus tiende a recidivar durante la adolescencia o el embarazo. Es frecuente que se observe intolerancia a los hidratos de carbono y, posteriormente, recidiva del cuadro de diabetes.
Este caso demuestra las grandes dificultades en el tratamiento con insulina en un niño tan pequeño. Aunque la única insulina de acción basal aprobada en esta edad es la NPH, se debió recurrir al tratamiento con insulina glargina. En otros centros estos pacientes se han tratado con bomba de infusión continua subcutánea.
Otra de las dificultades observadas fue la variabilidad glicémica asociada a un aporte endovenoso de insulina a concentración baja y con lento flujo de administración. Esto hace que la insulina tienda a adherirse a las superficies plásticas de los catéteres, ocasionando oscilaciones en su tasa de entrega. Este problema fue manejado con cambios frecuentes de la mezcla a infundir. En conclusión, describimos una paciente con diabetes neonatal transitoria debido a una alteración 6q24, que presentó un coma hiperglicémico grave a los tres días de vida. Este caso ilustra las dificultades en el manejo insulínico en un paciente prematuro y pequeño para la edad gestacional y recalca la importancia del estudio molecular para contar con un diagnóstico y pronóstico adecuados.
En conclusión, describimos una paciente con diabetes neonatal transitoria debido a una alteración 6q24, que presentó un coma hiperglicémico grave a los tres días de vida. Este caso ilustra las dificultades en el manejo insulínico en un paciente prematuro y pequeño para la edad gestacional y recalca la importancia del estudio molecular para contar con un diagnóstico y pronóstico adecuados.
Tabla 1. Características clínicas de la Diabetes Mellitus Neonatal Transitoria y de la Diabetes Neonatal Permanente.
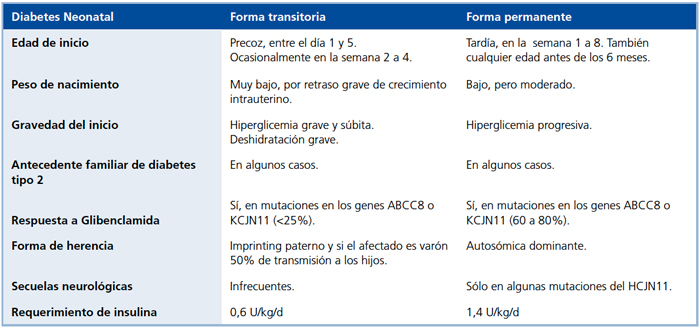
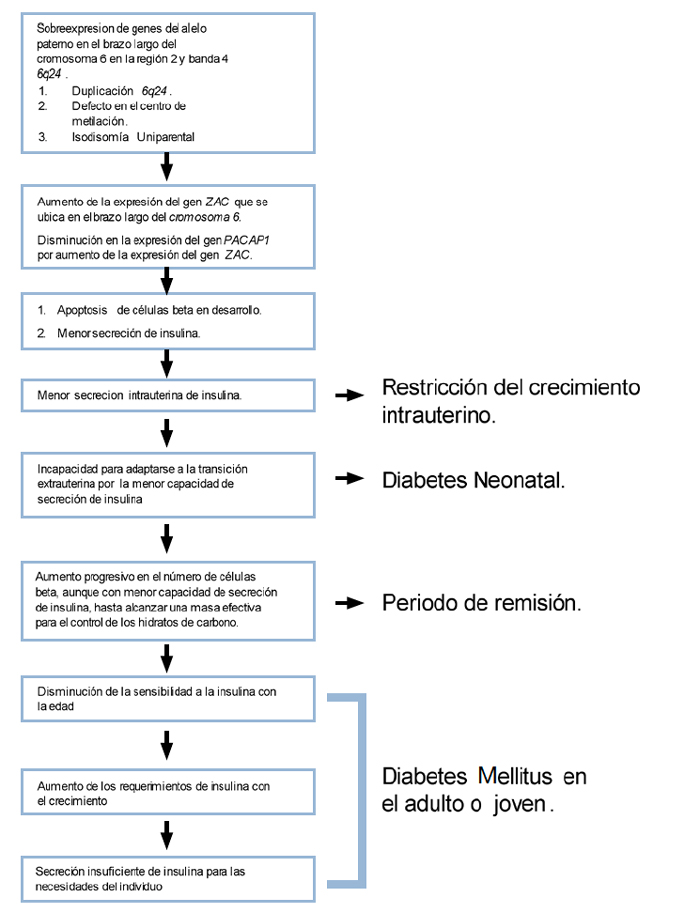
Figura 1. Secuencia fisiopatológica de hechos en la diabetes por alteración del 6q24.
Referencias
- Stanick J, Gasperikova D, Paskova M, Barak L, Jaborkova J, Jancova E, et al. 2007. Prevalence of permanent Neonatal Diabetes in Slovakia and successful replacement of insulin with sulfonylurea therapy in KCNJ11 and ABCC8 mutation carriers. J Clin Endocrinol and Metabolism. 92: 1276 . 1282.
- Polak M, Shield J. 2004. Neonatal and very early onset diabetes mellitus. 2003. Semin in Neonatol. (9): 59 . 65.
- Sperling MA. 2005. Neonatal diabetes mellitus: from understudy to center stage. Curr Opin in Pediatr. (1): 512 . 518.
- Hussain K, Cosgrove KE. 2005. From congenital hyperinsulinism to diabetes mellitus: the role of pancreatic ƒÀ-cell KATP channels. Pediatr Diabetes. (6): 103 . 113.
- Flanagan SE, Patch AM, Mackay DJ, Edghill EL, Gloyn AL, Robinson D, et al. 2007. Mutations in ATPSensitive K+ Channel Genes Cause Transient Neonatal Diabetes and Permanent Diabetes in Childhood or Adulthood. Diabetes. 56: 1930 - 1938.
- Gloyn AL, Pearson ER, Antcliff JF, Proks P, Bruining GJ, Slingerland AS, et al. 2004. Activating mutations in the gene encoding the ATPsensitive potassium .channel sbunit Kir6.2 and permanent neonatal Diabetes. N Engl J Med. 350: 1838 . 49.
- Hewson M, Nawadara V, Oliver J, Odgers C, Plummer J, Simmer K. 2000. Insulin infusions in the neonatal unit: Delivery variation due to adsorption. J Paedtr Child Health. 36: 216 . 220.
- Silverstein J, Klingensmith G, Copeland K, Plotnick L, Kauffman F, Laffel L, et al. 2005. Care of children and adolescents with type 1 diabetes: A statement of American Diabetes Asociation. Diabetes Care. 28: 186 . 212.
- Codner E, Flanagan SE, Ugarte F, Garcia H, Vidal T, Ellard S, Hatterslay AT. 2007. Sulfonylurea treatment in young children with neonatal diabetes: dealing with hyperglycemia, hypoglycemia and sick days. Diabetes Care. 2007. 28:28-9.
- Codner E, Flanagan SE, Ellard S, Garcia H, Hatterslay AT. 2005. High dose glibenclamide can replace insulin therapy despite transitory diarrhea in early-onset diabetes caused by novel R201L Kir 6.2 mutation. Diabetes Care. 28: 758-9.
- Temple IK, Gardner RJ, Robinson DO, Kibirige MS, Ferguson AW, Baum JD, et al. 1996. Further evidence for an imprinted gene for neonatal diabetes localised to chromosome 6q22-q23. Hum Mol Genet. 1996. 5(8) 117 . 1121.
Agradecimientos
Agradecemos a los doctores Andrew T Hattersley, Sian Ellard y Sarah E. Flanagan, del Institute of Biomedical Clinical Science, Peninsula Medical School, Exeter, UK, por el estudio molecular de los genes ABCC8 y KCNJ11. También agradecemos a los doctores Hilary Bullman y Deborah Mackay, University of Southhampton, UK, por el estudio del cromosoma 6. Además, nuestro reconocimiento al grupo de Neonatología que asumió las dificultades del crítico manejo metabólico, y a los miembros del equipo de Endocrinología y Genética del Hospital San Borja Arriarán; en especial, a nuestra enfermera educadora en diabetes Alejandra Ávila.