Tumor testicular por restos suprarrenales en un adolescente con hiperplasia suprarrenal congénita clásica. Revisión de su fiopatología e implicancias en fertilidad
Marcela Molina P¹, Carolina Martínez C², Andreína Cattani O¹, Cristián García B³, Alejandro Martínez A¹
Testicular adrenal rest tumors in a teenager
with classical congenital adrenal hyperplasia.
Report of one case
1Unidad de Endocrinología, Departamento de Pediatría, Facultad de Medicina.
2Departamento de Endocrinología, Facultad de Medicina.
3Departamento de Radiología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
Financiamiento: Este trabajo no tuvo financiamiento externo.
Conflictos de interés: Los autores declaran no tener conflictos de interés.
Correspondencia a:
Dr. Alejandro Martínez Aguayo.
E-mail: alemarti@med.puc.cl
Pontificia Universidad Católica de Chile, Santiago, Chile.
Teléfono: (56-2) 354-3402, Fax: (56-2) 638-4307.
Código postal: 8330074.
Recibido: 29 Agosto de 2008
Aceptado: 05 Diciembre de 2008
Testicular Adrenal Rest Tumors (TART) may play a role in fertility disturbances of patients with Classical Congenital Adrenal Hyperplasia (CAH). We report a 17 years old male with classical CAH, diagnosed in the newborn period due to a salt wasting crisis with dehydration and severe hyponatremia. He was treated with cortisol and fludrocortisone with a low adherence to therapy. He had a precocious puberty and accelerated bone age, and was treated with a luteinizing hormone releasing hormone (LHRH) analog during two years. At the age of 14 years, bilateral testicular masses were detected during the physical examination. Testicular color Doppler ultrasound showed the presence of TART. A new ultrasound at 17 years of age showed the persistence of adrenal rests and an abnormal testicular growth.
Key words: Congenital Adrenal Hyperplasia; Testicular Adrenal Rest Tumor and Infertility.
Introducción
La hiperplasia suprarrenal congénita (HSC) constituye un desorden con herencia autosómica recesiva debido a deficiencia de alguna de las 5 enzimas necesarias para la síntesis de cortisol en la corteza suprarrenal. En aproximadamente 90% de los casos es por deficiencia de 21 hidroxilasa. Esto altera la síntesis de cortisol, y en la mayoría de los casos, también la de aldosterona. Como consecuencia del déficit de cortisol aumenta la ACTH hipofisiaria, resultando en hiperplasia de la corteza suprarrenal y aumento de la producción de andrógenos. El exceso de andrógnos, en fetos femeninos produce virilización de los genitales externos, hecho que pasa desapercibido en neonatos de sexo masculino. En ambos sexos en etapa postnatal, además de la virilización, induce un rápido crecimiento lineal con aceleración de la edad ósea y consecuentemente talla baja en la edad adulta. El tratamiento de la HSC consiste en la sustitución de cortisol y aldosterona, y supresión de la producción excesiva de andrógenos1,2.
Los pacientes con HSC Clásica tienen menor fertilidad que la población normal, que se puede explicar por alteraciones funcionales y anatómicas. El exceso de andrógenos su-prarrenales3 puede producir supresión crónica de las gonadotrofinas, induciendo un hipogonadismo hipogo-nadotropo. Por otra parte, se ha observado la presencia de Restos Testiculares de Glándula Suprarrenal (RTGS) con prevalencia variable (0 a 94%), dependiendo de la población seleccionada y el método de detección. El desarrollo de la corteza suprarrenal primitiva ocurre cerca de las gónadas y los RTGS son considerados como tejido suprarrenal aberrante que ha descendido junto con las gónadas4. La presencia de RTGS se ha asociado a menor concentración de Inhibina B y AMH en niños y adolescentes5,6 y a menor fertilidad en adultos.
Comunicamos el caso de un adolescente de sexo masculino, con HSC Clásica que presenta tumores testiculares bila-terales compatible con restos adrenales. Describimos su evolución, analizando las teorías de origen de RTGS y las repercusiones sobre la función testicular e infertilidad.
Paciente y Métodos
Paciente
Paciente de sexo masculino, de 17 años, portador de HSC Clásica perdedora de sal, diagnosticada a los 28 días de vida por una deshidratación con hiponatremia grave (105 meq/L), hiperkalemia (7,5 meq/L), elevación de 17OH-Progesterona plasmática (> 100 ng/mL), de la actividad de renina plasmática (PRA > 20 ng/ml/h) y de testosterona (1.348 ng/dL). No tiene estudio molecular de mutación del CYP21. Una vez estabilizado de la crisis suprarrenal, continuó tratamiento con cortisol (10 a 15 mg/m2) y Fludrocortisona (0,15 mg/d).
A los 9 años se constata desarrollo de vello púbico Tanner II , volumen testicular de 4 mL, edad ósea (EO) de 13 años, Testosterona total de 59 ng/dL, ascenso de LH de 8 mUI/mL post estímulo con LHRH, diagnosticándose Pubertad Precoz Central, por lo que se agregó al tratamiento corticoidal, un análogo de LHRH durante 2 años.
A los 12 años una ecotomografía testicular, realizada en otro centro, demuestra testes de 4,9 cc, y no describen restos adrenales. A los 14 años, se solicita nueva ecografía testicular: Testículo derecho (TD) 6,3 cc; Testículo izquierdo (TI): 6,3 cc. En forma bilateral, adyacente a la región del mediastino testicular, se observan áreas hipoecogénicas, de contornos irregulares, lobuladas en el lado izquierdo, donde adquiere aspecto multinodular; miden 1,6 x 0,6 cm a derecha y 2,0 x 0,5 cm a izquierda. El estudio Doppler color demostró escaso flujo vascular en el espesor de estas áreas. No hay calcificaciones. El flujo vascular del resto del parénquima testicular es cualitativamente normal en ambos lados. En la cabeza del epidídimo derecho se observa un pequeño quiste ovalado de 0,4 cm. No hay signos de hidrocele ni varicocele. Las imágenes ecográficas corresponden a restos suprarrenales y a un quiste de epidídimo.
El control de laboratorio demostró: 17OH-Progesterona 290 ng/mL, androstenediona 16 ng/mL (VN 0,3 a 3,1), lo que sugieren un inadecuado cumplimiento del tratamiento. Para descartar la presencia de posibles tumores supra-rrenales se realiza TAC suprarrenal que muestra moderado engrosamiento de ambas astas suprarrenales, impregnación homogénea con el contraste endovenoso, sin lesiones nodulares. Se enfatiza al paciente y su familia las reper-cusiones sobre fertilidad por la presencia de restos adrenales y de la necesidad urgente de una adecuada adherencia al tratamiento (Tabla 1). A la edad de 17 años, considerando que su velocidad de crecimiento era 1,5 cm el último año y su EO de 17 años, se inicia prednisona 2,5mg c/12 h que posteriormente se aumenta a 2,5 y 5 mg/d. Una nueva ecotomografía testicular demostró persistencia de los restos adrenales, teste derecho de 6,6 cc e izquierdo de 7 cc (Figura 2), lo que evidencia un crecimiento testicular absolutamente inadecuado considerando que ya tenía 6 años de evolución puberal.
Figura 1. Curvas de crecimiento (estatura y peso) del paciente.
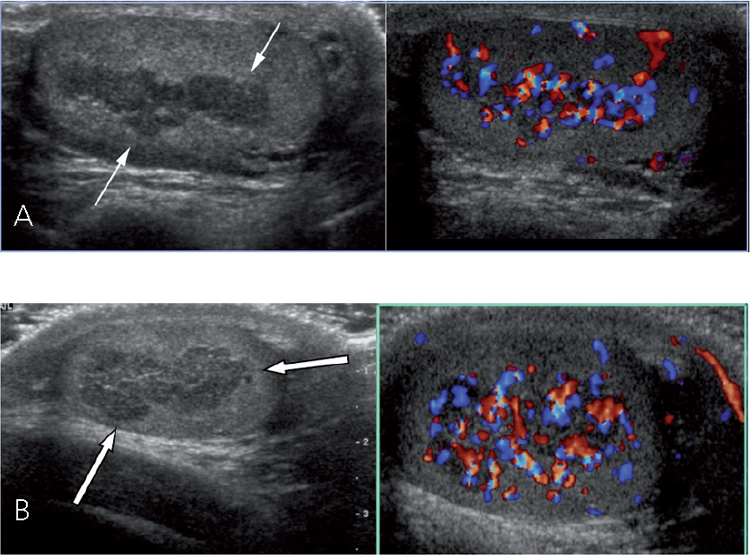
Figura 2. Ecografía con Doppler color. A: Testículo izquierdo. Las flechas blancas indican los Restos testiculares de glándula suprarrenal. B: Testículo derecho. Las flechas blancas indican los Restos testiculares de glándula suprarrenal.
Métodos
Las mediciones de 17-hidroxiprogesterona (17 OHP), an-drostenediona (A2), sulfato de dehidroepiandrostenediona (DHEA-S), testosterona (T), y actividad de renina plasmática (PRA) se realizaron en el laboratorio de la Universidad Católica. La 17 OHP fue determinada por radioinmunoensayo (RIA; Diagnostic Products Corporation). El límite inferior de detección fue 0,1 ng/mL con coeficiente de variación (CV) interensayo de 8%. El nivel sérico de DHEA-S fue cuantificado por Quimioluminiscencia competitiva (Immulite 2002; Diagnostic Products Corporation). La concentración mínima detectable fue de 0,3 ug/mL,y el Coeficiente de Variación (CV) interensayo 8,56%. A2 fue determinada por RIA (Diagnostic Systems Labora-tories) con un límite inferior de 0,1 ng/mL, y CV interensayo de 7,6%. Tetosterona sérica (T) fue medida por inmunoensayo electroquimioluminiscente (Modular Analytics E 170; Roche), con límite de detección en 10 ng/dL y CV interensayo de 3,4%. PRA se determinó por RIA (DiaSorin). La detección mínima de PRA fue 0,2 ng/mL/h, y el CV interensayo 6,7 %. Los resultados de los exámenes de laboratorio se detallan en la Tabla l.
Las ecotomografías Doppler color fueron realizadas por uno de los autores (CG) usando un transductor de alta resolución de 12 mHz. El tamaño testicular se evaluó por imágenes congeladas. El volumen testicular como el tumoral fue calculado usando la fórmula: V = L x W x D x 0,52, donde V es volumen (mL), L es la longitud máxima (cm), W es el ancho máximo (cm), and D es la profundidad máxima (cm).
Discusión
Nuestro paciente es un adolescente portador de HSC clásica, en tratamiento con fludrocortisona y cortisol, el que se cambia a prednisona una vez completado su crecimiento estatural. La evolución clínica y de los exámenes de laboratorio mostró un inadecuado cumplimiento de las indicaciones especialmente después de los 12 años. A los 14 años se detectan masas testiculares bilaterales compatibles con RTGS lo que se confirma con imagen ecográfica Dopler color.
El seguimiento a dos años, muestra persistencia de los restos adrenales testiculares y un tamaño testicular inadecuado (6,6 cc). Considerando que ha completado seis años de evolución puberal, el poco desarrollo del volumen testicular puede estar determinado fundamentalmente por un menor crecimiento de los túbulos seminíferos. El volumen testicular normalmente es 4 cc al inicio puberal hasta 15 a 25 cc al cabo de 4 a 5 años de evolución de la pubertad. Si bién durante este proceso hay una correlación entre el tamaño testicular y los niveles de testosterona secretada por las células de Leydig, éstas poco aportan al tamaño o volumen testicular.
El desarrollo de la corteza suprarrenal primitiva ocurre en la vecindad de las gónadas. Se ha considerado que los RTGS corresponden a tejido suprarrenal aberrante adherido al testículo de modo que desciende con estos durante el desarrollo7. Rutgers et al8, propone que estas masas podrían originarse a partir de células pluripotenciales que proliferan como resultado del alto nivel de ACTH. Un estudio en ratones identificó y caracterizó en los testículos embrionarios, una población nueva de células similares a las de la glándula suprarrenal. Estas células exhiben propiedades mixtas tanto de células suprarrenales como de Leidyg, y así expresan los marcadores suprarrenales Cyp11b1, Cyp21, y Cyp17 y responden a ACTH y hCG, pero no expresan marcadores específicos de células de Leydig como Insulin-Like Factor 3. Ello indicaría que son una población diferente de la de células esteroidogénicas que migran desde la gónada durante el desarrollo. Estos investigadores proponen que serían estas células los precursores de RTGS que se encuentran en los pacientes con HSC8.
Los RTGS pueden ser detectados desde la niñez en niños con HSC-C, dado que el aumento de la ACTH estimularía el crecimiento de células aberrantes suprarrenales, lo que sucede también en otras entidades que cursan con ACTH elevada como el síndrome de Nelson9 y la enfermedad de Addison10. También se ha descrito que existen restos suprarrenales en pacientes con ACTH normal o incluso disminuida11.
La fertilidad de los pacientes masculinos es reducida comparada con la población normal, especialmente en el caso de la HSC perdedora de sal. La principal causa es la presencia de RTGS en los testículos e hipogonadismo hipogonadotrópico. Los niveles suprimidos de gonadotrofinas se asocian a disfunción de los compartimientos testiculares como túbulos y células de Leydig. La testosterona plasmática se mantiene normal gracias a la conversión de andrógenos suprarrenales11,12.
La prevalencia de RTGS es muy variable (0 a 94%) dependiendo ella de la selección de los pacientes y el método de detección. Recientemente nosotros evaluamos 19 pacientes con HSC clásica, y encontramos que 4 de ellos tenían RTGS (21%)12 los que se asociaron a un inadecuado tratamiento de la HSC. El mecanismo del daño sería de tipo mecánico, considerando su ubicación cercana a la rete testis (mediastino testicular), produciendo obstrucción vascular y compresión de los túbulos seminíferos con azoospermia obstructiva y atrofia testicular. Además, se ha postulado un mecanismo paracrino, de daño por toxicidad sobre el tejido testicular, por producción local de esteroides y falla gonadal primaria, con aumento de gonadotrofinas y bajos niveles de inhibina B11,12.
Más del 60% de los RTGS no són detectados con la palpación testicular, lo que hace indispensable la realización de ecotomografía testicular periódica, en pacientes con riesgo de presentarlos, es decir, pacientes masculinos con HSC con inadecuado control; también consideramos importante realizar una ecografía a todos los niños que entren a etapa puberal por la posible repercusión sobre su fertilidad futura, o, a cualquier edad, en aquellos sujetos con inadecuado control de su enfermedad. La ecotomografía es el examen de elección en la detección y seguimiento de los RTGS, ya que es tan sensible como la resonancia nuclear magnética y es más accesible13.
Histológicamente en los testículos de los pacientes con RTGS se ha descrito disminución del diámetro de los túbulos seminíferos, fibrosis intersticial focal y peritubular y hialinización tubular. A la microscopia electrónica, semejan un tumor de células de Leydig con rasgos consistentes de células secretoras de esteroides; al contrario del tumor de células de Leydig, los RTGS nunca contienen cristaloides de Reinke. Entre las características clínicas importantes se incluyen una alta frecuencia de bilateralidad y disminución de tamaño del tumor con terapia corticoidal5,14. Todas estas características las tenía nuestro paciente, salvo la disminución de tamaño con la terapia corticoidal hecho atribuible muy probablemente a su falta de adherencia al tratamiento. Por otra parte, la ausencia de progresión del crecimiento testicular, sugiere compromiso tubular, ya que en la pubertad el tamaño testicular está determinado fundamentalmente por el desarrollo de los túbulos semi-níferos. Un marcador que nos permitiría corroborar esta aseveración sería la medición de inhibina B (exámen actualmente no disponible en nuestro medio), ya que los niveles de FSH, como marcador de daño tubular, es más tardío y menos sensible15. La evaluación del espermiograma, que nos permitiría conocer la morfología, motilidad y concentración de los espermios, fue considerado por el tratante y los padres como inadecuado en este momento en que no se busca fertilidad.
La base del tratamiento de los RTGS radica en la optimización del manejo de la HSC, asegurando la adherencia. Rutger et al8, comunicó un disminución del orden de 75% del tamaño tumoral en 16 pacientes. Claahsen-Van der Griten5, disminución en 6 de 15 pacientes, pero con aumento en uno. Por otra parte no siempre la disminución del tamaño de RTGS se asocia a mejoría de la fertilidad11,14.
El corticoide a usar depende de la edad del niño; en la etapa de crecimiento se elige cortisol, después se prefieren cor-ticoides de vida media más larga para facilitar la adherencia; la dexametasona nocturna ofrece mejor supresión de ACTH, y los mayores efectos colaterales serían transitorios. Sin embargo, el tipo y la dosis de corticoide es individual para cada paciente5,11,14. Nuestro paciente se mantiene con prednisona, ya que con dexametasona, se observó aumento significativo del peso.
Una opción que se ha evaluado es la cirugía, Claahsen–Van der Griten, efectuó enucleación tumoral en 9 pacientes, con 22 meses de seguimiento, y no observó mejoría en la azoospermia u oligoespermia, con inhibina B persis-tentemente baja que reflejan disfunción de las células de Sertoli. Tampoco hubo cambios en androstenediona y 17OH-Progesterona5,11. La cirugía debe ser realizada por alguien de mucha experiencia en gónada masculina y su beneficio depende del momento que se tome la decisión; si ya hay atrofia del tejido testicular es poco probable que mejore la fertilidad y se debería considerar la opción de aspirar espermios desde el epidídimo para su crio-preservación.
En conclusión en pacientes con HSC Clásica y en aquellos con factores de riesgo, se debe hacer hincapié en la importancia de una buena adherencia al tratamiento para prevenir el desarrollo de RTGS. El seguimiento de estos pacientes debe incluir evaluación con ecografías testiculares periódicas, que permitan una detección precoz de ellos, y evolución del volumen testicular, particularmente en la pubertad. Si se observa un aumento de la relación entre el volumen del tumor/ parénquima testicular o disminución de los niveles de inhibina B, se sugiere aumentar la dosis de glucocorticoides y eventualmente cirugía.
Dado las fuertes evidencias de disminución de fertilidad y azoospermia obstructiva en estos pacientes, debe considerarse evaluar en conjunto con el paciente y su familia, la criopreservación de semen11.
Agradecimientos
A la Dra. Florencia De Barbieri M., Departamento de Radiología. Escuela de Medicina, Pontificia Universidad Católica de Chile por facilitarnos las imágenes digitalizadas de las ecográficas testiculares.
Referencias
- White PC, Speiser PW. 2000. Congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Endocr Rev 21: 245-291.
- Speiser PW, White PC. 2003. Congenital adrenal hyperplasia. N Eng J Med 349: 776-788.
- Stikkelbroeck NM, Otten BJ, Pasic A, Jager GJ, Sweep CG, Noordam K, et al. 2001. High prevalence of testicular adrenal rest tumors, impaired spermatogenesis, and Leydig cell failure in adolescent and adult males with congenital adrenal hyperplasia. J Clin Endocrinol Metab 86: 5721-5728.
- Barwick TD, Malhotra A, Webb JA, Savage MO, Reznek RH. 2005. Embryology of the adrenal glands and its relevance to diagnostic imaging. Clin Radiol 60: 953-959.
- Otten BJ, Stikkelbroeck MM, Claahsen-van der Grinten HL, Hermus AR. 2005. Puberty and fertility in congenital adrenal hyperplasia. Endocr Dev 8: 54-66.
- Claahsen-van der Grinten HL, Otten BJ, Takahashi S, Meuleman EJ, Hulsbergen-van de Kaa C, Sweep FC, et al. 2007. Testicular adrenal rest tumors in adult males with congenital adrenal hyperplasia: evaluation of pituitary-gonadal function before and after successful testis-sparing surgery in eight patients. J Clin Endocrinol Metab 92: 612-615.
- Clark RV, Albertson BD, Munabi A, Cassorla F, Aguilera G, Warren DW, et al. 1990. Steroidogenic enzyme activities, morphology, and receptor studies of a testicular adrenal rest in a patient with congenital adrenal hyperplasia. J Clin Endocrinol Metab 70: 1408-1413.
- Rutgers JL, Young RH, Scully RE. 1988. The testicular “tumor” of the adrenogenital syndrome. A report of six cases and review of the literature on testicular masses in patients with adrenocortical disorders. Am J Surg Pathol 12: 503-513.
- Johnson RE, Scheithauer B. 1982. Massive hyperplasia of testicular adrenal rests in a patient with Nelson’s syndrome. Am J Clin Pathol 77: 501-507.
- Seidenwurm D, Smathers RL, Kan P, Hoffman A. 1985. Intratesticular adrenal rests diagnosed by ultrasound. Radiology 155: 479-481.
- Claahsen-Vander G, Stikkelbroeck N MML, Sweep CGJ, Hermus Armm Otten BJ. 2006. Fertility in patients with congenital adrenal hyperplasi J Pediatric Endocrinol Metab 19: 5, 677-685.
- Martínez-Aguayo A, Rocha A, Rojas N, García C, Parra R, Lagos M, et al and the Chilean Collaborative Testicular Adrenal Rest Tumor Study Group 2007. Testicular Adrenal Rest Tumors and Leydig and Sertoli Cell Function in Boys with Classical Congenital Adrenal Hyperplasia J Clin Endocrinol Metab 92: 4583-4589.
- Avila NA, Premkumar A, Merke DP. 1999. Testicular adrenal rest tissue in congenital adrenal hyperplasia: comparison of MR imaging and sonographic findings. AJR Am J Roentgenol 172: 1003-1006.
- Hedi L, Claahsen-van der Grinten, Barto J, Otten, Ad RMM Hermus, Fred CGJ Sweep, Christina A Hulsbergen-van de Kaa. 2008. Testicular adrenal rest tumors in patients with congenital adrenal hyperplasia can cause severe testicular damage. Fertility and Sterility 89: 3; 597-601.
- Kubini K, Zachmann M, Albers N, Hiort O, Bettendorf M, Wolfle J, Bidlingmaier F, Klingmuller D. 2000. Basal inhibin B and the testosterone response to human chorionic gonadotropin correlate in prepubertal boys. J Clin Endocrinol Metab 85: 134-138.