Sensibilidad diagnóstica de los distintos tiempos de la prueba de estímulo con clonidina, indicada para descartar deficiencia de hormona de crecimiento en niños con talla baja
Francisca Grob L.1, Marcela Molina P2, Patricio Romero M.3, Alejandro Martínez-Aguayo3, Anita Codoceo4,
Gabriel Cavada C.5 y Hernán García B.3
Timing of growth hormone peaks during the clonidine provocation test
1Becaria de Pediatría, Universidad de los Andes.
2Profesor Adjunto Departamento de Pediatría, Universidad de la Frontera.
3Departamento de Pediatría, Unidad de Endocrinología Pediátrica, Pontificia Universidad Católica de Chile.
4Becaria de Pediatría, Hospital Luis Calvo Mackenna, Universidad de Chile.
5Bioestadístico, Departamento de Salud Pública, Universidad de los Andes.
Correspondencia:
Hernán García Bruce
Pontificia Universidad Católica de Chile,
Escuela de Medicina,
Departamento de Pediatría
Lira 85, 5° piso, Santiago,
Teléfono 3543402,
Fax : 6384307
Mail: hgarciab@gmail.com
Los autores declaran no tener conflicto de intereses, ni haber recibido aportes financieros de ningún tipo.
Recibido: 7 de Septiembre de 2010
Aceptado: 12 de Noviembre de 2010
Background: Clonidine provocative test is used for the diagnosis of growth hormone (GH) deficiency. The duration of the test is not uniform across places where it is performed. Aim: To evaluate the frequency and timing of GH peaks during the clonidine test. To determine the timing with the highest diagnostic yield for GH deficiency. Patients and Methods: Analysis of the GH response during a clonidine test performed to 93 children with low stature, aged 11 ± 3 years (41% women), with mean z scores of -2.3 ± 0.8 for height and of 0.4 ± 0.9 for body mass index, that were consecutively studied. A oral dose of 0.15 mg/m2 of clonidine was administered and GH levels were determined by the chemiluminescent enzyme immunoassay method of solid phase at 0, +30, +60, +90 and +120 minutes after. The cut-off point for GH deficiency was set at 7 ng/dL. Results: In ten children GH levels were lower than 7 ng/dL during the test and were considered as having GH deficiency. In 86% of the 83 patients without GH deficiency, the peak over 7 ng/mL appeared at +60 minutes and in 89% the peak had appeared at +90 minutes. In only 11% of these children, the peak appeared at +120 minutes. Conclusions: The timing with the highest diagnostic yield for GH is +60 minutes after the administration of clonidine. However the sample at +120 minutes should not be eliminated, considering that the highest GH peak appears at that time in 11% of children.
Key words: Provocation Test Growth Hormone, Growth Hormone Deficiency, Clonidine, stature, Pediatrics.
La evaluación de la producción hipofisiaria de Hormona de Crecimiento (HC) no es sencilla, puesto que su secreción es pulsátil a través del día y la noche y varía de acuerdo a la edad y el estadío puberal, factores que deben ser considerados en la evaluación del déficit de HC. En los espacios inter pulsos de HC, los niveles de ésta son indetectables para la mayoría de los ensayos convencionales, por lo que una sola medición basal en cualquier horario no resulta útil para establecer la condición de la HC, a menos que esta medición coincida con un pico espontáneo de secreción1.
Por ello, se han desarrollado protocolos de medición nocturna seriada de HC, que contemplan la extracción de sangre cada 20 minutos, y son capaces de determinar su secreción; sin embargo, estos protocolos son muy complejos, costosos, y obligan a hospitalizar al paciente; en esencia, sólo se utilizan para fines de investigación2. Por esta razón, la medición de la "reserva" de HC a través de pruebas de estímulo constituye la base del diagnóstico del déficit de HC (GHD); para establecer este diagnóstico se requiere contar con 2 pruebas de estímulo alteradas en pacientes con talla baja, que cumplan además con los criterios axiológicos en cuanto a magnitud de su deficiencia de estatura y velocidad de crecimiento.
La medición de IGF-1 e IGFBP-3, si bien es de gran ayuda en el diagnóstico de GHD no determina con seguridad el diagnóstico pues son normales en el 20% de los GHD comprobados, y también se encuentran bajas en la insensibilidad a HC.
Estas "pruebas de provocación" de HC3 pueden realizarse con estímulos fisiológicos como el ayuno, sueño y ejercicio, o farmacológicos, dentro de los cuales se han utilizado Levodopa, Glucagon, Propanolol, Insulina, Arginina4 y Clonidina.
La Clonidina usada por vía oral es uno de los fármacos más usado para el diagnóstico de GHD. Sin embargo, existen pocos estudios que analicen su efectividad así como la sensibilidad de los distintos tiempos de la prueba para realizar el diagnóstico de GHD. La Clonidina, cuya indicación más habitual es el tratamiento de la hipertensión arterial, es un medicamento con actividad adrenérgica alfa, cuyo mecanismo de acción es aumentar la secreción del factor liberador hipotalámico de HC (GHRH). Para la realización de la prueba de estímulo se administra Clonidina en ayunas, obteniendo posteriormente muestras seriadas de sangre para medir HC, cuyos tiempos varían dependiendo del centro donde se realice el examen. La duración del test no es uniforme y puede variar entre 60 y 120 min en USA y Chile, y hasta 150 a 180 min en algunos centros europeos5,6.
El objetivo de este trabajo fue analizar los resultados de la prueba de Clonidina en niños con talla baja en los que se sospechó GHD, evaluar la frecuencia y distribución de los picos de HC en los distintos tiempos de la prueba, establecer el tiempo con mayor sensibilidad diagnóstica y estudiar la duración mínima necesaria de la prueba de estímulo para sustentar o excluir el diagnóstico de GHD.
Pacientes y Métodos
Se analizó en forma retrospectiva la respuesta de HC al estímulo con Clonidina en 93 niños de 10,58 ± 2,7 años (40,9% mujeres), con talla baja (puntaje z: -2,28 ± 0,8 DE) e IMC de + 0,36 ± 0,89 DE, derivados para estudio de su talla baja en la P. Universidad Católica de Chile entre los meses de marzo de 2007 y marzo de 2008. De acuerdo a nuestros protocolos, la prueba de Clonidina se realiza con posterioridad a un estudio inicial orientado a excluir pacientes portadores de enfermedad celíaca, alteraciones tiroideas y otras enfermedades crónicas, así como a aquellos con estigmas genéticos o desproporciones corporales evidentes al examen físico.
Los 93 niños realizaron la prueba en forma consecutiva en la sala metabólica de nuestra institución. Esta consistió en la administración de clonidina después de una noche de ayuno, iniciándose entre las 8:00 y 8:30 AM. Se instaló una vía venosa que se mantuvo permeable con solución salina. Luego de una muestra basal (0 minuto), se administró clonidina oral (0,15 mg/m2) y se extrajeron muestras de HC a los +30, +60, +90 y +120 minutos. La HC se midió a través del método de inmunoensayo enzimático quimioluminiscente en fase sólida (INMULITE 2000, Siemens) cuyos coeficientes de variación intra e inter ensayo fueron 5,2 y 5,3%, respectivamente. Se midió la presión arterial cada 30 minutos hasta una hora después de finalizado el examen. Se utilizó sensibilización ("priming") con esteroides sexuales en los varones mayores de 11 años sin evidencia de desarrollo puberal. Para ello se usó Enantato de Testosterona (50 mg im), por una vez, 7 días antes de la prueba. En el caso de las mujeres mayores de 9 años sin signos puberales se utilizó Etinilestradiol (40 ug/m2/d) durante los 2 días previos a la prueba.
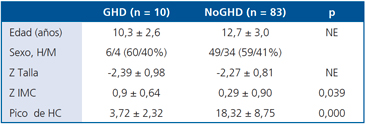
Para los efectos de este análisis consideramos como GHD a aquellos pacientes que obtuvieron un valor de HC < 7 ng/mL en todos los tiempos de la prueba de Clonidina; en sentido estricto, estos pacientes debieran ser considerados como probable GHD de acuerdo al consenso que para efectuar el diagnóstico de GDH se requiere de 2 pruebas alteradas con estímulos diferentes. Los pacientes cuyas respuestas a la prueba superaron el punto de corte de 7 ng/mL fueron denominados NoGHD, pues la naturaleza de su talla baja puede deberse a diferentes condiciones. De acuerdo a esto, se establecieron dos grupos, aquel que en uno o más tiempos de la prueba superó el punto de corte establecido (NoGHD) y el otro que nunca superó ese límite (GHD). El grupo GHD estuvo constituído por 10 pacientes de 10,33 ± 2,61 años, (40% mujeres) y el grupo NoGHD por 83 pacientes de 12,74 ± 3 años (41% mujeres).
En cada paciente se consignaron los valores de HC en los distintos tiempos, se determinó el pico máximo de HC después de la administración de clonidina, y el tiempo en el cual por primera vez se alcanzó el valor de HC > 7 ng/mL, si ello ocurría. Si bien este punto de corte se estableció en forma arbitraria, numerosos centros del mundo lo utilizan.
En todos los pacientes se registró peso y talla, y se calculó el índice de masa corporal (IMC). La talla y el IMC fueron expresados como DE (puntaje z) calculado por Epiinfo 2000 de las curvas del National Center Health Statistics de Estados Unidos del año 20007.
Las variables continuas se describen con su promedio y desviación estándar y las variables categóricas mediante sus frecuencias y proporciones. Las variables continuas se compararon según la presencia de NoGHD mediante el test "t" de Student y las variables categóricas mediante el test exacto de Fisher. Se usó una significación del 5% y los datos fueron procesados en el programa estadístico STATA versión 11.0.
Resultados
Utilizando nuestro punto de corte, 10 de 93 pacientes (10,8%) correspondieron a GHD (con las consideraciones señaladas), al no presentar un pico de HC > 7 ng/mL en ninguno de los tiempos medidos; contrariamente, 83 de 93 (89,2%) fueron NoGHD. En la Tabla 1 se muestran las características de los pacientes GHD y NoGHD. Ambos grupos son comparables excepto en el IMC que es mayor en niños GHD (p < 0,05). Además, el pico de HC es menor en pacientes con naturaleza de nuestra propia definición.
Tabla 1. Características basales de los pacientes en estudio
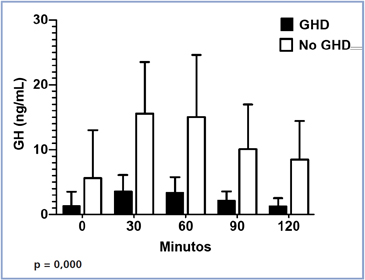
Analizando los promedios de HC en todos los tiempos de la prueba estos valores son mayores en los tiempos +30 y +60 minutos del estímulo (p = 0,000) en sujetos NoGHD, y menores en pacientes con GHD (Figura 1).
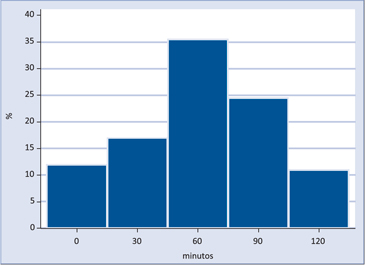
En pacientes NoGHD el primer valor de HC > 7 ng/mL que aparece después del estímulo con clonidina (Figura 2), se distribuye en forma relativamente uniforme en todos los tiempos, con predominio de la muestra de los +60 minutos.
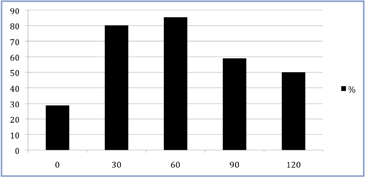
El 89% de los pacientes presentó este pico de HC antes de los +90 minutos; a los +120 minutos lo hizo el 11% restante. Sólo con la muestra +60, se diagnosticó un 85,5% de los pacientes NoGHD (Figura 3).
El tiempo que concentró la mayor cantidad de valores > 7 ng/mL en NoGHD fue +60 minutos.
Discusión
La evaluación de la secreción de HC usando pruebas farmacológicas de estímulo, si bien es controvertida8,9, se utiliza ampliamente en la mayoría de los centros. El cuestionamiento a su confiabilidad se fundamenta en que no son pruebas fisiológicas, las definiciones de respuesta subnormal son diferentes y arbitrarias, que además existe poca claridad en cuanto a la edad para el uso de sensibilización o "priming" con esteroides sexuales, y que los métodos para medir GH son diferentes, los costos elevados, poco reproducibles y se ocasionan molestias a los pacientes. Además, los niveles de corte para el diagnóstico de GDH varían de acuerdo al método utilizado.
A pesar de ello, estas pruebas entregan información importante sobre el funcionamiento del eje somatotrófico, complementaria al cuadro clínico y constituyen aún, junto a la determinación de IGF-1 e IGFBP-3, la mejor prueba confirmatoria tanto de la deficiencia de GH10, como de los cuadros de insensibilidad a la misma.
Este trabajo pretende aportar nuestro análisis de una serie consecutiva de 93 pruebas de Clonidina realizadas en un mismo centro, de acuerdo a un protocolo establecido, utilizando el mismo método de laboratorio para determinar HC, el mismo punto de corte para diagnóstico de GHD y un protocolo definido para el uso de sensibilización o "priming" con hormonas sexuales, dado que existe muy poca información disponible al respecto. Nos propusimos investigar la capacidad resolutiva de los distintos tiempos de la prueba oral de estímulo con clonidina para excluir el diagnóstico GHD, por ser ésta prueba ampliamente usada en nuestro medio. La clonidina es un medicamento de uso oral de fácil disponibilidad y con menos riesgos, comparado con otras alternativas como la insulina endovenosa, aunque puede producir molestias como mareos, náuseas e hipotensión. El punto de corte para el diagnóstico de GHD de 7 ng/mL es el más utilizado en niños, aunque se ha sugerido que dependiendo del método este debiera disminuir a < 5 ng/mL o aún < 3 ng/mL11 en niños prepuberes y mantenerse en los púberes. Sin embargo, algunos centros utilizan un corte único de 10 mg/mL para todas las edades. No dividimos a los pacientes por estadio puberal, ya que en nuestro protocolo todos los pacientes se interpretan de acuerdo al mismo punto de corte; si hubiéramos considerado otros puntos de corte, la prevalencia de sujetos GHD varía en forma importante y habría sido 6,5% y 25,8% para < 5 y < 10 ng/dL, respectivamente.
Galluzi et al, estudiaron la respuesta de GH a clonidina oral en 291 niños evaluados por talla baja, 164 de los cuales fueron considerados como talla baja idiopática (TBI) y 127 GHD. A pesar de utilizar un punto de corte diferente al nuestro, los autores calcularon la frecuencia de distribución de los picos de GH en los distintos tiempos de la prueba de clonidina, demostrando que si bien estos se distribuyen entre los +30 y +180 minutos, la gran mayoría de los picos de HC sobre 10 ng/mL ocurrieron entre los +30 y +60 minutos; además, consignan niveles sobre el punto de corte en 95,75% de los con TBI, sugiriendo que el test de clonidina oral puede ser acortado a sólo 90 minutos sin introducir cambios significativos en su validez.
Otro estudio realizó un análisis retrospectivo de la prueba de estimulación de clonidina oral efectuada en 66 pacientes (42 hombres), de 2 a 18 años de edad, para evaluar la utilidad clínica de la obtención de muestras a los 0, +60, +90 y +120 minutos. En 29 de 30 pacientes, la presencia de una respuesta normal de GH fue demostrada antes de los +90 minutos, concluyendo que la prueba de 90 min es la duración preferida cuando se emplea clonidina en la búsqueda de GHD12.
Estos resultados difieren de los nuestros, que muestran que si bien una prueba más abreviada con determinaciones de GH a los 0, +30 y +60 minutos posee la mejor capacidad de diagnóstico y siendo muy semejante a la prueba completa, existe un 11% de pacientes NoGHD cuya HC sobrepasa el punto de corte recién en el tiempo +120, lo que aconseja mantener la determinación de HC en ese tiempo. Podemos concluir que la prueba de estímulo con clonidina no debe abreviarse a 90 minutos. Por otra parte, un 24% de los pacientes alcanzan un valor útil para excluir el diagnóstico de GHD en el tiempo 0, lo que podría estar relacionado a factores ligados al stress del inicio de la prueba.
Otro punto a considerar es la diferencia significativa del IMC entre los pacientes GHD y NoGHD. Aquellos con GHD presentaron un mayor IMC, lo que puede ser debido a que los pacientes con este diagnóstico tienen mayor peso. Por otra parte, se sabe que la obesidad por sí misma determina picos menores de HC. Sin embargo, los obesos del grupo NoGHD responden ascendiendo la HC sobre 7 ng/mL, igual que los de peso normal, minimizando el factor relacionado a la obesidad. Dado que el diseño de nuestro estudio no incluyó medir los niveles de IGF-1 e IGFBP-3, no podemos aclarar completamente el punto.
En base a estos resultados y en consideración a la escasez de recursos de laboratorio proponemos el siguiente flujograma: a) tomar muestra de HC en todos los tiempos; b) analizar la muestra de los +60 minutos y si esta se encuentra sobre el nivel de corte no analizar las muestras subsiguientes (esta conducta permitió diagnosticar correctamente NoGHD a 71 de 83 pacientes (85,5%) en nuestra serie); c) si los resultados se ubican bajo el punto de corte,12 de 83 individuos (14,5% en nuestra serie), se deberán analizar todos los tiempos, incluido el +120 minutos, lo cual representaría hacerlo sólo en un pequeño porcentaje de los pacientes.
Referencias
- Rosenfeld R, Cohen P. 2008. Disorders of Growth Hormone/Insulin-like Growth Factor Secretion and Action. En: Sperling, Pediatric Endocrinology, Third Edition 254-321.
- Donaldson D, Hollowell J, Pan F, Gifford R, Moore W. 1989. Growth hormone secretory profiles on consecutive nights. J. Pediatr 115: 51-56.
- Bercu B, Shulman D, Root A, Spiliotis B. 1986. Growth hormoneprovocative testing frequently does not reflect endogenous secretion. J Clin Endocrinol Metab 63: 709-715.
- Alba-Roth J, Muller O, Schophl J, Von Werder K. 1988. Arginine stimulates growth hormone secretion by supressing endogenous somatostatin secretion. J Clin Endocrinol Metab 67: 1186-1189.
- Galluzzi F, Stagi S, Parpagnoli M, Losi S, Pagnini I, Favelli F, et al. 2006. Oral clonidine provocative test in the diagnosis of growth hormone deficiency in childhood: should we make the timing uniform? Horm Res 66 (6): 285-288.
- Strich D, Terespolsky N, Gillis D. 2009. Glucagon stimulation test for childhood growth hormone deficiency: timing of the peak is important. J Pediatr 154 (3): 415-419.
- http://www.cdc.gov/growthcharts/computer_programs.htm. Consultado el 07/09/10.
- Hilczer M, Smyczynska J, Lewinski A. 2006. Limitations of clinical utility of growth hormone stimulating tests in diagnosing children with short stature. Endocr Regul 40 (3): 69-75.
- Rosenfeld RG, Albertsson-Wikland K, Cassorla F, et al. 1995. Diagnostic controversy: The diagnosis of childhood growth hormone deficiency revisited. J Clin Endocrinol Metab 80: 1532-1540.
- Grote FK, Oostdijk W, De Muinck Keizer- Schrama SM, Dekker FW, Verkerk PH, Wit JM. 2005. Growth monitoring and diagnostic work-up of short stature: an international inventorization. J Pediatr Endocrinol Metab 18: 1031-1038.
- Costalonga EF, Antonini SR, Guerra-Junior G, Mendonca BB, Arnhold IJ, Jorge AA. 2009. The -202 A allele of insulin-like growth factor binding protein-3 (IGFBP3) promoter polymorphism is associated with higher IGFBP-3 serum levels and better growth response to growth hormone treatment in patients with severe growth hormone deficiency. J Clin Endocrinol Metab 94 (2): 588-595.
- Morris AH, Harrington MH, Churchill DL, Olshan JS. 2001. Growth hormone stimulation testing with oral clonidine: 90 minutes is the preferred duration for the assessment of growth hormone reserve. J Pediatr Endocrinol Metab 14: 1657-1660.