Hemoglobina glicosilada A1c como criterio diagnóstico de diabetes y pre-diabetes
Pilar Durruty A.1,2,3 y María Gabriela Sanzana G.3,4
Glycosylated hemoglobin as a diagnostic criterion for diabetes and pre diabetes
1Bioquímico.
2Unidad de Diabetes. Departamento de Medicina Occidente. Facultad de Medicina Universidad de Chile.
3Sección Endocrinología y Diabetes, Hospital Clínico Universidad de Chile.
4Unidad de Diabetes. Departamento de Medicina Interna. Clínica Las Condes.
Correspondencia:
Pilar Durruty A.
Fax: 6817414
E-mail: pdurruty@med.uchile.cl
Recibido: 19 de Octubre de 2010
Aceptado: 10 de Diciembre de 2010
The clinical usefulness of A1c glycosylated hemoglobin (A1c), in the metabolic control of diabetic patients is well known and the goal is to achieve values below 7% to prevent the appearance of microangiopathic complications. Standardized measurement methods are required to obtain trustful values. The proposal of the American Diabetes Association to accept A1c as a diagnostic criterion for diabetes and as a means to identify subjects at risk of developing the disease is currently being discussed. The establishment of universal cutoff points has been hindered by the fact that factors such as ethnic influence on glycosylation may modify values of A1c. The use of A1c as an alternative to blood glucose measured during fasting ad after a 75 g glucose load, will not be possible without standardizing measurement methods and performing studies to validate it as a diagnostic method in different populations, including Chileans.
Key words: Glycated hemoglobin A1c, standardization, diabetes and prediabetes.
El contacto directo en el interior de los eritrocitos de la hemoglobina con la glucosa y otros sacáridos provoca la formación de productos estables, a los que se denomina genéricamente hemoglobina glicosilada; este compuesto se conoce también con otros nombres: hemoglobina glicada, glucohemoglobina, fracción rápida de Hb, HbA1c, A1c y A1C. Desde el punto de vista químico, el término glicosilada se refiere al producto de reacciones enzimáticas entre glucosa y proteínas; en cambio se denomina glicada cuando es el resultado de una reacción no enzimática; en este caso la formación es por contacto directo y dado que sucede en varios pasos secuenciales, permite dar utilidad clínica a su medición, al evaluar indirectamente y en diferido la concentración de glucosa de los meses previos a su determinación.
En 1976, Koenig y cols1 fueron los primeros en informar la correlación de los niveles de glicemia en ayunas con la HbA1c (A1c) y propusieron su determinación para el control metabólico del diabético; posteriormente, Mortensen y Christophersen2 en la década del 70, demostraron que los niveles de A1c tenían una relación directa con la vida media de los eritrocitos y con los niveles de glucosa, en un período de 4 a 12 semanas, que se daba tanto en los diabéticos tipo 1 como en los tipo 2.
Desde hace 30 años se considera que los niveles de A1c son el eje central del control de los pacientes con diabetes; con valores de A1c se establecen las metas para su control y tratamiento. Su medición da una retrospectiva de los niveles de glucosa y es actualmente el mejor indicador de control en los pacientes diabéticos. La determinación de A1c es también el mejor predictor de progresión hacia complicaciones micro y macrovasculares; contrariamente, su reducción se asocia a disminución de las complicaciones de la diabetes3,4.
Estandarización de la A1c
La falta de confiabilidad ha sido la principal limitación de la determinación de A1c; para abordar este problema, en el año 1994, la International Federation of Clinical Chemistry (IFCC) y la Asociación Americana de Químicos Clínicos (AACC) establecieron un grupo de trabajo (WG) para la estandarización de las determinaciones de A1c a nivel mundial, mediante un sistema de medición de referencia internacional. Este grupo posteriormente fue disuelto para dar origen al National Glycohemoglobin Standarization Programs (NGSP) que inicio sus actividades en 1996 y aún está vigente.
Después de varios años el programa ha preparado, desarrollado y evaluado calibradores (sistema primario de referencia), implementado un método de referencia internacional y abierto la disponibilidad para que los laboratorios puedan ser continuamente monitorizados. Este grupo ha incorporado a laboratorios de distintos países formando una red de laboratorios de referencia, los que se usan en los programas nacionales de evaluación externa.
El 20105 el NGSP publicó una Declaración de Consenso, aprobada por la American Diabetes Association (ADA), la Asociación Europea para Estudios de Diabetes (EASD), la Federación Internacional de Diabetes (IDF) y la IFCC, e informaron lo siguiente:
1. Los resultados de A1c deben estandarizarse, utilizando para ello el método de referencia de la IFCC.
2. El método de la IFCC es en base a High Pressure Liquid Cromatography (HPLC) utilizado en el estudio del Diabetes Control Complication Trial (DCCT) y es el único validado para la estandarización y es el disponible para la certificación de otros métodos.
Algunos países usan otros métodos de estandarización; es así como Suecia emplea la cromatografía de intercambio iónico Mono S y Japón utiliza 6 calibradores con valores de A1c asignados por la Sociedad Japonesa de Diabetes.
3. Los resultados de A1c deben comunicarse y expresarse utilizando las unidades IFCC (mmol/mol), junto con las que se utilizan en la actualidad en % del NGSP. Al adoptar el procedimiento de estandarización de la IFCC los valores de A1c son más bajos debido a la alta especificidad del método de referencia, por lo que los expertos recomiendan usar las unidades mmol/mol.
La equivalencia se hace utilizando la ecuación:
A1c mmol/mol = 10,93 (A1c % – 23,5) ó A1c % = A1c mmol/mol + 2,15.
Es importante mencionar que al informar los resultados en unidades IFCC (mmol/mol) no se incluyen decimales.
Un listado de los métodos certificados puede ser consultada en la página web: (www.ngsp.org). En la Tabla 1 aparecen algunos de ellos. En Estados Unidos, menos del 1% de los laboratorios usan métodos no certificados por el NSGP.
Tabla 1. Métodos certificados por el National Glycohemoglobin Standarization Programs (NGSP), actualizado a Septiembre 2010
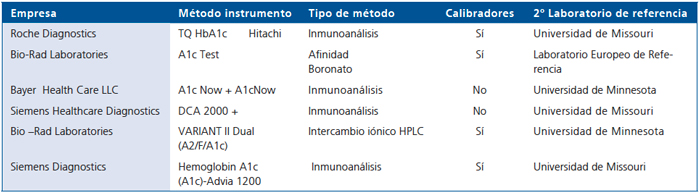
Adapt. www.ngsp.org
La introducción de este nuevo sistema propuesto por la IFCC presentará cambios significativos en la manera en que se informan los resultados a los pacientes y médicos. Así por ejemplo, la meta en HbA1c de 7% (NGSP) que recomienda la ADA para el control en pacientes diabéticos, utilizando la ecuación (IFCC =10,93 (A1c%)-23,50), equivaldría a 53 mmol/mol. La disminución de un 1% en A1c, por ejemplo de 8 a 7%, equivaldría a disminuir de 64 mmol/mol a 53 mmol/mol (Tabla 2).
Es ampliamente conocida la necesidad de contar con programas que evalúen la confiabilidad de los resultados de A1c entregados por los laboratorios, especialmente cuando las determinaciones de A1c son parte central del control glicémico y porque su reducción ha sido asociada con la disminución de las complicaciones producidas por la diabetes; así, todos los laboratorios deberían certificar el método de determinación de A1c que utilizan.
4. Para referirse a la hemoglobina glicada se debe decir HbA1c, aunque también se pueden utilizar en guías y material educativo las siglas A1c o A1C.
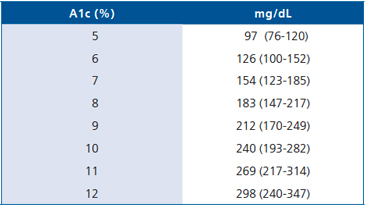
Los resultados del estudio ADAG (A1c-Derived Average Glucose)6 permitirán también expresar los resultados de A1c en forma de valor promedio de glicemia dado que se encontró una relación lineal entre HbA1c y la glucosa promedio (AG). La conversión de los valores de A1c en una cifra estimada del promedio de glucosa (eAG) en mg/dL, se puede efectuar mediante la siguiente ecuación: eAG = 28,7 (A1c – 46,7). La Tabla 3 ejemplifica algunas conversiones. Sin embargo, dado que la relación no ha sido demostrada en todas las poblaciones, la expresión eAG a partir de la A1c no ha sido incluida en el Consenso actual.
Tabla 2. Valores meta y unidades sugeridas para A1c cuando son realizadas con los métodos validados por el sistema de referencia IFCC

Tabla 3. Relación entre A1c y promedio de glicemias estimado del estudio A1c-Derived Average Glucosa (ADAG)6
Los expertos señalan que estas medidas deben ser adoptadas a la brevedad y expresan: "Este acuerdo contribuirá a la comparación de los resultados en todo el mundo, paralelamente al progreso del conocimiento científico relacionado con las características bioquímicas y analíticas de la A1c".
La próxima reunión de Consenso será en Diciembre del 2011; por lo que estas recomendaciones antes dichas estarán vigentes todo el 2011.
Factores que alteran los resultados de A1c
Diferentes situaciones pueden modificar las concentraciones de A1c, como lo son las hemoglobinopatías, las alteraciones derivadas de fármacos, ciertas patologías y además, variaciones genéticas y raciales.
Las hemoglobinopatías entre las que destacan las talasemias, un grupo de anemias hemolíticas y la anemia drepanocítica (o de células falciformes que presenta la hemoglobina S, una variante de la globina beta) son trastornos hereditarios cuya frecuencia se estima en alrededor de 5%; las formas clínicas van desde alteraciones hematológicas difícilmente detectables hasta anemias graves La hemoglobinopatías pueden alterar la confiabilidad del examen por tres mecanismos: 1) modificando el proceso de glicación de la hemoglobina; 2) generando un pico anormal en la cromatografía, y 3) presentando glóbulos rojos fácilmente hemolizables, lo que disminuye el tiempo de exposición de estos al ambiente glicémico7. En presencia de estas patologías, deben usarse de elección para la medición de A1c los ensayos de afinidad que permiten eliminar estas interferencias.
La Hb-carbamilada suele aparecer en pacientes con insuficiencia renal y su concentración es proporcional a la concentración de urea y es indistinguible de la A1c por algunos métodos, incrementando falsamente las concentraciones de A1c. Sin embargo, a pesar de la posible interferencia con la Hb-carbamilada los resultados de la A1c son válidos para los pacientes diabéticos con insuficiencia renal crónica si se utiliza el método adecuado8. En pacientes diabéticos tipo 2 en diálisis, la A1c, como parámetro de control metabólico, mostró una correlación de 0,78 con las glicemias promedio (p < 0,01); sin embargo, los valores de A1c < 8% se asociaba a glicemias más elevadas que las informadas para pacientes que no estaban en hemodiálisis (datos no publicados); en estas situaciones no se recomienda utilizar métodos de intercambio iónico que entregarían valores falsamente elevados de A1c. Asimismo, concentraciones elevadas de Hb-acetilada se han descrito en pacientes que ingieren ácido acetil salicílico en dosis mayor a 4 g/d, o tienen hipertrigliceridemias o hyperbilibirrubinemias marcada y con la ingesta crónica de alcohol y de opoides9.
Cualquier condición clínica que acorte la supervivencia de los eritrocitos o disminuya su vida media puede generar resultados falsos de A1c. La anemia por deficiencia de hierro puede inducir incrementos por arriba de 2% en A1c, lo cual revierte con el tratamiento con fierro10. En cambio, la anemia hemolítica tiene el efecto opuesto al de la deficiencia de hierro al reducir las concentraciones de A1c11.
Entre otras situaciones, los pacientes con HIV presentan valores más bajos de A1c. Respecto a la raza, se han demostrado mayores niveles de A1c en negros e hispanos no diabéticos; no es claro si existen diferencias étnicas en los procesos de glicación, en la vida media de los glóbulos rojos o en los niveles promedio de glicemia12. Este tipo de situaciones establecen una duda importante respecto de utilizar en forma universal los criterios de A1c para el diagnóstico de diabetes y pre-diabetes.
Los factores que alteran los valores de A1c deben ser considerados acuciosamente en aquellos resultados de A1c que el clínico estima dudosos.
A1c en el diagnóstico de diabetes y pre-diabetes
En la última revisión de las guías de manejo de la diabetes, la ADA promueve la medición de la A1c como un método fácil, rápido y accesible para el diagnóstico de la diabetes y pre-diabetes; lo recomiendan como una alternativa a las glicemias de ayuno y la 2 de horas postcarga de 75 g de glucosa para el diagnóstico de diabetes y de identificación de individuos en alto riesgo de desarrollar diabetes (pre-diabetes). Las Tablas 4a y 4b presentan los criterios de clasificación ADA 2010. Por otra parte, la OMS sigue recomendando que la prueba de tolerancia oral a la glucosa (PTGO) se mantenga como test diagnóstico, debido a que posee mayor sensibilidad y especificidad que la medición de glucosa sérica en ayuno; sin embargo, el inconveniente de esta prueba es su mayor costo y poca reproducibilidad, por lo que la glucosa sérica en ayuno sigue siendo el método diagnóstico de preferencia.
Tabla 4a. Criterios diagnósticos de diabetes ADA 2010
 Los criterios 1, 2 y 4 deben ser repetidos.
Los criterios 1, 2 y 4 deben ser repetidos.
Tabla 4b. Categorías de riesgo mayor de presentar diabetes, ADA 2010

El riesgo es continuo, siendo mayor en los valores más altos.
Tabla 5a. Ventajas de usar la medición de A1c para detección y diagnóstico de diabetes, comparada con la glicemia de ayunas

Tabla 5b. Limitaciones de usar la medición de A1c para la detección y diagnóstico de diabetes, comparada con la glicemia de ayunas

Las ventajas y limitaciones del la A1c para la detección y diagnóstico de diabetes, comparada con la glicemia de ayuno aparecen en las tablas 5a y 5b.
Es necesario señalar que la A1c tiene un menor coeficiente de variación interpersonal 3,6% (3,2-4,0); en cambio, para las glicemias en ayunas la fluctuación es de 5,7% (5,3-6,1) y para las de post carga 16,7% (15,0-18,3).
A1c como prueba diagnóstica
de diabetes
Se recomienda que el diagnóstico presuntivo de Diabetes con A1c ≥ 6,5% debe ser confirmado con la repetición de A1c, a menos que el paciente tenga síntomas clínicos o niveles de glicemia > 200 mg/dL.
El panel de expertos no recomienda mezclar los diferentes métodos de diagnóstico por la falta de concordancia entre ellos; de este modo se postula que A1c sea un método alternativo para el diagnóstico de diabetes.
Las evidencias que sustentan el uso de A1c con propósito diagnóstico se basan en estudios que demuestran que la prevalencia de las complicaciones de la diabetes aumenta en relación directa con los niveles de A1c en población no diabética; ellos son el Estudio Egipcio13, el de los Pima14 y el NHANES III15. En ellos, los valores de glicemia de ayuno y post carga y los de A1c situados en los 2 y 3 deciles superiores se asocian a una prevalencia de retinopatía notablemente más alta que el resto de los individuos. Además, datos preliminares del estudio colaborativo DETECT muestran que la prevalencia de retinopatía por examen de fondo de ojo está significativamente aumentada en los casos con A1c ≥ 6,5%16. También apoya la concordancia encontrada entre la A1c y la glicemia de ayunas, en una revisión de 9 estudios realizados en población asiática y europea según criterio OMS.
Respecto al punto de corte (≥ 6,5%) existen discrepancias, las que se generan en los distintos estudios; dado que la prevalencia de retinopatía es un fenómeno continuo, algunos autores proponen que el límite debe ser establecido entre 6,0-6,2%,pero para otros en cifras inferiores a 5,8%, con una sensibilidad de 86% y especificidad de 92%17. Un estudio reciente derivado del ARIC (Atherosclerotic Risk in Communities) encuentra que niveles más altos de A1c, pero aún en el área de los no diabéticos, están asociados con riesgo aumentado de enfermedad cardiovascular18.
En Chile, como en otros países en desarrollo, la carencia de un programa de estandarización dificulta el uso de la A1c como herramienta diagnóstica de diabetes. Además, no conocemos en detalle cuáles son los métodos más utilizados ni su confiabilidad. En América Latina se ha informado que en Uruguay, Argentina y México, se emplean de preferencias los inmunoanálisis y el quipo DCA-200019, contrariamente a lo que sucede en Europa donde son comúnmente usados los equipos de HPLC.
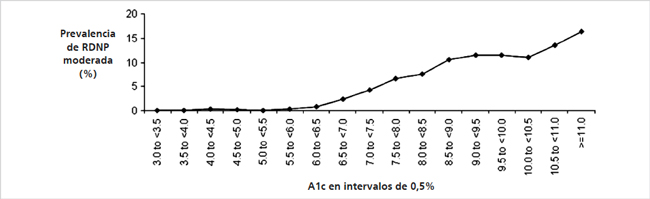
Figura 1. Prevalencia de retinopatía por intervalos de 0,5% y severidad de la retinopatía en participantes entre 20 y 79 años. Retinopatía diabética no proliferativa. Adaptado The International Expert Commitee 2009, Diabetes Care 32: 1327-1332.
A1c como prueba diagnóstica de pre-diabetes
La ADA también identifica, usando A1c, a los individuos con pre-diabetes. Basándose en estudios realizados en población no diabética, se determinó por regresión linear que una glicemia de ayunas de 100 mg/dL corresponde a una A1c de 5,4%, y una glicemia de 110 mg/dL a 5,6%; al efectuar el análisis de curva se estableció que una A1c de 5,7% comparado con otros puntos de corte tiene la mejor sensibilidad (39%) y especificidad (91%) para identificar a aquellos individuos con glicemia de ayunas mayor a 100 mg/dL. Otros estudios sugieren que una A1c de 5,7% se asocia a un riesgo similar al grupo con alto riesgo de presentar diabetes en el Diabetes Prevention Program (DPP). No se especifica si debe ser repetido o realizado como único examen o en combinación con los tradicionales glicemias de ayunas y/o PTGO, ni cual de ellos se debe preferir.
Varios estudios han investigado el impacto de este nuevo criterio diagnóstico; se ha encontrado una importante subestimación diagnóstica al utilizar la A1c; entre otros, el Estudio NHANES 1999-2006, con 7.209 individuos, encontró una menor prevalencia de anormalidad de la glicemia de ayuno al utilizar A1c 12,6% versus 28,2%, con los criterios clásicos de glicemias20. Para nosotros es interesante la publicación de Getaneh y cols21 quienes informan que la A1c diagnostica menos casos de diabetes y pre-diabetes en las distintas etnias o razas, situación particularmente importante en el grupo de caucásicos e hispanos (46% menor en diabetes). Fajans S y Herman W22 estudiando grupos muy seleccionados de pacientes concluyen que la A1c es menos sensible en el diagnóstico de diabetes y pre-diabetes y que se debería utilizar una combinación de mediciones con A1c y glucosa plasmática.
Con los antecedentes expuestos, nos parece poco probable que la hemoglobina glicosilada A1c pueda ser utilizada, en un futuro cercano en nuestro país, para realizar el diagnóstico de diabetes o pre-diabetes; sin embargo, su utilidad para evaluar el control metabólico de los pacientes con diabetes es claro, y muchas veces las decisiones terapéuticas se fundamentan en ella, requiriendo la estandarización de los métodos en uso de modo que otorguen confiabilidad.
Referencias
- Koenig RJ, Peterson CM, Kilo C, Cerami A, Williamson JR. 1976. Hemoglobin A1C as an indicator of the degree of glucose intolerance in diabetes. Diabetes 25: 230-232.
- Mortensen HB, Christophersen C. 1983. Glucosylation of human haemoglobin A in red blood cells studied in vivo: kinetics of the formation and dissociation of haemoglobin A1c. Clin Chem Acta 134: 317-326.
- Rohlfling CL, Wiedmeyer HM, Little RR, England JD, Tennill A, Goldstein DE. 2002. Defining the relationship between plasma glucose and HbA1c: an analysis of glucose profiles and HbA1c in the Diabetes Control and Complications Trial. Diabetes Care 25: 275-278.
- Murata GH, Hoffman RM, Duckworth WC, Wendel CS,
Shah JH. 2004. Contributions of weekly mean blood glucose values to hemoglobin A1c in insulin –treated type 2 diabetes:
the diabetes outcomes in veterans study. Am J Med Sci 327:
319-323. - Ragnar H, Garry J. 2010. Consensus Statement on the Worldwide Standarization of the Hemoglobin A1c Measurement. Clinical Chemistry 56 (8): 1362-1364.
- Nathan DM, Kuenen J, Borg R, Zheng H, Schoenfeld D, Heine RJ 2008. Translating the A1c assay into estimated average glucose values. Diabetes Care 31: 2399-2400.
- Lee ST, Weykamp CW, Lee YW, Kim JW, Ki CS. 2007. Effects of 7 hemoglobin variants on the measurement of glycohemoglobin by 14 analytical methods. Clin Chem 53: 2202-2205.
- Little RR, Tennill AL, Rohlfing C, Wiedm- eyer HM, Khanna R, Goel S, et al. 2002. Can glucohemoglobin be used to assess glycemic control in patients with chronic renal failure? Clin Chem 48 (5): 784-786.
- Selvin E, Hong Z, Brancati FL. 2009. Elevated A1c in adults Without a History of Diabetes in the U.S. Diabetes Care 32:
828-833. - Coban E, Ozdogan M, Timuragaoglu. 2004. Effect of Iron Deficiency Anemia on the Levels of Hemoglobin A1c in Nondiabetic Patients. Acta Haematol 112: 126-128.
- Panzer S, Kronik G, Lechner K, Bettelheim P, Newmann E, Dudczak R. 1982. Glycosylated hemoglobins (GHb): an index of red cell survival. Blood 59: 1348-1350.
- Herman WH, Ma Y, Uwaifo G, Haffner S, Kahn SE, Horton ES, Lachin JM, Montez MG, Brenneman T, Barrett-Connor 2007. Diabetes Prevention Program Research Group. Differences in A1C by race and ethnicity among patients with impaired glucose tolerance in the Diabetes Prevention Program. Diabetes 30: 2453-2457.
- Engelgau MM, Thompson TJ, Herman WH et al. 1997.Comparison of fasting and 2 hour glucose and HbA1c levels for diagnosing diabetes. Diabetes Care 20: 785-791.
- McCance Dr, Hanson RL, Charles MA, et al. 1994. Comparison of tests for glycated haemoglobin and fasting and two hour plasma glucose concentrations as diagnostic methods for diabetes. BMJ 308: 1323-1328.
- Nhanes III. National Health and Nutrition Examination Survey III, which was published in 1994.
- Vistisen D, Colagiuri S, Borch-Johnsen K. 2009. The DETECT-2 Collaboration. Bimodal distribution of glucose is not universally useful for diagnosing diabetes. Diabetes Care 32: 397-403.
- Selvin E, Steffes MW, Zhu H. 2010. Glycated hemoglobin, diabetes, and cardiovascular risk in nondiabetic adults. N Engl J Med 362: 800-811.
- Bennett AL, Guop M, Dharmage SC. 2007. HbA1C as a screening tool for detection of type 2 diabetes: a systematic review. Diabet Med 24: 333-343.
- Gómez-Pérez FJ, Aguilar CA, Almeda P, Cuevas D, Lerman I, Rull J. 2010. HbA1c for the Diagnosis of Diabetes Mellitus in a Developing Country. Arch of Med Res 41: 302-308.
- Devin M, Mann MD, Carson A, Shimbo D, Fonseca V. Fox C, Muntner P. 2010. Impact of HbA1c screening criterion on the diagnosis of pre-diabetes among US adults Diabetes Care 33: 2190-2195.
- Getaneh A, Andres R, Brillon D, Findley S. The A1c criterion for diabetes diagnosis among hispanic and non hispanic populations. DOI. 10.4158/EP10119-OR.
- Fajans S, Herman WH. Insufficient sensitivity of hemoglobin A1c determination in diagnosis or screening of early diabetic states. Metabolism DOI 10.1016/j.metab 2010.06.017