Melatonina inhibe la respuesta de cortisol a ACTH.
Posible mediación a través del gen reloj PER1
Francisco J. Valenzuela1a, Henry E. Reynolds1b, Claudia Torres-Farfán2c, Auristela Rojas1d, Guillermo J. Valenzuela3e y María Serón-Ferré1c
Melatonin inhibition of the cortisol response to acth may be exerted through period circadian protein homolog 1 (Per1)
1Facultad de Medicina, Programa de Fisiopatología, Instituto
de Ciencias Biomédicas, Universidad de Chile, Santiago, Chile.
2Instituto de Anatomía, Histología y Patología, Universidad
Austral de Chile, Valdivia, Chile.
3Department of Women’s Health, Arrowhead Regional
Medical Center, Colton, CA, USA.
aCandidato a Doctor en Ciencias Biomédicas, Facultad de
Medicina, Universidad de Chile.
bTesista de Bioquímica, Facultad de Ciencias Químicas y
Farmacéuticas, Universidad de Chile.
cPhD.
dTecnólogo Medico.
eMédico Cirujano.
Este trabajo fue financiado por la Sociedad Chilena
de Endocrinología y Metabolismo (proyecto SOCHED
2009-07) y el Fondo Nacional de Ciencia y Tecnología
(Fondecyt 1090381).
Correspondencia y solicitudes:
María Serón-Ferré (PhD), Salvador 486, Providencia,
Santiago, Chile, Departamento de Fisiopatología, ICBM, Facultad de Medicina, Universidad de
Chile, Casilla 16038, Santiago 9, Santiago, Chile.
Fax 56-2-2741628
E-mail: mseron@med.uchile.cl
Recibido: 15 septiembre 2011
Aceptado: 21 noviembre 2011
Background: Circadian cortisol production results from the interaction of the circadian
production of ACTH, the autonomic nervous system and intrinsic factors within
the gland. An additional regulator is the neuro-hormone melatonin. In human
adrenal gland cultures, melatonin inhibited ACTH stimulated cortisol production
and Per1 mRNA expression. ACTH actions on the adrenal involve early and late
responses. Aim: To investigate the effects of melatonin on the time course of ACTH
stimulated cortisol production and of Per1 expression in the lamb adrenal gland.
Material and Methods: Adrenal glands and plasma of five newborn lambs were
obtained. Adrenal glands were cut in 15 mg explants. Three of these explants were
stored for RNA extraction. The rest of explants were using in different culture protocols
with ACTH and melatonin. Results: Lambs had an in vivo a circadian variation
in plasma cortisol and in adrenal Per1 expression. In vitro, ACTH stimulated
an early and late increase in cortisol production and an early increase in Per1
expression reaching a maximum at 3 hours of treatment. Melatonin inhibited the
early Per1 response to ACTH without affecting the early ACTH stimulated cortisol
production. However, melatonin inhibited the late response of cortisol production
to ACTH. Conclusions: The inhibitory actions of melatonin on Per1 response to
ACTH may contribute to the inhibitory effects of melatonin on adrenal steroidogenic
response to ACTH.
Key words: Adrenal, Melatonin, Cortisol, clock genes, Per1.
Los glucocorticoides participan en prácticamente todas las funciones fisiológicas del organismo (respuesta al estrés, metabolismo, proliferación celular y respuesta inmunológica). Además están involucrados en la fisiopatología de enfermedades como la diabetes mellitus, el síndrome metabólico y la enfermedad de Cushing. La secreción de glucocorticoides presenta un marcado ritmo circadiano, con máximas concentraciones plasmáticas al comienzo de la etapa de actividad del individuo1,2. La producción circadiana de cortisol está regulada por la acción coordinada del ritmo circadiano de ACTH en plasma, el sistema nervioso autónomo a través de la inervación de la glándula suprarrenal y también por factores intrínsecos de esta glándula3,4. Asimismo, la glándula suprarrenal está expuesta cada noche al aumento de la concentración plasmática de melatonina, como consecuencia del ritmo circadiano de síntesis de esta hormona5. Melatonina, actuando directamente a través del receptor MT1, inhibe la respuesta de glucocorticoides a ACTH en las glándulas suprarrenal de primates no humanos, ovejas y de ratas6-8. Este efecto inhibitorio de melatonina sobre la producción de cortisol estimulada por ACTH, también está presente en la suprarrrenal humana9,10.
La glándula suprarrenal posee un reloj circadiano cuyos genes se expresan en la suprarrenal humana y de otras especies9,11,12. A nivel molecular, los relojes circadianos son generados por la interacción de un grupo de genes colectivamente denominados genes reloj y sus proteínas en un circuito autoregulado transcripcional/traduccional. Los máximos y mínimos de la expresión de los mRNA de los reguladores positivos Bmal1 y Clock y de los negativos Per1-2 y Cry1-2 muestran una expresión horaria opuesta en las 24-h. El heterodímero BMAL-CLOCK se une a las cajas E del promotor de los genes Per estimulando su transcripción3. Estudios utilizando microarreglos en la suprarrenal de primates no-humanos y en la rata demuestran una organización en las 24-h de la expresión de genes relacionados con diversas funciones biológicas: procesamiento de colesterol, enzimas y cofactores relacionados con la esteroidogénesis, síntesis y metabolismo de catecolaminas y síntesis y degradación de proteínas. Entre estos genes se encuentran Star, 3β-HSD y Cyp21 y el gen del receptor de ACTH (MCR2)11,12,13. Los genes reloj participan en la estimulación por ACTH de la producción de glucocorticoides, demostrado en ratones knockout y mediante supresión con sondas antisentido en la suprarrenal del mono capuchino12,14.
En suprarrenales humanas cultivadas por 12 horas, ACTH junto con estimular la expresión de las proteínas esteroidogénicas StAR and 3β-HSD y la producción de cortisol y progesterona, también estimuló la expresión del mRNA del gen Per1. Tanto la respuesta esteroidogénica a ACTH como la respuesta del gen reloj Per1, fueron inhibidas por melatonina10. Las acciones esteroidogénicas de ACTH involucran una respuesta temprana a través de la movilización de colesterol a las mitocondrias y una respuesta más prolongada a través de la inducción de genes de enzimas esteroidogénica15. Para aclarar sobre cuál de estas respuestas actúa melatonina, investigamos su efecto sobre la producción de cortisol y expresión de Per1 estimulada por ACTH, utilizando como modelo experimental la glándula suprarrenal de un animal diurno, el cordero de 5 días de edad.
Protocolos Experimentales y Métodos
1. Obtención de tejidos y plasma
Obtuvimos las glándulas suprarrenales y plasmas de corderos
recién nacidos destinados a investigaciones del Proyecto
Fondecyt 1090381. Los corderos nacieron en el vivero
de animales mayores de la Facultad de Medicina, ubicado en
el Programa de Fisiopatología, Campus Oriente, permaneciendo
con sus madres en jaulas individuales en condiciones
de luz:oscuridad 12:12, con disposición de agua ad libitum y
alimentación 2 veces al día. A los 4-6 días de edad los corderos
se sedaron con 10 mg/kg de peso de ketamina (KETAMIL,
Troy Laboratories, Australia) y se eutanizaron con una
sobredosis de 100 mg/kg de peso de tiopental sódico (OPET,
Jagsonpal Pharmaceutical Ltd, India) vía intravenosa a las
08 h (n = 4), 14 h (n = 14) y 20 h (n = 5). Se tomó una muestra
de sangre heparinizada para medir la concentración de cortisol
en plasma y se disecaron y pesaron ambas glándulas suprarrenales
en condiciones estériles. Inmediatamente de obtenidas,
las suprarrenales se cortaron en explantes de 15 mg,
tres explantes (representando la expresión de genes in vivo)
se guardaron en TRIzol (INVITROGEN, California, USA)
o en buffer de Lisis (PROMEGA, Madison, WI, USA) para
extracción de RNA. Los restantes explantes de suprarrenal
de los animales eutanizados a las 14 h se preincubaron por 9
hrs en medio DMEM-F12, GIBCO, a 37ºC, en atmosfera de
aire y 5% CO2 y luego se utilizaron en los tres protocolos de
cultivo descritos a continuación. Los protocolos experimentales
fueron aprobados por el Comité de Ética de la Facultad
de Medicina de la Universidad de Chile y de Fondecyt.
2. Protocolos experimentales
Protocolo 1. Efecto directo de melatonina sobre la producción
de cortisol y la expresión del gen reloj Per1 en respuesta
al tratamiento por 12h con ACTH.
Una vez completado el precultivo, los explantes de suprarrenal
de 5 corderos se cultivaron en triplicado en 500 μL
de medio solo (control), en medio con ACTH 10 nM y en
medio con ACTH 10 nM + Melatonina 100 nM. Una vez
finalizada la incubación, los explantes de cada tratamiento
se pesaron y guardaron en buffer de lisis. El sobrenadante
se guardό a -20 ºC para medir la producción de cortisol por
RIA16. La producción de cortisol se expresό como porcentaje
del control.
Protocolo 2. Efecto directo de melatonina sobre el curso
temporal de la respuesta de cortisol a ACTH en explantes
de glándula suprarrenal de corderos recién nacidos.
Los explantes de suprarrenal de 5 corderos se cultivaron
por 20 horas con medio solo y con ACTH 10 nM. Un tercer
grupo de explantes se cultivo por 8 h con ACTH 10 nM +
Melatonina 100 nM, luego se cambió el medio por ACTH
10 nM hasta completar las 20 horas de incubación. Cada 4
horas se recolectaron 3 explantes de cada tratamiento que se
pesaron y guardaron en TRIzol, el sobrenadante se guardo
a -20 ºC para medir la producción de cortisol por RIA. La
producción de cortisol se expresό como producción por mg
de tejido.
Protocolo 3. Efecto directo de melatonina sobre el curso
temporal de la expresión de Per1 en explantes de la glándula
suprarrenal de corderos recién nacidos durante las
primeras ocho horas de tratamiento con ACTH.
Los explantes de 4 animales se mantuvieron en cultivo
por 8 h en las condiciones descritas para el protocolo 1, recolectándose
3 explantes cada hora que se pesaron y guardaron
en TRIzol para medir la expresión de Per1.
3. Extracción de RNA y transcripción reversa
El RNA de las muestras guardadas en TRIzol se extrajo siguiendo las instrucciones del fabricante, seguido de un tratamiento con DNAsa utilizando las columnas del Kit SV Total RNA Isolation System, Promega. Las otras muestras guardadas en buffer de lisis se extrajeron con el mismo kit anterior, que incluye un tratamiento con DNAsa. Todos los RNA se almacenaron a -20°C. La transcripción reversa se realizó con 0,3 μg -1,3 μg de RNA extraídos por buffer de lisis, con 100 ng de hexameros random y 200 U M-MLV RT (INVITROGEN), volumen final de 20 μL. Las condiciones de transcripción fueron: 65ºC durante 5 minutos, 4ºC durante 5 minutos; 37ºC durante 2 minutos; 25ºC durante 10 minutos; 37ºC durante 50 minutos y 70ºC durante 15 minutos.
4. PCR en tiempo real
La expresión del mRNA del gene Per1 se midió por PCR cuantitativo (Applied Biosystem, Foster City, CA, USA) usando 0,3 μM de partidores de Per1 (For 5’-GGGCAAGGACTCAGAAAGAA- 3’ y Rev 5’-AGGCTCCATTGCTGGTAGAA- 3’; Cushman et al, 2007). Las condiciones de PCR fueron: denaturación inicial de 95ºC por 10 min y 45 ciclos de 95ºC por 15 seg y 60ºC de annealing/extensión por 1 minuto. La cuantificación se realizó interpolando las lecturas de las muestras en una curva estándar elaborada a partir de una cantidad conocida de producto de PCR, purificado y cuantificado mediante el software Scion Image (www.scioncorp.com), con respecto a un marcador de DNA. Los resultados se expresaron como fg Per1*1.000/ng RNA.
5. Análisis estadístico
Los resultados se expresaron como promedio ± error estándar (SEM). Los promedios se compararon por ANOVA de una vía, paramétrico o no paramétrico según lo apropiado y los test de Tukey y Dunn como post-hoc test, utilizando GraphPad Software, Inc. Prism (versión 5.0). Los resultados se consideraron significativas cuando P < 0,05.
Resultados
El cordero de 5 días de edad muestra cambios en la concentración plasmática de cortisol plasmático con la hora del día, siendo más alta a las 08 h que a las 20 h (Figura 1A). Los promedios de la concentración plasmática de cortisol calzan en una ecuación periódica de 24 h con un R2 = 0,56 consistente con una variación circadiana. La suprarrenal del cordero recién nacido, expresa el mRNA de Per1 con un mínimo a las 20 h sugiriendo una oscilación circadiana (Figura 1B). No detectamos diferencias en el peso de la suprarrenal con la hora del día.
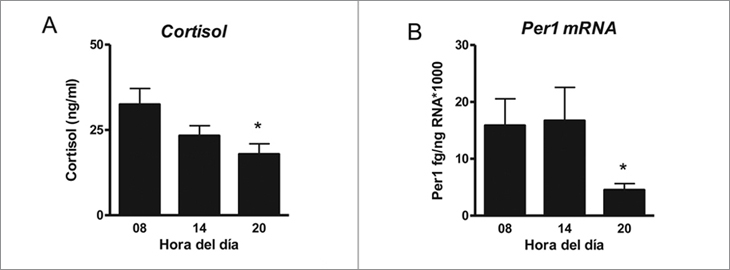 Figura 1. Función circadiana in vivo de la glándula suprarrenal del
cordero recién nacido. A. Promedio ± SEM de la concentración plasmática
de cortisol a las 08 h (n = 4), 14 h (n = 6) y 20 h (n = 5).
B. Promedio ± SEM de la expresión cuantitativa del mRNA de Per1
en las suprarrenales de los mismos animales .*P < 0,05, ANOVA una
vía, distinto de 08 h y test de Dunn.
Figura 1. Función circadiana in vivo de la glándula suprarrenal del
cordero recién nacido. A. Promedio ± SEM de la concentración plasmática
de cortisol a las 08 h (n = 4), 14 h (n = 6) y 20 h (n = 5).
B. Promedio ± SEM de la expresión cuantitativa del mRNA de Per1
en las suprarrenales de los mismos animales .*P < 0,05, ANOVA una
vía, distinto de 08 h y test de Dunn.
Efecto directo de melatonina sobre la producción de cortisol y la expresión del gen reloj Per1 en respuesta al tratamiento por 12 h con ACTH de explantes de glándula suprarrenal de corderos recién nacidos.
El tratamiento por 12 h con ACTH aumentó la producción de cortisol expresada como porcentaje de la producción por explantes de suprarrenal tratados con medio solo. Asimismo, aumento la expresión del gen reloj Per1. La presencia de melatonina en el medio inhibió ambos efectos de ACTH (Figuras 2A y 2B, respectivamente).
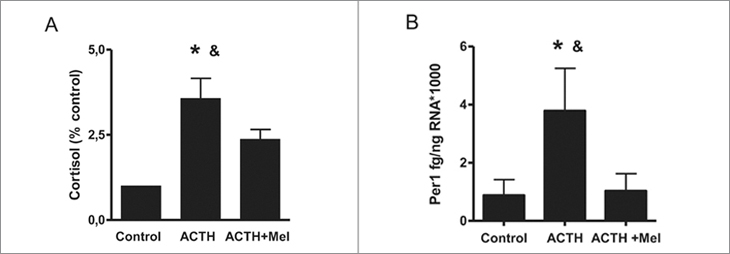 Figura 2. Efecto directo de melatonina sobre la producción de cortisol
y la expresión del gen reloj Per1 en respuesta al tratamiento
con ACTH por 12 h en explantes de glándula suprarrenal del cordero
recién nacido. A. Promedio ±SEM de la producción de cortisol expresada
como porcentaje del control, en suprarrenales tratadas con
ACTH 10 nM y ACTH + melatonina 100 nM por 12 horas. B. Promedio
± SEM de la expresión cuantitativa del mRNA de Per1, en suprarrenales
tratadas con ACTH 10nM y ACTH + melatonina 100nM por
12 horas, *P < 0,05, distinto del control y distinto de ACTH + Mel,
ANOVA una vía para mediciones repetidas y test de Tukey.
Figura 2. Efecto directo de melatonina sobre la producción de cortisol
y la expresión del gen reloj Per1 en respuesta al tratamiento
con ACTH por 12 h en explantes de glándula suprarrenal del cordero
recién nacido. A. Promedio ±SEM de la producción de cortisol expresada
como porcentaje del control, en suprarrenales tratadas con
ACTH 10 nM y ACTH + melatonina 100 nM por 12 horas. B. Promedio
± SEM de la expresión cuantitativa del mRNA de Per1, en suprarrenales
tratadas con ACTH 10nM y ACTH + melatonina 100nM por
12 horas, *P < 0,05, distinto del control y distinto de ACTH + Mel,
ANOVA una vía para mediciones repetidas y test de Tukey.
Efecto directo de melatonina sobre el curso temporal de la respuesta de cortisol a ACTH en explantes de glándula suprarrenal de corderos recién nacidos.
En mediciones realizadas cada 4 h por 20 h, observamos un patrón bifásico en la producción de cortisol estimulada por ACTH como se observa en la Figura 3. Inicialmente, en las primeras 8 h de tratamiento, se observa un aumento de la producción de cortisol por los explantes estimulados por ACTH, efecto que aumenta en las segundas 8 horas de incubación. La exposición a melatonina en cultivos con ACTH por las primeras 8 horas, no cambia la producción de cortisol durante este intervalo (Figura 3). Sin embargo, esta exposición a melatonina disminuye la producción de cortisol en las siguientes 8 horas de tratamiento con ACTH.
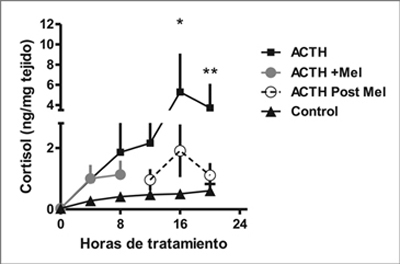 Figura 3. Efecto directo de melatonina sobre el curso temporal de la respuesta de
cortisol a ACTH en explantes de glándula suprarrenal de corderos recién nacidos.
Promedio ± SEM de la producción de cortisol medida cada 4 horas en explantes
cultivados con medio solo (control), ACTH 10 nM o ACTH + Melatonina 100nM
por 7 horas y luego cambiado por ACTH solo (Post melatonina con ACTH). (*,**
P < 0,05 n = 5, distinto de las 0, ANOVA una vía para mediciones repetidas, y
test de Tukey).
Figura 3. Efecto directo de melatonina sobre el curso temporal de la respuesta de
cortisol a ACTH en explantes de glándula suprarrenal de corderos recién nacidos.
Promedio ± SEM de la producción de cortisol medida cada 4 horas en explantes
cultivados con medio solo (control), ACTH 10 nM o ACTH + Melatonina 100nM
por 7 horas y luego cambiado por ACTH solo (Post melatonina con ACTH). (*,**
P < 0,05 n = 5, distinto de las 0, ANOVA una vía para mediciones repetidas, y
test de Tukey).
Efecto directo de melatonina sobre el curso temporal de la expresión de Per1 en explantes de la glándula suprarrenal de corderos recién nacidos durante las primeras ocho horas de tratamiento con ACTH.
Basados en los resultados anteriores estudiamos la expresión de Per1 en respuesta a ACTH y a ACTH más melatonina durante las primeras 8h de tratamiento. Como se observa en la Figura 4A, la expresión de Per1 se mantiene constante cuándo los explantes de suprarrenal se incuban con medio solo (control). Cuando los explantes son tratados con ACTH, se produce un aumento progresivo en la expresión de Per1, alcanzando un máximo a las 3 horas de incubación para luego disminuir (Figura 4B). El efecto de ACTH sobre la expresión de Per1 es inhibido cuando melatonina está presente en el medio (Figura 4C).
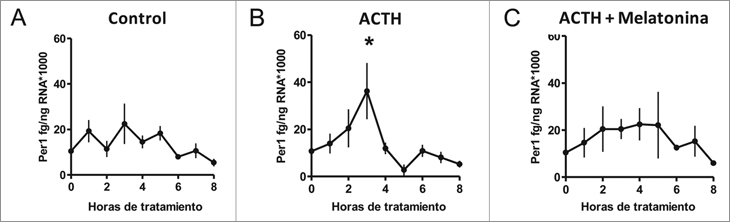 Figura 4. Efecto directo de melatonina sobre el curso temporal de
la expresión de Per1 en explantes de la glándula suprarrenal de
corderos recién nacidos durante las primeras ocho horas de tratamiento
con ACTH. Promedio ±SEM de la expresión de mRNA de
Per1 medida a cada hora en explantes de suprarrenal tratados con
(A) medio DMEM solo (control), (B) con ACTH 10 nM o (C) ACTH
100nM + Melatonina 100 nM (ACTH; * p < 0,05, n = 4, ANOVA de
una vía, mediciones repetidas y test de Tukey).
Figura 4. Efecto directo de melatonina sobre el curso temporal de
la expresión de Per1 en explantes de la glándula suprarrenal de
corderos recién nacidos durante las primeras ocho horas de tratamiento
con ACTH. Promedio ±SEM de la expresión de mRNA de
Per1 medida a cada hora en explantes de suprarrenal tratados con
(A) medio DMEM solo (control), (B) con ACTH 10 nM o (C) ACTH
100nM + Melatonina 100 nM (ACTH; * p < 0,05, n = 4, ANOVA de
una vía, mediciones repetidas y test de Tukey).
Discusión
En la glándula suprarrenal, ACTH induce una respuesta temprana de la producción de glucocorticoides, a través de la movilización de colesterol a las mitocondrias y una respuesta tardía a través de la inducción de genes de enzimas esteroidogénicas15. En el presente trabajo, detectamos aumentos tempranos y tardíos en la producción de cortisol estimulado por ACTH. Melatonina inhibió sólo la respuesta tardía de cortisol a ACTH. Junto con esto encontramos que ACTH indujo un aumento temprano de la expresión de Per1, efecto inhibido por melatonina. Las acciones inhibitorias tempranas de melatonina sobre Per1 contribuirían a la inhibición por melatonina de la respuesta de cortisol a ACTH.
En este estudio usamos como modelo experimental la glándula suprarrenal de un animal diurno, el cordero de 5 días de edad. Este animal muestra un ritmo de cortisol en plasma con valores más altos a las 08 que a las 20 horas, patrón similar a lo descrito en otros animales diurnos como el mono y el humano. A nivel suprarrenal encontramos un ritmo de la expresión del gen reloj Per1, lo que sugiere que la suprarrenal de cordero contiene un reloj circadiano, al igual que en otras especies9,11,13.
Utilizando explantes de glándula suprarrenales de cordero, confirmamos la acción inhibitoria de melatonina sobre la producción de cortisol estimulada por ACTH ya reportada cuando la exposición a ambas hormonas en cultivo se prolonga por 12 horas o más10,7,8. También confirmamos el hallazgo de una mayor expresión de Per1 en explantes tratados por 12h con ACTH y su inhibición por melatonina. Para ahondar en esta observación, estudiamos el patrón temporal de la respuesta de cortisol a ACTH, medido como la producción de cortisol cada 4h, manteniendo constante la concentración de ACTH, observando dos fases de aproximadamente 8 horas de duración cada una. No observamos efectos de melatonina sobre la fase inicial de la respuesta de cortisol a ACTH. Sin embargo, el tratamiento con melatonina en presencia de ACTH durante las primeras 8 horas inhibió la segunda fase de respuesta a ACTH, indicando que acciones tempranas de melatonina son necesarias para la respuesta tardía. No sabemos si esto refleja una diferencia entre el cordero y otras especies. ya que no hay estudios en la literatura de tratamiento con ACTH y melatonina en tiempos menores a 12-h. Por otra parte, el requerimiento de una exposición a melatonina por 12 horas o más para producir el efecto inhibitorio sobre la producción de cortisol inducida por ACTH representaría una característica propia de la suprarrenal. Lo anterior es debido a que en otros tejidos esteroidogénicos (cuerpo lúteo equino y células de Leydig de hámster), los efectos inhibitorios de melatonina sobre la producción de progesterona y testosterona estimulada por HCG y sobre la expresión de genes de enzimas esteroidogénicas, se observa ya a las tres horas de tratamiento17,18.
A continuación, estudiamos detalladamente, a intervalos de una hora, el curso temporal de la expresión de Per1 durante la fase temprana de la respuesta esteroidogénica a ACTH (primeras 8 horas de tratamiento). Observamos que la expresión de Per1 se mantiene constante en explantes tratados con medio solo. En contraste, ACTH induce un rápido incremento en la expresión de Per1 que alcanza un máximo a las tres horas de incubación. Este patrón temporal no se observa en los explantes tratados con ACTH + melatonina, que mantienen niveles constantes de Per1. Este efecto de ACTH sobre Per1 y su curso temporal se asemeja a los efectos a tiempos cortos reportados para PTH en una línea celular de osteoblastos19,20, en células granulosas estimuladas por FSH21 y en una línea celular de glioma estimuladas con norepinefrina22. Las tres hormonas mencionadas junto con ACTH, utilizan receptores de membrana acoplados a proteína G, los cuales generan una señal de transducción vía cAMP-Proteína Kinase A y la proteína CREB (cAMP Response Element Binding Protein).
Varios antecedentes asocian los genes reloj, y en particular Per1, con la producción de glucocorticoides por la suprarrenal. In vivo, la mayor expresión de Per1 en la glándula suprarrenal se encuentra en las horas en que la producción de cortisol es más elevada13. Otros experimentos muestran que la estimulación del nervio esplácnico produce una rápida inducción de la expresión de Per1 en la suprarrenal y aumenta la secreción de corticosterona23. Por otra parte, la ausencia de expresión de Per2/Cry1 en ratones knockout reduce la producción de corticosterona e inhibe la respuesta a ACTH12. Finalmente, el bloqueo de la expresión de genes reloj con sondas antisentido inhibe la respuesta a ACTH14. El presente trabajo muestra además que melatonina afecta directamente la expresión de Per1 inducida por ACTH. Este hallazgo concuerda con observaciones anteriores en que demostramos que melatonina, en ausencia de ACTH es capaz de inhibir la expresión circadiana de Bmal1 y Per2 en cultivo de glándula suprarrenal11,24 y con la observación de que melatonina disminuye la expresión de genes reloj en neuronas del núcleo estriado de ratón25.
En conclusión, en el presente trabajo caracterizamos la función circadiana de la suprarrenal de cordero, demostrando que ACTH induce la expresión temprana de Per1. Además, identificamos acciones inhibitorias tempranas de melatonina sobre esta respuesta que podrían ayudar a entender los efectos inhibitorios de melatonina sobre la esteroidogénesis. Las similitudes entre la suprarrenal del cordero y la humana, permiten abordar preguntas respecto a los mecanismos involucrados en la interacción ACTH-genes reloj-melatonina en la regulación de la producción de cortisol, una hormona fundamental en la homeostasis fisiológica.
Agradecimientos
Agradecemos a Natalia Méndez, médico veterinario por las cirugías y el cuidado experto de los animales.
Referencias
- Orth DN and Kovacs WJ. 1998. The adrenal gland. In:Wilson J,
Foster D, Kronenberg, Larsen P editors. Williams textbook of
Endocrinology 9th edition. Philadelphia: W.B. Saunders Company.
- Nader N, Chrousos GP, Kino T. 2010. Interactions of the circadian
CLOCK system and the HPA axis. Trends Endocrinol Metab 21:
277-286.
- Dickmeis T. 2009. Glucocorticoids and the circadian clock. J Endocrinol 200: 3-22.
- Engeland WC, Arnhold MM 2005. Neural circuitry in the
regulation of adrenal corticosterone rhythmicity. Endocrine 28:
325-332.
- Dubocovich ML, Delagrange P, Krause DN, Sugden D,
Cardinali DP, Olcese J. 2010. International Union of Basic and
Clinical Pharmacology. LXXV. Nomenclature, classification,
and pharmacology of G protein-coupled melatonin receptors.
Pharmacol Rev 62: 343-380.
- Torres-Farfán C, Richter HG, Rojas-García P, Vergara M,
Forcelledo ML, Valladares LE, et al. 2003. mt1 Melatonin receptor
in the primate adrenal gland: inhibition of adrenocorticotropinstimulated
cortisol production by melatonin. J Clin Endocrinol
Metab 88: 450-458.
- Torres-Farfán C, Valenzuela FJ, Mondaca M, Valenzuela GJ,
Krause B, Herrera EA, et al. 2008. Evidence of a role for
melatonin in fetal sheep physiology: direct actions of melatonin
on fetal cerebral artery, brown adipose tissue and adrenal gland. J
Physiol 586: 4017-4027.
- Richter HG, Torres-Farfán C, García-Sesnich J, Abarzúa-Catalán
L, Henríquez MG, Alvarez-Felmer M, et al. 2008 Rhythmic
expression of functional MT1 melatonin receptors in the rat
adrenal gland. Endocrinology 149: 995-1003.
- Campino C, Valenzuela F, Arteaga E, Torres-Farfán C, Trucco
C, Velasco A, et al. 2008. Melatonin reduces cortisol response to
ACTH in humans. Rev Med Chile 136: 1390-1397.
- Campino C, Valenzuela FJ, Torres-Farfán C, Reynolds HE,
Abarzúa-Catalán L, Arteaga E, et al. 2011. Melatonin exerts direct
inhibitory actions on ACTH responses in the human adrenal gland.
Horm Metab Res 43: 337-342.
- Valenzuela FJ, Torres-Farfán C, Richter HG, Méndez N, Campino
C, Torrealba F, et al. 2008. Clock gene expression in adult primate
suprachiasmatic nuclei and adrenal: is the adrenal a peripheral
clock responsive to melatonin?. Endocrinology 149: 1454-1461.
- Oster H, Damerow S, Kiessling S, Jakubcakova V, Abraham D,
Tian J, et al. 2006. The circadian rhythm of glucocorticoids is
regulated by a gating mechanism residing in the adrenal cortical
clock. Cell Metab 4: 163-173.
- Lemos DR, Downs JL, Urbanski HF. 2006. Twenty-four-hour
rhythmic gene expression in the rhesus macaque adrenal gland.
Mol Endocrinol 20: 1164-1176.
- Torres-Farfán C, Abarzúa-Catalán L, Valenzuela FJ, Méndez
N, Richter HG, Valenzuela GJ, et al. 2009. Cryptochrome 2
expression level is critical for adrenocorticotropin stimulation
of cortisol production in the capuchin monkey adrenal.
Endocrinology 150: 2717-2722.
- Sewer MB, Waterman MR. 2001. Insights into the transcriptional
regulation of steroidogenic enzymes and StAR. Rev Endocr Metab
Disord 2: 269-274.
- Torres-Farfán C, Valenzuela FJ, Germain AM, Viale ML, Campino
C, Torrealba F, et al. 2006. Maternal melatonin stimulates growth
and prevents maturation of the capuchin monkey fetal adrenal
gland. J Pineal Res 41: 58-66.
- Pedreros M, Ratto M, Guerra M. 2011. Expression of functional
melatonin MT(1) receptors in equine luteal cells: in vitro effects
of melatonin on progesterone secretion. Reprod Fertil Dev 23:
417-423.
- Frungieri MB, Mayerhofer A, Zitta K, Pignataro OP, Calandra RS,
González-Calvar SI. 2007. Direct effect of melatonin on Syrian
hamster testes: melatonin subtype 1a receptors, inhibition of
androgen production, and interaction with the local corticotropinreleasing
hormone system. Endocrinology 146: 1541-1552.
- Hanyu R, Hayata T, Nagao M, Saita Y, Hemmi H, Notomi T,
et al. 2011. Per-1 is a specific clock gene regulated by parathyroid
hormone (PTH) signaling in osteoblasts and is functional for
the transcriptional events induced by PTH. J Cell Biochem 112:
433-438.
- Hinoi E, Ueshima T, Hojo H, Iemata M, Takarada T, Yoneda Y.
2006. Up-regulation of per mRNA expression by parathyroid
hormone through a protein kinase A-CREB-dependent mechanism
in chondrocytes. J Biol Chem 281: 23632-23642.
- He PJ, Hirata M, Yamauchi N, Hashimoto S, Hattori MA. 2007.
Gonadotropic regulation of circadian clockwork in rat granulosa
cells. Mol Cell Biochem 302: 111-118.
- Morioka N, Sugimoto T, Tokuhara M, Dohi T, Nakata Y. 2010.
Noradrenaline induces clock gene Per1 mRNA expression in C6
glioma cells through beta(2)-adrenergic receptor coupled with
protein kinase A-cAMP response element binding protein (PKACREB)
and Src-tyrosine kinase - glycogen synthase kinase-3beta
(Src-GSK-3beta). J Pharmacol Sci 113: 234-245.
- Ishida A, Mutoh T, Ueyama T, Bando H, Masubuchi S, Nakahara
D, et al. 2005. Light activates the adrenal gland: timing of gene
expression and glucocorticoid release. Cell Metab 2: 297-307.
- Torres-Farfán C, Mendez N, Abarzúa-Catalán L, Vilches N,
Valenzuela GJ, Seron-Ferre M 2011. A circadian clock entrained
by melatonin is ticking in the rat fetal adrenal. Endocrinology
152:1891-1900.
- Imbesi M, Arslan AD, Yildiz S, Sharma R, Gavin D, Tun N, et al. 2009. The melatonin receptor MT1 is required for the differential regulatory actions of melatonin on neuronal ‘clock’ gene expression in striatal neurons in vitro. J Pineal Res 46: 87-94.