Efecto de la ingesta aguda de vanillina sobre la resistencia insulínica en humanos
José E. Galgani F.1,2,3,a, Giannella Leonelli N.1,b, Karla Vásquez O.1,c, Alejandra Espinosa E.4,d y Fernando Carrasco N.1
Effect of a single oral dose of vanillin on insulin resistance in humans
1Departamento de Nutrición. Facultad de Medicina.
Universidad de Chile. Santiago. Chile.
2Departamento de Nutrición, Diabetes y Metabolismo.
3Escuela de Nutrición y Dietética. Facultad de Medicina.
Pontificia Universidad Católica de Chile. Santiago. Chile.
4Escuela de Tecnología Médica. Facultad de Medicina.
Universidad de Chile. Santiago. Chile.
aNutricionista, PhD.
bNutricionista, MSc.
cBioquímico.
dTecnólogo Médico, PhD.
Financiamiento: Proyecto SOCHED 2011-03 (JEG), Fondecyt 11090007 (JEG) y Fondecyt
11090301 (AE).
Conflictos de interés: Los autores declaran
la ausencia de conflictos de interés.
Correspondencia:
José E. Galgani, PhD.
Departamento de Nutrición,
Diabetes y Metabolismo. Facultad de Medicina. Pontificia,
Universidad Católica de Chile.
Alameda 340. Santiago, Chile.
Teléfono: 354 6389. Fax: 633 8298.
E-mail: jgalgani@uc.cl
Recibido: 07 de diciembre de 2012
Aceptado: 02 de enero de 2013
Background: NADPH oxidase is a source of reactive oxygen species that may contribute to insulin resistance (IR). Aim: To assess the effect of a single oral dose of vanillin (a putative inhibitor of the enzyme) on IR in humans. Material and Methods: Using a crossover, random, double-blind design, eight lean and 10 obese males ingested 600 mg of vanillin or placebo followed by the ingestion of 75 g of glucose. Serum/plasma glucose, free-fatty acids, insulin, glutathione, C reactive protein concentrations and red blood cell glutathione concentration were determined. Insulin resistance was estimated by the Matsuda index. Results: Under fasting conditions, obese individuals had higher glucose and insulin and lower red blood cell glutathione levels than their lean counterparts (p < 0.01). Serum free-fatty acids, total and oxidized plasma glutathione concentrations were similar in both groups. After glucose ingestion, obese individuals had a lower red blood cell total glutathione concentration and increased plasma oxidized glutathione concentration than their lean counterparts (p < 0.05). In addition, obese participants had a higher level of IR (p < 0.001) and impaired serum free-fatty acid suppression (p < 0.001) than their lean counterparts. Ingestion of vanillin did not modify any of these variables when compared with placebo in obese individuals. In lean volunteers a reduction in Matsuda index was detected when vanillin was administered, compared to placebo (4.3 ± 0.6 and 3.6 ± 0.6 respectively; p < 0.05). Conclusions: IR was ameliorated after vanillin ingestion among lean but not obese participants.
Key words: insulin sensitivity, oxidative stress, apocynin, NOX2, inflammation, obesity.
La obesidad está usualmente asociada a resistencia insulínica (RI), en la cual la menor acción insulínica es parcialmente compensada por una hipersecreción de la hormona1,2. Tanto la obesidad como la RI se caracterizan por ser estados pro-oxidantes y pro-inflamatorios3-5. En efecto, el exceso de producción de especies reactivas de oxígeno (EROs) relativo a su neutralización (i.e., estrés oxidativo) ha demostrado ser un factor causal de la RI6.
Las EROs poseen diverso origen sub-celular, siendo la mitocondria la principal fuente de estas moléculas7. La oxidación de NADPH (catalizado por la NADPH oxidasa) es otra fuente relevante de EROs8,9. Esta enzima puede ser activada por glucosa10,11, insulina12 y ácidos grasos10,13,14. Todas estas moléculas usualmente circulan en mayor concentración en obesidad. Al respecto, ratones obesos vs no obesos muestran mayor expresión de algunas subunidades de NADPH oxidasa (gp91phox y p47phox) en tejido adiposo15. En la misma línea, individuos con síndrome metabólico muestran mayor actividad de NADPH oxidasa en células mononucleares sanguíneas16.
Esta enzima también desempeña un papel central en las alteraciones inducidas por lípidos en el metabolismo hepático de glucosa. En este sentido, la exposición de una línea celular de hepatocitos a palmitato redujo la capacidad de la insulina por suprimir la liberación de glucosa. Sin embargo, este fenotipo se revirtió cuando la actividad de la NADPH oxidasa fue bloqueada de manera farmacológica o molecular13. Basado en lo anterior se ha propuesto que esta enzima puede mediar las alteraciones metabólicas derivadas de la obesidad16, lo cual ha incentivado la búsqueda de inhibidores de esta enzima.
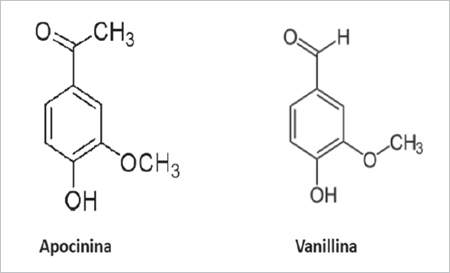
Existen diversos inhibidores de la NADPH oxidasa17,18, entre los que destaca la apocinina19. Esta molécula bloquea la translocación de p47phox desde el citosol a la membrana celular, previniendo su unión a gp91phox, y de esta forma la activación del complejo enzimático. Una molécula con alto grado de homología estructural a la apocinina es la vanillina (Figura 1), este último un ingrediente alimentario de amplio uso en humanos20. La vanillina posee actividad inhibitoria de NADPH oxidasa in vitro similar a la apocinina18. Por otra parte, recientemente demostramos que la vanillina inhibe ex vivo el “estallido respiratorio” en hígado de rata21, una respuesta mediada por la activación de la NADPH oxidasa presente en las células de Kupffer22. Finalmente, el efecto in vivo de un extracto vegetal rico en vanillina fue estudiado en ratas alimentadas con una dieta alta en grasa por 8 semanas. El grupo que recibió el extracto tuvo un perfil metabólico más favorable, caracterizado por una menor concentración circulante de glucosa, triglicéridos e insulina23.
La evidencia anterior sugiere que la vanillina podría ser una potencial estrategia para inhibir esta enzima y eventualmente prevenir las alteraciones metabólicas asociadas al estrés oxidativo. En humanos, el estudio de la acción in vivo de la ingesta de vanillina sobre parámetros metabólicos, inflamatorios y oxidantes permanece inexplorado. Este es nuestro primer estudio evaluando el efecto de una ingesta aguda y elevada de vanillina en individuos con y sin obesidad sobre la RI.
Sujetos y Métodos
Voluntarios
Ocho hombres delgados y 10 hombres obesos sanos (según examen físico y de laboratorio), no fumadores fueron reclutados por avisaje público (Tabla 1). Ninguno de ellos practicaba actividad física regularmente (> 60 min/semana), estaba sometido a dieta para modificar la masa corporal, o consumía fármacos y/o suplementos nutricionales. El estudio fue aprobado por el Comité de Ética de la Facultad de Medicina, Universidad de Chile, y los voluntarios firmaron el consentimiento informado previo a su participación.
Tabla 1. Características de los individuos
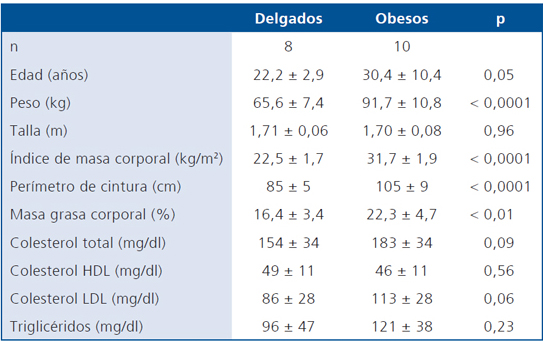 Datos expresados en promedio y desviación estándar.
Datos expresados en promedio y desviación estándar.Diseño experimental
Mediante un ensayo cruzado, aleatorio y de doble ciego se determinó el efecto de la vanillina sobre la RI. Después de la visita inicial, los voluntarios acudieron al Departamento de Nutrición (Universidad de Chile) en dos ocasiones en condiciones de ayuno nocturno de 10-12 h. Los voluntarios fueroninstruidos a mantener su dieta usual, evitar la actividad física intensa y consumo de alcohol por dos días previos a cada visita. En cada visita se determinó la masa y temperatura corporal. Posteriormente, se aplicó un cuestionario estándar para evaluar la presencia/ausencia de síntomas durante las últimas 12 h. Luego, se instaló una vía para la extracción de sangre venosa antes (-10 min) y después (30, 60, 90 y 120 min) de la ingesta de glucosa más placebo o vanillina. Al tiempo cero, los voluntarios ingirieron 75 g de glucosa disuelta en 290 ml de agua más dos cápsulas de vanillina (600 mg en total) o placebo. Una vez terminada la extracción de sangre, se aplicó el mismo cuestionario estándar, y esta vez se consultó por la presencia/ausencia de síntomas durante las últimas 2 h. Finalmente, se determinó la composición corporal mediante absorciometría de rayos X de energía dual (DXA; Lunar DPX-L, Lunar Radiation Corp. Madison, WI). La misma secuencia de procedimientos (excepto medición por DXA) se repitió 7 ± 1 días después.
Cápsulas
Cada cápsula contenía 300 mg de vanillina o placebo (dextrosa monohidratada grado alimenticio). Ambos tipos de cápsula estaban recubiertas por gelatina y fueron elaboradas por Alfa Chilena S.A. (Santiago, Chile).
Glucosa, ácidos grasos libres e insulina en suero
La glucosa fue determinada mediante el método de glucosa
oxidasa (error intra- e inter-ensayo < 1% y 1,5%, respectivamente).
Los ácidos grasos libres mediante un método
colorimétrico (WAKO Chemicals, NEFA-HR2; error intra- e
inter-ensayo < 1%, respectivamente). La insulina mediante
un ensayo de quimioluminiscencia directa e inmunoensayo
de sandwich de dos sitios (ADVIA Centaur; Bayer®; error
intra- e inter-ensayo < 4,5% y 5%, respectivamente). Estos
análisis se realizaron a los tiempos -10, 30, 60, 90 y 120 min.
La respuesta integrada postprandial para cada metabolito u
hormona se determinó calculando el área bajo la curva (AUC)
mediante el método del trapezoide. Por su parte, el grado de
RI se estimó a partir de las mediciones de glicemia e insulinemia
de ayuno y postprandial utilizando el índice de Matsuda24.
Glutatión total y oxidado en eritrocitos y plasma
La concentración de glutatión total (GSH) y oxidado (GSSG) se determinó mediante un ensayo de reciclaje enzimático basado en la acción de la glutatión reductasa25,26. Este ensayo tiene un error intra- e inter-ensayo < 1% y 2%, respectivamente. La medición de GSH y GSSG se realizó de forma paralela en las muestras sanguíneas extraídas en los tiempos -10, 30, 60 y 120 min. A partir de estos valores se determinó el área bajo la curva (AUC) mediante el método del trapezoide.
Proteína C-reactiva (PCR) ultrasensible en suero
La concentración sérica de PCR se determinó a través de un kit ELISA ultrasensible (human hsCRP ELISA, Biovendor, Czech Republic), el cual tiene un coeficiente de variación intra-ensayo de 2,9% e inter-ensayo de 4,1%. La medición se realizó a partir de muestras extraídas a los tiempos -10 y 120 min.
Síntomas y efectos adversos
La presencia de síntomas y efectos adversos se realizó mediante un cuestionario estándar27, el cual consulta por la presencia de 34 síntomas (ej. cansancio, hambre, somnolencia, etc.) a 4 intensidades (ausencia, ligera, moderada o intensa presencia).
Análisis estadístico
Los datos se presentan como promedio ± desviación o
error estándar. Para el análisis se utilizó el programa estadístico
SAS versión 9.2 (SAS Institute, Cary, NC). Los datos se
analizaron mediante análisis de covarianza (PROC MIXED)
con medidas repetidas. El tratamiento (placebo vs vanillina),
grupo (delgados vs obesos) y su interacción (tratamiento ×
tiempo) fueron los efectos determinantes. La significancia
estadística entre comparaciones múltiples fue ajustada mediante
el test de Tukey-Kramer. La frecuencia de síntomas y
efectos adversos se evaluó mediante análisis de c2. El nivel
de significancia fue de 5%.
Resultados
Todos los voluntarios completaron satisfactoriamente el protocolo de estudio. No hubo cambios de masa corporal durante el estudio en delgados (0,03 ± 0,35 kg; p = 0,85) y obesos (0,09 ± 1,23 kg; p = 0,82). Las cápsulas fueron bien toleradas y la presencia o ausencia de síntomas y eventos adversos fue similar entre el placebo y la vanillina (p > 0,05).
Proteína C-reactiva en suero y concentración de glutatión total y oxidado en plasma
La concentración de PCR en individuos obesos respecto a delgados fue mayor cualquiera sea la condición evaluada (Tabla 2). No se observó cambios en la concentración de PCR en la transición ayuno-postprandial (p = 0,50) o en respuesta a la vanillina (p = 0,66).
La concentración de glutatión total y oxidado plasmático en ayuno fue similar entre grupos (Tabla 2). La razón glutatión total/oxidado fue diferente entre los días de estudio (p = 0,04, Tabla 2), lo cual no puede ser atribuido a la ingestión de la vanillina dado que la medición se realizó en ayuno. En respuesta a la ingesta de glucosa, se calculó el área bajo la curva para el glutatión total, oxidado y la razón entre ambos. En relación al glutatión total, no hubo diferencias en función del grupo o la vanillina. Sin embargo, el área bajo la curva para el glutatión oxidado fue mayor, y consecuentemente, la razón glutatión total/oxidado fue menor en obesos respecto a delgados (Tabla 2). Ninguna de estas variables fue influenciada por la ingesta de vanillina (Tabla 2).
Tabla 2. Concentración de proteína-C reactiva y glutatión plasmático en delgados y obesos
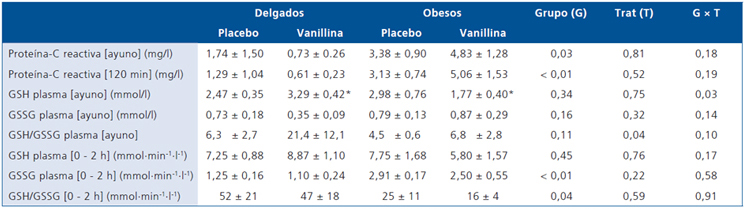
GSH, glutatión total; GSSG, glutatión oxidado; [0-2 h] corresponde al área total bajo la curva en respuesta a la ingesta de glucosa; Trat, tratamiento (placebo vs vanillina). *p < 0,05.
Concentración de glutatión en eritrocitos
La concentración de glutatión total en eritrocitos evaluada en ayuno (p = 0,04) o la respuesta integrada postprandial (p = 0,02) fue mayor en delgados vs obesos (Figura 2). Respecto al glutatión oxidado no se observaron diferencias entre grupos tanto en ayuno (p = 0,75) como postprandial (p = 0,89) (Figura 2). De igual forma, no se observaron diferencias entre grupos para la razón glutatión total/oxidado. Respecto al efecto de la ingesta de la vanillina, la concentración de glutatión total u oxidado no fue modificada (p = 0,37- 0,93; Figura 2).
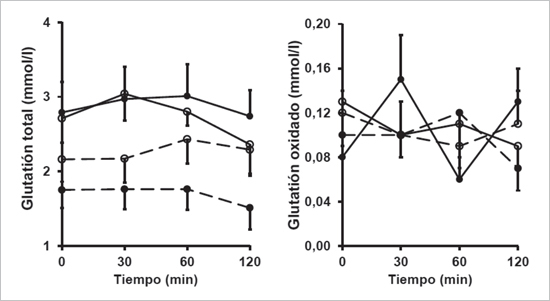 Figura 2. Concentración de glutatión total y oxidado en eritrocitos antes y después
de la ingesta de glucosa en delgados y obesos. Línea continua: Delgados;
Línea discontinua: Obesos. Círculo abierto: Placebo; Círculo cerrado: Vanillina.
Datos expresado en promedio y error estándar.
Figura 2. Concentración de glutatión total y oxidado en eritrocitos antes y después
de la ingesta de glucosa en delgados y obesos. Línea continua: Delgados;
Línea discontinua: Obesos. Círculo abierto: Placebo; Círculo cerrado: Vanillina.
Datos expresado en promedio y error estándar.
Respuesta glicémica
Los obesos respecto a los delgados tuvieron mayor glicemia en ayuno (p < 0,0001) y postprandial (p < 0,001) (Figura 3). En respuesta a la ingestión de glucosa, la glicemia alcanzó el valor máximo a los 30 y 60 min en delgados y obesos, respectivamente. A los 120 min, la glicemia fue similar a la observada en ayuno en delgados (p = 0,78-0,95) y obesos (p = 0,13-0,15). Respecto al tratamiento, la respuesta integrada postprandial no fue modificada por la ingesta de vanillina en delgados (p = 0,97) y obesos (p = 0,97) (Figura 3).
Respuesta insulínica y grado de resistencia insulínica
Los obesos respecto a los delgados tuvieron mayor insulinemia en ayuno (p < 0,01) y postprandial (p = 0,02) (Figura 3). En respuesta a la ingestión de glucosa, la insulinemia alcanzó el valor máximo entre los 30 y 60 min en ambos grupos (Figura 3). A los 120 min, la insulinemia fue similar a la observada en ayuno en delgados (p = 0,67-0,99), pero no en obesos (p < 0,05) (Figura 3). La respuesta integrada postprandial no fue modificada por la ingesta de vanillina vs placebo en delgados (p = 0,77) y obesos (p = 0,99) (Figura 3).
El grado de RI fue mayor en obesos vs delgados (menor valor de índice de Matsuda, Figura 4). El tratamiento con vanillina no modificó la RI en obesos, con una diferencia relativa ([vanillina–placebo]/placebo×100) de -3,7 ± 9,0% (rango: -47,0-48,2%; p = 0,69). Sin embargo, la vanillina vs placebo mostró una diferencia relativa de 27,6 ± 11,8% (rango: 0,2-98,4%; p = 0,05), es decir, el grado de RI fue menor posterior a la ingesta de vanillina vs placebo.
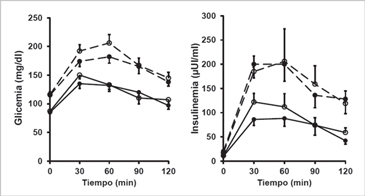 Figura 3. Concentración de glucosa e insulina en suero antes y después de la
ingesta de glucosa. Línea continua: Delgados; Línea discontinua: Obesos. Círculo
abierto: Placebo; Círculo cerrado: Vanillina. Datos expresado en promedio y error
estándar.
Figura 3. Concentración de glucosa e insulina en suero antes y después de la
ingesta de glucosa. Línea continua: Delgados; Línea discontinua: Obesos. Círculo
abierto: Placebo; Círculo cerrado: Vanillina. Datos expresado en promedio y error
estándar. 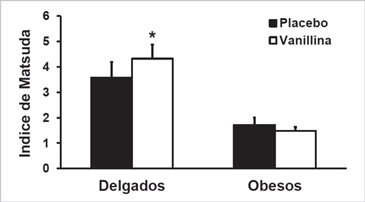 Figura 4. Índice de resistencia insulínica en obesos y delgados después de la
ingesta de placebo y vanillina. Datos expresado en promedio y error estándar.
*Placebo vs Vanillina: p < 0,05.
Figura 4. Índice de resistencia insulínica en obesos y delgados después de la
ingesta de placebo y vanillina. Datos expresado en promedio y error estándar.
*Placebo vs Vanillina: p < 0,05.
Ácidos grasos libres
La concentración de ácidos grasos libres en ayuno fue similar en delgados respecto a obesos (385 ± 45 vs 484 ± 55 μmoles/l, respectivamente; p = 0,91). En respuesta a la ingestión de glucosa, la concentración de ácidos grasos libres disminuyó en ambos grupos, sin embargo, se observó una tendencia a una mayor supresión en delgados vs obesos (-84 ± 4 vs -42 ± 17%, respectivamente; p = 0,09). Tal patrón se hizo evidente una vez calculado el área bajo la curva, existiendo un menor valor en delgados vs obesos (216 ± 23 vs 581 ± 105 μmoles·min-1·l-1, respectivamente; p < 0,001).
El tratamiento con vanillina no modificó el grado de supresión (p = 0,59) o respuesta integrada (p = 0,31) de ácidos grasos libres séricos.
Discusión
La ingesta aguda de 600 mg de vanillina mostró un modesto aunque significativo efecto atenuador de la RI. Esto fue evidente sólo en delgados, mientras que en obesos, a pesar de su mayor grado de RI, estrés oxidativo e inflamación no hubo modificaciones en este parámetro. Los cambios en el grado de RI inducidos por la vanillina no fueron acompañados por cambios en el estado oxidativo e inflamatorio, al menos en los indicadores utilizados en este estudio.
Un aspecto a considerar en la interpretación de estos resultados es la exposición a la vanillina que tuvieron delgados y obesos. En humanos, la ingesta máxima permitida de vanillina es de 10 mg/kg/día28, por lo que la dosis suministrada en este estudio debiera ser inocua en la mayor parte de la población adulta. Considerando la diferencia en masa corporal entre grupos, la dosis suministrada por kg de masa corporal fue en promedio 1,4 veces mayor en delgados vs obesos. Esto puede haber determinado el menor potencial de detectar diferencias en individuos con obesidad. Un modelo a explorar es la administración crónica de vanillina (ej. semanas o meses). No optamos por tal intervención por razones presupuestarias y de seguridad de la dosis administrada, en parte por ser este el primer estudio en humanos utilizando una dosis oral elevada de vanillina.
La falta de resultados más consistentes puede estar determinada por una pérdida de actividad de esta molécula al ser administrada por vía oral. La vanillina puede ser oxidada en presencia del pH ácido del estómago como también convertida en el hígado a ácido vanillínico. Este último posee menor actividad como inhibidor de NADPH oxidasa29,30. Adicionalmente, la vanillina podría tener una baja tasa de absorción intestinal, previniendo su llegada a los órganos blancos. El hallazgo que la infusión directa de vanillina al hígado inhibió el estallido respiratorio demuestra que esta molécula puede efectivamente inducir cambios hepáticos21. Aun así, en el presente estudio observamos una reducción de la RI en todos los individuos delgados posterior a la administración oral de vanillina vs placebo.
El indicador de RI utilizado en este estudio24 no permite dilucidar si la diferencia en RI está atribuida a una menor absorción intestinal de glucosa, mayor utilización tisular de glucosa o mayor capacidad supresora de la producción hepática de glucosa.
Considerando que el intestino delgado seguido por el
hígado serán los órganos de mayor exposición a un agente
administrado por vía oral, el efecto de la vanillina sobre tales
procesos puede ser un blanco interesante de estudio. Dado
que la respuesta glicémica fue similar entre el placebo y la
vanillina, sugiere que la absorción intestinal de glucosa no
resultó afectada por la vanillina, aunque mediciones específicas
permitirán confirmar este aspecto. De esta forma, si el
cambio en la RI no está atribuido a diferencias en la absorción
intestinal de vanillina, y tomando en cuenta la relevancia
de este órgano en la regulación de la tolerancia oral a la
glucosa y la RI31, el potencial efecto atenuador de la vanillina
sobre la actividad de NADPH oxidasa, estrés oxidativo y RI
en hígado parece una hipótesis atractiva.
En este estudio confirmamos el hallazgo que marcadores de estrés oxidativo e inflamación están aumentados en obesos vs delgados3,5,15. Sin embargo, fracasamos en observar el aumento en marcadores de estrés oxidativo e inflamación reportados en respuesta a la ingesta de una solución oral de glucosa, los cuales incluyen mayor expresión génica de IL1α, IL1β, IL6, p47phox como también en el contenido proteico de p47phox en membrana celular de células mononucleares circulantes32-35. Algunos de estos cambios muestran ser atenuados cuando sustancias anti-oxidantes naturales se consumen de manera conjunta con la glucosa34. Los indicadores de estrés oxidativo e inflamación usados en este estudio pueden no ser suficientemente sensibles para detectar cambios agudos en el estado inflamatorio y oxidante.
En conclusión, la ingesta de 600 mg de vanillina fue bien tolerada por los individuos de este estudio. Su ingesta se acompañó de una reducción de la RI de manera consistente en todos los sujetos delgados. Estos antecedentes estimulan el estudio del efecto de dosis crónicas de vanillina incluyendo un número de individuos que permita mayor poder para detectar diferencias en los parámetros estudiados.
Agradecimientos
Un especial agradecimiento a Juana Codoceo, Jorge
Inostroza, Paula Ibarra y Dr. Francisco Pérez por su colaboración
en la ejecución de este estudio. Agradecemos a todos
los voluntarios que gentilmente accedieron a participar.
Referencias bibliográfica
- Bogardus C, Lillioja S, Mott DM, Hollenbeck C, Reaven G. 1985. Relationship between degree of obesity and in vivo insulin action in man. Am J Physiol 248(3 Pt 1): E286-91.
- Galgani JE, Ravussin E. 2012. Postprandial whole-body glycolysis is similar in insulin-resistant and insulin-sensitive non-diabetic humans. Diabetologia 55 (3): 737-742.
- Brown LA, Kerr CJ, Whiting P, Finer N, McEneny J, Ashton T. 2009. Oxidant stress in healthy normal-weight, overweight, and obese individuals. Obesity (Silver Spring) 17 (3): 460-466.
- Urakawa H, Katsuki A, Sumida Y, Gabazza EC, Murashima
S, Morioka K, et al. 2003. Oxidative stress is associated with
adiposity and insulin resistance in men. J Clin Endocrinol Metab 88 (10): 4673-4676. - Gregor MF, Hotamisligil GS. 2011. Inflammatory mechanisms in obesity. Annu Rev Immunol 29: 415-445.
- Houstis N, Rosen ED, Lander ES. 2006. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature 440 (7086): 944-948.
- Barja G. 1999. Mitochondrial oxygen radical generation and leak: sites of production in states 4 and 3, organ specificity, and relation to aging and longevity. J Bioenerg Biomembr 31 (4): 347-366.
- Bedard K, Krause KH. 2007. The NOX family of ROS-generating NADPH oxidases: physiology and pathophysiology. Physiol Rev 87 (1): 245-313.
- Lambeth JD. 2004. NOX enzymes and the biology of reactive oxygen. Nat Rev Immunol 4 (3): 181-189.
- Morgan D, Oliveira-Emilio HR, Keane D, Hirata AE, Santos da Rocha M, Bordin S, et al. 2007. Glucose, palmitate and proinflammatory cytokines modulate production and activity of a phagocyte-like NADPH oxidase in rat pancreatic islets and a clonal beta cell line. Diabetologia 50 (2): 359-369.
- Morgan D, Rebelato E, Abdulkader F, Graciano MF, Oliveira- Emilio HR, Hirata AE, et al. 2009. Association of NAD (P) H oxidase with glucose-induced insulin secretion by pancreatic betacells. Endocrinology 150 (5): 2197-2201.
- Espinosa A, Garcia A, Hartel S, Hidalgo C, Jaimovich E. 2009. NADPH oxidase and hydrogen peroxide mediate insulin-induced calcium increase in skeletal muscle cells. J Biol Chem 284 (4): 2568-2575.
- Gao D, Nong S, Huang X, Lu Y, Zhao H, Lin Y, et al. 2010. The effects of palmitate on hepatic insulin resistance are mediated by NADPH Oxidase 3-derived reactive oxygen species through JNK and p38MAPK pathways. J Biol Chem 285 (39): 29965-29973.
- Graciano MF, Santos LR, Curi R, Carpinelli AR. 2011. NAD(P) H oxidase participates in the palmitate-induced superoxide production and insulin secretion by rat pancreatic islets. J Cell Physiol 226 (4): 1110-1117.
- Furukawa S, Fujita T, Shimabukuro M, Iwaki M, Yamada Y, Nakajima Y, et al. 2004. Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest 114 (12): 1752-1761.
- Fortuno A, San Jose G, Moreno MU, Beloqui O, Diez J, Zalba G. 2006. Phagocytic NADPH oxidase overactivity underlies oxidative stress in metabolic syndrome. Diabetes 55 (1): 209-215.
- Johnson DK, Schillinger KJ, Kwait DM, Hughes CV, McNamara EJ, Ishmael F, et al. 2002. Inhibition of NADPH oxidase activation in endothelial cells by ortho-methoxysubstituted catechols. Endothelium 9 (3): 191-203.
- Kanegae MP, da Fonseca LM, Brunetti IL, Silva SO, Ximenes VF. 2007. The reactivity of ortho-methoxy-substituted catechol radicals with sulfhydryl groups: contribution for the comprehension of the mechanism of inhibition of NADPH oxidase by apocynin. Biochem Pharmacol 74 (3): 457-464.
- Stefanska J, Pawliczak R. 2008. Apocynin: molecular aptitudes. Mediators Inflamm 2008: 106-507.
- Walton NJ, Mayer MJ, Narbad A. 2003. Vanillin. Phytochemistry 63 (5): 505-515.
- Galgani JE, Nunez B, Videla LA. 2012. Vanillin suppresses Kupffer cell-related colloidal carbon-induced respiratory burst activity in isolated perfused rat liver: anti-inflammatory implications. Food Funct. Sep 24.
- Decker K. 1990. Biologically active products of stimulated liver macrophages (Kupffer cells). Eur J Biochem 192 (2): 245-261.
- Park S, Kim da S, Kang S. 2011. Gastrodia elata Blume water extracts improve insulin resistance by decreasing body fat in dietinduced obese rats: vanillin and 4-hydroxybenzaldehyde are the bioactive candidates. Eur J Nutr 50 (2): 107-118.
- Matsuda M, DeFronzo RA. 1999. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care 22 (9): 1462-1470.
- Galgani JE, Vásquez K, Leonelli G, Espinosa A, Araya H, Pérez- Bravo F. 2012. Assessment of red blood cell glutathione status in insulin resistance. Appl Physiol Nutr Metab 37 (5): 997-1002.
- Rahman I, Kode A, Biswas SK. 2006. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Protoc 1 (6): 3159-3165.
- Wadden TA, Stunkard AJ, Day SC, Gould RA, Rubin CJ. 1987. Less food, less hunger: reports of appetite and symptoms in a controlled study of a protein-sparing modified fast. Int J Obes 11 (3): 239-249.
- SIDS O. Vanillin. http://wwwinchemorg/documents/sids/ sids/121335pdf. 1996.
- Farthing D, Sica D, Abernathy C, Fakhry I, Roberts JD,
Abraham DJ, et al. 1999. High-performance liquid
chromatographic method for determination of vanillin and
vanillic acid in human plasma, red blood cells and urine.
J Chromatogr B Biomed Sci Appl 726 (1-2): 303-307. - Castor LR, Locatelli KA, Ximenes VF. Pro-oxidant activity of apocynin radical. 2010. Free Radic Biol Med 48 (12): 1636-1643.
- Ferrannini E, Bjorkman O, Reichard GA, Jr., Pilo A, Olsson M, Wahren J, et al. 1985. The disposal of an oral glucose load in healthy subjects. A quantitative study. Diabetes 34 (6): 580-588.
- Aljada A, Friedman J, Ghanim H, Mohanty P, Hofmeyer D, Chaudhuri A, et al. 2006. Glucose ingestion induces an increase in intranuclear nuclear factor kappaB, a fall in cellular inhibitor kappaB, and an increase in tumor necrosis factor alpha messenger RNA by mononuclear cells in healthy human subjects. Metabolism 55 (9): 1177-1185.
- Deopurkar R, Ghanim H, Friedman J, Abuaysheh S, Sia CL, Mohanty P, et al. 2010. Differential effects of cream, glucose, and orange juice on inflammation, endotoxin, and the expression of Toll-like receptor-4 and suppressor of cytokine signaling-3. Diabetes Care 33 (5): 991-997.
- Ghanim H, Sia CL, Upadhyay M, Korzeniewski K, Viswanathan P, Abuaysheh S, et al. 2010. Orange juice neutralizes the proinflammatory effect of a high-fat, highcarbohydrate meal and prevents endotoxin increase and Toll-like receptor expression. Am J Clin Nutr 91 (4): 940-949.
- Sage AT, Holtby-Ottenhof S, Shi Y, Damjanovic S, Sharma AM, Werstuck GH. 2012. Metabolic syndrome and acute hyperglycemia are associated with endoplasmic reticulum stress in humanmononuclear cells. Obesity (Silver Spring) 20 (4): 748-755.