Efecto del estado nutricional neonatal en la asociación entre polimorfismo rs9939609 del gen FTO y obesidad en niños chilenos de origen amerindio
Jorge Sapunar1, Natalia Ulloa2, Sylvia Asenjo3, Andrea Gleisner3, Katia Sáez4, Benilde Riffo2 y Sergio Muñoz1
Effects of neonatal undernutrition on the association of obesity with rs9939609 polymorphism of fto gene among amerindian children
1Centro de Excelencia CIGES
Universidad de La Frontera.
2Departamento de Bioquímica
Clínica e Inmunología, Facultad de
Farmacia.
3Departamento de Pediatría,
Facultad de Medicina.
4Departamento de Estadística,
Facultad de Cs Física y Matemáticas,
Universidad de Concepción.
Correspondencia a:
Jorge Sapunar Z.
E mail: jorge.sapunar@ufrontera.cl
Recibido:
Aceptado:
Background: The presence of A allele in FTO gene is associated with a higher risk of obesity. Aim: To investigate the effect of neonatal nutritional status on the association between FTO gene rs9939609 variant and obesity in a cohort of Chilean children with Amerindian ancestry. Material and Methods: Using birth registries, the neonatal ponderal index of 238 obese and 136 normal weight children was calculated. Nutritional status of participants was determined using cutoff points proposed by the Center for Disease Control. FTO polymorphism was measured by real time polymerase chain reaction. Results: The presence of FTO A allele was associated with a higher risk of obesity (odds ratio (OR) 1.87 95% confidence intervals (CI) 1.14-3.06, p < 0.01). The effect of this allele was only significant among males. The risk of obesity associated with A allele presence was non-significantly higher among males with a neonatal ponderal index below percentile 10, as compared with their counterparts with a neonatal ponderal index above this value (OR 5.65 95% CI 0.87-60.4). A logistic regression analyzing the presence of A allele as a risk factor for obesity using neonatal nutritional status and gender as control variables, did not substantially change the results. Conclusions: There is a non-significant effect of neonatal undernutrition on the risk of obesity conferred by the presence of A allele of FTO gene.
Key words: Amerindian, childhood obesity, FTO gene, genetic association studies, newborn, nutritional status.
La obesidad común es una enfermedad compleja
cuyo desarrollo resulta de la interacción de factores
ambientales y genéticos1. Entre los factores
genéticos que se asocian con aumento del índice de masa
corporal (IMC) destaca el polimorfismo de un solo nucleótido
(SNP) rs9930969 del gen FTO, inicialmente vinculado
con diabetes mellitus 22. El alelo A de rs9930969
tiene una alta frecuencia en diferentes poblaciones3 y se
asocia con un riesgo aumentado de obesidad en adultos,
adolescentes y escolares4-6. Nuestro grupo confirmó la
asociación entre el alelo de riesgo A de rs9930969 con
obesidad en niños chilenos amerindios y con marcadores
de resistencia a la insulina en el sub-grupo de mujeres
pre-adolescentes7.
El rol funcional de FTO en humanos aún se desconoce, pero existe creciente evidencia de la asociación entre variantes comunes del gen y patrones de conductas alimentarias en niños6,8,9. El efecto de SNPs de FTO en el IMC parece variar con la edad, alcanzando su máxima expresión a los 20 años para luego declinar hasta aproximadamente los 40 años10.
La desnutrición neonatal es considerada un factor de riesgo para obesidad y enfermedades cardiometabólicas en el adulto11,12. Para la valoración neonatal del estado nutricional se ha utilizado la relación peso de nacimiento y edad gestacional13-15, sin embargo, podría tener mejor valor diagnóstico la estimación de índice ponderal neonatal (IPN)16,17.
Al evaluar la asociación entre variantes comunes de FTO y peso de nacimiento ésta no fue significativa18, sin embargo, el efecto de los SNPs de FTO rs649940 y rs1121980 en el IMC durante la infancia y la vida adulta es potenciado por el antecedente de bajo peso de nacimiento19.
Nuestro objetivo es conocer el efecto de la desnutrición neonatal determinada por IPN en la asociación entre el SNP rs9930969 y obesidad en niños chilenos amerindios.
Material y Método
Estudio post hoc realizado en una muestra de niños con edades entre 6 a 11 años residentes del área urbana de la Comuna de Hualpén, Región del Bío-Bío, Chile.
Los instrumentos y técnicas utilizadas en la antropometría se describen previamente7. La condición de eutrófico y obesos se estableció de acuerdo a los percentiles de IMC corregidos por edad y sexo definidos por el CDC20.
Retrospectivamente se obtuvieron edad gestacional, peso y talla de nacimiento desde los registros de atención del parto. El IPN se calculó de acuerdo a la fórmula: 100 x (Talla en cm)/(peso en g)3 21. La condición de desnutrición neonatal se definió como IPN < percentil 10 de la tabla de la Sociedad Chilena de Pediatría22.
El SNP rs9939609 fue determinado utilizando DNA genómico extraído de leucocitos. Las muestras fueron amplificadas por PCR a tiempo real utilizando los primers definidos por López-Bremejo23. Los detalles de la genotipificación fueron descritos previamente7. La estratificación poblacional fue controlada mediante amplificación de sitios polimórficos que definen las estirpes amerindias de DNA mitocondrial7.
Análisis estadístico
Para esta comunicación los grupos de comparación fueron clasificados en obesos (IMC > p95) y eutróficos (IMC > p5 y < p85). La variable de exposición portación del alelo de riesgo A fue dicotomizada en haplotiposilvestre TT y portadores de A (TA y AA). La variable de control desnutrición neonatal fue dicotomizada en desnutrición neonatal (IPN < p10) y normal (IPN > 10).
Alternativamente se evaluó el efecto de la nutrición neonatal en la asociación entre la portación del alelo A de rs9939609 y obesidad, utilizando IPN como variable continua corrigiéndolo por la edad gestacional (IPN x 40/ Edad gestacional en semanas).
La interacción de la nutrición neonatal en la asociación entre la portación del alelo de riesgo y la condición de obesidad en la infancia se modeló por regresión logística múltiple en el programa estadístico STATA 11 (STATA Corp.), considerando el sexo.
Resultados
La muestra original la conformaban 238 niños obesos y 136 eutróficos que se redujo, por la disponibilidad de los datos perinatales, a 225 niños obesos (casos) y 111 eutróficos (controles). El 20,6% de la muestra presentó IPN < p10. En la Tabla 1 se puede apreciar que la portación del alelo A se asoció con un mayor riesgo de obesidad (OR 1,873 IC 95% 1,149-3,062 valor p = 0,0076).
Al estratificar por sexo se aprecia que el efecto de la portación del alelo A en el riesgo de obesidad fue sólo significativo entre los varones (Tabla 2). Al estratificar por la condición de desnutrición neonatal llama la atención la gran diferencia en el riesgo de obesidad de la portación del alelo A entre sujetos con IPN ≤ p10 y> p10 (OR 5,65 vs OR 1,69), sin embargo, el efecto no fue preciso en los niños que tenían desnutrición neonatal (IC 95% 0,87-60,4) probablemente por falta de tamaño muestral (Tabla 3).
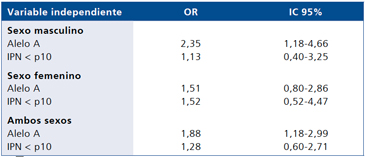
Al estimar el riesgo de obesidad asociado a la portación de alelo A en un modelo de regresión logística múltiple que incluyó la condición de desnutrición neonatal (Tabla 4), éste aumenta ligeramente en el sexo masculino en relación a la estimación cruda (OR 2,53 vs OR 2,33). En el sexo femenino no se encontró asociación (OR: 1,167468. Valor p = 0,647. IC 95% 0,60 a 2,27).
Tabla 1. Riesgo de obesidad según haplotipo: homozigotos + heterozigotos para A (expuestos) vs silvestres (no expuestos)
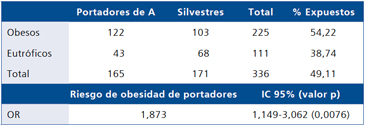
Tabla 2. Efecto del sexo en el riesgo de obesidad atribuible al alelo A
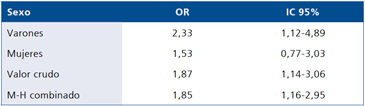 Test de Homogeneidad (M-H) valor p = 0,0084. M-H: Mantel-Haensel.
Test de Homogeneidad (M-H) valor p = 0,0084. M-H: Mantel-Haensel.
Tabla 3. Efecto de la nutrición neonatal en el riesgo de obesidad atribuible al alelo A
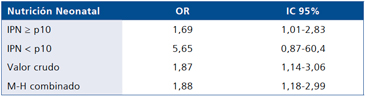
Tabla 4. Efecto combinado de la portación del alelo A de rs9939609 de FTO y de la desnutrición neonatal como variable dicotómica en el riesgo de obesidad en niños chilenos. Modelo de regresión logística múltiple
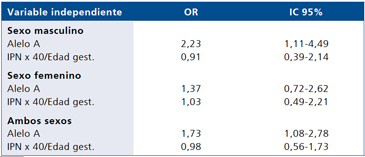
Al modelar el riesgo de obesidad de los portadores del alelo A, considerando la variable nutrición neonatal como continua (IPN x 40/Edad gestacional en semanas), éste disminuyó ligeramente respecto al análisis crudo en el sexo masculino (OR 2,23 vs OR 2,33). Mediante este análisis tampoco se encontró efecto significativo de la portación del alelo A en el riesgo de obesidad en el sexo femenino (Tabla 5).
Tabla 5. Efecto combinado de la portación del alelo A de rs9939609 de FTO y de la nutrición neonatal como variable continua (IPN x 40/ edad gestacional en semanas) en el riesgo de obesidad en niños chilenos. Modelo de Regresión Logística Múltiple
Discusión
La hipótesis de Barker, propuesta a principios de los noventa, señala que alteraciones en la nutrición fetal inducirían adaptaciones metabólicas, funcionales y finalmente estructurales que predispondrían al sujeto en la vida adulta a enfermedades cardiovasculares, metabólicas y endocrinas11,12,24.
Este fenómeno conocido como programación fetal, mediante estudios epidemiológicos, se ha vinculado con diversos desenlaces desfavorables en distintas etapas de la vida extrauterina afectando prácticamente todos los sistemas funcionales del organismo25-31.
Considerando el efecto de algunas variantes comunes del gen FTO en el riesgo de obesidad en niños, adolescentes y adultos y los recientes avances en la identificación del rol fisiopatológico de FTO en el desarrollo de obesidad3-9, nos pareció pertinente estudiar el efecto de la nutrición fetal en la asociación entre el alelo A de rs9939609 y obesidad infantil.
Previamente, Mei y cols18, no encontraron asociación entre ninguna de los 29 SNPs estudiados y la antropometría al nacer, descartando el rol de FTO en el estado nutricional fetal. Estudios longitudinales como el de Hardy10 señalan que el efecto de FTO, en el riesgo de obesidad, se hace evidente a partir de los 7 años, alcanzo su máxima expresión alrededor de los 20 años. Esto tiene coherencia con el posible rol de FTO en la conducta alimentaria6,8,9.
En un estudio más reciente Mei y colaboradores19, en un modelo de regresión lineal, establecen que el peso de nacimiento tiene un efecto significativo en la asociación entre la portación de alelos de riesgo de rs6499640 y rs1121980 con el IMC antes y después de los 18 años.
Nuestro estudio establece que la portación aumenta el riesgo de obesidad infantil en varones chilenos de origen amerindio. La condición de desnutrición neonatal mostró una tendencia a potenciar el efecto del alelo A en varones, aunque no alcanzó significación estadística. Al incluir la condición de desnutrición neonatal en un modelo de regresión logística múltiple, el efecto del alelo A en el riesgo de obesidad infantil no cambió respecto a la estimación cruda. Por primera vez, en este tipo de investigación, definimos la desnutrición neonatal por IPN.
Las principales limitaciones de nuestro estudio fueron la reducción del tamaño muestral original atribuible a la disponibilidad parcial de los datos perinatales de los niños y que la condición de desnutrición neonatal sólo afectaba al 20% de la muestra. Por ello, aunque la magnitud del efecto de la nutrición neonatal en la asociación del alelo A de rs9939609 de FTO con obesidad fue muy importante, el intervalo de confianza fue muy amplio.
Conclusión
Nuestros resultados no permiten concluir que la desnutrición neonatal potencia la asociación entre el alelo A del SNP rs9939609 de FTO y obesidad infantil, comunicado por otros autores en otras etnias y con otros SNP.
Referencias bibliográficas
- Loos RJ, Bouchard C. 2008. FTO: the first gene contributingto common forms of human obesity. Obes Rev 9: 246-250.
- Frayling TM. 2007. Genome-wide association studies provide new insights into type 2 diabetes aetiology. Nat Rev Genet 8: 657-662.
- Frayling TM, Timpson NJ, Weedon MN et al. 2007. A common variant in the FTO gene is associated withbody mass index and predisposes to childhood andadult obesity. Science 316: 889-894.
- Loos RJ. 2009. Recent progress in the genetics of commonobesity. Br J Clin Pharmacol 68: 811-829.
- Dina C, Meyre D, Gallina S, et al. 2007. Variation in FTO contributes to childhood obesity and severe adultobesity. Nat Genet 39: 724-726.
- Cecil JE, Tavendale R, Watt P, Hetherington MM, Palmer CN. 2008. An obesity-associated FTO gene variantand increased energy intake in children. N Engl J Med 359: 2558-2566.
- Riffo B, Asenjo S, Sáez K, Aguayo C, Muñoz I, Bustos P, et al. 2011. FTO gene is related to obesity in Chilean Amerindian children and impairs HOMA-IR in prepubertal girls. Pediatric Diabetes.
- Wardle J, Carnell S, Haworth CM, Farooqi IS, O'Rahilly S, Plomin R. 2008. Obesity associated genetic variation in FTO is associated with diminished satiety. J Clin Endocrinol Metab 93: 3640-3643.
- Timpson NJ, Emmett PM, Frayling TM, Rogers I, Hattersley AT, McCarthy MI, et al. 2008. The fat mass-and obesity-associated locus and dietary intake in children. Am J Clin Nutr 88: 971-978.
- Hardy R, Wills AK, Wong A, Elks CE, Wareham NJ, Loos RJF, et al. 2010. Life course variations in theassociations between FTO and MC4R gene variants and body size. Hum Mol Genet 19: 545-552.
- Barker DJP, Osmond C, Golding J, Kuh D, Wadsworth MEJ. 1989 Growth in utero, blood pressure in childhood and adult life, and mortality fromcardiovascular disease. BMJ 298: 564-567.
- Godfrey KM, Barker DJP. 2000. Fetal nutrition and adult disease. Am J Clin Nut 71: 1344S-1352S.
- Battaglia FC, Lubchenco LO. 1967. A practical classification of newborn infants by weight and gestational age. J Pediatr 71: 159-163.
- Gruenwald P. 1966. Growth of the human fetus. I. Normal growth and its variation. Am J Obstet Gynec 94 (8): 1112-1118.
- Hadlock FP, Harrist RB, Martínez-Poyer J. 1991. In utero analysis of growth: A sonographic weight standard. Radiology 181 (1): 129-133.
- Vintzileos AM, Lodeiro JC, Feinstein SJ, Campbell WA, Weinbaum PJ, Nochimson DJ. 1986. Value of fetal ponderal index in predicting growth retardation. Obstet Gynecol 67 (4): 584-588.
- Yagel S, Zacut D, Igelstein S, Palti Z, Hurwitz A, Rosenn B. 1987. In utero ponderal index as a prognostic factor in the evaluation of intrauterine growth retardation. Am J Obstet Gynecol 157 (2): 415-419.
- Mei H, Chen W, Srinivasan SR, Jiang F, Schork N, Murray S, Smith E, So JD, Berenson GS. 2010. FTO influences on longitudinal BMI over childhood and adulthood and modulation onrelationship between birth weight and longitudinal BMI. Hum Genet 128: 589-596.
- Mei H, Chen W, Jiang F, He J, Srinivasan S, Smith E, Schork N, Murray S, Berenson GS. Longitudinal Replication Studies of GWAS Risk SNPsInfluencing Body Mass Index over the Course of Childhood and Adulthood. PLoS ONE 7 (2): e31470. doi:10.1371/journal.pone.0031470.
- CDC/NCHS CDC 2000 Growth Charts: United States. http://www.chc.gov/growthcharts.
- Vintzileos AM, Lodeiro JC, Feinstein SJ, Campbell WA, Weinbaum PJ, Nochimson DJ. 1986. Value of fetal ponderal index in predicting growthretardation. Obstet Gynecol 67: 584-588.
- Milad M, Novoa JM, Fabres J, Samamé MM, Aspillaga C. 2010. Recomendación sobre Curvas de Crecimiento Intrauterino. Rev Chil Pediatr 81 (3): 264-274.
- López-Bermejo A, Petry CJ, Díaz M, et al. 2008. The association between the FTO gene and fat mass inhumans develops by the postnatal age of two weeks. J Clin Endocrinol Metab 93: 1501-1505.
- Barker DJP. 1995 Fetal origins of coronary heart disease. BMJ 311: 171-174.
- Shaheen SO, Barker DJP. 1994. Early lung growth and chronic airflowobstruction. Thorax 49: 533-536.
- Clark PM, Hindmarsh PC, Shiell AW, Law CM, Honour JW, Barke DJP. 1996. Size at birth and adrenocortical function in childhood. Clin Endocrinol 45: 721-726.
- Hales CN, Barker DJP, Clark PMS, et al. 1991. Fetal and infant growth and impaired glucose tolerance at age 64. BMJ 303: 1019-1022.
- Barker DJP, Hales CN, Fall CHD, Osmond C, Phipps K, Clark PMS. 1993. Type 2 (non-insulin-dependent) diabetes mellitus, hypertension andhyperlipidaemia (syndrome X): relation to reduced fetal growth. Diabetologia 36: 62-67.
- Cooper C, Kuh D, Egger P, Wadsworth M, Barker DJP. 1996. Childhood growth and age at menarche. Br J Obstet Gynaecol 103: 814-817.
- Cooper C, Fall C, Egger P, Hobbs R, Eastell R, Barker D. 1997. Growth in infancy and bone mass in later life. Ann Rheum 56: 17-21.
- Barker DJP, Martyn CN, Osmond C, Hales CN, Fall CHD. 1993. Growth in utero and serum cholesterol concentrations in adult life. BMJ 307: 1524-1527.