Hiperprolactinemia y disfunción sexual en el varón
Enzo Devoto C.1 y Lucía Aravena C.2
Hyperprolactinemia and sexual dysfunction among males
1Endocrinólogo. Clínica privada.
Hernando de Aguirre 194 of. 62.
Providencia.
2Endocrinóloga. Clínica privada.
Nueva Providencia 1881, of. 2205.
Correspondencia a:
Dr. Enzo Devoto C.
Fax: 222290238.
E-mail: edevoto@vtr.net
Recibido: 18-10-2014
Aceptado: 06-01-2014
Hyperprolactinemic males usually have a hypoactive libido and less commonly, erectile dysfunction and disturbances of orgasm and ejaculation. Hyperprolactinemia alters the balance between neurotransmitters, neuropeptides and hormones involved in libido and erection, affecting dopaminergic tone. An imbalance between dopamine, that stimulates sexual function and serotonin that inhibits it, is generated. In the central nervous system, hyperprolactinemia inhibits centers controlling sexual desire and erection. At the neuroendocrine level, it decreases GnRH, LH and testosterone pulses, resulting in a hypogonadotrophic hypogonadism. Erection is also inhibited peripheral actions of low testosterone and high prolactin levels. There is a disturbance of penile smooth muscle relaxation and of the parasympathetic sacrum-penis reflex arch. In experimental animals, acute hyperprolactinemia hampers the central erection mechanism whereas in chronic conditions, peripheral disturbances also occur. Even correcting low testosterone levels, the adverse effects of hyperprolactinemia on sexual function persist. The use of dopaminergic agonists may achieve normal prolactin and testosterone levels resulting in normal sexual function. Chronic hyperprolactinemia results in progressive deterioration of sexual function and a higher hypothalamic damage that does not respond to clomiphene. In this situation and in the presence of sellar tumors that destroy gonadotrophic cells, there is indication of androgenic replacement maintaining the use of dopaminer gic agonists.
Key words: Varón hiperprolactinémico, sexual dysfunction, hyperprolactinemic hypogonadism, Clomiphene.
La Prolactina (PRL) secretada por el lactotropo hipofisiario
es tónicamente inhibida por Dopamina
proveniente del sistema tuberoinfundibular que vía
porta hipofisiaria actúa en su receptor D2. Su secreción
es estimulada por estradiol, TRH y opioides.
Además de su rol en lactancia, existen receptores cerebrales de PRL en sistema límbico, núcleo arcuato, núcleos del área media preóptica del hipotálamo, etc., y en aparato genital (testículo, próstata, vesículas seminales y pene)1.
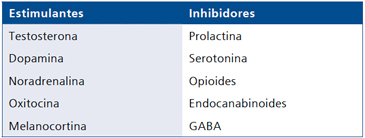
La PRL se autoregula en condiciones fisiológicas por un circuito de asa corta ejerciendo un feedback positivo sobre Dopamina. Así, ante aumentos transitorios de PRL (Ej. pos orgasmo) el feedback positivo sobre Dopamina normaliza el alza de PRL2. En hiperprolactinemia crónica en cambio, disminuye el tono dopaminérgico y aumenta el serotoninérgico alterándose la respuesta sexual por desbalance entre sus factores estimuladores (Dopamina-Testosterona) e inhibidores (PRL-Serotonina) 2,3 (Tabla 1).
Tabla 1. Hormonas, neurotransmisores y neuropéptidos estimulantes e inhibidores del deseo sexual
Causas y mecanismos de hiperprolactinemia
- Deficiencia de dopamina hipotalámica: tumor, proceso infiltrativo, irradiación, drogas: depletora de Dopamina (Reserpina) e inhibidora de su síntesis (Metildopa).
- Alteración del transporte de Dopamina por lesión del sistema porta debido a compresión (adenoma no funcionante) o sección del tallo.
- Bloqueo del receptor D2 del lactotropo: fármacos (Clorpromazina-Haloperidol Sulpiride-Domperidona- Metoclopramida-Verapamilo-Risperidona-Olanzapina).
- Estimulación del lactotropo: aumento de TRH (hipotiroidismo primario), estradiol, opioides; estimulación refleja generada en pared toráxica incluido el pearcing.
- Aumento de Serotonina por inhibición de su recaptación
por: Fluoxetina-Paroxetina-Sertralina-Venlafaxina-
Bupropion).
- Disminución del clearance de PRL: insuficiencia renal.
- Crecimiento tumoral del lactotropo: prolactinomaacromegalia (somatolactotropinoma).
- Otros: epilepsia del lóbulo temporal, cirrosis hepática, hipofisitis linfocítica, pseudohiperprolactinemia por macroprolactina4,5.
Epidemiología
Existen cifras variables de prevalencia de hiperprolactinemia en población adulta; Miyai señala 0,4%, correspondiendo 0,17 a varones6 y Melmed 10 a 20 por 100.000 varones4.
Diagnóstico de hiperprolactinemia en el varón
Recomendaciones para medición de PRL: extracción venosa en paciente no estresado, 2 a 3 h después del despertar, en ayunas y 24 h previas sin actividad sexual.
Hiperprolactinemia: PRL sobre el límite superior del método, generalmente mayor de 15 ng/ml4; sobre 35 ng/ ml se considera de importancia clínica o hiperprolactinemia severa7.
Ante un valor elevado de PRL, se recomienda una segunda muestra o determinarla en un "pool" de 3 muestras cada 20 min.
Clínica de varón con hiperprolactinemia
Disfunción sexual: deseo sexual hipoactivo (100% de los casos); disfunción eréctil (47-80%); trastornos de la eyaculación; ginecomastía (8-30%); galactorrea (5-33%); infertilidad. Síntomas neuro-oftalmológicos (en macroprolactinoma y macroadenoma no funcionante)8.
Si bien esta clínica es frecuente en el varón hiperprolactinémico, la hiperprolactinemia no es etiología frecuente en la mayoría de los consultantes por disfunción sexual, correspondiendo al 1,5 a 5%9-11; causa deseo sexual hipoactivo en el 2 a 5%10,12,13 y disfunción eréctil (generalmente asociada a deseo sexual hipoactivo) en el 0,5 a 5,3%14. En 216 varones que nos consultaron por disfunción sexual, encontramos como causa a la hiperprolactinemia en el 3,2% de los casos. (Devoto E, Aravena L. Libro de resumen XIV Congreso Chileno de Endocrinología y Metabolísmo 2003, pág 185).
En una población de 117 pacientes estudiados por ginecomastía, en las de causa endocrina no encontramos hiperprolactinemia15.
Investigación de la causa de hiperprolactinemia
Descartar enfermedad sistémica, endocrinopatía, fármacos y drogas que produzcan hiperprolactinemia.
Solicitar estudio de imagen selar investigando causa tumoral: microadenoma (tumor < 10 mm), macroadenoma (tumor > 10 mm) u otro proceso orgánico selar o supraselar.
Se señala que una PRL sobre 250 ng/ml indica presencia de macroadenoma, aunque microadenoma e hiperprolactinemia inducida por fármaco pueden dar un valor cercano a este. En macroadenoma no funcionante el valor es menor de 100 ng/ml; puede confundirse con macroprolactinoma cuya altísima secreción de PRL altera la determinación de laboratorio, dando cifras de PRL falsamente bajas.
En estos casos se recomienda diluir la muestra al 1%, lo que permite demostrar el valor real elevado de PRL al superarse el efecto gancho4.
Frecuencia de causas de hiperprolactinemia en
el varón
Macroadenoma 70%; microadenoma 15%, no tumoral 11%8. Según Vilar: prolactinoma 56%; drogas 14%; macroprolactina 9%; hipotiroidismo 6%, hiperprolactinemia idiopática 4%, etc.16 La hiperprolactinemia idiopática es diagnóstico de exclusión de otras causas. Algunos niegan su existencia argumentando la presencia de un microprolactinoma no diagnosticado. En estos casos, en la época inicial del TAC, apareció un 37% de microadenoma durante el seguimiento17.
Actualmente con técnica de imagen más sensible sólo 10% de la hiperprolactinemia idiopática correspondería a esta causa4.
Investigación de macroprolactina
Las formas moleculares de PRL son: monomérica de 23 kDa (Little), Big de 50 kDa y macroprolactina (Big- Big) o complejo de PRL-IgG de baja actividad biológica in vivo y de generación extrahipofisiaria por fenómeno inmunológico. Se recomienda investigarla en hiperprolactinemia asintomática4, aunque autores por su alta prevalencia (10 a 46%)5,18, recomiendan realizarla en toda hiperprolactinemia utilizando la técnica de precipitación con polietilenglicol (PEG). Un PEG con recuperación de PRL mayor de 40% descarta macroprolactina.
Terapia médica con agonistas dopaminérgicos
(AD)
Objetivos de la terapia: normalizar PRL, recuperar función gonadal, mejorar clínica de hiperprolactinemia. En microprolactinoma lograr su desaparición y mantener remisión pos suspensión de terapia. En macroprolactinoma: reducción de tamaño y eventual desaparición, impidiendo que su efecto masa altere en forma irreversible la función hipofisiaria y genere complicación extrahipofisiaria.
Mecanismo de acción del AD
Al ligarse al receptor D2 inhibe la adenilciclasa disminuyendo la proliferación del lactotropo, síntesis y liberación de PRL19.
- Bromocriptina de 2,5 a 15 mg al día en 3 dosis debido a su corta vida media, (dosis promedio 7,5 mg). Efectos secundarios: gastrointestinales, hipotensión ortostática, síncope, etc. Existe un 10% de resistencia a la Bromocriptina que se diagnostica cuando alcanzándose la dosis máxima durante 6 meses no se consigue normoprolactinemia.
- Cabergolina, por su larga vida media se administra en 1 ó 2 dosis semanales de 0,5 a 3 mg. Se considera superior a la Bromocriptina en porcentaje de disminución de la hiperprolactinemia, facilidad de administración y bajos efectos colaterales con menor porcentaje de abandono. Su desventaja es su mayor costo. Ambos fármacos disminuyen el nivel de PRL y hacen desaparecer la sintomatología19.
Sería erróneo pensar que obtenido un buen resultado terapéutico con Bromocriptina, éste se deteriorara al cambiar a Cabergolina, a menos que existiera resistencia a esta última20.
El descenso de la hiperprolactinemia es progresivo requiriendo hasta 12 meses para normalizarse.
Al suspender el AD luego de un tratamiento prolongado
puede ocurrir:
- Persistencia de la hiperprolactinemia y reaparición de
la sintomatología.
- Remisión o mantención de un período prolongado de
normoprolactinemia.
- Recaída.
En hiperprolactinemia idiopática y microprolactinoma, Cabergolina normaliza la hiperprolactinemia en el 92% de los casos vs 80% con Bromocriptina.
Pos suspensión de Cabergolina existe 24% de recurrencia en hiperprolactinemia no tumoral, 32% en microprolactinoma y 43% en macroprolactinoma19. Puede también ocurrir remisión espontánea en paciente no tratado5.
Testosterona plasmática en hiperprolactinemia
El 80 a 90% del varón hiperprolactinémico presenta hipotestosteronemia por hipogonadismo hipogonadotropo y consultan por disfunción sexual (76 a 95%).
Existe un porcentaje de hiperprolactinemia sintomática (descartada la macroprolactina) con Testosterona normal, incluso en micro y macroprolactinoma9,21,22.
En nuestra casuística de hipogonadismo hipogonadotropo encontramos un 6,5% de hiperprolactinemia23.
Fisiopatología del hipogonadismo hipogonadotropo por hiperprolactinemia
- Inhibición del GnRH por hiperprolactinemia.
- Además en macroprolactinoma disminución de la población de gonadotropos hipofisiarios por efecto masa.
La función testicular depende de la pulsatilidad del GnRH y de gonadotropinas, alterada en hiperprolactinemia. Thorner y Besser señalaron hace años que este hipogonadismo hipogonadotropo no responde al Clomifeno y se recupera con Bromocriptina24. Winters y Troen demostraron en varón hiperprolactinemico disminución de la pulsatilidad de LH25, restaurándose la LH y normalizándose la hipotestosteronemia bajo administración pulsátil prolongada del GnRH26.
Actualmente se destaca el rol estimulador de Kisspeptina sobre neuronas productoras del GnRH. La PRL tiene receptores en neuronas generadoras de Kisspeptina, ejerciendo un efecto inhibitorio sobre su secreción. Lahiperprolactinemia bloquearía la estimulación del GnRH mediada por Kisspeptina27.
Para el diagnóstico del hipogonadismo hipogonadotropo adquirido se recomienda la guía de la Endocrine Society28 que aplicamos modificada para un mayor estudio de sus causas funcionales23.
Si no obtenemos recuperación del eje hipotálamo hipófisis testicular (HHT) a los 6 meses de normoprolactinemia sugerimos administrar citrato de Clomifeno, quien regulando el generador de pulsos del GnRH corrige la disfunción hipotalámica del hipogonadismo persistente pese a normalización de la hiperprolactinemia con AD30.
Por este mecanismo, el Clomifeno logra el mismo resultado en varones con hipogonadismo funcional idiopático reversible29.
En microadenoma e hiperprolactinemia idiopática el Clomifeno determina en el 70% de los casos alza de LH y T, no respondiendo un 30%30, sugiriendo en ellos una mayor alteración funcional hipotalámica.
En macroprolactinoma por efecto masa se produce insuficiencia gonadotropa, explicando la respuesta negativa al Clomifeno. En ambos casos esta respuesta negativa indica terapia de reemplazo androgénica.
Ante hipogonadismo persistente corregida la hiperprolactinemia se debe evaluar la aparición de otra causa de hipogonadismo, como el hipogonadismo funcional por enfermedad sistémica, fármacos o drogas y el secundario a otras endocrinopatías que pudieran jugar un rol en la no recuperación del eje HHT. La posibilidad de un hipogonadismo hipogonadotropo idiopático de inicio adulto31 o del hipogonadismo asociado al envejecimiento concomitantes con hipogonadismo por hiperprolactinemia, es difícil de sostener ya que por definición en ambos cuadros debe excluirse hiperprolactinemia.
Hiperprolactinemia y disfunción sexual
masculina
Fases de la respuesta sexual: 1) Líbido o deseo sexual; 2) Excitación: tumefacción, erección peneana, respuesta neurovegetativa y muscular; 3) Orgasmo; 4) Eyaculación; 5) Detumescencia peneana y período refractario33.
En este proceso influyen factores anatómicos, funcionales (interacción de neurotransmisores, neuropéptidos, hormonas) y sicosocioculturales.
Existe una estructura neuronal y vías que relacionan distintas zonas del sistema nervioso que participan en estas fases.
La Testosterona tiene un rol organizacional de centros cerebrales y medulares durante la vida intrauterina, completando algunos de ellos su desarrollo al inicio de la pubertad34. En la pubertad la Testosterona activa estas estructuras interactuando con neurotransmisores, neuropéptidos y hormonas estimulantes o inhibitorias del deseo y excitación (Tabla 1).
En el deseo sexual participan corteza cerebral, tálamo óptico, hipocampo, núcleo acumbens, amígdala y otros. Los sistemas dopaminérgicos nigroestriatal y mesolímbico proyectan hacia estas zonas liberando Dopamina que estimula la respuesta sexual y el grado de alerta para captar los estímulos sexuales.
La función cognitiva de la corteza (pensamientos, fantasías) es responsable de la parte sicogénica de la respuesta sexual. El tálamo integra las aferencias sensitivas y sensoriales referentes a sexualidad, siendo importante en otras especies las aferencias olfatorias (feromonas). El sistema límbico le otorga el componente emocional a los estímulos. El hipocampo y zonas relacionadas con la memoria nos dan un recuerdo positivo o negativo de la experiencia sexual.
El núcleo acumbens estimulado por Dopamina recibe señales que significan recompensa o placer y activa amígdala y lóbulo prefrontal para transformar la líbido en excitación.
En la célula piramidal glutaminérgica del lóbulo prefrontal reside la función ejecutiva y la inteligencia emocional (neuronas espejos), jerarquizándose y organizándose la respuesta apropiada frente a una situación. Permite la manifestación de una conducta ante estímulos que dan recompensa o placer e inhibe las conflictivas o riesgosas.
Si este lóbulo da paso a mensajes químicos generados por el deseo sexual, se activa la amígdala que por su vía eferente (estría terminalis y su núcleo del lecho) estimula la zona anterior preóptica del hipotálamo y los núcleos neurovegetativos y motores iniciándose la etapa de la excitación35.
En el hipotálamo anterior existe en animales inferiores
el núcleo sexual dimórfico y en humanos los núcleos
intersticiales o INH. Estos núcleos son estimulados por
Testosterona y Dopamina; sus conexiones inducen liberación
de oxitocina en los núcleos supraóptico y paraventricular.
La oxitocina por vía neurovegetativa estimula el
centro parasimpático sacro S2-S4 generando la erección
central.
La vía nerviosa parasimpática y el nervio pudendo establecen un arco reflejo entre S2-S4 y el pene, siendo responsables de la erección refleja36,37.
Las terminaciones nerviosas en el endotelio arterial y en los sinusoides del cuerpo cavernoso, estimulan la óxido nítrico sintetasa produciendo óxido nítrico y cGMP que relajan la musculatura lisa arterial y sinusoidal iniciando la erección36.
La Testosterona activa la síntesis de óxido nítrico sintetasa y el trofismo de los tejidos peneanos, favoreciendo la respuesta vascular e inhibiendo la síntesis de tejido fibroso en la trabécula. Este hecho explicaría el rol local además del central de los andrógenos en la erección37.
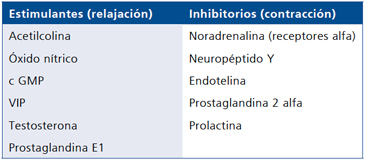
La Tabla 2 sintetiza la acción fisiológica y fisiopatológica de la PRL sobre la función sexual basados en estudios animales y humanos2.
Tabla 2. Factores estimulantes e inhibitorios de la erección mediante la relajación y contracción de la musculatura lisa de arteria cavernosa y trabécula del cuerpo cavernoso
Disfunción sexual en el varón
hiperprolactinémico
La hiperprolactinemia produce:
- Deseo sexual hipoactivo: Ausencia persistente de fantasía, pensamiento y deseo de actividad sexual.
- Disfunción eréctil: Incapacidad persistente de lograr y mantener una erección suficiente para una actividad satisfactoria.
- Trastorno de eyaculación.
- Trastorno del orgasmo: anorgasmia.
Nos referiremos al rol de la hiperprolactinemia en deseo sexual hipoactivo y disfunción eréctil33.
Antiguamente se consideraba que el 90% de la disfunción eréctil era de causa sicogénica derivándose inicialmente al especialista de salud mental39; criterio actualmente modificado ya que un 25% es psicogénica, 25% orgánica y el resto mixta36.
¿Cómo la PRL produce disfunción sexual?
Testosterona y Dopamina juegan un rol estimulatorio en deseo sexual y erección, y la PRL inhibitorio, existiendo sus receptores en encéfalo, médula espinal y pene. La hiperprolactinemia impide la acción dopaminérgica en estas estructuras que participan en la respuesta sexual, estableciéndose un desbalance Dopamina/Serotonina, predominando la acción inhibitoria de esta última.
El déficit de Testosterona del hipogonadismo hipogonadotropo por hiperprolactinemia y la misma hiperprolactinemia, actúan conjuntamente en la etiología de la disfunción sexual.
La hiperprolactinemia ejerce una acción inhibitoria más potente que el estímulo de Testosterona sobre la sexualidad.
Hace años Carter señaló que no mejoraba la disfunción sexual administrando Testosterona en presencia de hiperprolactinemia no corregida40.
La PRL por acción directa altera deseo y excitación sexual actuando tanto a nivel central como periférico. En disfunción eréctil inhibe el mecanismo de la erección sicogénica o central y tiene un efecto peneano impidiendo el aumento de la óxido nítrico sintetasa alterando la respuesta vascular2.
La hiperprolactinemia aguda afecta la función eréctil en forma diferente que la crónica.
Observamos en un varón hiperprolactinémico41 un deterioro progresivo de la función sexual, iniciándose como deseo sexual hipoactivo, agregándose posteriormente disfunción eréctil central y finalmente periférica. La disociación entre erección central y periférica se ha comunicado también en secciones medulares que respetan la zona lumbosacra y bajo acción de fármacos (fluoxetina)42.
En experimentos en ratas, la hiperprolactinemia aguda altera la erección central manteniendo la periférica43 y la crónica lleva a un compromiso de ambas44. Este modelo experimental podría explicar el deterioro progresivo de la disfunción sexual de este paciente.
Debe investigarse el rol de la hiperprolactinemia en disfunción sexual, ya que constituye una causa tratable de problemas que afectan severamente la vida personal y de pareja.
Referencias bibliográficas
- Ben-Jonathan N, La Pensee CR, La Pensee EW. 2008. What can we learn from rodents about prolactin in humans? Endocr Rev 29: 1-41.
- Galdiero M, Pivonello R, Grasso L, Cozzolino A, Colao A. 2012. Growth hormone, prolactin and sexuality. J Endocrinol Invest 35: 782-794.
- Suchecki D, Tiba PA, Machado RB. 2012. REM sleep rebound as an adaptive response to stressful situations. Front Neurol 2: 3-41.
- Melmed S, Casanueva FF, Hoffman AR, Kleinberg DL, Montori VM, Schlechte JA, et al. 2011. Diagnosis and treatment of hyperprolactinemia: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 96: 273-288
- Vilar L, Fleseriu M, Bronstein M. 2014. Challenges and pitfalls in the diagnosis of hyperprolactinemia. Arq Bras Endocrinol Metab 58: 9-22.
- Miyai K, Ichihara K, Kondo K, Mori S. 1986. Asymptomatic hyperprolactinaemia and prolactinoma in the general populationmass screening by paired assays of serum prolactin. Clin Endocrinol (Oxf) 25: 549-554.
- Maggi M, Buvat J, Corona G, Guay A, Torres L. 2013. Hormonal causes of male sexual dysfunction and their management: hyperprolactinemia, Thyroid disorders, GH disorders and DHEA. J Sex Med 10: 661-677.
- Walsh JP, Pullan PT. 1997. Hyperprolactinemia in males: a heterogeneous disorder. Aust N Z J Med 27: 385-390.
- Buvat J, Lemaire A, Buvat-Herbaut M, Fourlinnie JC, Racadot A, Fossati P. 1985. Hyperprolactinemia and sexual function in men. Horm Res 22: 196-203.
- Corona G, Mannucci E, Fisher AD, Lotti F, Ricca V, Balercia G, et al. 2007. Ef fect of hyperprolactinemia in male patients consulting for sexual dysfunction. J Sex Med 4: 1485-1493.
- Bhasin S, Enzlin P, Coviello A, Basson R. 2007. Sexual dysfunction in men and women with endocrine disorders. Lancet 369: 597-611.
- Leonard M, Curtis JN, Morales A. 1989. Hyperprolactinemia and impotence: why, when and how to investigate. J Urol 142: 992-994.
- Buvat J, Lemaire A. 1997. Endocrine screening in 1,022 men with erectile dysfunction: clinical significance and cost-effective strategy. J Urol 158: 1764-1767.
- Venetikou MS, Lambou T, Gizani D. 2008. Hyperprolactinaemia due to hypothalamic-pituitary disease or drug-induced in patients with erectile dysfunction. Andrologia 40: 240-244.
- Devoto CE, Madariaga AM, Aravena L, Lioi CX. 2007.
Etiología de la ginecomastía: Importancia de no subdiagnosticar
una ginecomastia patológica. Rev Med Chile 135: 189-197. - Vilar L, Freitas MC, Naves LA, Casulari LA, Azevedo M,
Montenegro RJr, et al. 2008. Diagnosis and management of
hyperprolactinemia: results of a Brazilian multicenter study with 1234 patients. J Endocrinol Invest 31: 436-444. - Pontiroli AE, Falsetti L. 1984. Development of pituitary adenoma in women with hyperprolactinaemia: clinical, endocrine, and radiological characteristics. Br Med J 288: 515-518.
- Glezer A, Bronstein MD. 2012. Approach to the patient with persistent hyperprolactinemia and negative sellar imaging. J Clin Endocrinol Metab 97: 2211-2216.
- Guillam MP, Molitch ME, Lombardi G, Colao A. 2006. Advances in the treatment of prolactinomas. Endocr Rev 27: 485-536.
- Iyer P, Molitch ME. 2011. Positive prolactin response to bromocriptine in 2 patients with cabergoline-resistant prolactinomas. Endocr Pract 17: 55-58.
- De Rosa M, Zarrilli S, Vitale G, Di Somma C, Orio F, Tauchmanova L, et al. 2004 Six months of treatment with cabergoline restores sexual potency in hyperprolactinemic males: an open longitudinal study monitoring nocturnal penile tumescence. J Clin Endocrinol Metab 89: 621-625.
- Buvat J. 2003. Hyperprolactinemia and sexual function in men: a short review. In J Impot Res 15: 373-377.
- Devoto E, Aravena L, Madariaga M. 2012. Motivos de consulta y cuadros clínicos causantes de hipogonadismo masculino. Elevada frecuencia del hipogonadismo hipogonadotropo funcional del adulto. Rev Chil Endocrinol diabetes; 5: 163-171.
- Thorner MO, Besser GM. 1974. Long-term treatment of galactorrhea and hypogonadism with bromocriptine. Br Med J 2: 419-422.
- Winters SJ, Troen P. 1984. Altered pulsatile secretion of luteinizing hormone in hypogonadal men with hyperprolactinemia. Clin Endocrinol 21: 257-263.
- Bouchard P, Lagoguey M, Brailly S, Schaison G. 1985.
Gonadotropin-realising hormone pulsatile restores
luteinizing hormone pulsatility and normal testosterone levels
in males with hyperprolactinemia. J Clin Endocrinol Metab 60: 258-262.
- Kaiser UB. 2012. Hyperprolactinemia and infertility: new insights. J Clin Invest 122: 3467-3468.
- Bashin S, Cunningham G, Hayes FG, Matsunoto A, Snyder P, Swerdloff RS, et al. 2010. Testosterone therapy in adult men with androgen deficiency sindromes: an Endocrine Society clinical practice guidelines. J Clin Endocrinol Metab; 95: 2536-2559.
- Devoto E, Aravena L. 2008. Hipogonadismo hipogonadotropo funcional hipotalámico idiopático pospuberal en el varón. Rev Int Androl 6: 89-96.
- Silicani R, Abucham J. 2008. Recovery of persistent hipogonadism by clomiphene in males with prolactinomas under dopamine agonist treatment. Eur J Endocrinol 161: 163-169.
- Nachtigall LB, Boepple PA, Pralong FP, Crowley WF Jr. 1997. Adult-onset idiopathic hypogonadotropic hypogonadism-a treatable form of male infertility. N Engl J Med 336: 410-415.
- Devoto E, Aravena L. 2013. Andropausia. En: de la Parra I, Cortolezzi M eds. Endocrinología ginecológica. Buenos Aires, Journal 287-294.
- Kandel FR, Kousa V, Swerdloff RS. 2001. Male sexual function and its disorders: physiology, pathophysiology, clinical investigation and treatment. Endocr Rev 22: 342-388.
- Gorski R. 1995. Pharmacology, Biology and Clinical Applications of Androgen. In Bhasin S ed. Androgens and sexual differentiation of the brain. New York, Wiley liss Inc, p 159-168.
- Pfaus JG. 2009. Pathways of sexual desire. J Sex Med 6: 1506-1533.
- Sáenz de Tejada I. Erectile dysfunction. Pathophysiology.
In Lue T, Giuliano F, Khoury S, Rosen S, eds. 2004. Clinical
Manual of Sexual Medicine. Sexual Dysfunctions in Men. Birmingham UK. Health Publications Ltd, p. 22. - Schober JM, Pfaff D. 2007. The neurophysiology of
sexual arousal. Best Prac Res Clin Endocrinol Metab 21:
445-461. - Traish A, Guay AT. 2006. Are androgens critical for penile erections in human? Examining the clinical and preclinical evidence. J Sex med 3: 382-407.
- Condra M, Morales A, Harris C, Daicar A, Surridge D. 1990. Impotence and the MMPI: Where did we go wrong? Int impot Res 2: 167-174.
- Carter J, Tyson J, Tolis G, Van Vliets S, Faiman CH, Friesen H. 1978. Prolactin secreting tumors and hypogonadism in 22 men. N Engl J Med 299: 847-852.
- Devoto E, Madariaga M, Aravena L. 2014. Hiperprolactinemia funcional idiopática en el varón. Efecto de la hiperprolactinemia
en la función sexual a propósito de un caso con 29 años de
seguimiento. Rev Int Androl 12: 112-116.
- Csokaa A, Bahrick A, Mehtonen O. 2008. Persistent sexual dysfunction after discontinuation of selective serotonin reuptake inhibitors. J Sex Med 5: 227-233.
- Rehman J, Christ G, Alyskewy CZ, Kerr E, Melman A. 2000. Experimental hyperprolactinemia in a rat model: alteration in centrally mediated neuroerectile mechanism. Int J Impot Res 12: 23-32.
- Aoki H, Fujioka T, Matsuzaka J, Kubo T, Nakamura K, Yasuda N. 1995. Supression by prolactin of the electrically induced erectile response through its direct effect on the corpus cavernosum penis in the dog. J Urol 154: 595-600.