Hiperparatiroidismo primario en adolescente. Reporte de caso
Claudia Lozano C.1, Macarena Salinas V.2 y Marcela Molina P.3
Primary hyperparathyroidism in adolescent. Case report
IPediatra. Facultad de Medicina, Universidad de La Frontera, Temuco.
2Becada de Pediatría. Facultad de Medicina, Universidad de La Frontera, Temuco.
3Endocrinólogo Infantil. Servicio de Pediatría, Hospital Dr. Hernán Henríquez Aravena. Facultad de Medicina, Universidad de La Frontera, Temuco.
Autores declaran no presentar conflictos de interés ni financiamiento.
Correspondencia:
Claudia Lozano Canales
Claro Solar 115, Facultad de Medicina, Universidad de La Frontera, Temuco.
Teléfono (045) 2325769
claudia.lozano.canales@gmail.com
Recibido: 18-10-2017
Aceptado: 29-11-2017
Introduction: The hypercalcemia is infrequent in pediatrics, its clinical is diverse, and its etiology is determined by age. Among the dependent causes of parathormone (PHT) is the hyperthyroidism, state of hypersecretion of PHT by parathyroid glands (PG). The primary hyperparathyroidism (PHPT) is rare in children, there are 200 reported cases. In older children, the causes for PHPT correspond to parathyroid adenoma, multiglandular disease and parathyroid carcinoma. Objective: Report a case of an 11 years old male adolescent. He presents three months symptoms of constipation, anorexia, vomiting and weight loss. Urgent consultation due to an increase of his symptoms, in exams stand out: calcemia 16.67 mg/dl (NV 8.8-10.8 mg/dl), phosphatemia 2.21 mg/dl (NV 4.5-5.5 mg/dl), parathormone (PHT) 308.7 pg/ml (NV 15-68.3 pg/ml), calciuria/creatininuria 0.56 (NV < 0.2). He was hospitalized to manage his severe hypercalcemia, it was indicated hyperhydration, monopotassium phosphate, intravenous hydrocortisone and furosemide. In his study was performed a cervical ultrasound which showed a solid node in the right parathyroid gland, hypoechogenic and scintigram parathyroid compatible with right superior parathyroid adenoma. In the waiting for surgery was necessary the administration of intravenous pamidronate. In the post-operatory, he evolved with hipocalcemia that was corrected with intravenous calcium carbonate, overlapping to oral calcium and calcitriol. Conclusion: The PHPT is a pathology of low prevalence in pediatrics, one hundred times less than adults. In the adolescent, the most frequent cause is the parathyroid adenoma. It should be considered as a differential diagnosis in cases of symptomatic hypercalcemia in this age group.
Key words: Hypercalcemia, hyperparathyroidism, parathyroid adenoma.
Introducción
La hipercalcemia se define con un calcio total sérico mayor a 10,5 mg/dl1, es infrecuente en niños, sus manifestaciones clínicas aparecen con calcemia mayor a 12 mg/dl2. Los síntomas son inespecíficos, incluyen debilidad, irritabilidad, letargia, confusión, anorexia, náuseas, vómitos, constipación, entre otros2. Las etiologías están determinadas por edad, pudiendo encontrarse una base genética3. Las causas pueden ser dependientes o no de paratohormona (PTH)3. Entre las primeras, está el hiperparatiroidismo; estado de hipersecreción de PTH por las glándulas paratiroides (PT)4. Se clasifica en primario cuando existe excesiva secreción de PTH por hiperplasia, adenoma o carcinoma paratiroideo; secundario a hipocalcemia o deficiencia de vitamina D; y terciario por función autónoma de PT después de hiperparatiroidismo secundario prolongado1,4.
El hiperparatiroidismo primario (HPP) en niños es raro, reportándose 200 casos en la literatura5. En neonatos y lactantes la causa más habitual son mutaciones del receptor sensible a calcio (CaSR)5. En niños mayores y adolescentes las etiologías son adenoma paratiroideo único, enfermedad multiglandular por trastornos familiares hereditarios, síndrome de hiperparatiroidismo-tumor de mandíbula y carcinoma paratiroideo5.
Objetivo
Reportar caso de un adolescente con hipercalcemia severa provocada por hiperparatiroidismo primario a causa de un adenoma paratiroideo.
Caso clínico
Adolescente masculino de 11 años, previamente sano. Presenta historia de tres meses de constipación y anorexia. A los dos meses, se agregan náuseas, vómitos y pérdida de peso de 10 kg. Acude a Servicio de Urgencia, se solicitan exámenes, destacando: calcemia 16,67 mg/dl (VN 8,8-10,8 mg/dl) y fosfemia 2,21 mg/dl (VN 4,5-5,5 mg/dl). Ingresa a Servicio de Pediatría de Hospital Hernán Henríquez Aravena, para manejo y estudio. Se inicia hiperhidratación, fostato monopotásico, hidrocortisona y furosemida intravenosos (iv). En exámenes (Tabla 1), destaca: PTH 308,7 pg/ml (VN 15-68,3 pg/ml), calcemia de 13,2 mg/dl (VN 8,8-10,8 mg/dl) y fosfemia de 2,7 mg/dl (VN 4,5-5,5 mg/dl), índice calciuria/creatininuria 0,56 (VN < 0,2). Se realiza ecografía cervical que muestra PT derecha con nódulo sólido, hipoecogénico, de contornos delimitados, vascularizado al Doppler de 9,6 por 5,4 por 12 mm (Figura 1), por hallazgo se solicita cintigrama paratiroideo con Tecnecio 99 metaestable (Tc99m)-Sestamibi, destaca foco de acumulación de Sestamibi en polo superior del lóbulo tiroideo derecho, probable adenoma paratiroideo (Figura 2).
Tabla 1. Exámenes de laboratorio
Días desde inicio de estudio |
1 |
2 |
9 |
9 |
15 |
42 |
56 |
Calcemia (VN 8,8-10,8 mg/dl) |
16,67 |
13,2 |
7,8 |
|
6,9 |
9,3 |
9,1 |
Fosfemia (VN 4,5 a 5,5 mg/dl) |
2,21 |
2,7 |
2,6 |
|
4,3 |
5,1 |
4,6 |
PTH (VN 15-68,3 pg/ml) |
|
308,7 |
1.634 |
|
77,7 |
|
|
Índice calciuria/creatininuria (VN < 0,2) |
|
0,56 |
|
|
|
0,47 |
|
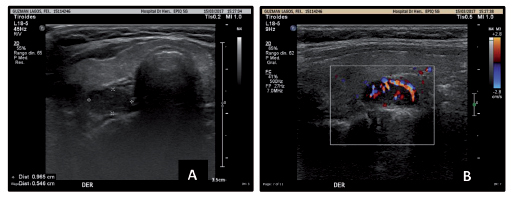 Figura 1. Ecografía cervical. A. Glándula paratiroides derecha con nódulo de aspecto sólido, hipoecogénico, de contornos bien delimitados de 9,6 por 5,4 por 12 mm de diámetro. B. Nódulo antes descrito se observa vascularizado al Doppler.
Figura 1. Ecografía cervical. A. Glándula paratiroides derecha con nódulo de aspecto sólido, hipoecogénico, de contornos bien delimitados de 9,6 por 5,4 por 12 mm de diámetro. B. Nódulo antes descrito se observa vascularizado al Doppler.

Para evaluar compromiso y etiología se solicita densitometría ósea: cadera derecha Z-score -1,9, cadera izquierda Z-score -2,0, columna vertebral lumbar Z score -0,7, ecografía reno-vesical normal, IGF-1 202 ng/ml (VN 183-850 ng/ml), 25-hidroxi-vitamina D 29,4 ng/ml (VN 20-100 ng/ml), prolactina 5,42 ng/ml (VN 3,46-19,4 ng/ml), TSH 0,91 mUI/L (VN 0,5-4,8 mUI/L), T4 libre 1,11 ng/dl (VN 0,8-1,7 ng/dl), FSH 0,65 mUI/ml (VN 0,95-11,95 mUI/ml), LH 1,87 mUI/ml (VN 0,57-12,07 mUI/ml), testosterona 1,18 ng/ml (Tanner II VN 0,18-0,50ng/ml), cortisol 6,2 ug/ml (VN 3,7-19,4 ug/ml). Se excluye compromiso hipofisiario actual como parte de neoplasia endocrina múltiple (NEM). Hipercalcemia no generó repercusión renal, pero sí ósea.
Evoluciona con bradicardia y QT corregido corto (0,28 segundos). Se traslada a Unidad de Tratamiento Intermedio para administración de pamidronato y monitorización. Se reseca adenoma paratiroideo. En postoperatorio presenta hipocalcemia que se corrige con carbonato de calcio iv, el que se traslapa a carbonato de calcio y calcitriol orales. PTH desciende de 1.634 pg/ml a 77,7 pg/ml. Evoluciona asintomático, con normalización de calcemia y fosfemia.
En controles ambulatorios se disminuye carbonato de calcio hasta suspenderse y se mantiene calcitriol. En último control, calcemia 9,1 mg/dl (VN 8,8-10,8 mg/dl), fosfemia 4,1 mg/dl (VN 4,5-5,5 mg/dl). Biopsia de PT confirma adenoma paratiroideo.
Discusión
La PTH es la principal hormona calciotrópica, su síntesis y secreción en las PT están controladas por la concentración de calcio ionizado extracelular4. El CaSR detecta esta concentración y desencadena la liberación de PTH en respuesta a su disminución. Cuando desciende el calcio ionizado, la PTH incrementa la resorción ósea y reabsorción renal de calcio, y estimula el metabolismo de la vitamina D a su forma activa 1,25 dihidroxi-vitamina D que participa en la absorción intestinal de calcio4.
El hiperparatiroidismo, estado de hipersecreción de PTH por las PT, puede ser primario cuando existe excesiva secreción de PTH por hiperplasia, adenoma o carcinoma de PT, secundario a hipocalcemia o deficiencia de vitamina D, y terciario por función autónoma de PT después de hiperparatiroidismo secundario prolongado1,4.
La causa más frecuente de HPP en neonatos y lactantes son mutaciones de CaSR5. En niños y adolescentes las causas son adenoma paratiroideo único, enfermedad multiglandular por trastornos familiares hereditarios comprendiendo NEM tipos 1 y 2a e hiperparatiroidismo aislado familiar y carcinoma paratiroideo5.
La prevalencia de HPP en niños es cien veces menos frecuente que en adultos6, con una incidencia de 1 en 300.000 nacidos vivos7. En niños, el HPP presenta similar prevalencia en ambos sexos, presentándose entre los 13-16 años7.
En 65-70% de los casos se evidencia una mutación somática esporádica que origina un adenoma paratiroideo solitario; y en 27-31%, una mutación de línea germinal heredada que produce un adenoma o hiperplasia múltiple en todas las PT4,5,8.
Los síndromes genéticos comprenden 5-15% de los HPP8. La NEM1, forma más común de HPP heredado (90%), edad de inicio 20-25 años, cursa con hiperplasia o adenomas paratiroideos múltiples, se asocia en 60-70% con tumor pancreático, 15-42% con tumor pituitario, que en un 25% de los casos secretan hormona de crecimiento o prolactina8.
El 80% de los adultos con HPP son asintomáticos5,9. La presentación clínica de HPP en niños y adolescentes es más grave, un 80% son sintomáticos y un 44% con daño de órgano final5,8-10. Los síntomas son inespecíficos: astenia (39%), pérdida de peso (32%); renales (41%) como hipercalciuria, poliuria, diabetes insípida nefrogénica y nefrolitiasis9,11; músculo-esqueléticos (16%) como atrofia muscular, dolor óseo, debilidad, hiporreflexia y osteoporosis, fracturas patológicas, osteítis fibrosa quística8; gastrointestinales (25%) como náuseas, vómitos y dolor abdominal, pancreatitis, constipación8; neuropsiquiátricos (8%) como irritabilidad, demencia y confusión; y alteraciones cardíacas como disminución del ST y QT corto en electrocardiograma2,5,7.
En estudio bioquímico de HPP destaca hipercalcemia, hipofosfemia, PTH aumentada o inapropiadamente normal8. La calcemia se afecta por la albuminemia y estado ácido base2. Se deben solicitar: fosfatasas alcalinas, función renal, 25-hidroxivitamina D, calciuria, índice calciuria/creatininuria, densitometría ósea y ecografía renal2,5. En asintomáticos, con hipercalcemia leve, PTH marginalmente elevada o normal e hipocalciuria debe descartarse hipercalcemia hipocalciúrica familiar5,8. Debe excluirse NEM8.
Para evidenciar glándulas aumentadas de volumen y si la alteración es única o múltiple, se realiza estudio imagenológico que comprende ecografía cervical y cintigrafía con Tecnecio 99 metoxi-isobutilnitrilo-Sestamibi (Tc99m-Sestamibi). En la primera, los adenomas se observan como nódulos ecoicos homogéneos, altamente vascularizados al Doppler. Tiene una sensibilidad de 86%, especificidad de 67% y un valor predictivo positivo de 95% en identificación de glándulas adenomatosas e hiperplásicas8,9.
El cintigrama Tc99m-Sestamibi evidencia adenomas paratiroideos y glándulas hiperplásicas. El 60-80% de los adenomas se detectan por Sestamibi, existen limitaciones en enfermedad multiglandular y adenomas pequeños. Es mejor que la ecografía para detectar adenomas ectópicos. Para el estudio de HPP esporádica tiene una sensibilidad de 60-92% y especificidad de 97%. La ecografía junto a cintigrama Tc99m-Sestamibi presentan una sensibilidad de 73-95% en evidenciar adenomas únicos8,9.
El 86% de los adolescentes con HPP presenta una glándula afectada, los adenomas únicos representan el 65% de los casos, un 27% corresponde a hiperplasia paratiroidea9,12,13.
El objetivo del manejo médico es optimizar la excreción de calcio, disminuir su salida desde el compartimento óseo y aumentar sus depósitos2,5. Pacientes con calcemia mayor a 12,02 mg/dl, requieren hospitalización para hiperhidratación con solución fisiológica 3.000-4.000 ml/m2/día, administración de furosemida 1 mg/kg cada 6 h, hidrocortisona 5 mg/kg cada 6 h que disminuye la absorción intestinal de calcio y aumenta su excreción urinaria e infusión de bifosfonatos como pamidronato que bloquean la resorción ósea11. Asintomáticos con hipercalcemia leve-moderada deben estudiarse, no requieren manejo específico.
El tratamiento definitivo implica cirugía, para corrección permanente de calcemia y PTH, alivio de síntomas, y prevención o reversión del daño de órgano final. La técnica, depende de la patología paratiroidea y estudio imagenológico. La cirugía es segura y efectiva, con baja tasa de complicaciones y una tasa de curación del 100% a los 6 meses14. La paratiroidectomía mínimamente invasiva, produce menor morbilidad y estadía hospitalaria5,15. Debe considerarse suplementación de calcio y vitamina D35.
Conclusiones
La hipercalcemia es infrecuente en niños, sus manifestaciones son inespecíficas, requiere un alto índice de sospecha diagnóstica. Se puede diferenciar etiología según edad, y determinar si es una causa dependiente o no de PTH. Si se encuentra PTH elevada se debe sospechar hiperparatiroidismo, que puede ser primario, secundario o terciario. Si es primario la etiología más probable es un adenoma paratiroideo, se debe realizar estudio imagenológico y resección tumoral, procedimiento de significancia curativa.
Referencias bibliográficas
- Garfias C, Villanueva S, Ugarte F. 2011. Hiperparatiroidismo primario: presentación de un caso y revisión de la literatura. Rev Chil Pediatr 82 (4): 336-343.
- Aránguiz C, Trujillo O, Reyes M. 2005. Emergencias endocrinas en pediatría: diagnóstico y manejo. Rev Med Chile 133: 1371-1380.
- Davies J. 2015. Approach to the Child with Hypercalcaemia. Endocr Dev. Basel, Karger 28: 101-118.
- Bilezikian J, Marcus R, Levine M, Marcocci C, Silverberg S, Potts J. 2015. The Parathyroids. Third Edition 2015. Chapter 25: Primary Hyperparathyroidism in Children and Adolescents.
- Alagaratnam S, Kurzawinski T. 2015. Aetiology, Diagnosis and Surgical Treatment of Primary Hyperparathyroidism in Children: New Trends. Horm Res Paediatr 2015; 83: 365-375.
- Fraser W. 2009. Hyperparathyroidism. Lancet 374: 145-158.
- Mallet E. 2008. Working Group on Calcium Metabolism. Primary Hyperparathyroidism in Neonates and Childhood. Horm Res 69: 180-188.
- Marcocci C, Cetani F. 2011. Primary Hyperparathyroidism. N Engl J Med 2011; 365: 2389-97.
- Roizen J, Levine M. 2014. A Meta-Analysis Comparing the Biochemistry of Primary Hyperparathyroidism in Youths to the Biochemistry of Primary Hyperparathyroidism in Adults. J Clin Endocrinol Metab 99 (12): 4555-4564.
- Crouzeix G, Kerlan V. 2014. Hyperparathyroïdie primaire: nouveaux concepts, nouvelles recommandations. Annales d’Endocrinologie 75: S21-S36.
- Kollars J, Zarroug A, Heerden J, Lteif A, Stavlo P, Suárez L, et al. 2005. Primary Hyperparathyroidism in Pediatric Patients. Pediatrics 115: 974.
- Belcher R, Metrailar A, Bodenner D, Stack B. 2013. Characterization of hyperparathyroidism in youth and adolescents: A literature Review. International Journal of Pediatric Otorhinolaryngology 77: 318-322.
- Lou I, Schneider D, Sippel R, Chen H, Elfenbein D. 2017. The Changing Pattern of Diagnosing Primary Hyperparathyroidism in Young Patients. Am J Surg 213 (1): 146-150.
- Mancilla E, Levine M, Adzick N. 2017. Outcomes of minimally invasive parathyroidectomy in pediatric patients with primary hyperparathyroidism owing to parathyroid adenoma:A single institution experience. J Pediatr Surg 52 (1): 188-191.
- Pashtan I, Grogan R, Kaplan S, Devon K, Angelos P, Liu D, et al. 2013. Primary hyperparathyroidism in adolescents: the same but different. Pediatr Surg Int 29: 275-279.