Estudio de frecuencia y asociación de los polimorfismos RS965513 y RS1867277 del gen FOXE1 con el carcinoma papilar de tiroides y su riesgo de recurrencia en población chilena
Carolina Valdivia P.1,2, Daniela Olivari U.1,2, María Javiera Pérez E.1,2, Alejandra Tapia Castillo1,2, David Ortiz C.1,2, Eric Barros L.1,2, Carlos E. Fardella B.1,2, Cristián A. Carvajal M1,2, José Miguel Domínguez R-T1,2.
Frequency and association of the polymorphisms RS965513 and RS1867277 of the FOXE1 gene with papillary thyroid carcinoma and its risk of recurrence in Chilean population
1 Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
2 Centro de Estudios Traslacionales en Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
*Correspondencia a: José Miguel Domínguez R/ jdomingu@ uc.cl Diagonal Paraguay 362, Piso 4, Santiago Centro, Chile 8330077. Teléfono: 2 2354 3095
Fuentes de financiamiento: SOCHED 2015-02, CONICYT-FONDECYT 1150437 y CETREN-UC.
Recibido: 04-09-2019
Aceptado: 20-11-2019
Resumen. Resumen: Introducción: El gen FOXE1 (Forkhead box E1) codifica para un factor de transcripción involucrado en la morfogénesis tiroidea. El cáncer papilar de tiroides (CPT) se ha asociado con polimorfismos (SNP) de FOXE1 rs1867277 y rs965513 en población asiática y europea. Nuestro objetivo fue investigar la frecuencia y asociación de SNP rs1867277 y rs965513 con CPT y el riesgo de recurrencia de CPT en sujetos chilenos. Métodos: Se reclutaron sujetos con y sin CPT, se describieron sus características epidemiológicas y la forma de presentación clínica (AJCC VIII y MINSAL 2013). Se aisló ADN de leucocitos periféricos y evaluó ambos SNP mediante PCR-HRM y secuencia. Se compararon las frecuencias alélicas y genotípicas entre casos CPT y controles, y entre pacientes CPT de distintos riesgos de recurrencia. Se compararon frecuencia y se estimó el riesgo con test de Fisher y cálculo de odds-ratio (OR). Resultados: De los 184 sujetos, 156 (85%) eran mujeres, edad 39,3±12,3 años; 90 con CPT y 94 sin CPT 26 (28,9%) pacientes eran de riesgo muy bajo, 45 (50%) bajo, 16 (17,8%) intermedio y 3 (3,3%) alto según MINSAL 2013. En relación a la frecuencia de alelo menor (MAF) calculada en sujetos control y CPT, fue 31,7% y 24,5% (SNP rs965513), y 36,7% y 30,1% 8 (rs1867277), respectivamente (p NS). Tampoco fueron diferentes las MAF calculados y comparados entre pacientes con CPT de riesgo bajo e intermedio/alto. Sin embargo, la combinación de los genotipos rs1867277GG y rs965513AA se asoció a mayor riesgo de CPT. Conclusiones: En pacientes chilenos, se describe una frecuencia MAF de los SNP rs1867277 y rs965513 cercana a un 30%, las cuales no se asocian a CPT ni riesgo de recurrencia, sin embargo, sujetos con una combinación genotípica particular podrían tener mayor riesgo de CPT.
Palabras claves: Neoplasias tiroideas; Predisposición genética a enfermedades; Polimorfismo.
Abstract: Introduction: FOXE1 gene (Forkhead E1 box) codes for a transcription factor involved in thyroid morphogenesis. Papillary thyroid cancer (PTC) has been associated with FOXE1 polymorphisms (SNPs) rs1867277 and rs965513 in Asian and European population. Our aim was to investigate the frequency and the association of SNPs rs1867277 and rs965513 with PTC and the risk of recurrence of PTC in Chilean subjects. Methods: We recruited subjects with and without PTC. In those with PTC, their epidemiological characteristics and clinical features presentation are described according to AJCC VIII and MINSAL 2013 scales. Peripheral leukocyte DNA was isolated and both SNPs were evaluated using PCR-HRM and sequencing. Allelic and genotypic frequencies were compared between PTC cases and controls, and between PTC patients with different recurrence risks. Results: Of the 184 subjects, 156 (85%) were women, age 39.3 ± 12.3 years; 94 (51%) without PTC and 90 with PTC (49%): 26 (28.9%) patients had very low, 45 (50%) low, 16 (17.8%) intermediate and 3 (3.3%) high risk of recurence according to MINSAL 2013. Regarding the minor allele frequency (MAF) calculated on control and PTC subjects, was 31.7% and 24.5% (SNP rs965513), and 36.7% and 30.1% (rs1867277), respectively (p NS). In patients with PTC, MAFs were not different between patients with low and intermediate/high risk PTC. However, the combination of rs1867277GG and rs965513AA genotypes were associated with an increased risk of PTC. Conclusions: In Chilean patients, the MAF frequency of SNPs rs1867277 and rs965513 is near 30%, and they are are not associated with PTC or its risk of recurrence. However, subjects with a particular genotypic combination may have an increased risk of PTC.
Keywords: Genetic predisposition to diseases, Polymorphism, Thyroid neoplasms.
El cáncer papilar de tiroides (CPT) es la neoplasia endocrinológica más frecuente y su incidencia ha aumentado sostenidamente en las últimas tres décadas a nivel mundial1,2,3. En Chile la situación es similar, y en 2014 se estimó una incidencia de cáncer de tiroides en 7,6 casos por cada 100.000 personas/ año, 90% de ellos CPT, similar a lo reportado en la literatura3.
Si bien la etiología del CPT no está del todo aclarada, se postula que la interacción entre variantes genéticas y factores ambientales determinan una susceptibilidad individual4,5. Existen factores de riesgo conocidos, como la exposición a radiación ionizante durante la infancia y el antecedente familiar de CPT en dos o más familiares de primer grado5. Sin embargo, en más de un 95% de los pacientes con CPT no se identifica ninguno de estos factores de riesgo4. En las últimas dos décadas se han intentado identificar genes asociados al desarrollo y pronóstico de CPT. Mediante GWAS (Genome Wide Association Study), estudios internacionales han descrito la asociación de 19 polimorfismos en el gen FOXE1 (Forkhead box E1), que codifica para un factor de transcripción tiroideo FOXE1, con un mayor riesgo de CPT4,6,7,8.
FOXE1 forma parte de la familia de factores de transcripción tiroideo en “cabeza de tenedor” o forkhead/winged-helix domain. Es una proteína de 373 aminoácidos y es codificado por el gen FOXE1 ubicado en el cromosoma 9q22.33, que solo tiene 1 exón (Figura 1). Estimulado por la hormona tiroestimulante (TSH), FOXE1 regula la transcripción de tiroglobulina, peroxidasa y Dual oxidase 2, enzimas fundamentales en la síntesis de hormonas tiroideas4,7,9. FOXE1 juega un rol esencial en el crecimiento y desarrollo de la glándula tiroides y en la proliferación y diferenciación de las células foliculares. Es un regulador clave de la función celular, incluyendo crecimiento y diferenciación celular, así como el desarrollo tumoral, invasión y desarrollo de metástasis8.
Diferentes polimorfismos de un nucleótido (SNP) en el gen FOXE1 se han asociado a mayor de riesgo de CPT en población caucásica y asiática.
Un meta-análisis que incluyó 16 estudios con 120.258 pacientes demostró las siguientes asociaciones entre diferentes SNPs y CPT: rs965513 OR 1.74 (IC 95% 1.62–1.86, P<0.01) y rs1867277 OR 1.62 (IC 95% 1.50–1.76, P<0.01)10.
Se ha estudiado también la asociación entre la presencia de más de uno de estos SNPs y el aumento de riesgo de CPT. En un estudio que incluyó 781 pacientes con cáncer diferenciado de tiroides y 6.122 controles, la presencia del diplotipo AA del rs1867277 y también el genotipo AA del rs965513 se asoció a un aumento significativo de cáncer diferenciado de tiroides con un OR 4.45 (IC 95% 3.379-5.876, P<0.01)11.
Desde el punto de vista funcional, el rs1867277 se ubica en la región promotora de FOXE1 y sólo el alelo A es capaz de formar un complejo proteico con los factores de transcripción USF1 y USF2 (upstream transcription factors 1 y 2), que regulan positivamente la actividad transcripcional del promotor de FOXE19. El rs965513 se ubica aproximadamente a 57 kb del locus de gen FOXE1, el alelo A se ha asociado a una menor expresión de FOXE1 y TSHR (receptor de TSH), lo que es compatible con una menor diferenciación celular, que favorecería el desarrollo y crecimiento tumoral9. El alelo de menor frecuencia en ambos SNPs es adenina (A), y las frecuencias alélicas menores (MAF, del inglés minor alelle frecuency) reportadas para los rs1867277 y rs965513 son 40% y 20%, respectivamente10,12.
El objetivo de este estudio es investigar la frecuencia de los SNPs rs965513 y rs1867277 del gen FOXE1 en sujetos chilenos con y sin CPT, y evaluar su relación con el riesgo de recurrencia.
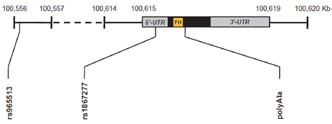 Figura 1. Representación esquemática del gen FOXE1 con las posiciones de
SNPs rs965513, rs1867277 y rs71369530 (polyala). Las regiones no traducidas
5´y 3´ UTR´s se representan en gris, el único exón en negro y la secuencia
forkhead binding domain en amarillo (FH).
Figura 1. Representación esquemática del gen FOXE1 con las posiciones de
SNPs rs965513, rs1867277 y rs71369530 (polyala). Las regiones no traducidas
5´y 3´ UTR´s se representan en gris, el único exón en negro y la secuencia
forkhead binding domain en amarillo (FH).Sujetos y métodos
Sujetos. Se reclutaron 94 sujetos de 18 o más años sin CPT. Se incluyeron pacientes sometidos a tiroidectomía total con estudio histológico benigno, o con ecografía tiroidea que no evidenció nódulos tiroideos, o nódulos tiroideos con patrón ecográficamente benigno según ATA 2015 o con estudio citopatológico benigno (categoría II según escala de Bethesda II)13,14. En el mismo período de tiempo se reclutaron 90 sujetos de 18 o más años con diagnóstico post-operatorio de CPT, tratados en la Red de Salud UC Christus. Todos fueron tratados con cirugía y uso selectivo de radioyodo, de acuerdo a las guías MINSAL15.
Se registró la edad al diagnóstico, género y la presencia de factores de riesgo para CPT (exposición a radiación ionizante, antecedente de CPT en familiares de 1° grado, presencia de síntomas atribuibles al CPT). Adicionalmente, en los pacientes con CPT se registraron los hallazgos de la ecografía cervical pre-operatoria, el estudio histopatológico completo (diámetro tumoral mayor, número de focos, bilateralidad, presencia de invasión vascular, extensión extra-tiroidea macro o microscópica y compromiso ganglionar cervical) y la presencia de metástasis a distancia.
El riesgo de recurrencia de los pacientes con CPT se definió de acuerdo a la escala MINSAL 2013, que considera elementos del estudio preoperatorio, los hallazgos intraoperatorios, la histología tumoral y el resultado de la exploración sistémica en pacientes sometidos a ablación con radioyodo, para clasificar a los pacientes en 4 categorías de riesgo de recurrencia: alto, intermedio, bajo y muy bajo15. Adicionalmente, los pacientes con CPT fueron etapificados de acuerdo al sistema AJCC VIII, que clasifica a los pacientes en etapas que predicen mortalidad específica por CPT16. Los pacientes con CPT fueron clasificados en 2 grupos según su riesgo de recurrencia MINSAL 2013: riesgo bajo/muy bajo; riesgo intermedio/alto.
Se excluyeron aquellos sujetos que cumplieran con al menos una de las siguientes características: edad menor de 18 años, que tuvieran cáncer de tiroides de otro tipo histológico o estudio preoperatorio o histopatológico incompleto.
Este estudio fue aprobado por el comité de Ética Científico de la Facultad de Medicina de la Pontificia Universidad Católica de Chile y todos los participantes firmaron un consentimiento informado para participar en el estudio.
Estudio genético para detectar los polimorfismos rs 1867277 y rs 965513 del gen FOXE1
A partir de muestras de sangre preservadas con EDTA se aisló ADN genómico desde leucocitos periféricos mediante la técnica de Lahiri17. La concentración del ADN fue medida en el equipo NanoQuant® infinite M200pro (TECAN, Suiza). Todas las muestras de ADN fueron diluidas a 100 ng/ul con agua libre de nucleasas (Thermo scientific®).
Las muestras de ADN de todos los pacientes fueron amplificadas por técnica de PCR utilizando 500ng de ADN genómico y las siguientes condiciones de amplificación: a) 95ºC por 8 min, 95ºC por 15 seg, 63ºC por 15 seg, 72ºC por 20 seg, por 40 ciclos con partidores especificos rs1867277_ FW: AGCGGGCACCACAGACCAG y rs18 1867277_RV: AGAGGCTCGGGAGTGACC; b) 95ºC por 8 min, 95ºC por 15 seg; 56ºC por 15 seg, 72ºC por 20 seg, por 40 ciclos con partidores especificos rs965513_FW: GGAGGTAGCAGGCAGAGAAT; rs96_RV: CCCAGGCTCAGGTTATGTCTT. El PCR-HRM (high resolution melting) se llevó a cabo en un termociclador Corbett Rotor – Gene TM6000-HRM, con el protocolo ya descrito de la enzima Fast EvaGreen qPCR Master Mix (Biotium®, Hayward, CA). Para el estudio de ambos polimorfismos (rs), se validaron los resultados de las curvas de melting de acuerdo al resultado de la secuenciación por técnica Sanger de controles conocidos (Macrogen Inc, Seúl, Corea).
Análisis estadístico
El tamaño muestral se calculó en base a la frecuencia descrita para adenina en el rs965513: 35% y 58% en controles y casos respectivamente18, estimando un OR de 2,47, con una potencia de 80% y utilizando un intervalo de confianza del 95%, con lo que se obtuvo un tamaño de 84 sujetos por grupo.
Para ambos grupos (casos y controles) se determinó la frecuencia alélica de ambos polimorfismos. Se realizó un análisis de equilibrio de Hardy-Weinberg en la población estudiada. Entre los casos y controles se comparó la frecuencia de cada uno de los alelos y genotipos por Chi2, y se determinó el OR según los modelos recesivo, dominante y de codominancia de cada polimorfismo.
Se consideró significancia estadística con un valor p < 0,05. El análisis estadístico se realizó con los programas SPSS (versión 15.0.0: SPSS, Inc., Chicago, IL) y GraphPad Prism (versión 7.00 para Windows, GraphPad Software, La Jolla, CA).
Resultados
Se incluyeron un total de 184 sujetos, 156 (85%) mujeres, edad 39,3±12,3 años; 90 sujetos con CPT y 94 sin CPT. No hubo diferencias de edad ni género entre grupos con y sin CPT. Ochenta y seis pacientes (95,6%) tenían CPT etapa I, 3 (3,3%) etapa II y 1 (1,1%) etapa IVB de acuerdo al sistema AJCC VIII. Según MINSAL 2013, 26 (28,9%) pacientes eran de riesgo muy bajo, 45 (50%) bajo, 16 (17,8%) intermedio y 3 (3,3%) alto. Cincuenta y tres pacientes (59%) se realizaron tiroidectomía total y en 36 (40%) se realizó disección ganglionar. Sólo 1 paciente (1%) fue tratado con tiroidectomía parcial y 49 pacientes (55%) recibieron radioyodo (mediana dosis 100mCi, rango 30-200mCi).
El análisis de equilibrio de Hardy-Weinberg (H-W) en la población estudiada da cuenta que los SNPs rs965513 y rs1867277 están en equilibrio de H-W: rs1867277 X2 0,666; GL1; p NS; y rs965513 X2 0,301; GL1; p NS.
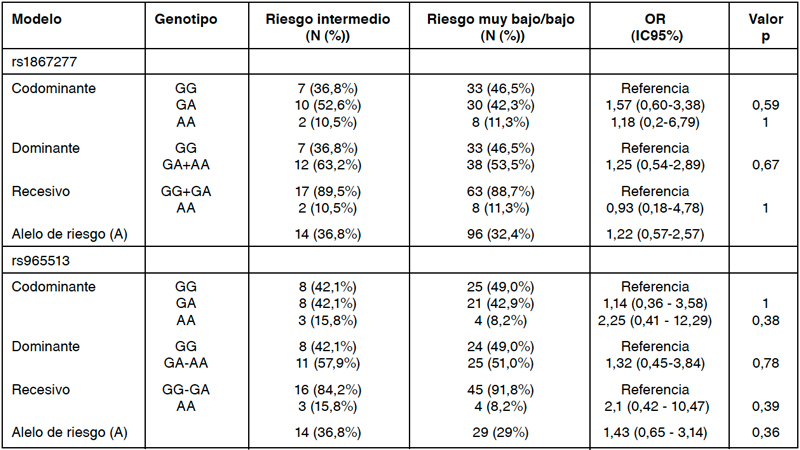
En relación a la frecuencia de alelo menor (MAF) calculada en sujetos control y CPT, fue de 31,7% y 24,5% (SNP rs965513), y 36,7% y 30,1% 8 (rs1867277), respectivamente. No se encontraron diferencias en las frecuencias alélicas ni genotípicas entre los pacientes con y sin CPT de acuerdo a los modelos de análisis codominante, dominante ni recesivo (Tabla 1). Asimismo, no se encontraron diferencias al comparar pacientes con CPT de riesgo bajo y de riesgo intermedio/alto (Tabla 2). Al estudiar el impacto de las combinaciones de haplotipos de los rs1867277 y rs965513 en CPT, considerando la combinación de alelos GG en ambos SNPs como referencia, la combinación de los genotipos rs1867277 GG y rs965513 AA se asoció a mayor riesgo de CPT (OR 1,75; p= 0,019) y de CPT riesgo intermedio/ alto (OR 14,25; p=0,034), lo cual fue evidenciado en 5 pacientes del grupo CPT quienes presentaban una progresión avanzadas del cáncer, como compromiso ganglionar, entre otros.
Tabla 1: Asociación de rs1867277 y rs965513 con cáncer papilar de tiroides (CPT).
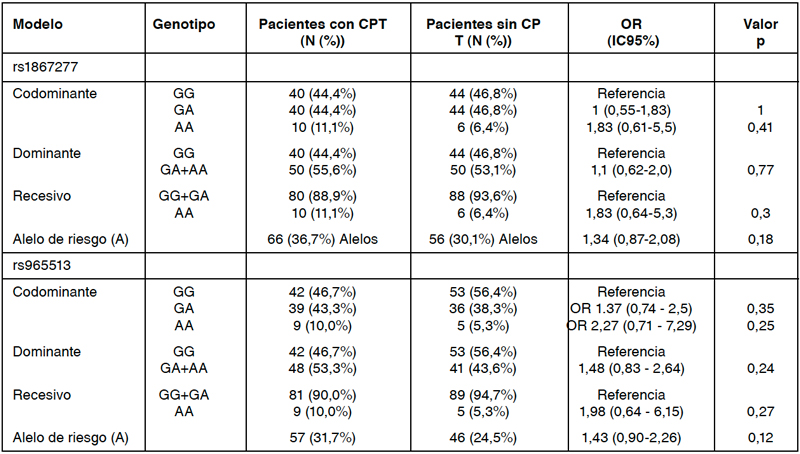
Tabla 2: Asociación de rs1867277 y rs965513 con riesgo de recurrencia en cáncer papilar de tiroides (CPT), según escala MINSAL 2015.
Discusión
Este es el primer estudio latinoamericano que investiga la frecuencia de los SNPs rs965513 y rs1867277 en pacientes con y sin CPT. Al evaluar el impacto de cada SNP, no se encontraron diferencias en las frecuencias alélicas ni genotípicas entre los pacientes con y sin CPT, ni entre los distintos grupos de riesgo de recurrencia. Sin embargo, la combinación de los genotipos rs1867277GG y rs965513AA se asoció a mayor riesgo de CPT y a mayor riesgo de recurrencia.
Se ha postulado que la susceptibilidad individual para tener CPT depende de una compleja interacción entre factores ambientales y la coexistencia de alteraciones genéticas de baja penetrancia4,5. En ese sentido, entre los resultados obtenidos destaca que la coexistencia de los genotipos se asociara a mayor riesgo de CPT y riesgo de recurrencia. Esta combinación se dio en 5 pacientes con CPT: 3 de ellos (60%) correspondían a CPT de riesgo intermedio según la escala MINSAL 2013, y cuatro (80%) presentaban compromiso ganglionar clínico, con metástasis ganglionares cervicales de hasta 3,2cm de diámetro mayor. Es importante señalar que en la cohorte total de pacientes con CPT, sólo 16 (17,8%) fueron clasificados de riesgo intermedio y 35 (39%) se presentaron con metástasis ganglionares al diagnóstico. Si bien en otras series son los alelos de menor frecuencia, adenina en el caso de los SNPs estudiados, los que se han asociado a CPT y presentaciones más agresivas de CPT, en esta serie fue la combinación de los genotipos rs1867277 GG y rs965513 AA las que se asoció a este efecto.
A diferencia de los estudios publicados en poblaciones asiáticas y europeas, en esta población chilena los SNPs rs965513 y rs1867277 no se asociaron a CPT ni a riesgo de recurrencia en el análisis alélico ni genotípico. Una posible explicación para este fenómeno son las diferencias en las frecuencias de los alelos menores (MAF) encontradas en esos estudios y el nuestro18. Por ejemplo, una serie portuguesa reportó MAF de 40% para el rs1867277 en el grupo control y 53% el grupo con CPT, respectivamente, mientras que en nuestro estudio esas MAF fueron 36,7% y 30,1%, respectivamente18. En relación al rs965513, ese mismo estudio encontró MAF de 35% y 58% en controles y casos respectivamente, que en nuestra serie llegaron a 31,7% y 24,5%, respectivamente. Las diferencias de MAFs entre poblaciones ha sido reportada previamente: un meta-análisis que incluyó 120.258 individuos, para el rs965513 encontró una MAF en el grupo control de 6% en población asiática y 40% en población caucásica10, lo cual indica una alta variabilidad del MAF dada por la etnia de la población de estudio.
Una de las fortalezas de este estudio es la selección de los casos y los controles. Como en otras series publicadas, en el grupo de casos se incluyeron pacientes con diagnóstico histológico de CPT, que fueron tratados por esa patología10. Sin embargo, a diferencia de estudios previos, el grupo de controles de esta serie está conformado por sujetos en quienes se descartó razonablemente CPT por distintos métodos, lo que permite definir dos grupos clínicamente diferentes y comparar de manera adecuada los SNPs en ambos grupos8,10.
Las diferencias entre las frecuencias alélicas de nuestra serie y las previamente reportadas podrían impactar negativamente sobre el cálculo del tamaño muestral de nuestro estudio, con ello sería necesario identificar un tamaño muestral mayor al calculado para encontrar diferencias entre ambos grupos.
En conclusión, este estudio muestra que, en población chilena, los rs1867277 y rs965513 presentan una frecuencia MAF cercana al 30% y no se asocian por separado a CPT ni riesgo de recurrencia. Sin embargo, en la población estudiada la combinación genotípica de SNP rs1867277 GG y rs965513 AA se asocia a mayor riesgo de CPT y riesgo de recurrencia.
Agradecimientos. Agradecemos a nuestros pacientes y voluntarios que desinteresadamente aportaron sus datos para la realización de este estudio.
Referencias
- Davies L, Welch HG. Current thyroid cancer trends in the United States. JAMA Otolaryngol Head Neck Surg. 2014; 140(4): 317-22.
- Mosso L, Campusano C, González H, Domínguez JM, Salman P, Suazo V, et al. [From macro to micro thyroid carcinoma: records of a clinical hospital from 1991 to 2010]. Rev Med Chil. 2013; 141(4): 442-448.
- Sapunar J, Munoz S, Roa J. Epidemiología del cáncer de tiroides en Chile: Resultados del estudio INCATIR. Revista médica de Chile. 2014; 142(9): 6.
- Nagy R, Ringel MD. Genetic predisposition for nonmedullary thyroid cancer. Horm Cancer. 2015; 6(1): 13-20.
- Bauer AJ. Clinical behavior and genetics of nonsyndromic, familial nonmedullary thyroid cancer. Front Horm Res. 2013; 41: 141-148.
- Gudmundsson J, Sulem P, Gudbjartsson DF, Jonasson JG, Sigurdsson A, Bergthorsson JT, et al. Common variants on 9q22.33 and 14q13.3 predispose to thyroid cancer in European populations. Nat Genet. 2009; 41(4): 460-464.
- Fernández LP, López-Márquez A, Santisteban P. Thyroid transcription factors in development, differentiation and disease. Nat Rev Endocrinol. 2015;11(1):29-42.
- Chen YH, Zhang YQ. Exploration of the association between FOXE1 gene polymorphism and differentiated thyroid cancer: a meta-analysis. BMC Med Genet. 2018; 19(1): 83.
- Landa I, Ruiz-Llorente S, Montero-Conde C, Inglada-Pérez L, Schiavi F, Leskelä S, et al. The variant rs1867277 in FOXE1 gene confers thyroid cancer susceptibility through the recruitment of USF1/USF2 transcription factors. PLoS Genet. 2009; 5(9): e1000637.
- Zhuang Y, Wu W, Liu H, Shen W. Common genetic variants on FOXE1 contributes to thyroid cancer susceptibility: evidence based on 16 studies. Tumour Biol. 2014; 35(6): 6159-666.
- Jones AM, Howarth KM, Martin L, Gorman M, Mihai R, Moss L, et al. Thyroid cancer susceptibility polymorphisms: confirmation of loci on chromosomes 9q22 and 14q13, validation of a recessive 8q24 locus and failure to replicate a locus on 5q24. J Med Genet. 2012; 49(3): 158-163.
- Zhu H, Xi Q, Liu L, Wang J, Gu M. Quantitative assessment of common genetic variants on FOXE1 and differentiated thyroid cancer risk. PLoS One. 2014; 9(1): e87332.
- Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1): 1-133.
- Cibas ES, Ali SZ, Conference NTFSotS. The Bethesda System For Reporting Thyroid Cytopathology. Am J Clin Pathol. 2009;132(5): 658-665.
- Wohllk N, Pineda P, Tala H, Domínguez JM, González H, Amaral H, et al. 2013; Guía Clínica Nódulo Tiroideo y cáncer diferenciado de tiroides. https://www.minsal.cl/sites/default/files/files/GPCTiroides.pdf. Accedido el 06.11.19
- Tuttle RM, Haugen B, Perrier ND. Updated American Joint Committee on Cancer/Tumor-Node-Metastasis Staging System for Differentiated and Anaplastic Thyroid Cancer (Eighth Edition): What Changed and Why? Thyroid. 2017; 27(6): 751-756.
- Lahiri DK, Nurnberger JI. A rapid non-enzymatic method for the preparation of HMW DNA from blood for RFLP studies. Nucleic Acids Res. 1991; 19(19): 5444.
- Tomaz RA, Sousa I, Silva JG, Santos C, Teixeira MR, Leite V, et al. FOXE1 polymorphisms are associated with familial and sporadic nonmedullary thyroid cancer susceptibility. Clin Endocrinol (Oxf). 2012; 77(6): 926-933.