Efecto del extracto hidroalcohólico de la planta Lampaya medicinalis Phil. (Verbenaceae) sobre la esteatosis inducida in vitro en hepatocitos humanos
Paulina Ormazábal1,*, Gabriela Yuri2, Sofía Sanhueza2, Mariana Cifuentes3, Karin Herrera2, Adrián Paredes4, Glauco Morales5.
Effect of the hydroalcoholic extract of the plant Lampaya medicinalis
Phil. (Verbenaceae) on in vitro-induced steatosis in human hepatocytes
1. Bioquímico. Universidad de O'Higgins
e Instituto de Nutrición y Tecnología de
los Alimentos (INTA). Santiago. Chile.
2. Nutricionista. Instituto de Nutrición y Tecnología de los Alimentos (INTA). Santiago. Chile.
3. Químico farmacéutico. Instituto de Nutrición y Tecnología de los Alimentos (INTA). Santiago. Chile.
4. Químico. Universidad de Antofagasta. Antofagasta. Chile.
5. Profesor de Biología y Química. Universidad
de Antofagasta. Antofagasta. Chile.
*Correspondencia: Paulina Ormazábal.
Av. Libertador Bernardo O'Higgins 611, Rancagua, Chile.
Teléfono: +56 2 23328 6038.
E-mail: paulina.ormazabal@uoh.cl;
p.ormazabal@inta.uchile.cl
Apoyo financiero: Proyecto SOCHED
2018-03.
Recibida: 17-06-2020
Aceptada: 08-10-2020
Resumen: Introducción: La enfermedad del hígado graso no alcohólico (EHGNA) es la forma más común de enfermedad hepática. A nivel celular se caracteriza por la acumulación de triglicéridos (TG) en forma de gotas lipídicas (GL) dando lugar a esteatosis e inflamación. Entre los factores relevantes para la síntesis de TG se encuentran las enzimas DGAT1/2 que catalizan la etapa final de la síntesis de TG, y la proteína FABP4 que transporta lípidos intracelulares y se expresa en modelos de enfermedad hepática dependiente de obesidad. Por otra parte, TNF-α es una reconocida citoquina involucrada en el proceso inflamatorio en la EHGNA. La medicina popular del norte de Chile ha utilizado la planta Lampaya medicinalis Phil. (Verbenaceae) para el tratamiento de algunas enfermedades inflamatorias. Objetivo: Evaluar el efecto de un extracto hidroalcóholico de lampaya (EHL) sobre la esteatosis y expresión de marcadores de inflamación en hepatocitos tratados con ácidos grasos. Diseño experimental: Estudio in vitro en cultivos de la línea celular humana HepG2 tratadas con ácido oleico (AO) y ácido palmítico (AP). Métodos: Se incubó hepatocitos HepG2 con AO/AP por 24 horas en presencia o no de EHL. Se evaluó la presencia de GL y el contenido de TG intracelulares por Oil Red O y Nile Red, respectivamente. La expresión de DGAT1/2, FABP4 y TNF-α fue evaluada por qPCR. Resultados: Los hepatocitos tratados con AO/AP mostraron un aumento en las GL y TG, así como una mayor expresión de DGAT2 en comparación al control. El cotratamiento con EHL revirtió los efectos inducidos por AO/AP. Conclusiones: EHL revierte el incremento en las GL, TG y en la expresión de DGAT2 inducido por AO/AP en células HepG2. Estos hallazgos sugieren un efecto hepatoprotector de la Lampaya contra la esteatosis, y apoyarían su uso complementario en el tratamiento de patologías con componente inflamatorio como la EHGNA.
Palabras clave: Enfermedad de hígado graso no alcohólico; Esteatosis; Inflamación; Hepatocitos HepG2; Lampaya medicinalis Phil.
Abstract: Non-alcoholic fatty liver disease (NAFLD) is the most common liver disease. At the cellular level, it is characterized by the accumulation of triglycerides (TG) in the form of lipid droplets (LD), which leads to steatosis and inflammation. Among relevant factors for TG synthesis are the enzymes DGAT1/2 catalyzing the final stage of TG synthesis, and the protein FABP4 which transports intracellular lipids and is expressed in cell models of obesity-dependent liver disease. Additionally, TNF-α is a cytokine involved in the inflammatory process associated to NAFDL. Lampaya medicinalis Phil. (Verbenaceae) is a plant used in folk medicine in northern Chile to treat some inflammatory diseases. Objective: To evaluate the effect of the hydroalcoholic extract of lampaya (HEL) on steatosis and the expression of inflammatory markers in hepatocytes treated with fatty acids. Study design: In vitro study in cultures of the human HepG2 cell line treated with oleic acid (OA) and palmitic acid (PA). Methods: HepG2 hepatocytes were incubated with OA/PA for 24 hours in the presence and absence of HEL. The formation of LD and the accumulation of intracellular TG were assessed by Oil Red O and Nile Red, respectively. The expression of DGAT1/2, FABP4 and TNF-α was assessed by qPCR. Results: The treatment with OA/PA increased the levels of LD and TG as well as the expression of DGAT2 in HepG2 hepatocytes compared to control cells. HEL cotreatment counteracted OA/PA-induced effects. Conclusions: HEL prevents the increase in LD and TG levels and DGAT2 expression induced by OA/PA in HepG2 cells. These findings suggest that lampaya may have a protective effect against hepatic steatosis, which would support its complementary use in the treatment of pathologies associated with inflammation, such as NAFLD.
Keywords: HepG2 hepatocytes; Inflammation; Lampaya medicinalis Phil.; Non Alcoholic Fatty Liver Disease (NAFLD); Steatosis.
La enfermedad de hígado graso no alcohólico (EHGNA) es una patología hepática de alta prevalencia1 caracterizada por la presencia de esteatosis en ausencia de consumo excesivo de alcohol2,3. La alteración en el metabolismo de ácidos grasos (AG) provenientes de la lipogénesis hepática de novo y lipólisis del tejido adiposo, juega un rol clave en el desarrollo de la esteatosis. Estos AG son almacenados en forma de triglicéridos (TG) en las gotas lipídicas (GL) intracelulares del hepatocito, una característica propia de la EHGNA4. El exceso de TG hepáticos se asocia a inflamación y muerte celular4,5. Diversos estudios han demostrado que la citoquina factor de necrosis tumoral alfa (TNF-α, por sus siglas en inglés) es clave en el desarrollo de la EGHNA6.
Las diacilglicerol aciltransferasa 1 y 2 (DGAT1/2) son enzimas hepáticas que catalizan la etapa final de la síntesis de TG7. DGAT1 juega un rol importante en la esterificación de AG exógenos, mientras que DGAT2 incorpora AG de síntesis endógena8. Entre los AG que constituyen los TG hepáticos se encuentran en forma abundante el ácido oleico (AO) y ácido palmítico (AP)9. El ingreso de AG al hepatocito se ve favorecido por la presencia de moléculas transportadoras, como la proteína ligante de ácidos grasos 4 (FABP4, por sus siglas en inglés). Interesantemente, la expresión de FABP4 se ha visto elevada en modelos de enfermedad hepática dependiente de obesidad10.
La planta Lampaya medicinalis Phil. (Verbenaceae), conocida como lampaya, crece en la puna atacameña en el nor te de Chile. En la medicina popular se emplean sus hojas para preparar infusiones y tratar enfermedades inflamatorias11,12,13. Esta planta posee una gran actividad antioxidante y antiinflamatoria, atribuida principalmente a sus componentes fenólicos y flavonoides14,15. Interesantemente, la exposición al extracto hidroalcóholico de lampaya (EHL) mejora la respuesta inflamatoria inducida por AP en macrófagos15, sin embargo, se desconoce si es capaz de contrarrestar las alteraciones inducidas por AG a nivel hepático. Por lo tanto, el objetivo de esta investigación fue evaluar el efecto del EHL sobre la acumulación de TG y la expresión de marcadores lipogénicos y proinflamatorios en hepatocitos HepG2 tratados con AO/AP por 24 horas.
Material y Método
Material vegetal
Las hojas y partes aéreas de Lampaya medicinalis Phil. fueron recolectadas cerca de Socaire, en el norte de Chile. El material botánico fue identificado por el profesor Roberto Rodríguez, Facultad de Ciencias Biológicas y Recursos Naturales de la Universidad de Concepción.
Preparación del extracto hidroalcohólico de lampaya (EHL)
Las hojas de Lampaya (1,2 kg) se secaron al aire y se molieron mecánicamente para obtener un polvo fino que se depositó en una bolsa de algodón para luego realizar una extracción exhaustiva con una mezcla de EtOH:H2O (1:1, 10L) durante una semana a temperatura ambiente. El extracto de EtOH:H2O se filtró y evaporó a presión reducida. El extracto acuoso remanente se liofilizó obteniéndose una masa verde oscura viscosa (EHL). El rendimiento de la solución liofilizada fue del 12,5% (p/p). El extracto se almacenó a 4° C y antes de su uso se disolvió en dimetilsulfóxido (DMSO, Sigma- Aldrich, EE.UU.) y se preparó un stock de 10 mg/mL. Se prepararon diluciones adicionales en medio de cultivo a partir de la solución stock.
Cultivo de la línea celular HepG2
Se utilizó la línea celular HepG2 (ATCC® HB- 8065™), derivada de un carcinoma hepatocelular humano y validado para el estudio de la fisiopatología de hepatocitos humanos16. Las células se mantuvieron en un medio mínimo esencial (MEM), con 10% de suero fetal bovino (SFB) suplementado con antibióticos (1% penicilina/estreptomicina), en una atmósfera controlada (37 °C; 5% CO2).
Viabilidad celular y tratamientos
Se evaluó la viabilidad celular en presencia de 0,01 μg/mL y 10 μg/mL de EHL, respecto al grupo control. Las células HepG2 se trataron con 0,01 y 10 μg/mL de EHL durante 24 h. Posteriormente se agregaron 20 μl de solución del compuesto 3-(4,5-dimetiltiazol-2-il)- 5-(3-carboximetoxifenil)-2-(4-sulfofenil)-2H-tetrazolio (MTS) por pocillo (100 μl), y se registró la absorbancia después de 3 h a 490 nm (y a 630 nm para restar la absorbancia de base).
El AO y el AP son ampliamente utilizados en modelos de esteatosis in vitro17,18,19. En cultivos de hepatocitos, el AP se usa para inducir inflamación, mientras que el AO se utiliza para inducir la acumulación intracelular de TG20. Por lo tanto, se preparó una mezcla de AO/AP (1 mM, 2:1) (Sigma-Aldrich, EE.UU.) utilizando albúmina de suero bovino libre de ácidos grasos al 10% (FFABSA, Sigma-Aldrich, EE.UU.). Los hepatocitos HepG2 se incubaron o no con AO/AP durante 24 h en presencia o no de EHL. Las condiciones experimentales fueron: control (vehículo), 1 mM AO/AP (2:1), 0,01 μg/mL de EHL, 10 μg/mL de EHL, 0,01 μg/mL de EHL+1 mM AO/ AP y 10 μg/ml de E HL+1 mM AO/AP.
Tinción Oil Red O
Después de los tratamientos, las células HepG2 se fijaron con formaldehído al 10% durante 20 minutos y se tiñeron con solución de Oil Red O (Sigma-Aldrich, EE.UU.) al 60% durante 50 minutos a temperatura ambiente, seguido de una contra tinción con hematoxilina antes de la observación al microscopio invertido (Motic AE2000) conectado a u na cámara digital (Moticam 2000).
Determinación fluorimétrica del contenido de triglicéridos por Nile Red
Para evaluar el contenido de TG, las células se tripsinizaron a 37 °C durante 3-5 min, inactivando la enzima por adición de medio de cultivo suplementado con SFB. Las células se centrifugaron a 800 g durante 20 min y luego se incubaron durante 5 a 7 minutos a temperatura ambiente con solución de 1 mg/ml de Nile Red (Sigma- Aldrich) en PBS. La fluorescencia se evaluó utilizando filtros de excitación (485 nm) y de emisión (572 nm). Los resultados se normalizaron por el contenido de proteína, el que a su vez se determinó por un método basado en ácido bicinconínico (Pierce, EE.UU.).
Extracción de ARN total, transcripción reversa y análisis de qPCR
Se obtuvo el ARN total luego de lisar las células utilizando Trizol® (Invitrogen, EE.UU.). El ARN se extrajo utilizando el Mini Kit PureLinkTM RNA (Invitrogen, EE.UU.), según las instrucciones del fabricante. La transcripción reversa se realizó utilizando el kit High Capacity cDNA Reverse Transcription (Applied Biosystems, EE.UU.). La expresión de ARNm se evaluó en Step One Real-time PCR System (Applied Biosystems, EE.UU.), empleando el kit para qPCR SYBR® FAST (Applied Biosystems, EE.UU.). Se utilizaron partidores validados en nuestro laboratorio (Tabla 1). Los resultados se normalizaron de acuerdo a la expresión del gen de referencia GAPDH y la expresión se calculó usando el modelo Pfaffl21. Los ensayos se realizaron en duplicado.
Análisis estadístico
Se utilizó la estadística no paramétrica que no tiene ningún supuesto de distribución, dada la baja confiabilidad de las pruebas de normalidad para los pequeños tamaños de muestra utilizados en este trabajo. Se utilizó la prueba de Wilcoxon y la prueba de Friedman con las comparaciones múltiples de Dunn, cuando fue apropiado, para la comparación de parámetros entre los controles y las células tratadas. Se utilizó el software GraphPad Prism 6. Los datos se muestran como medias ± error estándar de la media (EEM), y un valor de p <0,05 se consideró significativo.
Tabla 1. Secuencia de partidores para qPCR.

EHL no afecta la viabilidad celular en hepatocitos HepG2
Se evaluó la viabilidad celular en hepatocitos incubados con 0,01 y 10 μg/mL de EHL por 24 horas. Como se aprecia en la figura 1, las concentraciones de EHL no afectaron la viabilidad celular de HepG2 en relación al control. Por tanto, se emplearon ambas concentraciones del EHL para evaluar su efecto hepatoprotector.
El EHL contrarresta el incremento en el contenido de triglicéridos inducido por AO/AP en hepatocitos HepG2
Las células HepG2 se incubaron por 24 horas bajo las condiciones previamente descritas. Como se observa en la figura 2A, existe un aumento de GL (tinción roja) en las células expuestas a AO/AP, respecto a las células controles, confirmando la efectividad del modelo utilizado. La coincubación con EHL se traduce en una menor tinción de GL respecto a los hepatocitos tratados solo con los AG. El extracto por sí solo no induce la acumulación de GL en células HepG2. Posteriormente, se evaluó el contenido de TG utilizando el reactivo fluorescente Nile Red en HepG2 expuestas o no a AO/AP, con o sin EHL. Consistente con lo observado al microscopio, la figura 2B muestra un incremento en el contenido de TG por efecto de AO/AP en HepG2 (p<0,05), mientras que la coincubación con EHL previno los efectos de los AG. No hubo diferencias en el contenido de TG entre las células incubadas con el extracto y el vehículo.
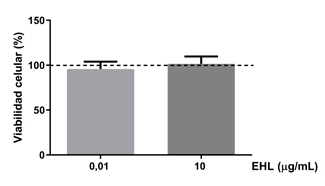
Figura 1: Efecto de 0,01 y 10 μg/mL de EHL sobre la viabilidad de células HepG2. La viabilidad celular se evaluó usando el reactivo MTS según se indica en Materiales y Métodos. La línea punteada representa el valor de 100% (células tratadas con vehículo). Las barras representan la media ± EEM (n=11). *p<0,05 versus Control (vehículo). Test pareado de rangos con signo de Wilcoxon.
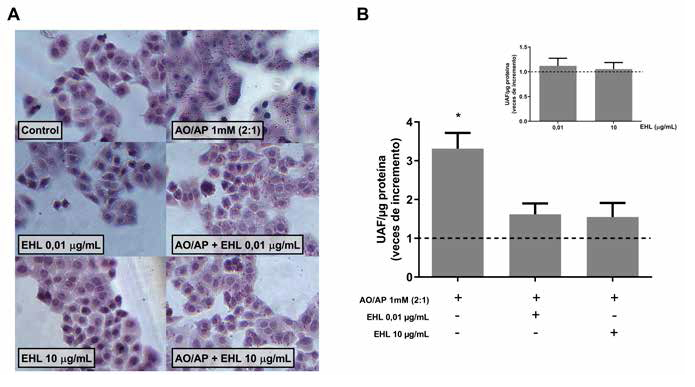
Figura 2: Efecto del tratamiento con AO/AP, EHL y AO/AP +EHL sobre la acumulación de gotas lipídicas y triglicéridos en células HepG2. (A) La acumulación de GL se mediante tinción con Oil Red O. Microfotografías ópticas a un aumento de 40x. (B) El contenido de TG se evaluó por fluorimetría utilizando el reactivo Nile Red. La línea punteada representa el control normalizado a 1. UAF= Unidades Arbitrarias Fluorimétricas. Las barras representan la media ± EEM (n=7); *p<0.05 versus condición control. Test de Friedman con comparaciones múltiples de Dunn.
El EHL previene la inducción en la expresión de mRNA de DGAT2 mediada por AO/AP en hepatocitos HepG2
El tratamiento con AO/AP mostró una fuerte tendencia a aumentar la expresión de DGAT2 en relación a células controles (p=0,055), mientras que el cotratamiento con EHL restauró su expresión a niveles comparables al control (Figura 3). No hubo cambios en la expresión de DGAT1 entre la condición control (valor 1), 1 mM AO/AP (1,14 ± 0,08), 0,01 μg/mL de EHL (0,88 ± 0,05) y 10 μg/mL de EHL (1,08 ± 0,04). Por su parte, EHL no induce cambios en la expresión de DGAT1 o 2 respecto al grupo control.
Efecto de los ácidos grasos AO/AP sobre la expresión de TNF-α Y FABP4
Como se aprecia en la figura 4A-B, la mezcla AO/AP no tuvo efecto sobre la expresión de FABP4 y TNF-α en relación al control. Asimismo, EHL no induce cambios en la expresión de estos genes respecto al grupo control.
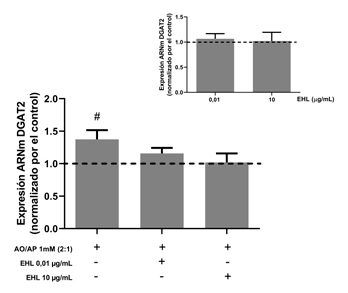 Figura 3: Efecto del tratamiento con AO/AP, EHL y AO/AP + EHL sobre la expresión
del ARNm de DGAT2 en hepatocitos HepG2. Las células se expusieron por 24 h
a 1 mM AO/AP (2:1) en presencia o no de 0,01 o 10 μg/mL de EHL. Se utilizó la
expresión de GAPDH como control interno. La línea punteada representa el control
normalizado a 1. Las barras representan la media ± EEM (n=7). Test de Friedman
con comparaciones múltiples de Dunn (# p=0,055).
Figura 3: Efecto del tratamiento con AO/AP, EHL y AO/AP + EHL sobre la expresión
del ARNm de DGAT2 en hepatocitos HepG2. Las células se expusieron por 24 h
a 1 mM AO/AP (2:1) en presencia o no de 0,01 o 10 μg/mL de EHL. Se utilizó la
expresión de GAPDH como control interno. La línea punteada representa el control
normalizado a 1. Las barras representan la media ± EEM (n=7). Test de Friedman
con comparaciones múltiples de Dunn (# p=0,055).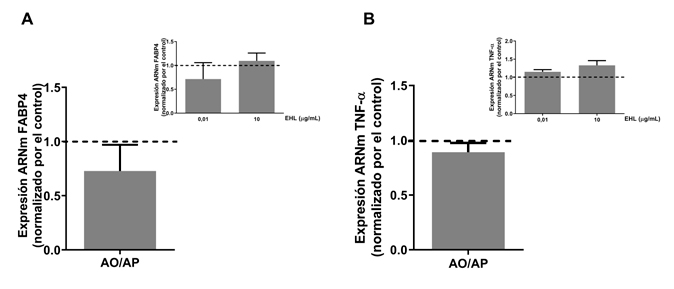 Figura 4: Efecto del tratamiento con AO/AP, EHL y AO/AP + EHL sobre la expresión del ARNm de (A) FABP4 y (B) TNF-α en hepatocitos HepG2. Las células se
expusieron por 24 h a 1 mM AO/AP (2:1) en presencia o no de 0,01 o 10 μg/mL de EHL. Se utilizó la expresión de GAPDH como control interno. La línea punteada
representa el control normalizado a 1. Las barras representan la media ± EEM (n=4). Test pareado de rangos con signo de Wilcoxon y test de Friedman con
comparaciones múltiples de Dunn.
Figura 4: Efecto del tratamiento con AO/AP, EHL y AO/AP + EHL sobre la expresión del ARNm de (A) FABP4 y (B) TNF-α en hepatocitos HepG2. Las células se
expusieron por 24 h a 1 mM AO/AP (2:1) en presencia o no de 0,01 o 10 μg/mL de EHL. Se utilizó la expresión de GAPDH como control interno. La línea punteada
representa el control normalizado a 1. Las barras representan la media ± EEM (n=4). Test pareado de rangos con signo de Wilcoxon y test de Friedman con
comparaciones múltiples de Dunn.Discusión
Debido al aumento en la prevalencia de la obesidad y sus comorbilidades, se han buscado terapias alternativas para el tratamiento o prevención de estas patologías. Ancestralmente, la población ha utilizado plantas medicinales para tratar o curar enfermedades. Localmente, reportes orales indican que la infusión de lampaya es usada para el tratamiento de algunas enfermedades inflamatorias11,12,13. La EHGNA se caracteriza por la acumulación de lípidos intracelulares y el desarrollo de una respuesta inflamatoria6. En este estudio se reporta por primera vez el efecto protector in vitro del EHL contra la acumulación de TG hepáticos en un modelo de esteatosis inducida por AO/ AP en células HepG2.
Los AG provenientes de la dieta son fundamentales en la acumulación de TG hepáticos presente en la EHGNA, e interesantemente AO y AP corresponden a algunos de los AG más abundantes en dichos TG9. La evidencia indica que el uso de plantas medicinales ricas en polifenoles, como resveratrol y quercetina, disminuyen la acumulación de lípidos en hepatocitos HepG222,23, consistente con ello, el EHL previene la acumulación de TG intracelulares inducidos por AG, lo que podría relacionarse con el alto contenido de flavonoides y polifenoles presente en el EHL14,15.
El desarrollo de esteatosis hepática está regulado, en parte, por una activación de la maquinaria de síntesis de TG hepáticos que utiliza como sustrato AG provenientes de la lipogénesis hepática de novo y de la lipólisis del tejido adiposo24. Para este último caso, las proteínas transportadoras de lípidos, como FABP4, son claves para el ingreso de AG extrahepáticos al interior del hepatocito10,25. Por lo tanto, en este estudio evaluamos FABP4 considerando que es una proteína que se expresa también en modelos de enfermedad hepática dependiente de obesidad10, sin encontrar cambios en la expresión de esta proteína al exponer los hepatocitos a AG. La evidencia ha reportado un incremento en la secreción de FABP4 en medios de cultivo de células HepG2 tratadas con 200 μM AO o AP por 72 h10, sin embargo, en nuestro trabajo se evaluó la expresión de ARNm de FABP4 en hepatocitos tratados con AO/AP por 24 h, sugiriéndose que el uso de otros tiempos y concentraciones de tratamiento con AG, así como el uso individual de ellos, podría inducir la expresión/secreción de FABP4 en células HepG2. Interesantemente, el incremento en la expresión de la enzima lipogénica DGAT2 inducido por AO/AP se revirtió al incubar las células HepG2 con el EHL, sin observar cambios en la expresión de la enzima DGAT1. Concordante con estos antecedentes, estudios en animales y en células HepG2, han reportado un aumento en la expresión de DGAT2 en modelos de esteatosis, sin incremento en la expresión de DGAT126,27, sugiriendo que DGAT2 es la enzima dominante en la homeostasis de TG en los hepatocitos28. De forma similar a lo encontrado en nuestro estudio, el uso de capsulas de Jiangzhi, compuestas por hierbas ricas en flavonoides de la medicina tradicional China, revierte el aumento de la expresión de DGAT2 en modelos animales de esteatosis hepática26, sugiriendo un efecto hepatoprotector29,30,31.
La inflamación es uno de los principales signos presentes en la EHGNA. Esta respuesta inflamatoria está caracterizada por un aumento en la producción de citoquinas proinflamatorias, como TNF-α6. En nuestro modelo, la inducción de esteatosis no se acompañó de un aumento en la expresión de TNF-α. Evidencia indica que la utilización de 300 μM de AO y 200 μM de AP por 72 horas en hepatocitos HepG2 incrementa significativamente la expresión de esta citoquina32, lo que podría explicar esta diferencia en nuestro estudio. Respecto a la actividad antinflamatoria de polifenoles y flavonoides33,34,35, el EHL reduce in vitro la expresión de marcadores inflamatorios inducidos por AP en macrófagos humanos15. Adicionalmente, se ha reportado que la veletuina, un flavonoide presente en la Lampaya, inhibe la expresión de TNF-α14,36. La evidencia indica también que el tratamiento con algunos compuestos activos como resveratrol, barberina, quercetina, catequina y silimarina reducen el incremento de TNF-α inducido por AG en células HepG237,38. Sin embargo, dicha habilidad no pudo ser confirmada para el EHL en hepatocitos HepG2 con esteatosis por la carencia de la inducción de una respuesta inflamatoria. Es posible que no hayamos observado un incremento en TNF-α debido a la necesidad de un mayor tiempo de incubación con AG para inducir su expresión, no obstante el aumento temprano en los TG intracelulares reportado en estas condiciones39. Por lo tanto, futuros estudios donde se induzca una respuesta inflamatoria en células HepG2 serán de utilidad para revelar el efecto del EHL sobre dicho fenómeno.
En resumen, este estudio evalúa por primera vez el efecto hepatoprotector del EHL en la acumulación de lípidos y reducción de un marcador lipogénico (DGAT2) en un modelo de esteatosis hepática in vitro en células HepG2. Se sugiere que estos efectos son resultado de la presencia de flavonoides y polifenoles en el EHL, sin embargo, los mecanismos exactos por los cuales el extracto disminuye la acumulación de TG, deben ser estudiados con mayor profundidad. Bajo las condiciones experimentales evaluadas no se generó un aumento en la expresión del transportador FABP4 ni de marcadores proinflamatorios como la citoquina TNF-α, lo cual invita a continuar investigando nuevos tiempos de incubación y/o dosis de AG para inducir otros marcadores de eventos claves en la fisiopatología de la EHGNA. Finalmente, se requieren estudios adicionales que incluyan modelos in vivo para determinar la efectividad biológica del EHL como hepatoprotector frente a la esteatosis en individuos con EHGNA.
Declaración de intereses: Los autores no declaran conflicto de interés alguno.
Referencias
- Maruyama H, Kiyono S, Kondo T, Sekimoto T, Yokosuka O. Palmitateinduced regulation of PPARγ via PGC1α: A mechanism for lipid accumulation in the liver in nonalcoholic fatty liver disease. Int J Med Sci. 2016; 13(3): 169-178.
- Zhao NQ, Li XY, Wang L, Feng ZL, Li XF, Wen YF, et al. Palmitate induces fat accumulation by activating C/EBPβ-mediated G0S2 expression in HepG2 cells. World J Gastroenterol. 2017; 23(43): 7705-7715.
- Ullah R, Rauf N, Nabi G, Ullah H, Shen Y, Zhou YD, et al. Role of nutrition in the pathogenesis and prevention of non-alcoholic fatty liver disease: Recent updates. Int J Biol Sci. 2019; 15: 265-276.
- Friedman SL, Neuschwander-Tetri BA, Rinella M, Sanyal AJ. Mechanisms of NAFLD development and therapeutic strategies. Nat Med. 2018; 24: 908-922.
- Hetherington AM, Sawyez CG, Zilberman E, Stoianov AM, Robson DL, Borradaile NM. Differential Lipotoxic Effects of Palmitate and Oleate in Activated Human Hepatic Stellate Cells and Epithelial Hepatoma Cells. Cell Physiol Biochem. 2016; 39(4): 1648-1662.
- Braunersreuther V, Viviani GL, Mach F, Montecucco F. Role of cytokines and chemokines in non-alcoholic fatty liver disease. World J Gastroenterol. 2012; 18(8): 727-735.
- Liu Y, Millar JS, Cromley DA, Graham M, Crooke R, Billheimer JT, et al. Knockdown of Acyl-CoA:diacylglycerol acyltransferase 2 with antisense oligonucleotide reduces VLDL TG and ApoB secretion in mice. Biochim Biophys Acta - Mol Cell Biol Lipids. 2008; 1781(3): 97-104.
- Qi J, Lang W, Geisler JG, Wang P, Petrounia I, Mai S, et al. The use of stable isotope-labeled glycerol and oleic acid to differentiate the hepatic functions of DGAT1 and -2. J Lipid Res. 2012; 53(6): 1106-1116.
- Araya J, Rodrigo R, Videla LA, Thielemann L, Orellana M, Pettinelli P, et al. Increase in long-chain polyunsaturated fatty acid n-6/n-3 ratio in relation to hepatic steatosis in patients with non-alcoholic fatty liver disease. Clin Sci. 2004; 106(6): 635-643.
- Thompson KJ, Austin RG, Nazari SS, Gersin KS, Iannitti DA, McKillop IH. Altered fatty acid-binding protein 4 (FABP4) expression and function in human and animal models of hepatocellular carcinoma. Liver Int. 2018; 38(6): 1074-1083.
- Mellado, V.; Medina, E.; San Martin C. Herbolaria Médica de Chile. Ministerio de Salud, Gobierno de Chile. Santiago de Chile. 1977: 168-169.
- Castro V. Botánica y Pueblos Originarios. Actas 2° Congreso de Plantas Medicinales. San Bernardo, Chile. 1995; 49 .
- Monterrey M. Hierbas medicinales andinas de la 2a Región. Ministerio de Educación. Santiago de Chile. 1994; 33-35.
- Morales G, Paredes A. Antioxidant activities of Lampaya medicinalis extracts and their main chemical constituents. BMC Complement Altern Med. 2014; 14: 1-12.
- Ormazabal P, Cifuentes M, Varì R, Scazzocchio B, Masella R, Pacheco I, Vega W, Paredes A, Morales G. Hydroethanolic Extract of Lampaya Medicinalis Phil. (Verbenaceae) Decreases Proinflammatory Marker Expression in Palmitic Acid-exposed Macrophages. Endocr Metab Immune Disord Drug Targets. 2020; 20(8): 1309-1320.
- Bokhari M, Carnachan RJ, Cameron NR, Przyborski SA. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 2007; 211(4): 567-576.
- Gómez-Lechón MJ, Donato MT, Martínez-Romero A, Jiménez N, Castell JV, O’Connor JE. A human hepatocellular in vitro model to investigate steatosis. Chem Biol Interact. 2007; 165(2): 106-116.
- Lee MR, Yang HJ, Park K Il, Ma JY. Lycopus lucidus Turcz. ex Benth. Attenuates free fatty acid-induced steatosis in HepG2 cells and non-alcoholic fatty liver disease in high-fat diet-induced obese mice. Phytomedicine. 2019; 55: 14-22.
- Lee MR, Park K Il, Ma JY. Leonurus japonicus houtt attenuates nonalcoholic fatty liver disease in free fatty acid-induced HepG2 cells and mice fed a high-fat diet. Nutrients. 2018; 10(1): 20.
- Chen X, Li L, Liu X, Luo R, Liao G, Li L, et al. Oleic acid protects saturated fatty acid mediated lipotoxicity in hepatocytes and rat of non-alcoholic steatohepatitis. Life Sci. 2018; 203: 291-304.
- Pfaffl MW. A new mathematical model for relative quantification in realtime RT-PCR. Nucleic Acids Res. 2001; 29(9): e45.
- zdebska M, Piątkowska-Chmiel I, Korolczuk A, Herbet M, Gawrońska- Grzywacz M, Gieroba R, et al. The beneficial effects of resveratrol on steatosis and mitochondrial oxidative stress in HepG2 cells. Can J Physiol Pharmacol. 2017; 95(12): 1442-1453.
- Rafiei H, Omidian K, Bandy B. Dietary polyphenols protect against oleic acid-induced steatosis in an in vitro model of NAFLD by modulating lipid metabolism and improving mitochondrial function. Nutrients. 2019; 11(3): 541.
- Ipsen DH, Lykkesfeldt J, Tveden-Nyborg P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease. Cell Mol Life Sci. 2018; 75(18): 3313-3327.
- Coe NR, Bernlohr DA. Physiological properties and functions of intracellular fatty acid-binding proteins. Biochim Biophys Acta. 1998; 1391(3): 287-306.
- Zhao Y, Pan Y, Yang Y, Batey R, Wang J, Li Y. Treatment of rats with Jiangzhi Capsule improves liquid fructose-induced fatty liver: Modulation of hepatic expression of SREBP-1c and DGAT-2. J Transl Med. 2015; 13(1): 174.
- Choi YJ, Lee CH, Lee KY, Jung SH, Lee BH. Increased hepatic fatty acid uptake and esterification contribute to tetracycline-induced steatosis in mice. Toxicol Sci. 2015; 145(2): 273-282.
- Stone SJ, Myers HM, Watkins SM, Brown BE, Feingold KR, Elias PM, et al. Lipopenia and Skin Barrier Abnormalities in DGAT2-deficient Mice. J Biol Chem. 2004; 279(12): 11767-1176.
- Chen P, Cao Y, Bao B, Zhang L, Ding A. Antioxidant capacity of Typha angustifolia extracts and two active flavonoids. Pharm Biol. 2017; 55(1): 1283-1288.
- Lin L, Ni B, Lin H, Zhang M, Li X, Yin X, Qu C, Ni J. Traditional usages, botany, phytochemistry, pharmacology and toxicology of Polygonum multiflorum Thunb.: a review. J Ethnopharmacol. 2015 Jan 15; 159:1 58- 183.
- Shahzad M, Shabbir A, Wojcikowski K, Wohlmuth H, C. Gobe G. The Antioxidant Effects of Radix Astragali (Astragalus membranaceus and Related Species) in Protecting Tissues from Injury and Disease. Curr Drug Targets. 2016; 17(12): 1331-1340.
- Latorre J, Moreno-Navarrete JM, Mercader JM, Sabater M, Rovira, Gironès J, et al. Decreased lipid metabolism but increased FA biosynthesis are coupled with changes in liver microRNAs in obese subjects with NAFLD. Int J Obes. 2017; 41(4) 620-630.
- Morales G, Paredes A, Olivares A, Bravo J. Acute oral toxicity and antiinflammatory activity of hydroalcoholic extract from Lampaya medicinalis phil in rats. Biol Res. 2014; 47(1): 6.
- Van De Wier B, Koek GH, Bast A, Haenen GRMM. The potential of flavonoids in the treatment of non-alcoholic fatty liver disease. Crit Rev Food Sci Nutr. 2017; 57(4): 834-855.
- Akhlaghi M. Non-alcoholic Fatty Liver Disease: Beneficial Effects of Flavonoids. Phytother Res. 2016; 30(10): 1559-1571.
- Xie C, Kang J, Li Z, Schauss AG, Badger TM, Nagarajan S, et al. The açaí flavonoid velutin is a potent anti-inflammatory agent: Blockade of LPSmediated TNF-α and IL-6 production through inhibiting NF-κB activation and MAPK pathway. J Nutr Biochem. 2012; 23(9): 1184-1191.
- Rafiei H, Omidian K, Bandy B. Comparison of dietary polyphenols for protection against molecular mechanisms underlying nonalcoholic fatty liver disease in a cell model of steatosis. Mol Nutr Food Res. 2017; 61(9): 1-29.
- Vidyashankar S, Sandeep Varma R, Patki PS. Quercetin ameliorate insulin resistance and up-regulates cellular antioxidants during oleic acid induced hepatic steatosis in HepG2 cells. Toxicol Vitr. 2013; 27(2): 945-953.
- Feldstein AE, Werneburg NW, Canbay A, Guicciardi ME, Bronk SF, Rydzewski R, et al. Free fatty acids promote hepatic lipotoxicity by stimulating TNF-α expression via a lysosomal pathway. Hepatology. 2004; 40(1): 185-194.