Tres versiones del “Ogtt Squeezer”, un programa para evaluar de un vistazo la información metabólica de la curva de tolerancia a la glucosa
Patricio Contreras C.1,2,*, Yanara Bernal G.2, Pilar Vigil P.1,2,3
Three versions of the “Ogtt Squeezer”, a program to evaluate at-aglance the metabolic information of the oral glucose tolerance test
1. Endocrinólogo. Fundación Médica San Cristóbal. Reproductive Health Research Institute (RHRI), Santiago, Chile.
2. Enfermera. Reproductive Health Research Institute (RHRI), Santiago, Chile
3. Ginecóloga. Vicerrectoría Comunicaciones, Universidad Católica de Chile, Fundación Médica San Cristóbal. Reproductive Health Research Institute (RHRI) Santiago, Chile.
*Correspondencia: Patricio H. Contreras / pathomero@gmail.com
Reproductive Health Research Institute (RHRI).
Lira 140 oficina 201, 8330078, Santiago, Chile.
Financiamiento: Grant interno del RHRI
Recibido: 07-08-2020
Aceptado: 08-10-2020
Resumen: El diagnóstico clínico de resistencia insulínica (RI) es difícil, ya que el Clamp no es aplicable a la clínica. El así llamado “síndrome metabólico”, un predictor clínico de la RI, no identifica alrededor de la mitad de los sujetos afectados. Previamente, definimos adecuadamente (Análisis ROC) los niveles de corte diagnóstico de los siguientes predictores bioquímicos: HOMA1, HOMA2, QUICKI e ISI-Composite, a través de analizar datos de 90 sujetos (53 no resistentes y 37 resistentes) que tenían una medición directa de su resistencia insulínica (Test de supresión pancreática, TSP, Test de Reaven) y también, una curva de tolerancia a la glucosa oral (CTG). Los puntos de corte obtenidos exhibieron un mucho mejor desempeño diagnóstico comparados con los puntos de corte convencionales. También encontramos un predictor nuevo, simple, económico y eficiente, el I0*G60. Definimos la “normalidad metabólica” de la CTG usando las medianas de los valores de varios parámetros en 312 sujetos con un G120 dentro de los 2 primeros terciles del grupo de normo-tolerantes a la glucosa (NGT, n=468; G120: 51-110 mg/dL, los con mejor función beta insular). A las medianas de la función beta insular y de la sensibilidad insulínica se les asignó un valor de un 100%. Se calculó el % relativo de función beta insular (%RFBI) y el % relativo de sensibilidad insulínica (%RSI) del resto de la cohorte (n=573) contra estos valores de referencia. El “OGTT Squeezer” se escribió en Excel. Las glicemias y las insulinemias de la CTG fueron las entradas del programa. Las salidas fueron: I0*G60, ISI-OL, QUICKI, and HOMA1 (predictores) y el índice insulinogénico, el índice de disposición, %RFBI y %RSI (parámetros). El programa también caracterizó la tolerancia glucídica de acuerdo a los criterios de la ADA 2003. El formato final del programa, HTML 5, facilita su uso. Desarrollamos tres versiones del programa: completa, abreviada y mínima.
Palabras clave: CTG; Categorización Metabólica de la CTG; HOMA1; I0*G60, ISI Composite; Índice de Disposición Oral; Índice Insulinogénico; Predictores Bioquímicos de resistencia insulínica; QUICKI; % Relativo Función Beta-Insular; % Relativo de Sensibilidad Insulínica.
Abstract: Clinically, diagnosing insulin resistance (IR) is difficult since the Clamp is not applicable to clinical work. The so-called “Metabolic Syndrome”, a clinical surrogate of IR, fails to identify around 50% of affected subjects. Previously, we properly defined (ROC Analysis) the diagnostic cut-offs of the following biochemical predictors: HOMA1, HOMA2, QUICKI, and ISI-Composite by analyzing data from 90 subjects (53 non-insulin-resistant and 37 insulin-resistant subjects) who had a direct measurement of insulin resistance (Pancreatic Suppression Test, PST, Reaven’s Test), and also, an Oral Glucose Tolerance Test (OGTT). The resulting cut-offs exhibited much better performances compared with the conventional cut-offs. We also found a new, simple, inexpensive and efficient predictor, the I0*G60. We chose to define the “metabolic normalcy” of the OGTT by using the median values of several parameters in 312 NGT subjects with a G120 in the first 2 tertiles of the NGT group (n=468; G120: 51-110 mg/dL, those with the best beta-cell function). The median values of both Beta-Cell Function and Insulin Sensitivity of these subjects were assigned a 100% value. Both % Relative Beta-Cell Function (%RBCF) and % Relative Insulin Sensitivity (%RIS) of everyone else in the cohort (n=573) was calculated against these reference values. The “OGTT Squeezer” was written in Excel. The OGTT’s glucose and insulin values served as the inputs of the program. The outputs were: I0*G60, ISI-OL, QUICKI, and HOMA1 (predictors), and Insulinogenic Index, Disposition Index, %RBCF, and %RIS (parameters). Moreover, the program characterized the OGTT according to the ADA 2003 criteria. The HTML 5 format of the program facilitates its use. We developed 3 versions of the program: complete, abbreviated, and minimal versions.
Keywords: Biochemical predictors of insulin resistance; HOMA1; Insulinogenic Index; ISI Composite; I0*G60; OGTT; Oral disposition Index; OGTT metabolic categorization QUICKI; % Relative Beta-Cell Function; % Relative Insulin Sensitivity.
Hay una tendencia mundial a descartar la Curva de Tolerancia a la Glucosa (GTG) como prueba diagnóstica de prediabetes y de diabetes. La CTG ha sido criticada y se la ha tildado como una prueba diagnóstica poco reproducible, incómoda y cara, especialmente si se miden insulinemias, además de las glicemias. En su reemplazo, la HbA1c ha sido propuesta como prueba diagnóstica de diabetes mellitus (dos valores mayores de 6,5%), junto con los niveles de glicemia de ayunas mayores de 126 mg/dL en ayunas. El diagnóstico de prediabetes se haría con valores de glicemias de ayuno entre 100 y 125 mg/dL.
Similarmente, se nos propone reemplazar el diagnóstico de resistencia insulínica por el de síndrome metabólico, el que requiere solamente de una evaluación clínica somera: perímetro de cintura, niveles de triglicéridos, de colesterol HDL y de glicemia en ayunas, junto con medición de la presión arterial.
La simplificación de los diagnósticos de resistencia insulínica, prediabetes y diabetes (condiciones clínicamente bastante silenciosas) parece ventajosa a primera vista. Sin embargo, a nuestro juicio, parece haber más riesgos que beneficios con este enfoque: enfermos no diagnosticados (falsos negativos), diagnósticos tardíos y pérdida de oportunidades de detener el avance a la diabetes con medidas simples.
La resistencia a la insulina es altamente prevalente1 y estaría presente en al menos un 25% de la población adulta. Los porcentajes de prevalencia son mínimos en adultos jóvenes, delgados y físicamente activos y crecen a medida que la población envejece, sube de peso y se torna sedentaria.
Medición directa de la sensibilidad / resistencia a la insulina
El diagnóstico y la cuantificación del fenómeno en clínica es difícil, dado que el clamp euglicémico hiperinsulinémico (CEH), el estándar de oro en la medición de la sensibilidad insulínica muscular es complejo de realizar y de alto costo. Nuestra corta experiencia con el CEH2 nos hizo descartarlo como alternativa factible para nuestro país. Hace más de 20 años atrás trajimos al país el modelo mínimo de Bergman (medición indirecta de la resistencia insulínica). Concluimos que esta metódica requiere de un procedimiento algo complejo y de la medición de un alto número de insulinemias, con un ensayo de primer nivel, lo que lo hace impráctico. Desde 2003 hemos usado con gran éxito el test de supresión pancreática (TSP) con Octreótida3,4, habiendo practicado más de 800 mediciones directas de resistencia insulínica5. El TSP es una medición directa de la resistencia a la insulina, al igual que el CEH. Su uso, por cuestiones de tiempo y costo relativo es restringido, a pesar de ser muy fácil de implementar. Es importante recordar que el TSP en su forma original, fue publicado por el grupo de Gerald Reaven en 19703, 9 años antes que se publicara la versión definitiva del CEH6.
El escaso conocimiento del TSP entre los diabetólogos se debe a que Gerald Reaven no tuvo interés en que otros grupos de investigadores usaran su método de medición directa de la resistencia insulínica. La gigantesca contribución del grupo de Reaven en el campo de la resistencia insulínica fue hecha con el TSP, no con el CEH. El TSP tiene una pléyade de virtudes: es simple y económico, sólo requiere medir 9 glicemias, es altamente reproducible y tiene una correlación de 0,93 con los resultados del CEH7. Durante las tres horas del TSP se infunden en forma continua tres elementos: insulina cristalina (32 mU/m2/ min, para provocar una hiperinsulinemia de alrededor de 50 mU/mL, lo que suprime la producción hepática de glucosa y estimula su captación muscular), glucosa al 10% (267 mg/m2/ min) y octreótida (0,27 mg/m2/min, para suprimir la producción pancreática de insulina y glucagon). Las 4 glicemias de los últimos 30 minutos del TSP (150-160-170 y 180 minutos) se promedian para obtener la Glicemia de Equilibrio (GE), la que oscilará entre 50 y 400 mg/dL (8 veces de diferencia entre la mínima y la máxima). En estas condiciones, la GE del TSP es directamente proporcional a la resistencia insulínica muscular. Una GE ≥150 mg/dL es diagnóstica de resistencia a la insulina8,9.
Knowles et al.10 hizo una comparación directa entre los resultados del CEH y los resultados del TSP en 15 sujetos no diabéticos. Los resultados fueron altamente concordantes y más aún, fue capaz de obtener ecuaciones precisas de transformación entre los valores del CEH y los del TSP. Finalmente, Ferrannini et al.11 en una excelente revisión sobre los métodos de medición de la resistencia insulínica afirmó: “en nuestra opinión el TSP es el mejor test, después del CEH, para cuantificar la resistencia insulínica; es fácil y seguro y puede hacerse al lado de la cama del enfermo con un entrenamiento mínimo”.
Estimación de la resistencia a la insulina
los “predictores de resistencia insulínica”. Hay predictores clínicos y predictores bioquímicos. En un intento por acercarse al diagnóstico de resistencia insulínica, existe el predictor clínico del fenómeno, el llamado síndrome metabólico. Este es una entelequia clínica asociada a un aumento de riesgo de enfermedades cardiovasculares y de diabetes. Es un “cuadro de consenso” y como los consensos alcanzados varían, tiene variadas definiciones, de modo que alguien puede ser portador del síndrome a juzgar por un criterio y no serlo de acuerdo a otro criterio. Su principal debilidad es que tiene una muy baja de sensibilidad (alrededor de un 50%) para pesquisar sujetos con resistencia insulínica12. El criterio con mejor agudeza clínica es a nuestro juicio el del ATP III13. El criterio de la IDF14, que pretende ser universal, tiene el serio problema de exigir la presencia de obesidad abdominal, en circunstancias que hay muchos resistentes a la insulina que no la presentan. En 2009 la IDF derogó la exigencia de obesidad abdominal y trató de consensuar con otras organizaciones –como el National Heart, Lung, and Blood Institute y la American Heart Association–, un criterio diagnóstico, pero persisten las diferencias en los perímetros de cintura exigidos15. DeFronzo y Reaven son conocidos detractores del concepto de síndrome metabólico.
Por lo tanto, nosotros –también disidentes del concepto de síndrome metabólico16,17–, usamos los predictores bioquímicos de resistencia/sensibilidad a la insulina para diagnosticar el fenómeno. La gran abundancia de estos predictores nos indica desde ya sus dificultades. En efecto, su mayor problema es una baja sensibilidad (tasa de verdaderos positivos), asociado a una alta especificidad (tasa de verdaderos negativos). Esto implica un alto porcentaje de enfermos no detectados por estos predictores (falsos negativos) y un bajo porcentaje de falsos positivos (sujetos sanos que dan un predictor positivo). Los predictores bioquímicos más conocidos son el HOMA18, el QUICKI19 y el ISI Composite de Matsuda-DeFronzo20.
El uso práctico de estos predictores ha sido cuasi caótico, ya que los puntos de corte para diagnosticar resistencia a la insulina no se han obtenido en una forma científicamente correcta. La única forma correcta de hacerlo es tener sujetos resistentes y no resistentes a la insulina, inobjetablemente clasificados por una medición directa de la resistencia o de la sensibilidad a la insulina (sea por TSP o por CEH), en los cuales se calculan los predictores bioquímicos a través de medir glicemias e insulinemias en ayunas (HOMA y QUICKI) o durante la CTG (ISI Composite, I0*G60). Con estos datos se construye una Curva ROC (“Receiver Operating Characteristics”) y se obtiene fácilmente el punto de corte del predictor (aquel donde la sumatoria de sensibilidad y especificidad sea máxima).
En Chile, Acosta et al.21 estudiaron una población de 120 sujetos de peso normal (IMC 21,7 ± 1,6 [DE]) de 19 a 40 años de edad, en los cuales se asumió una sensibilidad normal a la insulina. Sus glicemias de ayunas fueron 81,6 ± 9,4 mg/ dL, sus insulinemias de ayunas fueron 9,7 ± 2,4 mU/mLy sus índice HOMA eran 1,96 ± 0,57. Definieron el punto de corte de este predictor como su promedio más una desviación estándar (2,53). En contraste, en 53 sujetos nuestros, con un TSP normal (o sea, probadamente sensibles a la insulina), los valores encontrados fueron: glicemias, 89,1 ± 8,5 mg/ dL, insulinemias, 6,3 ± 3,4 mU/mL y HOMA, 1,39 ± 0,7622. La gran diferencia entre estas dos poblaciones es que las insulinemias de ayunas de Acosta et al. fueron 54% mayores que las nuestras, lo que indica que su población estaba, muy probablemente, contaminada con sujetos resistentes a la insulina. Si hubiésemos aplicado el criterio usado por Acosta et al. (promedio del HOMA más una desviación estándar) habríamos obtenido una cifra de 2,15 como punto de corte. La diferencia entre 2,15 y 2,53 no es menor, ya que la segunda cifra se asociará con una mucho menor sensibilidad del predictor. En nuestro trabajo con 90 sujetos altamente sospechosos de ser resistentes a la insulina22 encontramos que el punto de corte correcto del HOMA era >2,09, lo que se asocia a una sensibilidad diagnóstica de 75,7%, lo que contrasta con una sensibilidad de solo 56,8% cuando se usa el punto de corte popular en Chile, >2,6.
Garmendia et al.23 también en Chile, optaron por definir el punto de corte del HOMA diagnóstico de resistencia a la insulina, como el percentil 75 de este valor en 803 sujetos no diabéticos, mayores de 60 años, de peso normal (232 hombres y 571 mujeres). De nuevo, el peso normal y la ausencia de diabetes llevó a los investigadores a calificarlos –sin demostrarlo–, como sensibles a la insulina. La mediana del HOMA fue de 1,7 y el percentil 75 fue de 2,57. En contraste, el percentil 75 del HOMA de nuestros 53 sujetos probadamente sensibles a la insulina fue de 1,89, lo que indica que los sujetos supuestamente sensibles a la insulina de esta investigación incluían probablemente sujetos resistentes a la insulina. Complementariamente, los investigadores definieron a los resistentes a la insulina como aquellos sujetos con intolerancia a la glucosa o insulinemia a los 120 minutos de una CTG >60 μU/mL. El análisis ROC lo hicieron dividiendo a los sujetos en resistentes a la insulina (los últimos), y en sensibles a la insulina (los de peso normal). El punto de corte del HOMA para definir resistencia a la insulina fue de 2,04 a 2,33. Los autores declararon finalmente que el punto de corte para definir resistencia a la insulina en esta población era >2,6. En resumen, podemos afirmar respetuosamente que en Chile se usa un punto de corte del HOMA (>2,6) definido menos que óptimamente.
Nuestro aporte
En 2008 reportamos en esta revista24 que, usando el punto corte del HOMA recomendado en Chile (>2,6), la sensibilidad diagnóstica de este predictor (contra los resultados del TSP) era de sólo un 44%, lo que implicaba un alto porcentaje de falsos falsos negativos de un 56%. En ese momento pensamos que parte importante del problema era la falta de estandarización del ensayo de insulina. Posteriormente nos percatamos que el punto de corte del predictor en uso en Chile, al igual que en el resto del mundo, no estaba bien determinado. En efecto, nunca encontramos en la literatura un análisis ROC de los valores de los predictores contrastados contra una medición directa de la resistencia insulínica.
Para dilucidar lo que en realidad pasaba, reunimos un grupo de 90 sujetos (53 sensibles y 37 resistentes a la insulina) altamente sospechosos de ser resistentes a la insulina que tenían no solo el TSP hecho, si no, además, una curva de tolerancia a la glucosa (CTG, 75 g) con medición seriada de glucosa e insulina sérica (0-30-60-90 y 120 minutos). Esto nos permitió delinear, con un análisis ROC y un análisis Bayesiano, el desempeño diagnóstico de: HOMA1, HOMA2, QUICKI e ISI Composite. Además, nos permitió describir un nuevo y superior predictor de resistencia insulínica, el I0*G60, cuyo desempeño superó al resto de los predictores. Este trabajo se publicó en junio del 2019 en el Journal of The Endocrine Society22.
Lo más sorprendente de nuestros resultados fue el hecho que el I0*G60 superara el desempeño del ISI Composite, el robusto predictor descrito en 2001 por Matsuda y DeFronzo. Por esta razón, estudiamos la relación entre el I0*G60 y el ISI-OL (ISI-OnLine, fórmula actual de cálculo del ISI en la página web de Matsuda: http://mmatsuda.diabetes-smc.jp/ english.html). Así, logramos demostrar la existencia de una estrecha relación matemática hiperbólica rectangular entre estos dos predictores y modelamos la relación obteniendo una ecuación, por la cual el dato del I0*G60 permite predecir muy certeramente el resultado del ISI-OL25. Más aún, la correlación entre los resultados del I0*G60 y los del ISI-OL fue muy alta, de -0,906.
El estudio de los predictores22 nos permitió encontrar científicamente los puntos de corte correctos del HOMA, del QUICKI, del ISI-OL y el de nuestro nuevo predictor. El análisis ROC permite encontrar el punto de corte con el mejor índice de Youden (sensibilidad más especificidad, menos 1). Los puntos de corte hallados para los tres primeros predictores resultaron muy diferentes a los generalmente en uso: HOMA (>2,09 versus >2,6), QUICKI (<0,341 versus <0,330) e ISIOL (<4,45 versus <2,5), lo que explica en buena parte el bajo desempeño diagnóstico de éstos. El punto de corte del I0*G60 fue >1.110.
Finalmente, quedó al descubierto la jerarquía de desempeño diagnóstico de estos predictores con los análisis ROC y Bayesiano aplicados. El mejor desempeño correspondió a nuestro nuevo predictor (AUROC 0,867, sensibilidad 0,865 y exactitud global 0,822) y el peor correspondió en empate, al HOMA y al QUICKI (AUROC 0,829, sensibilidad 0,757 y exactitud global 0,789). El desempeño del ISI-OL estuvo al medio de los extremos (AUROC 0,829, sensibilidad 0,835 y exactitud global 0,789).
Encontrando la “normalidad metabólica” de la CTG27
Para tener un punto de referencia sólido de “normalidad metabólica” con qué comparar, construimos una base de datos de 573 mujeres26 en edad reproductiva sin sospechas de alteraciones glucídicas, que consultaron por variadas razones ginecológicas, a las cuales –por protocolo–, se les efectuó una CTG con 75 g de glucosa y medición seriada de glicemias e insulinemias (0-30-60-90-120 minutos). Se categorizó la CTG de acuerdo a los criterios 2003 de la ADA27. De ellas, 468 (81,7%) fueron normo-tolerantes a la glucosa (NGT), 100 (17,45%) fueron prediabéticas (PD) y 5 (0,87%) fueron diabéticas (DM2). En seguida, para seleccionar las mujeres más sanas del grupo NGT, se las ordenó por sus valores de G120. Como lo demostró en 2004 el grupo de DeFronzo, el valor de la G120 es un excelente indicador del deterioro de la función beta insular28. Así, las mujeres en los dos primeros terciles de los valores de G120 (n=312), constituyeron las personas más normales de las NGT (las con mejor función beta insular). De hecho, sus glicemias de ayunas fueron 84,7 ± 6,4 mg/dL, sus insulinemias de ayunas eran 6,0 ± 4,3 mU/mL y sus índices HOMA eran 1,27 ± 0,95 (DE), muy en consonancia con los valores encontrados en nuestros 53 sujetos probadamente sensibles a la insulina.
En la tabla 1 se detalla el modo de cálculo del índice insulinogénico, del índice de disposición, del %RFBI y del %RSI, con los datos de la figura 2.
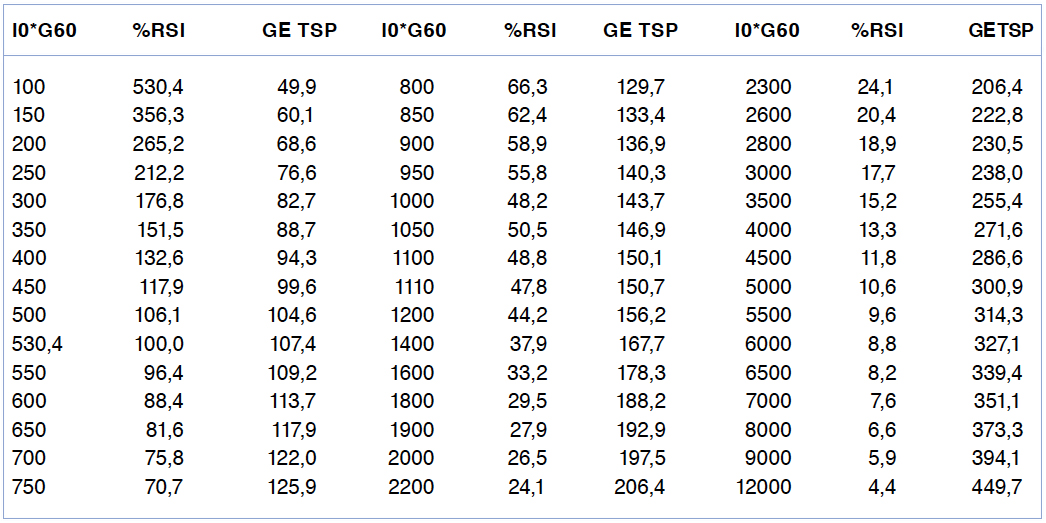
Si bien el I0*G60 predice directamente la glicemia de equilibrio del TSP (GE del TSP) según el modelamiento matemático de esta relación16, su cálculo no es muy simple. Por esta razón decidimos transformar el valor del I0*G60 en un % Relativo de Sensibilidad Insulínica (%RSI). La mediana del I0*G60 de las 312 mujeres de referencia (530,4; RIC, 314,3- 831) fue considerado el 100% de sensibilidad a la insulina. En la tabla 2 se muestra la equivalencia matemática entre el valor del I0*G60 y los valores del %RSI y los de la GE del TSP. Un valor de 530,4 de I0*G60 equivale a 100% del %RSI y a una GE de 107 mg/dL. El punto de corte del I0*G60 >1.110 equivale a <47,8% de %RSI y a una GE >150,7 mg/dL. En la figura 1 se muestra en la abscisa, los valores del I0*G60 y en la ordenada, los valores predichos del %RSI y los valores predichos del GE del TSP.
Tabla 1. Cálculo de los parámetros metabólicos del Squeezer.
| Parámetros | Fórmulas | Cálculo ejemplo figura 2 | Resultado |
| Índice insulinogénico (II) | (I30-I0) / (G30-G0) | (74,9-17,4) / (165-109) | 1,03 |
| Índice de disposición (ID) | (1.000 * II) / I0*G60 | (1.000 * 1,03) / 3.393 | 0,30 |
| % Relativo Función beta insular (%RFBI) | (100 * ID) / Mediana IDa | (100 * 0,30) / 2,5a | 12% |
| % Relativo sensibilidad insulínica (%RSI) | [100 * (Mediana I0*G60b / I0*G60)] | [100 * (530,4b / 3.393)] | 15,6% |
a Mediana de ID en Población de Referencia (terciles 1 y 2 de sujetos con G120 –51-110 mg/dL–, en 468 sujetos normo-tolerantes a la glucosa,
n=312); Rango Intercuartil, 1,57-5,1.
b Mediana de “I0*G60” en Población de Referencia (terciles 1 y 2 de sujetos de G120 en 468 sujetos normo-tolerantes a la glucosa, n=312);
Rango Intercuartil, 314,3-831.
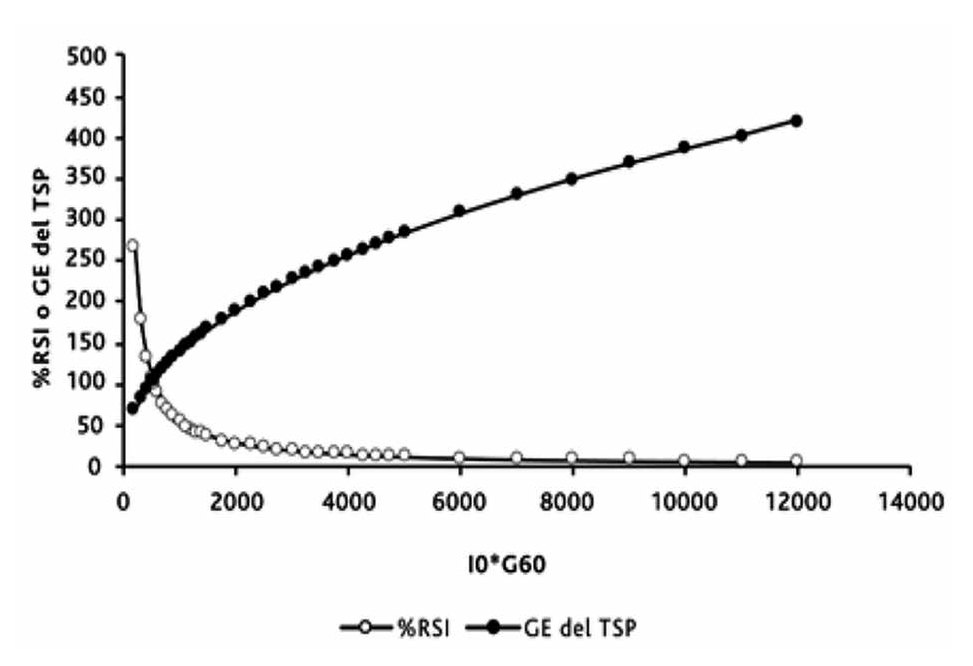 Figura 1: Relación matemática del I0*g60 con %RSI y ge del TSP.
Figura 1: Relación matemática del I0*g60 con %RSI y ge del TSP.Tabla 2. Equivalencias del I0*G60 con %RSI y con Glicemia de Equilibrio del TSP
El programa “OGTT Squeezer”16,29
Con las fórmulas bien definidas de los predictores (I0*G60, ISI-OL, QUICKI y HOMA), del índice insulinogénico, del índice de disposición, del %RFBI y del %RSI fue posible programar su solución en Excel. Además, logramos que el programa categorizara metabólicamente la CTG de acuerdo a los criterios de la ADA 200327.
Sin embargo, cualquier usuario de Excel aprende lo difícil que es el uso práctico de los programas escritos en este formato. Cualquier error de digitación puede llevar a la pérdida de información valiosa y aún a inutilizar el programa. Por esta razón transformamos el programa en este formato a un programa escrito en hipertexto (HTML 5). Este tipo de programa es amable y el usuario no puede malograrlo. Las fórmulas están fuera del alcance del usuario y el programa soporta cualquier error del operador sin dejar de funcionar.
Se generaron 3 versiones en hipertexto:
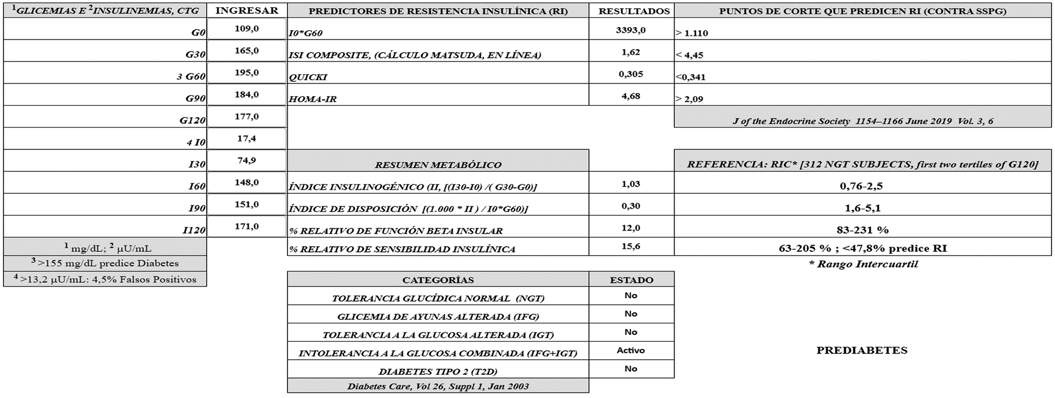
- Versión completa (Figura 2): Requiere 5 glicemias y 5 Insulinemias (0-30-60-90-120 min). Es el procedimiento más caro y proporciona las siguientes respuestas: I0*G60, ISI-OL, QUICKI, HOMA, índice insulinogénico, índice de disposición, %RFBI, %RSI y categorización metabólica de la CTG.
- Versión mínima (Figura 3): Requiere 3 glicemias (0-60- 120 minutos) y 1 Insulinemia (0). Es el procedimiento más económico, pero también el que proporciona menos respuestas: I0*G60, QUICKI, HOMA, %RSI y categorización metabólica. Su principal limitación es que no informa de la situación de las células beta insulares (%RFBI).
- Versión abreviada (Figura 4): Requiere 4 glicemias (0- 30-60-120 minutos) y 2 insulinemias (0-30 minutos). Es el procedimiento más costo-efectivo. Sólo se pierde el cálculo del ISI-OL (predictor menos eficiente que el I0*G60). Ahorra 1 glicemia (90 minutos) y 3 insulinemias (60-90 y 120 minutos). Informa tanto del %RSI como del %RFBI.
Las figuras 2, 3 y 4 ingresan los datos de un sujeto con una intolerancia combinada a la glucosa (glicemia de ayunas alterada e intolerancia a la glucosa). Los 4 predictores de resistencia a la insulina fueron positivos, el índice insulinogénico fue normal, pero cuando se corrigió por la resistencia insulínica (estimada por el I0*G60), o sea como índice de disposición, se advierte el daño beta insular, que resulta ser subnormal, de 0,3 (rango intercuartil de población de referencia 1,6-5,1). Este parámetro, dividido por la mediana del correspondiente parámetro en la población de referencia (2,5), fue solo de un 12 % (%RFBI; rango intercuartil de población de referencia, 83-231%). Finalmente, el I0*G60 del paciente (3.393), comparado con la mediana del mismo parámetro en la población de referencia (530,4) produjo una sensibilidad insulínica relativa (%RSI) de solo un 15,6% (100*530,4/3.393), muy por debajo del cut-off que indica la presencia de resistencia insulínica (<47,8%).


Posibles usos del OGTT Squeezer
- Generar aplicaciones telefónicas para plataformas Android y iPhone. Estas aplicaciones no requieren ni de señal telefónica ni de WiFi, porque se resuelven en el teléfono. Por lo tanto, pueden usarse en localidades remotas sin señal telefónica ni acceso a Internet. Esta solución, si bien es práctica, tiene el inconveniente que obliga al usuario a ingresar las glicemias e insulinemias necesarias con un tiempo escaso;
- Entregar el programa al laboratorio para que el informe de la GTG entregue toda la información que proporciona el Squeezer. Esta solución parece la más lógica. Para ello, el laboratorio debería ofrecer las 3 alternativas (CTG completa, mínima y abreviada) estandarizadas y “paquetizadas”.
Creemos que el OGTT Squeezer puede ser un aporte al clínico en la atención de pacientes, especialmente si viene con informe desde el laboratorio. Las versiones completa y abreviada informan no solo la magnitud estimada de la resistencia insulínica, sino que, además, informan la magnitud estimada de la función beta insular. Sólo el deterioro de la función beta insular lleva al paciente a la diabetes, no así la mera resistencia insulínica. La versión mínima del programa es incapaz de informar de la función beta insular, pero categoriza metabólicamente la CTG, informa los predictores de resistencia insulínica y estima cuantitativamente la resistencia a la insulina. La versión completa del Squeezer aumenta el costo de la CTG y sólo aporta el cálculo del ISI-OL a los resultados de la versión abreviada.
El Squeezer ahorra tiempo y estandariza la información metabólica entregada al médico. Solamente la experiencia con su eventual uso mostrará sus aportes y limitaciones. El instrumento puede refinarse con el uso.
Referencias
- Contreras P, Mella I, Aguirre C, Zura ML, Pérez J. Insulinorresistencia, un fenómeno frecuente en clínica. Rev Med Chile 1993; 121: 184-196.
- Contreras P, Villanueva CL, Calvillán M, Morales H, Mella I, Pérez J et al.Sensibilidad a la insulina: ausencia de diferencias sexuales al expresarla en función de la masa magra. Rev Med Chile 1991; 119: 5-10.
- Shen SW, Reaven GM, Farquhar JW. Comparison of impedance to insulinmediated glucose uptake in normal subjects and in subjects with latent diabetes. J Clin Invest. 1970; 49(12): 2151-2160.
- Pei D, Jones CNO, Bhargava R, Chen YDI, Reaven GM. Evaluation of octreotide to assess insulin mediated glucose disposal by the insulin suppression test. Diabetologia. 1994; 37(8): 843-845.
- Contreras PH, Vigil P. Letter to the Editor: “Long-term testosterone administration on insulin sensitivity in older men with low or low-normal testosterone levels”. J Clin Endocrinol Metab 2019; 104(3): 678-679.
- DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 1979; 237(3): E214-E223.
- Greenfield MS, Doberne L, Kraemer F, Tobey T, Reaven G. Assessment of insulin resistance with the insulin suppression test and the euglycemic clamp. Diabetes. 1981; 30(5): 387-392.
- Kim MK, Reaven GM, Chen YD, Kim E, Kim SH. Hyperinsulinemia in individuals with obesity: role of insulin clearance. Obesity (Silver Spring). 2015; 23(12): 2430-2434.
- Vigil P, Contreras P, Alvarado JL, Godoy A, Salgado AM, Cortés ME. Evidence of subpopulations with different levels of insulin resistance in women with polycystic ovary syndrome. Hum Reprod. 2007; 22(11): 2974- 2980.
- Knowles JW, Assimes TL, Tsao PS, Natali A, Mari A, Quertermous T, Reaven GM, Abbasi F. Measurement of insulin-mediated glucose uptake: direct comparison of the modified insulin suppression test and the euglycemic, hyperinsulinemic clamp. Metabolism. 2013; 62(4): 548-553.
- Ferrannini E, Mari A. How to measure insulin sensitivity. J Hypertens. 1998; 16(7): 895-906.
- Cheal KL, Abbasi F, Lamendola C, McLaughlin T, Reaven GM, Ford ES. Relationship to insulin resistance of the adult treatment panel III diagnostic criteria for identification of the metabolic syndrome. Diabetes. 2004; 53(5): 1195-1200.
- Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, Gordon DJ, Krauss RM, Savage PJ, Sidney C. Smith SC, Spertus JA, Costa F. Diagnosis and Management of the Metabolic Syndrome. An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005; 112: 2735-2752.
- Alberti KGMM, Zimmet P, Shaw J. Metabolic syndrome-a new worldwide definition. A Consensus Statement from the International Diabetes Federation. Diabet. Med. 2006: 23, 469-480.
- Alberti KGMM, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, Fruchart JC, James WPT, Loria CM, Smith, SC. Harmonizing the Metabolic Syndrome: A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009; 120: 1640-1645.
- Contreras PH, Bernal YA, Vigil P. Usando la Curva de Tolerancia a la Glucosa para calcular el Porcentaje Relativo de Sensibilidad Insulínica y la Función Beta Insular Relativa. Rev Med Chile. 2020; 148: 436-443.
- Contreras PH, Bernal YA, Vigil P. The I0*G60, a new kid on the block. EC Endocrinology and Metabolic Research. 2020; 5 (2): 1-6.
- Mathews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and b-cell function from fasting glucose and insulin in man. Diabetologia. 1985; 28(7): 412-419.
- Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, Quon MJ. Quantitative insulin sensitivity check index: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab. 2000; 85(7): 2402-2410.
- Matsuda M, DeFronzo RA. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care. 1999; 22(9): 1462-1470.
- Acosta AM, Escalona M, Maiz A, Pollak F, Leighton F. Determinación del índice de resistencia insulínica mediante HOMA en una población de la Región Metropolitana de Chile. Rev Méd Chile. 2002; 130: 1227-1231.
- Contreras PH, Salgado AM, Bernal YA, Vigil P. A Simple and Improved Predictor of Insulin Resistance Extracted From the Oral Glucose Tolerance Test: The I0*G60. J Endo Soc. 2019; 3(6): 1154-1166.
- Garmendia ML, Lera L, Sánchez H, Uauy R, Albala C. Valores normativos de resistencia a la insulina mediante HOMA-IR en adultos mayores de Santiago de Chile. Rev Méd Chile 2009; 137: 1409-14016.
- Salgado AM, Acosta AM, Maiz A, Vigil P, Contreras P. Estudio crítico del HOMA como método de pesquisa de resistencia insulínica en clínica. Rev Chil Endo. 2008; 1(2).
- Contreras PH, Bernal YA, Vigil P. A strong, rectangular hyperbolic relationship links the I0G60 with the Matsuda-DeFronzo’s insulin sensitivity index. EC Endocrinology and Metabolic Research. 2020; 5(10): 09-14.
- Contreras PH, Bernal YA, Vigil P. Glucose tolerance, insulin sensitivity and beta cell function in a large, unselected cohort of women of reproductive age. En preparación.
- The Expert Committee On The Diagnosis And Classification Of Diabetes Mellitus. Follow-up Report on the Diagnosis of Diabetes Mellitus. Diabetes Care. 2003; 26(11): 3160-3167.
- Gastaldelli A, Ferrannini E, Miyazaki Y, Matsuda M, DeFronzo RA. Betacell dysfunction and glucose intolerance: results from the San Antonio metabolism (SAM) study. Diabetologia. 2004; 47: 31-33.
- Contreras PH. The “Squeezer”: an HTML programme designed to estimate relative insulin sensitivity and relative beta cell function using OGTT data. Diabetologia. 2020; 63(Suppl 1): S1-S485. Abstract 326