Aumento de la lipocalina orosomucoide-1 (ORM1) en sujetos con Hiperaldosteronismo primario
Jorge Pérez L1+, María G. Ugarte S2+, Alejandra Tapia-Castillo3, Gabriela Doberti D4, Carlos Fardella B5, Cristian Carvajal M6*
Increase of lipocalin ORM1 in Primary Aldosteronism
- Bioquímico, Laborato r io de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
- Estudiante de Medicina, Universidad de los Andes, Santiago, Chile.
- Postdoctorante Pontificia Universidad Católica de Chile, Santiago Chile.
- Residente de Endocrinología, Pontificia Universidad Católica de Chile, Santiago Chile.
- Profesor titular, Jefe del Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
- Profesor Asociado, Jefe de Laboratorio de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile, Santiago, Chile.
*Correspondencia:
ccarvajm@uc.cl
Cristian A. Carvajal, PhD.
Departamento de Endocrinología,
Facultad de Medicina, Pontificia
Universidad Católica de Chile.
Diagonal Paraguay 362, 4° piso.
Santiago, Chile.
Los autores declaran no tener conflictos de interés.
+Ambos autores contribuyeron igualmente
en el estudio.
Fuentes de financiamiento:
Proyecto
SOCHED 2019-09 y parcialmente por
PROGRAMA ICM-ANID, ICN09_016;
FONDECYT 1212006, 3200646, CONICYT-
FONDEQUIP EQM150023, CETREN-
UC.
Recibido: 03-09-2021
Aceptado: 05-11-2021
Resumen: El hiperaldosteronismo primario (HAP) es la causa más común de hipertensión arterial secundaria. A pesar de la prevalencia del HAP (6-10%) y sus consecuencias, los mecanismos que median los efectos deletéreos renales y extrarenales originados por la aldosterona más allá de la hipertensión arterial (ej. inflamación renal, alteraciones cardiacas y disfunción vascular), siguen siendo poco conocidos. Estudios previos sugieren que el exceso de aldosterona aumentaría proteínas sensibles a la activación del receptor de mineralocorticoides (MR), como las lipocalinas LCN2 (NGAL) y ORM1. Objetivo: Determinar la concentración de las lipocalinas ORM1, NGAL y NGAL-MMP9 en sujetos HAP. Sujetos y Métodos: Estudio de cohorte transversal en sujetos adultos (similares en sexo, edad e IMC) separados en controles normotensos (CTL), hipertensos esenciales (HE) y con screening positivo de HAP (aldosterona ≥9 ng/dL y ARP < 1 ng/mL*h acorde a las guías internacionales de HAP). Se determinó la presión arterial sistólica (PAS) y diastólica (PAD), aldosterona plasmática, actividad renina plasmática (ARP) y la relación aldosterona / actividad de renina plasmática (ARR). Se determinó la concentración de NGAL, NGAL-MMP9 y ORM1 en suero por ELISA. Resultados: Detectamos mayores niveles de ORM1 en sujetos HAP. No se detectaron diferencias en NGAL ni NGAL-MMP9 entre los grupos. Detectamos una asociación positiva de ORM1 con ARP (rho= -0,407, p=0,012) y con ARR (rho= 0,380 p= 0,021). Conclusión: La mayor concentración de ORM1 en sujetos HAP y las asociaciones de ORM1 con aldosterona, ARP y ARR, proponen a esta proteína como un potencial biomarcador de HAP y de utilidad en el desarrollo de algoritmos diagnósticos de HAP.
Palabras clave: Biomarcador; Hipertensión; Hiperaldosteronismo primario; ORM1.
Abstract: Primary hyperaldosteronism (PA) is the most common cause of secondary
hypertension. Despite the prevalence of PA (6-10%) and its consequences, the
mechanisms that mediate the deleterious renal and extrarenal effects caused by
aldosterone beyond arterial hypertension (eg renal inflammation, cardiac alterations
and vascular dysfunction), remain barely known. Previous studies suggest that excess
aldosterone would increase proteins sensitive to activation of the mineralocorticoid
receptor (MR), such as lipocalins LCN2 (NGAL) and ORM1. Aim: To determine
the concentration of the lipocalins ORM1, NGAL and NGAL-MMP9 in PA subjects.
Subjects and Methods: Cross-sectional study in adult subjects (similar in sex, age
and BMI) grouped as normotensive controls (CTL), essential hypertensive (HE) and
subjects with positive PA screening (aldosterone ≥ 9 ng/dL and PRA <1 ng/mL*h,
according to international PA guidelines). Systolic (SBP) and diastolic (DBP) blood
pressure, plasma aldosterone, plasma renin activity (PRA), and plasma aldosterone
renin ratio (ARR) were determined. The concentration of NGAL, NGAL-MMP9 and
ORM1 in serum was determined by ELISA. Results: We detected higher levels
Recibido: 03-09-2021 of ORM1 in PA subjects. No differences in NGAL or NGAL-MMP9 were detected
between the groups. We detected a positive association of ORM1 with ARP (rho =
-0.407, p < 0.05) and with ARR (rho = 0.380 p <0.05). Conclusion: The high levels
of ORM1 in PA subjects and the associations of ORM1 with aldosterone, ARP and
ARR, suggest ORM1 is a potential biomarker of PA, and useful in the development
of a diagnostic algorithm for PA.
Keywords: Biomarker; Hypertension; Primary aldosteronism; ORM1.
La hipertensión arterial (HTA) es un problema de salud pública que afecta a 1,39 mil millones de personas en el mundo con una prevalencia del 31,1% y 27,6% en Chile1. En el 80% de los casos, la etiología de la hipertensión es desconocida, sin embargo, entre un 5-15% de estos hipertensos esenciales (HE), tendrían un cuadro de HTA secundaria a desórdenes endocrinos2. Entre ellos, se identifica el hiperaldosteronismo primario (HAP), el cual es una patología del sistema endocrino que tiene una prevalencia aproximada del 10% en la población HE3,4,5, y es la causa más frecuente de HTA secundaria. El HAP se caracteriza por una secreción inapropiada de aldosterona independiente de sus reguladores fisiológicos renina, angiotensina II y concentraciones de sodio6. El HAP es una condición patológica asociada a la activación del receptor mineralocorticoide (MR) por exceso de aldosterona circulante. Esta activación crónica del MR, aumenta el transporte de sodio y reabsorción de agua a nivel renal7, provocando una expansión del volumen sanguíneo que conduce a la elevación de la presión arterial8.
Actualmente el HAP se considera como una patología con un espectro fenotípico más amplio, donde es posible identificar formas subclínicas (incluyendo normotensos, correspondiente al 4% de los HAP), hasta fenotipos clínicos más severo o manifiestos con HTA, hipokalemia y una elevada razón aldosterona / actividad de renina plasmática (ARR)9,10. Los sujetos con HAP subclínico se caracterizan por no presentar manifestaciones clínicas evidentes (ej. presión arterial normal, normokalemia), sin embargo, tienen niveles renina suprimidos (<1 ng/ml*h) y elevación de aldosterona10,11,12, lo que se observa con una elevación de la ARR. Si bien el uso de la ARR ha contribuido significativamente al screening de individuos con HAP3, diversos factores como el género, la edad, etnicidad13, fármacos14, el método o técnica de laboratorio usado15 y la variabilidad intra-sujeto16, dificultan la correcta interpretación de este valor.
Junto con la importancia del diagnóstico de HAP por su asociación con aumento de la presión arterial, también se ha vuelto relevante debido a que altos niveles de aldosterona circulante presumen una activación excesiva del MR en tejidos extrarrenales, lo que produce efectos deletéreos independientes del aumento de presión arterial como inflamación, remodelamiento vascular y fibrosis, afectando al corazón17, el endotelio vascular18, el sistema inmune19 y el tejido adiposo20. A pesar de la alta prevalencia del HAP, los mecanismos que median los efectos deletéreos renales y extrarrenales del aumento de aldosterona más allá de la HTA, siguen siendo poco conocidos.
Recientemente se reportó que la expresión de la proteína orosomucoide-1 (ORM1), conocida también como glicoproteína acida alfa-1 (AGP1)21, podría estar regulada por elementos de la vía de regulación del MR22,23, proponiéndola como un atractivo biomarcador de la activación mineralocorticoide. ORM1 es una proteína de fase aguda sintetizada principalmente en el hígado que previamente ha sido reportada como un factor de riesgo cardiovascular24,25, y su expresión está bajo regulación tanto de citoquinas proinflamatorias (ej: TNF-α, interleucina (IL-1, IL-8, IL-11, IL-6) como de glucocorticoides26,27.
Por otro lado, la proteína NGAL (neutrophil gelatinase associated-lipocalin)28 es una glicoproteína perteneciente a la familia de las lipocalinas que participa en la regulación de variados procesos inflamatorios. NGAL es expresada en diferentes poblaciones celulares, incluyendo neutrófilos, riñones, endotelio, cardiomiocitos e hígado28,29. Esta proteína ha sido incluida como marcador en la evaluación de riesgo cardiovascular30, por su alto valor predictivo de enfermedad renal en pacientes con insuficiencia cardiaca31,32. Estudios in vitro han demostrado un aumento en la expresión de NGAL en células cardiacas estimuladas con aldosterona y su expresión podría estar regulada por el MR28,33. NGAL es capaz de formar un complejo estable y biológicamente activo con la Metaloproteinasa de matriz 9 (MMP9), la cual está encargada de la degradación de la matriz extracelular, con lo cual evita su degradación y prolonga su actividad29. El aumento del complejo NGAL-MM9 ha sido asociado positivamente con el daño cardiovascular34.
En este sentido, el presente estudio busca evaluar la concentración de las lipocalinas ORM1, NGAL y el complejo NGAL-MMP9 en suero de sujetos HAP, para complementar y optimizar su diagnóstico.
Sujetos y Métodos
Se estudió una cohorte de 39 sujetos chilenos de similar estado socioeconómico y etnicidad, incluyendo sujetos de ambos sexos de entre 18-60 años. Todos los pacientes que participaron en el estudio firmaron un consentimiento informado de acuerdo con las guías de la Declaración de Helsinki y aprobado por el Comité de Ética de la Facultad de Medicina de la Pontificia Universidad Católica de Chile, bajo el certificado de aprobación CECMedUC 190823001 y 200619004.
Se clasificó los participantes según sus características clínicas y bioquímicas en 3 grupos: sujetos controles (CTL), hipertensos esenciales (HE) y sujetos con screening positivo de hiperaldosteronismo primario (HAP), los cuales fueron similares en género, edad e índice de masa corporal (IMC).
Todos los sujetos tuvieron una dieta de sodio ad libitum y declararon no realizar ninguna dieta extrema en el mes del análisis, ni consumir productos a base de hierbas. Se excluyó a los sujetos con enfermedad renal, insuficiencia hepática, insuficiencia cardiaca y diabetes mellitus. Se excluyó además a aquellos que estuvieran bajo tratamiento de glucocorticoides o anticonceptivos orales debido a sus efectos en la producción de hormonas adrenales14. Dado que gran parte de los pacientes hipertensos podrían estar recibiendo medicación antihipertensiva que afecte el sistema renina angiotensina aldosterona (RAAS) al momento del estudio, los antihipertensivos fueron reemplazados por amlodipino doxazosina por 15 días para el control de presión arterial.
Análisis Bioquímicos
Todos los sujetos del estudio cuentan con una ficha clínica donde se consignaron los datos más relevantes de la historia clínica y del examen físico. Se obtuvieron muestras de suero, plasma y orina. Se determinó la concentración de aldosterona en suero, actividad de renina plasmática (ARP), creatinuria, electrolitos plasmáticos y urinarios. La determinación de aldosterona y ARP se realizó mediante inmunoensayo utilizando kits comerciales (Coat-ACount Kit; Siemens, Los Ángeles, CA y DiaSorin, Stillwater, MN, respectivamente). La concentración de sodio y potasio en orina de 24 horas se evaluó mediante los métodos descritos previamente35. Todas las muestras de suero, plasma y orina se almacenaron a -80°C hasta el análisis.
Clasificación de los Sujetos
El grupo HAP se definió como sujetos con aldosterona en suero ≥ 9 ng/dL y ARP < 1 ng/mL*h acorde a las guías internacionales de HAP y la revisión de Vaidya et al7,9. El grupo HE se clasificó según las Guías Clínicas de Hipertensión Arterial del año 201736. El grupo Control se conformó por sujetos normotensos con parámetros clínicos y bioquímicos normales36.
Cuantificación de las proteínas ORM1 y NGAL
Las concentraciones de ORM1 se midieron mediante ELISA utilizando un kit comercial (DAGP00, R&D Systems, Inc, USA), al igual que las concentraciones de NGAL (DLCN20, R&D Systems, Inc, USA) y el complejo NGAL-MMP9 (DM9L20, R&D Systems, Inc, USA).
Datos y análisis estadísticos
Los datos de variables continuas se expresaron como mediana y rango intercuartil (Q2[Q1-Q3]). La diferencia entre el número de hombres y mujeres por grupo fueron analizadas por el test de χ2. La normalidad se evaluó mediante la prueba de Kolmogorov-Smirnov. Se utilizó el test de Kruskall-Wallis para análisis no paramétricos y un post test de Dunn. Todos los análisis estadísticos fueron realizados mediante el programa GraphPad Prism versión 9.0 y se consideró un p < 0,05 como significativo.
Resultados
El grupo control incluyó 13 sujetos, de los cuales 6 fueron hombres y 7 mujeres, el grupo HE incluyó 12 sujetos de los cuales 8 fueron hombres y 4 mujeres, y el grupo HAP incluyó 13 sujetos de los cuales 7 fueron hombres y 6 mujeres. En el grupo HAP, se observó mayor PAD (86 [76-95] vs 84 [81- 91] vs 75 [71-76] mmHg, p= 0,0003) y PAS (141 [129-153] vs 134 [123-139] vs 116 [110-121] mm Hg, p= 0,0005) que el grupo HE y control respectivamente (Tabla 1). El grupo HAP mostró una mayor concentración de aldosterona que el grupo HE (12.7 [10.4-13.7] vs 8.0 [6.6-8.7] ng/dL, p= 0,0019) y el grupo control (12.7 [10.4-13.7] vs 8.4 [6.4-11.9] ng/dL, p= 0,0149) (Figura 1a). Por otro lado, la ARP fue menor en el grupo HAP que en el grupo HE (0.8 [0.5-1.0] vs 1.7 [1.3- 2.5] ng/mL*h, p= 0,0001) y el grupo Control (0.8 [0.5-1.0] vs 1.7 [1.3-2.3] ng/mL*h, p= 0,0001) (Figura 1b). Cuando se comparó la ARR, se observó diferencias significativas entre el grupo HAP y el grupo HE (17.5 [13.1-20.1] vs 4.5 [3.0-6.3], p= 0,0001), y entre HAP y el grupo control (17.5 [13.1-20.1] vs 4.9 [3.1-7.0] p= 0,0001) (Figura 1c).
No se observó diferencias significativas en la concentración de electrolitos en sangre ni en muestras de orina de 24 horas, o de sus fracciones excretadas (Tabla 1).
Al determinar la concentración de la proteína ORM1 en suero se observó que el grupo HAP presentó una mayor concentración de ORM1 que el grupo HE (858,1 [59,2-1139] vs 62,5 [47,1-365,9] μg/mL, p= 0,01) y el grupo control (858,1 [59,2-1139] vs 88,0 [23,8-650,3] μg/mL, p= 0,0048) (Figura 2a).
No se observaron diferencias significativas en las concentraciones de NGAL (Figura 2b) ni del complejo NGALMMP9 (Figura 2c) en suero entre los grupos de estudio.
Se realizó un estudio de asociación de la concentración de ORM1 en suero, con parámetros clínicos y bioquímicos de tamizaje de HAP (Aldo sterona, ARP y ARR). Se observó una asociación positiva entre la concentración de ORM1 y la concentración de aldosterona (rho=0,33, p=0,05) y ARR (rho= 0,380 p= 0,021) (Figura 3). Por otro lado, se detectó una asociación negativa entre concentración de ORM1 con la ARP (rho= -0,407, p=0,012) (Figura 3). No se observó asociaciones significativas entre la concentración de ORM1 con ninguna otra característica clínica ni bioquímica (Tabla 1). No se observaron asociaciones significativas entre la concentración de NGAL con los parámetros clínicos y bioquímicos de la tabla 1 ni con ORM1.
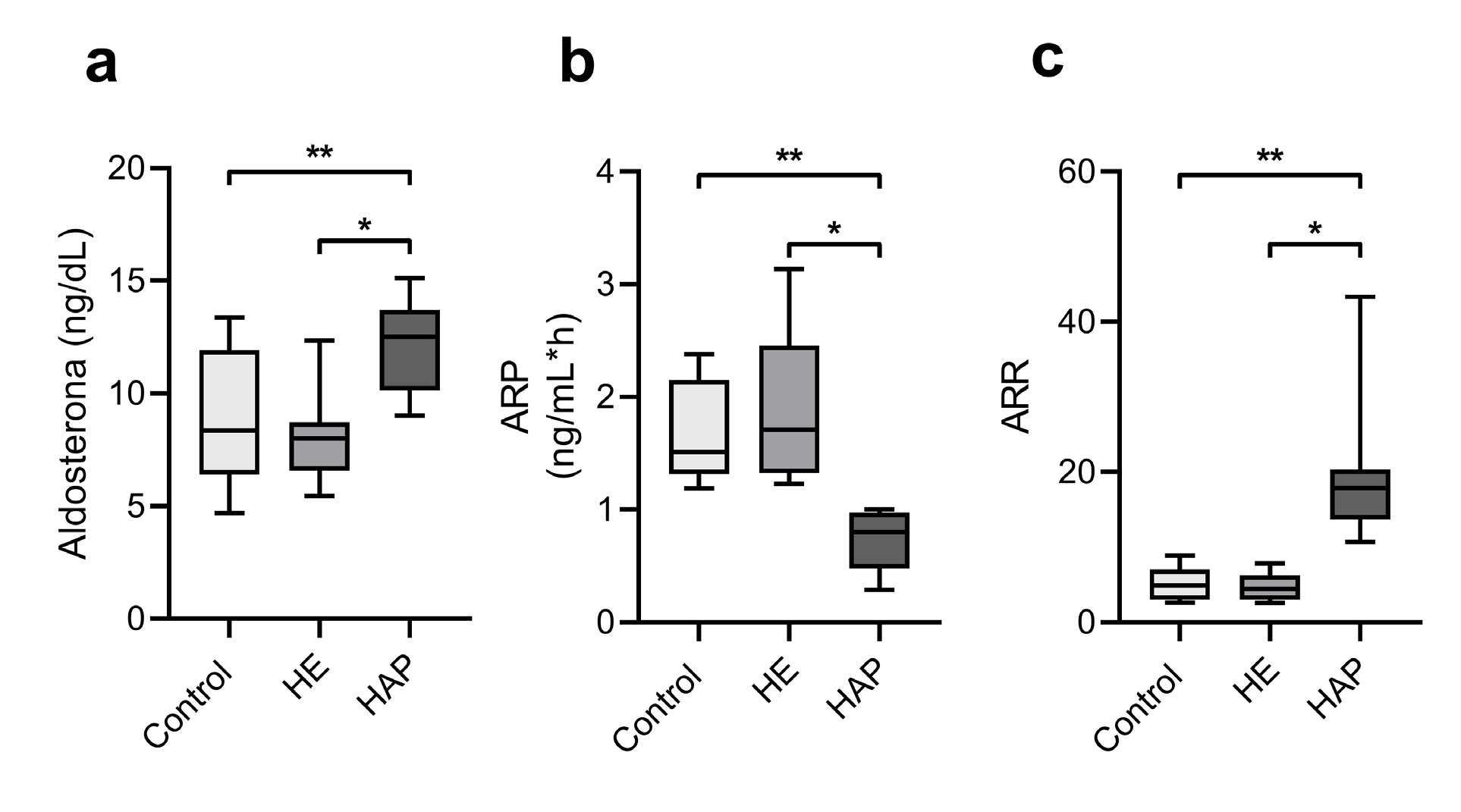 Figura 1: Parámetros bioquímicos relevantes en el screening de hiperaldosteronismo primario en grupos HAP, HE y controles normotensos. a. Concentración
de aldosterona en suero de los grupos Control, HE y HAP. Se observó diferencias significativas entre el grupo HAP y el grupo HE y el grupo control. b. Actividad
de renina plasmática de los grupos Control HE y HAP (ng/mL*h). La ARP disminuye en los sujetos HAP en comparación a los HE y el grupo Control. c. Razón
aldosterona/actividad de renina plasmática de los grupos Control, HE y HA. Cuando se utiliza la razón entre aldosterona/ARP, las diferencias entre grupos son
mayores que al utilizar cualquiera de estos 2 por separado, observándose diferencias significativas entre el grupo HAP y el grupo HE y el grupo Control. Los datos
se presentan como mediana y rango intercuartil [Q1-Q3]. *p< 0,05. **p< 0,01. ***p<0,0001. Análisis realizados mediante Kruskal-Wallis.
Figura 1: Parámetros bioquímicos relevantes en el screening de hiperaldosteronismo primario en grupos HAP, HE y controles normotensos. a. Concentración
de aldosterona en suero de los grupos Control, HE y HAP. Se observó diferencias significativas entre el grupo HAP y el grupo HE y el grupo control. b. Actividad
de renina plasmática de los grupos Control HE y HAP (ng/mL*h). La ARP disminuye en los sujetos HAP en comparación a los HE y el grupo Control. c. Razón
aldosterona/actividad de renina plasmática de los grupos Control, HE y HA. Cuando se utiliza la razón entre aldosterona/ARP, las diferencias entre grupos son
mayores que al utilizar cualquiera de estos 2 por separado, observándose diferencias significativas entre el grupo HAP y el grupo HE y el grupo Control. Los datos
se presentan como mediana y rango intercuartil [Q1-Q3]. *p< 0,05. **p< 0,01. ***p<0,0001. Análisis realizados mediante Kruskal-Wallis.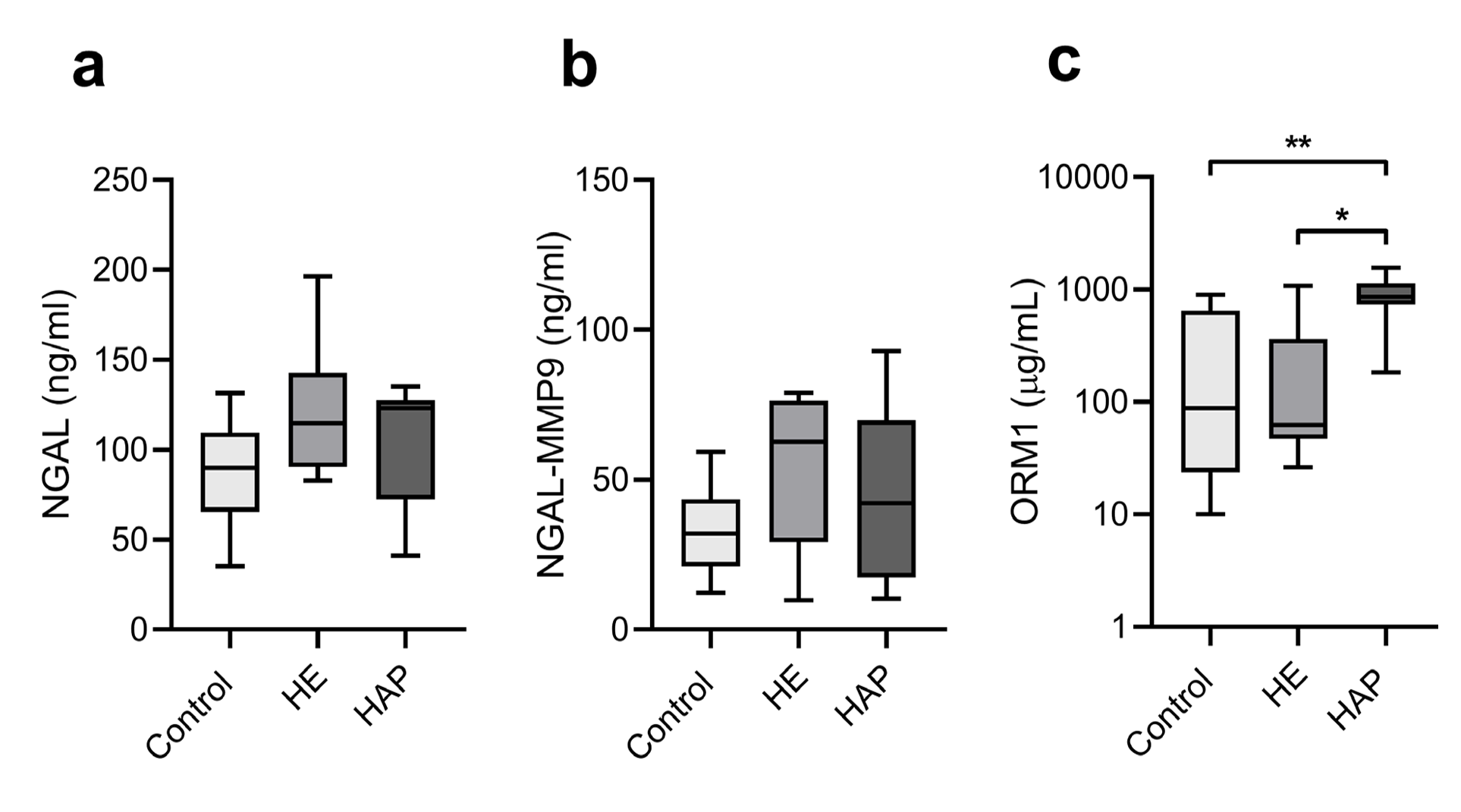 Figura 2: Concentración de NGAL, NGAL-MMP9 y ORM1 en suero en de sujetos HAP, HE y controles normotensos. a. Concentración sérica de NGAL en sujetos
HAP, HE y Controles. No se observó diferencias significativas de la concentración de NGAL entre los grupos de estudio. Se observó un aumento significativo de
la concentración de ORM1 en suero de sujetos HAP en comparación al grupo HE y Control. b. Concentración sérica del complejo NGAL-MMP9 en sujetos HAP,
HE y Controles. c. Concentración sérica de ORM1 en sujetos HAP, HE y Controles expresado como log10. Se observó una relación similar a la concentración de
NGAL libre, sin diferencias de la concentración de NGAL-MMP9 entre los grupos de estudio. Los datos se presentan como mediana y rango intercuartil [Q1-Q3].
*p< 0,05. **p< 0,01. Análisis realizados mediante Kruskal-Wallis.
Figura 2: Concentración de NGAL, NGAL-MMP9 y ORM1 en suero en de sujetos HAP, HE y controles normotensos. a. Concentración sérica de NGAL en sujetos
HAP, HE y Controles. No se observó diferencias significativas de la concentración de NGAL entre los grupos de estudio. Se observó un aumento significativo de
la concentración de ORM1 en suero de sujetos HAP en comparación al grupo HE y Control. b. Concentración sérica del complejo NGAL-MMP9 en sujetos HAP,
HE y Controles. c. Concentración sérica de ORM1 en sujetos HAP, HE y Controles expresado como log10. Se observó una relación similar a la concentración de
NGAL libre, sin diferencias de la concentración de NGAL-MMP9 entre los grupos de estudio. Los datos se presentan como mediana y rango intercuartil [Q1-Q3].
*p< 0,05. **p< 0,01. Análisis realizados mediante Kruskal-Wallis.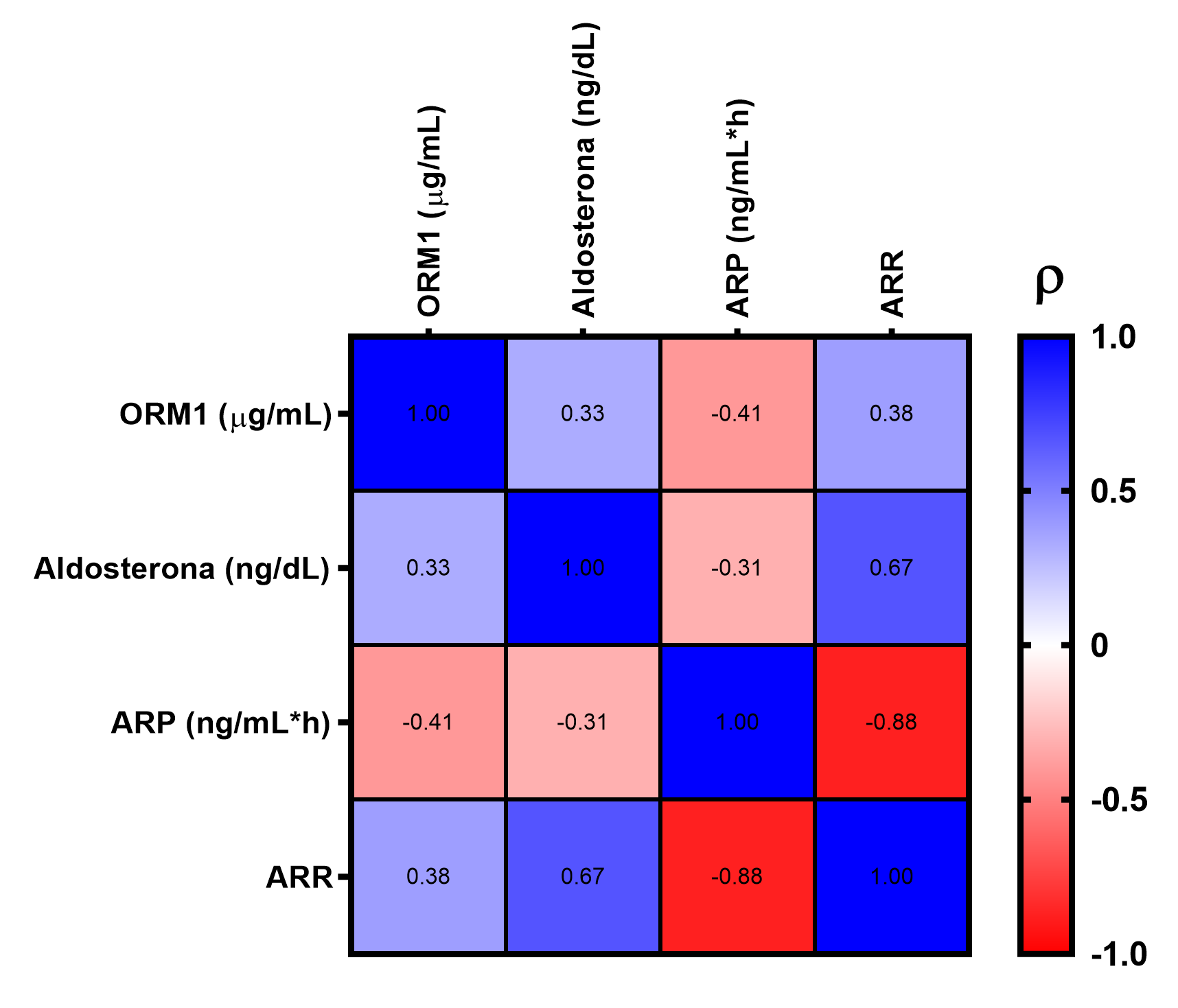 Figura 3: Mapa de calor de la asociación entre la concentración
de ORM1, Aldosterona sérica, ARP y ARR en sujetos HAP, HE y
controles normotensos. Las asociaciones positivas se reportan
en tonalidades azules con el respectivo valor de ρ (rho) dentro de
cada casilla. De igual forma se reportan las asociaciones negativas
en tonalidades rojas. Se observó asociaciones significativas entre
la concentración sérica de ORM1 con las 3 variables bioquímicas
más relevantes en el screening de HAP. Todos los estudios de
asociación se realizaron mediante el test de Spearman para variables
no paramétricas, p < 0,05.
Figura 3: Mapa de calor de la asociación entre la concentración
de ORM1, Aldosterona sérica, ARP y ARR en sujetos HAP, HE y
controles normotensos. Las asociaciones positivas se reportan
en tonalidades azules con el respectivo valor de ρ (rho) dentro de
cada casilla. De igual forma se reportan las asociaciones negativas
en tonalidades rojas. Se observó asociaciones significativas entre
la concentración sérica de ORM1 con las 3 variables bioquímicas
más relevantes en el screening de HAP. Todos los estudios de
asociación se realizaron mediante el test de Spearman para variables
no paramétricas, p < 0,05.Tabla 1. Características clínicas y bioquímicas de los sujetos según grupo.
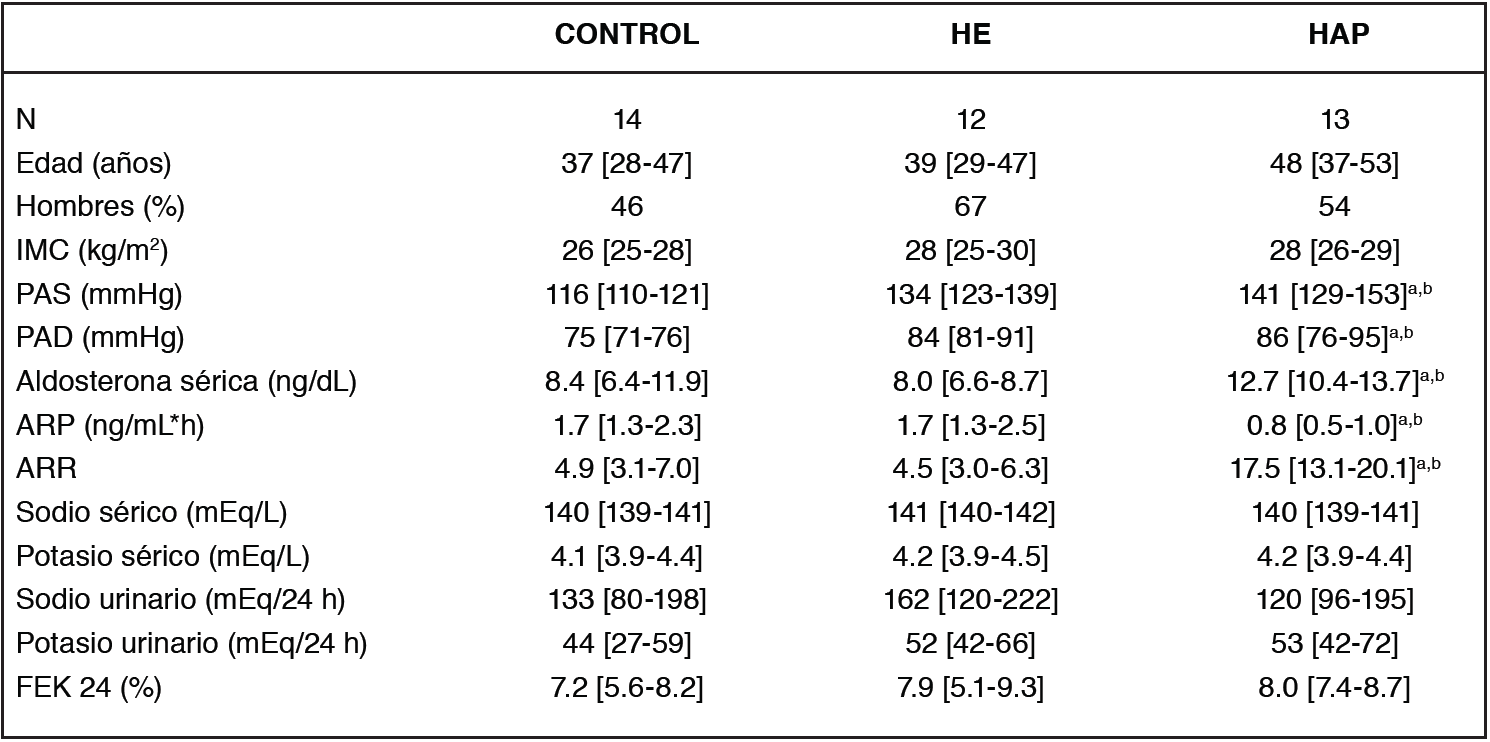
Tabla resumen de parámetros clínicos y bioquímicos relevantes en el diagnóstico de hiperaldosteronismo primario de los 39 sujetos que comprende el estudio, clasificados en 3 grupos de individuos normotensos sanos (Control), Hipertensos esenciales (HE) y con screening positivo de hiperaldosteronismo primario (HAP). Los datos se presentan como mediana y rango intercuartil [Q1-Q3]. PAS: Presión Sistólica; PAD: Presión Diastólica; ARP: Actividad de renina plasmática; ARR: Razón Aldosterona/ARP; FEK: Fracción Excretada de Potasio. a Diferente del grupo control. b Diferente del grupo HE. Análisis realizados mediante Kruskal-Wallis, p < 0,05 y prueba de χ2, p < 0,05.
Discusión
En el presente estudio, se evaluó la concentración de las lipocalinas ORM1, NGAL y el complejo NGAL-MMP9 en suero como potenciales biomarcadores de sospecha diagnóstica de HAP. En ellos observamos una mayor concentración de ORM1 en suero en comparación con el grupo HE y Control (Figura 2a). Además, demostramos por primera vez una asociación positiva entre la concentración de ORM1 y la aldosterona plasmática, y también una asociación negativa con ARP (Figura 3). Ambos resultados son consistentes con la sospecha clínica de HAP, el cual estaría asociado a un mayor estado inflamatorio y a una activación de MR. A la fecha no existen publicaciones que asocien a ORM1 con parámetros bioquímicos de tamizaje de HAP. En este sentido, la diferencia de concentración de ORM1 entre los sujetos HAP vs HE (Figura 2) y su asociación con aldosterona, ARP y la ARR (Figura 3) incluso utilizando un tamizaje “permisivo” de HAP9, sugiere que la medición de esta proteína en sangre podría ser útil en la sospecha diagnóstica de HAP tanto clínica como subclínica (ej. en ausencia de aumento de la presión arterial o HTA).
Recientemente demostramos el aumento de ORM1 en vesículas extracelulares urinarias en sujetos con HAP mediante análisis proteómicos21. Los resultados del presente estudio son concordantes con ese reporte, sugiriendo que la medición de ORM1 tanto en suero como en EVs podría ser candidato como biomarcador temprano de HAP. ORM1 es una proteína de fase aguda asociada a riesgo cardiovascular, cuyo aumento en circulación se ha reportado en varias enfermedades37,38,39. Junto con ello, se ha descrito que el promotor del gen de ORM1 contiene regiones de unión a elementos regulatorios de la vía mineralocorticoide como MRE y Sp122,40 y que su expresión disminuye en presencia de antagonistas del MR como espironolactona41, sugiriendo que ORM1 podría ser un interesante biomarcador subrogado (“surrogate biomarker”) de la activación mineralocorticoide.
Similar a lo comentado para ORM1, diversos autores han reportado la proteína NGAL como un marcador de daño renal33,42,43,44,45 y un potencial marcador de la actividad mineralocorticoide33,46. En el presente estudio, no se observó diferencias significativas en la concentración sérica de NGAL ni NGAL-MMP9 entre los sujetos HAP, HE y Controles (Figura 2b y 2c). Como tampoco se observaron asociaciones significativas con variables críticas de HAP, como aldosterona, ARP y la ARR. Estudios previos han reportado que el promotor del gen de NGAL contienen regiones que son capaces de unirse al MR y que la expresión de NGAL estaría regulada por este receptor33. Sin embargo, otros factores estarían involucrados en la regulación de los niveles de NGAL, tal como el factor nuclear Kappa-B (NF-kB)47. Reportes previos han descrito una regulación antagónica a nivel transcripcional entre MR y NF-kB48, y cómo el desbalance entre estos dos factores (especialmente a nivel cardiaco) puede alterar la expresión de NGAL, reflejando que la regulación en los niveles plasmáticos de esta proteína sería compleja33. En esta misma publicación, el equipo de Laouche et al, observó que la infusión directa de aldosterona en murinos es incapaz de aumentar los niveles circulantes de NGAL, puesto que el incremento en los niveles de esta proteína sólo ocurre en ratones sometidos a nefrectomía, infusión de aldosterona y dieta rica en sal (NAS “challenge”)33. Otro reporte por Sun et al. revela que el tejido adiposo visceral sería también importante en los niveles y efectos de NGAL circulante en condiciones fisiopatológicas49. Basados en estos reportes, sugerimos que el aumento de NGAL y NGAL-MMP9 en sujetos con identificados como HAP puede ser multifactorial y su rol como potencial biomarcador en formas subclínicas de HAP es discutible. La exploración a futuro de los niveles de NGAL total podrían revelar quizás alguna asociación.
Dentro de las limitaciones del presente estudio se debe considerar que ninguno de los sujetos clasificados como HAP cuenta con una prueba confirmatoria, ya sea de sobrecarga salina, captopril o fludrocortisona, lo cual sería interesante evaluar a futuro en esta u otra cohorte de sujetos.
En conclusión, reportamos una mayor concentración de ORM1 circulante en sujetos con screening positivo de HAP, lo que concuerda con lo observado previamente en vesículas extracelulares urinarias21 y modelos animales de HAP. La asociación de ORM1 con parámetros bioquímicos de tamizaje de HAP, apoyan la utilidad de ORM1 en el desarrollo de un algoritmo diagnóstico de formas clínicas y subclínicas de HAP.
Referencias
- MINSAL. MdS. Primeros resultados Encuesta Nacional de Salud 2016- 2017. Departamento de Epidemiología, División de Planificación Sanitaria, Subsecretaría de Salud Pública. 2017.
- Pappachan JM and Buch HN. Endocrine Hypertension: A Practical Approach. Adv Exp Med Biol. 2017; 956: 215-237.
- Mulatero P, Stowasser M, Loh K-C, Fardella CE, Gordon RD, Mosso L, et al. Increased Diagnosis of Primary Aldosteronism, Including Surgically Correctable Forms, in Centers from Five Continents. The Journal of Clinical Endocrinology & Metabolism. 2004; 89: 1045-1050.
- Mosso L, Carvajal C, González A, Barraza A, Avila F, Montero Jn, et al. Primary Aldosteronism and Hypertensive Disease. Hypertension. 2003; 42: 161-165.
- Funder JW. Primary Aldosteronism: The Next Five Years. Horm Metab Res. 2017; 49: 977-983.
- Tomaschitz A, Pilz S, Ritz E, Obermayer-Pietsch B, Pieber TR. Aldosterone and arterial hypertension. Nat Rev Endocrinol. 2010; 6: 83-93.
- Funder JW, Carey RM, Mantero F, Murad MH, Reincke M, Shibata H, et al. The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016; 101: 1889-1916.
- Jackson RV, Lafferty A, Torpy DJ, Stratakis C. New genetic insights in familial hyperaldosteronism. Ann N Y Acad Sci. 2002; 970: 77-88.
- Vaidya A, Mulatero P, Baudrand R, Adler GK. The Expanding Spectrum of Primary Aldosteronism: Implications for Diagnosis, Pathogenesis, and Treatment. Endocr Rev. 2018; 39: 1057-1088.
- Brown JM, Robinson-Cohen C, Luque-Fernandez MA, Allison MA, Baudrand R, Ix JH, et al. The Spectrum of Subclinical Primary Aldosteronism and Incident Hypertension: A Cohort Study. Annals of internal medicine. 2017; 167: 630-641.
- Ito Y, Takeda R, Takeda Y. Subclinical primary aldosteronism. Best Pract Res Clin Endocrinol Metab. 2012; 26: 485-495.
- Stavropoulos K, Imprialos K, Papademetriou V, Faselis C, Tsioufis K, Dimitriadis K, et al. Primary Aldosteronism: Novel Insights. Curr Hypertens Rev. 2020; 16: 19-23.
- Ahmed KS, Bogdanet D, Abadi S, Dineen R, Boran G, Woods CP, et al. Rates of abnormal aldosterone/renin ratio in African-origin compared to European-origin patients: A retrospective study. Clin Endocrinol (Oxf). 2019; 90: 528-533.
- Eisenhofer G, Peitzsch M, Kaden D, Langton K, Pamporaki C, Masjkur J, et al. Reference intervals for plasma concentrations of adrenal steroids measured by LC-MS/MS: Impact of gender, age, oral contraceptives, body mass index and blood pressure status. Clin Chim Acta. 2017; 470: 115-124.
- Brown JM, Siddiqui M, Calhoun DA, Carey RM, Hopkins PN, Williams GH, et al. The Unrecognized Prevalence of Primary Aldosteronism: A Cross-sectional Study. Ann Intern Med. 2020; 173: 10-20.
- Yozamp N, Hundemer GL, Moussa M, Underhill J, Fudim T, Sacks B, et al. Intraindividual Variability of Aldosterone Concentrations in Primary Aldosteronism: Implications for Case Detection. Hypertension. 2021; 77: 891-899.
- Ohno Y, Sone M, Inagaki N, Kawashima A, Takeda Y, Yoneda T, et al. Nadir Aldosterone Levels After Confirmatory Tests Are Correlated With Left Ventricular Hypertrophy in Primary Aldosteronism. Hypertension. 2020; 75: 1475-1482.
- McCurley A, Jaffe IZ. Mineralocorticoid receptors in vascular function and disease. Molecular and cellular endocrinology. 2012; 350: 256-265.
- Gomez-Sanchez EP. Mineralocorticoid receptors in the brain and cardiovascular regulation: minority rule? Trends in endocrinology and metabolism: TEM. 2011; 22: 179-187.
- Schutten MT, Houben AJ, de Leeuw PW, Stehouwer CD. The Link Between Adipose Tissue Renin-Angiotensin-Aldosterone System Signaling and Obesity-Associated Hypertension. Physiology (Bethesda). 2017; 32: 197- 209.
- Barros ER, Rigalli JP, Tapia-Castillo A, Vecchiola A, Young MJ, Hoenderop JGJ, et al. Proteomic Profile of Urinary Extracellular Vesicles Identifies AGP1 as a Potential Biomarker of Primary Aldosteronism. Endocrinology. 2021; 162.
- receptor transactivation and DNA binding of a glucocorticoid response element within the serum/glucocorticoid-inducible protein kinase (sgk) gene promoter by the p53 tumor suppressor protein. Mol Endocrinol. 1997; 11: 312-329.
- Kolla V, Robertson NM, Litwack G. Identification of a mineralocorticoid/ glucocorticoid response element in the human Na/K ATPase alpha1 gene promoter. Biochem Biophys Res Commun. 1999; 266: 5-14.
- Berntsson J, Östling G, Persson M, Smith JG, Hedblad B, Engström G. Orosomucoid, Carotid Plaque, and Incidence of Stroke. Stroke. 2016; 47: 1858-1863.
- Fejes-Tóth G and Náray-Fejes-Tóth A. Early aldosterone-regulated genes in cardiomyocytes: clues to cardiac remodeling? Endocrinology. 2007; 148: 1502-1510.
- Hochepied T, Berger FG, Baumann H and Libert C. Alpha(1)-acid glycoprotein: an acute phase protein with inflammatory and immunomodulating properties. Cytokine Growth Factor Rev. 2003; 14: 25-34.
- Luo Z, Lei H, Sun Y, Liu X, Su DF. Orosomucoid, an acute response protein with multiple modulating activities. J Physiol Biochem. 2015; 71: 329-340.
- Buonafine M, Martinez-Martinez E, Jaisser F. More than a simple biomarker: the role of NGAL in cardiovascular and renal diseases. Clinical science (London, England: 1979). 2018; 132: 909-923.
- Cheng JM, Akkerhuis KM, Meilhac O, Oemrawsingh RM, Garcia-Garcia HM, van Geuns RJ, et al. Circulating osteoglycin and NGAL/MMP9 complex concentrations predict 1-year major adverse cardiovascular events after coronary angiography. Arterioscler Thromb Vasc Biol. 2014; 34: 1078-1084.
- Goff DC, Jr., Lloyd-Jones DM, Bennett G, Coady S, D’Agostino RB, Gibbons R, et al. 2013 ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014; 129: S49-73.
- Palazzuoli A, Ruocco G, Pellegrini M, De Gori C, Del Castillo G, Franci B, et al. Comparison of Neutrophil Gelatinase-Associated Lipocalin Versus B-Type Natriuretic Peptide and Cystatin C to Predict Early Acute Kidney Injury and Outcome in Patients With Acute Heart Failure. The American journal of cardiology. 2015; 116: 104-11.
- Kshirsagar AV, Coresh J, Brancati F and Colindres RE. Ankle brachial index independently predicts early kidney disease. Ren Fail. 2004; 26: 433-443.
- Latouche C, El Moghrabi S, Messaoudi S, Nguyen Dinh Cat A, Hernandez- Diaz I, Alvarez de la Rosa D, et al. Neutrophil gelatinase-associated lipocalin is a novel mineralocorticoid target in the cardiovascular system. Hypertension. 2012; 59: 966-972.
- Hemdahl AL, Gabrielsen A, Zhu C, Eriksson P, Hedin U, Kastrup J, et al. Expression of neutrophil gelatinase-associated lipocalin in atherosclerosis and myocardial infarction. Arterioscler Thromb Vasc Biol. 2006; 26: 136- 142.
- Campino C, Hill C, Baudrand R, Martínez-Aguayo A, Aglony M, Carrasco CA, et al. Usefulness and Pitfalls in Sodium Intake Estimation: Comparison of Dietary Assessment and Urinary Excretion in Chilean Children and Adults. Am J Hypertens. 2016; 29: 1212-1217.
- Whelton PK, Carey RM, Aronow WS, Casey DE Jr, Collins KJ, Dennison Himmelfarb C, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018; 71: e13-e115.
- Gornik O, Lauc G. Glycosylation of serum proteins in inflammatory diseases. Dis Markers. 2008; 25: 267-278.
- Turner GA. N-glycosylation of serum proteins in disease and its investigation using lectins. Clin Chim Acta. 1992; 208: 149-171.
- Kuroda Y, Kita Y, Shibukawa A, Nakagawa T. Role of biantennary glycans and genetic variants of human alpha1-acid glycoprotein in enantioselective binding of basic drugs as studied by high performance frontal analysis/ capillary electrophoresis. Pharm Res. 2001; 18: 389-393.
- Alam T, An MR, Mifflin RC, Hsieh CC, Ge X, Papaconstantinou J. transactivation of the alpha 1-acid glycoprotein gene acute phase responsive element by multiple isoforms of C/EBP and glucocorticoid receptor. The Journal of biological chemistry. 1993; 268: 15681-1568.
- Gravez B, Tarjus A, Jimenez-Canino R, El Moghrabi S, Messaoudi S, Alvarez de la Rosa D, et al. The diuretic torasemide does not prevent aldosteronemediated mineralocorticoid receptor activation in cardiomyocytes. PLoS One. 2013; 8: e73737.
- Mao S, Jiang T, Shang G, Wu Z, Zhang N. Increased expression of neutrophil gelatinase-associated lipocalin receptor by interleukin-1β in human mesangial cells via MAPK/ERK activation. Int J Mol Med. 2011; 27: 555-560.
- Bolignano D, Donato V, Coppolino G, Campo S, Buemi A, Lacquaniti A, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a marker of kidney damage. Am J Kidney Dis. 2008; 52: 595-605.
- Lalanne A, Beaudeux JL, Bernard MA. NGAL: a biomarker of acute and chronic renal dysfunction. Ann Biol Clin (Paris). 2011; 69: 629-636.
- Rhee H, Shin N, Shin MJ, Yang BY, Kim IY, Song SH, et al. High serum and urine neutrophil gelatinase-associated lipocalin levels are independent predictors of renal progression in patients with immunoglobulin A nephropathy. Korean J Intern Med. 2015; 30: 354-361.
- Tarjus A, Martinez-Martinez E, Amador C, Latouche C, El Moghrabi S, Berger T, et al. Neutrophil Gelatinase-Associated Lipocalin, a Novel Mineralocorticoid Biotarget, Mediates Vascular Profibrotic Effects of Mineralocorticoids. Hypertension. 2015; 66: 158-166.
- Bu DX, Hemdahl AL, Gabrielsen A, Fuxe J, Zhu C, Eriksson P, et al. Induction of neutrophil gelatinase-associated lipocalin in vascular injury via activation of nuclear factor-kappaB. Am J Pathol. 2006; 169: 2245- 2253.
- Kolla V and Litwack G. Inhibition of mineralocorticoid-mediated transcription by NF-kappaB. Arch Biochem Biophys. 2000; 383: 38-45.
- Sun WY, Bai B, Luo C, Yang K, Li D, Wu D, et al. Lipocalin-2 derived from adipose tissue mediates aldosterone-induced renal injury. JCI Insight. 2018; 3: e120196.