Variante celulas altas de cancer papilar de tiroides. Reporte de casos
Carolina Guarneri O1, Ulises Parada M1, Gabriela Mintegui R2, Ornela Rocha S3, Andrea Cristiani V4, Beatriz Mendoza T2, Luis Cazabán C1.
Tall Cell variant of papillary thyroid cancer. Case report
- Cirujano. Clínica Quirúrgica “A”. Facultad de Medicina. Hospital de Clínicas, Universidad de la República. Montevideo, Uruguay.
- Endocrinóloga. Clínica de Endocrinología y Metabolismo. Facultad de Medicina. Hospital de Clínicas, Universidad de la República. Montevideo, Uruguay.
- Residente. Anatomía Patológica. Facultad de Medicina. Hospital de Clínicas, Universidad de la República. Montevideo, Uruguay
- Anatomo patóloga. Anatomía Patológica. Facultad de Medicina. Hospital de Clínicas, Universidad de la República. Montevideo, Uruguay.
*Correspondencia: Carolina Guarneri O
carolaguarneri@gmail.com
Recibido: 17-09-2021
Aceptado: 05-11-2021
Resumen: El cáncer papilar constituye aproximadamente el 80% de todos los casos de cáncer de tiroides y el 85% de los tumores diferenciados. La variante de células altas representa el 1,3 al 12% del cáncer papilar siendo la variante agresiva más común de estos tumores. Posee un comportamiento agresivo, con mayor incidencia de invasión extratiroidea, linfovascular y metástasis a distancia, responsables de tasas de recurrencia más altas y peor pronóstico. Los casos aquí reportados reflejan las características que hacen sospechar mayor agresividad tumoral, desde el diagnóstico. Describimos dos pacientes de sexo femenino, entre 40 y 50 años, con historia de corta evolución, cuya presentación fue con síntomas de compresión locorregional y adenopatías metastásicas en cuello. Con hallazgos ecográficos e intraoperatorios de relevancia en cuanto la agresividad tumoral que hicieron sospechar la presencia de una variante agresiva del cáncer papilar. La histopatología de la variante de células altas posee una base molecular diferente respecto al papilar clásico que le confiere mayor morbi-mortalidad, constituyendo un factor de pronóstico independiente para la recurrencia. El tratamiento quirúrgico es la tiroidectomía total con vaciamiento profiláctico de los ganglios linfáticos centrales y eventualmente vaciamiento lateral de cuello según valoración preoperatoria, con posterior ablación postoperatoria de restos tiroideos mediante yodo radiactivo.
Palabras clave: Cáncer de tiroides agresivo; Cáncer papilar de tiroides; Recurrencia; Tratamiento; Variante a células altas.
Abstract: Papillary cancer constitutes approximately 80% of all thyroid cancer
cases and 85% of differentiated tumors. The tall cell variant represents 1.3 to 12%
of papillary cancers, being the most common aggressive variant of these tumors.
It has an aggressive behavior, showing a higher incidence of extrathyroid and lymphovascular
invasion and distant metastasis, responsible for higher recurrence rates
and a worse prognosis. The cases reported here reflect characteristics that make
us suspect tumor aggressiveness. These are female patients, between 40 and 70
years old, with a history of short evolution. They present locoregional symptoms or
metastatic adenopathies, with ultrasound and intraoperative findings of relevance
in terms of tumor aggressiveness that led to the suspicion of the presence of an
aggressive variant of papillary cancer. The histopathology of the tall cell variant has
a different molecular basis that confers its own morbidity and mortality, being an
independent prognostic factor for recurrence. Total thyroidectomy is recommended
with prophylactic dissection of the central lymph nodes and eventually lateral neck
dissection according to preoperative evaluation followed by postoperative ablation
with radioactive iodine.
Keywords: Aggresive thyroid cancer; Papillary thyroid cancer; Recurrence; Tall cell
variant; Treatment.
El cáncer diferenciado de tiroides representa el 90% de todos los tipos de cáncer tiroideos1. El cáncer papilar (CP) constituye aproximadamente el 80% de todos los casos de cáncer de tiroides y el 85% de los tumores diferenciados2. En general los CP se asocian a buena supervivencia, baja tasa de invasión local, recidivas o metástasis. Sin embargo, algunas variantes de éstos pueden comportarse de manera más agresiva con características clínicas, patológicas y moleculares propias. Estos subtipos histológicos se consideran según la American Thyroid Association (ATA) de mayor riesgo de recurrencia, metástasis y en algunas oportunidades con baja respuesta al tratamiento con radioyodo3. Entre las variantes más agresivas de CP se encuentran la esclerosante difusa, células altas, células columnares, patrón sólido y la de células prominentes en forma de tachuela4,5. La variante de células altas (VCA) se define como tal cuando éstas representan al menos el 30-50% del universo celular del tumor, siendo sus células al menos dos veces más altas que anchas, con abundante citoplasma eosinofílico6.
El objetivo es presentar tres casos clínicos de la variante a células altas, con similar manifestación clínica y hallazgos intraoperatorios cuya presentación hizo sospechar desde el inicio una variante agresiva.
Casos clínicos
Caso 1: Mujer, 39 años. Sana. Consulta por tumoración de cuello de meses de evolución. Presenta disfagia para sólidos, intermitente sin elementos de organicidad y episodios de disfonía, en eutiroidismo. Al examen buen estado general, nódulo palpable a izquierda, solidario al eje central de cuello, de 3 cm. Ecografía tiroidea que informa nódulo sólido, de 26x13 mm, hipoecogénico, heterogéneo con calcificaciones de 1-3 mm. Vascularización peri e intranodular. Adenomegalias cervicales bilaterales con pérdida del hilio graso, heterogéneas con calcificaciones. EUTIRADS5,7. Punción aspiración aguja fina (PAAF) BETHESDA VI, adenopatías positivas. Se realiza tiroidectomía total con vaciamiento central y lateral de cuello sin complicaciones. Del intraoperatorio se destaca tejido de aspecto fibrótico que retrae el recurrente izquierdo (Figura 1) y grueso componente fibrótico que engloba la vena yugular interna homolateral la cual se liga y reseca ante eventual compromiso tumoral. Respecto al informe anatomopatológico: carcinoma papilar multifocal con 40% de células de morfología tipo células altas. Áreas de efracción capsular con compromiso del tejido adiposo peritiroideo sin compromiso de la vena yugular.
Caso 2: Mujer, 49 años, sin antecedentes patológicos a destacar. Ingresa por cuadro de tres meses de evolución por tumoración de cuello de crecimiento rápido, dolorosa, acompañada por disfonía, en eutiroidismo. Al examen se destaca: nódulo en lóbulo tiroideo derecho, de 4 cm, firme. Ecografía que mostró glándula tiroides aumentada a expensas del lóbulo derecho, con nódulo sólido, de 34x29 mm, heterogéneo, con sectores marcadamente hipoecogénicos y microcalcificaciones. Sin claro plano graso de separación del nódulo con músculos infrahioideos a derecha, pero si del paquete vascular. No adenomegalias cervicales. EUTIRADS5. PAAF Bethesda VI. De la valoración preoperatoria se destaca parálisis de cuerda vocal derecha, con buena luz glótica. Se realizó tiroidectomía total con vaciamiento central y lateral derecho. Del procedimiento quirúrgico se destaca presencia de invasión de músculos infrahioideos, recurrente derecho y músculo liso de esófago y faringe. La anatomía patológica informó carcinoma predominantemente papilar, compuesto en 60% por células de 3 a 4 veces mayor altura que ancho. (Figura 2) A nivel de la cápsula efracción capsular con invasión perineural; la lesión contacta con el margen cruento.
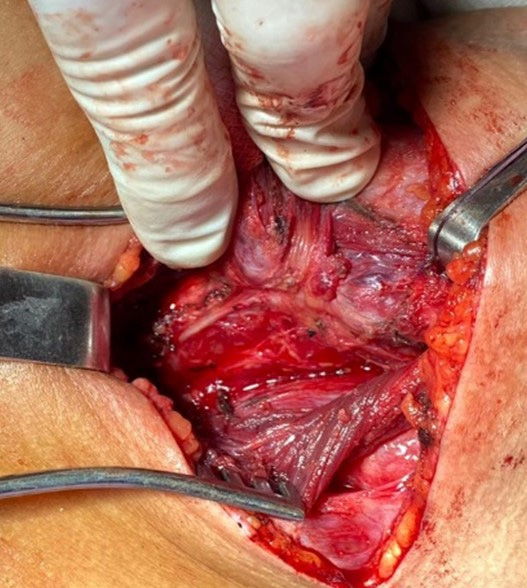 Figura 1: Se evidencia lóbulo tiroideo rebatido medialmente con importante
retracción recurrencial por fibrosis.
Figura 1: Se evidencia lóbulo tiroideo rebatido medialmente con importante
retracción recurrencial por fibrosis.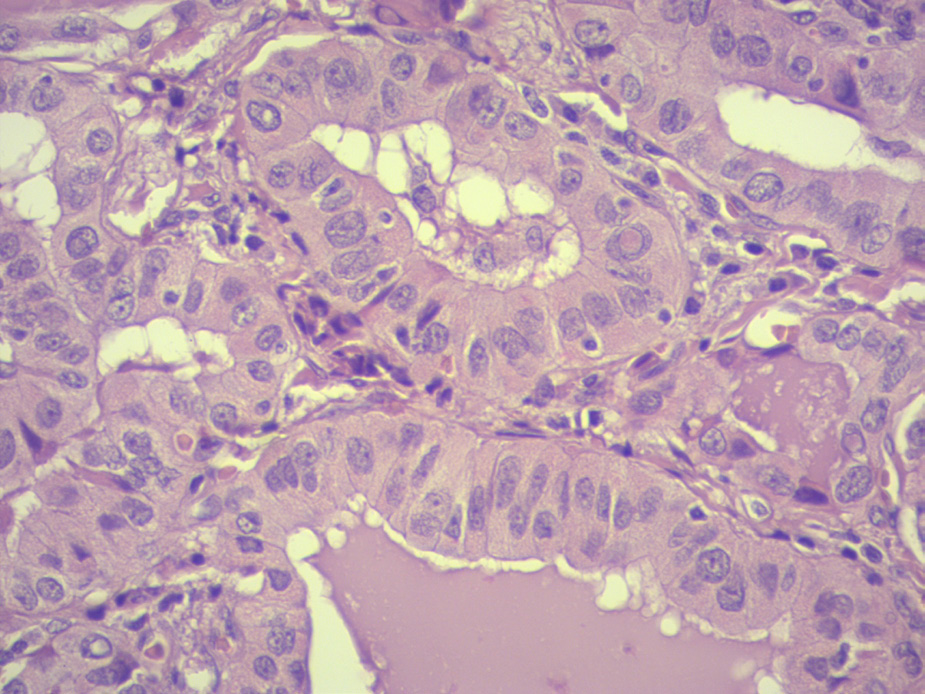 Figura 2: La figura muestra células tumorales tres veces más altas que anchas,
con un citoplasma eosinófilo granular y presencia de pseudoinclusiones,
características de esta neoplasia.
Figura 2: La figura muestra células tumorales tres veces más altas que anchas,
con un citoplasma eosinófilo granular y presencia de pseudoinclusiones,
características de esta neoplasia.Discusión
La incidencia global de cáncer de tiroides se encuentra en aumento. El carcinoma papilar generalmente sigue de curso clínico indolente, son una sobrevida a 5 años es del 98%. La variante de células altas representa el 1,3 al 12% de los CP, siendo la variante agresiva más común de los papilare carolinaguarneris. Posee un comportamiento agresivo, mostrando mayor incidencia de invasión extratiroidea (EET), linfovascular y metástasis a distancia, responsables de tasas de recurrencia más altas y peor pronóstico8. Desde el punto de vista histológico, se definen como tumores con estructura papilar revestida por células 2 o 3 veces más altas que anchas. Las células tumorales poseen abundante citoplasma eosinofílico. No existe consenso en cuanto al punto de corte de porcentaje de células de estas características que debe existir para ser catalogado como esta variante. Sin embargo, lo más aceptado es que el universo tumoral esté representado por más del 30-50% por células altas. Frecuentemente presentan evasión capsular. Múltiples trabajos describen la presencia de mayor compromiso ganglionar, EET e incluso metastásico (poco frecuente) en comparación del papilar clásico, lo que puede conferir un factor de riesgo independiente, con impacto en la evolución y sobrevida del paciente9. El compromiso del tracto aerodigestivo en el papilar es conocido hasta en el 7-16% de los casos. Los sitios incluyeron la endolaringe, tráquea, esófago, msculos infrahioideos y nervio laríngeo recurrente. Los patrones de invasión del tumor son comúnmente por extensión directa del tumor primario y menos comúnmente por extensión de ganglios linfáticos paratraqueales metastásicos10. El perfil molecular es variable, dentro de las mutaciones el papel fundamental es para el BRAFV600E con una prevalencia del 80% al 100%. Wong et.al.11 describen mayor frecuencia de mutaciones BRAF en casos con más del 50% de componente de células altas. Reordenamientos RET / PTC se han descrito en el 35,8% de los casos, en comparación al 17,2% del papilar clásico12.
Del punto de vista clínico, asienta frecuentemente en pacientes de sexo femenino, en la quinta década de vida, con un tamaño tumoral superior al papilar clásico pudiendo ser de manifestación sintomática mayor13 Respecto a la valoración ecográfica de estas lesiones, se proponen características ecográficas sugestivas: la presencia borde espiculado y microlobulado14.
En lo referente al tratamiento y según las recomendaciones de la ATA para las variantes agresivas del CP de tiroides se propone la tiroidectomía total con vaciamiento central de cuello en tumores T3 y T4. En el último caso, debe considerarse la necesidad de tratamiento ablativo con yodo15. La multifocalidad, la extensión extratiroidea, invasión vascular, metástasis ganglionar o sistémica y mutación BRAF, asocian características clínico-patológicas más agresivas y peor pronóstico que el CP clásico. Es así que algunos autores sugieren que en los CP a células altas de alto riesgo se justifica un tratamiento agresivo y mejores estrategias de seguimiento16.
Los casos comentados reflejan características que hacen sospechar agresividad tumoral. Se trata de pacientes de sexo femenino, entre 40 y 50 años, con historia de corta evolución. Presentan síntomas locorregionales o adenopatías metastásicas, con hallazgos ecográficos e intraoperatorios de relevancia en cuanto la agresividad tumoral que hicieron sospechar la presencia de una variante agresiva del CP.
Conclusión
Si bien el cáncer de tiroides podría considerarse el más “indolente” dentro de la patología oncológica, algunas variantes pueden tener una presentación y evolución de mayor agresividad. La histopatología de la variante de células altas posee una base molecular diferente que le confiere morbi-mortalidad propia, siendo un factor de pronóstico independiente para la recurrencia. Es recomendable la tiroidectomía total con vaciamiento profiláctico de los ganglios linfáticos centrales y eventualmente vaciamiento lateral de cuello según valoración preoperatoria seguida de ablación postoperatoria con yodo radiactivo.
Declaración de conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Referencias
- Carcinoma de tiroides de Sherman SI. Lanceta. 2003; 361: 501-511. doi: 10.1016 / S0140-6736 (03) 12488-9. [PubMed]
- Zhu X, Yao J, Tian W. Tecnología de microarrays para investigar genes asociados con el carcinoma papilar de tiroides. Mol Med Rep. 2015; 11: 3729-3733. [PubMed]
- Haugen BR, Alexander EK, Bible KC, et al. 2015 Directrices de manejo de la American Thyroid Association para pacientes adultos con nódulos tiroideos y cáncer de tiroides diferenciado: el grupo de trabajo de las Directrices de la American Thyroid Association sobre nódulos tiroideos y cáncer de tiroides diferenciado. Tiroides. 2016; 26: 1-133.
- Lam AK-Y, Lo CY, Lam KS-L. Carcinoma papilar de tiroides: una revisión clínico-patológica de las variantes histológicas de 30 años. Endocr Pathol. 2005; 16: 323-330. [PubMed]
- Y. Nikiforov, P. Biddinger, L. Thompson, Diagnostic Pathology. Molecular Genetics of the Thyroid. Second edition, Lippincott- Wolters Kluwer-2012.
- Romero A, Parra R, Chinchilla S, Reyes A. Thyroid pathology: differences and ontroversies between the pathology report and clinical interpretation. Part I: prognostic factors. Rev Colomb Cancerol. 2017; 21(3): 160-116.
- Russ G, Bonnema SJ, Erdogan MF, Durante C, Ngu R, Leenhardt L. European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur Thyroid J. 2017 Sep; 6(5): 225-237. doi: 10.1159/000478927. Epub 2017 Aug 8. PMID: 29167761; PMCID: PMC5652895
- Gunalp B, Okuyucu K, Ince S, Ayan A, Alagoz E. Impact of tall cell variant histology on predicting relapse and changing the management of papillary thyroid carcinoma patients. Hell J Nucl Med. 2017 May-Aug; 20(2): 122-127. doi: 10.1967/s002449910552. Epub 2017 Jul 12
- Nath MC, Erickson LA. Aggressive Variants of Papillary Thyroid Carcinoma: Hobnail, Tall Cell, Columnar, and Solid. Adv Anat Pathol. 2018 May; 25(3): 172-179. doi: 10.1097/PAP.0000000000000184
- Mintegui G; Del Pozo E, Mendoza B. Carcinoma papilar de tiroides, variante de células altas: reporte de caso / Papillary thyroid carcinoma, high cell variant: case report. Rev Chil Endo. 2020; 13(3): 105-109. Ilus Artigo em Espanhol | LILACS | ID: biblio-1117580
- Wong KS, Higgins SE, Marqusee E, Nehs MA, Angell T, Barletta JA. Tall cell variant of papillary thyroid carcinoma: impact of change in WHO definition and molecular nalysis. Endocr Pathol. 2019; 30:43-48.
- Coca-Pelaz A, Shah JP, Hernandez-Prera JC, Ghossein RA, Rodrigo JP, Hartl DM, et al. Papillary Thyroid Cancer-Aggressive Variants and Impact on Management: A Narrative Review. Adv Ther. 2020 Jul; 37(7): 3112-3128. doi: 10.1007/s12325-020-01391-1. Epub 2020 Jun 1.
- Cartwright S, Fingeret A. Contemporary evaluation and management of tall cell variant of papillary thyroid carcinoma. Curr Opin Endocrinol Diabetes Obes. 2020 Oct; 27(5): 351-357. doi: 10.1097/MED.0000000000000559
- Baek HJ, Kim DW, Shin GW, et al. Ultrasonographic features of papillary thyroid carcinomas according to their subtypes. Front Endocrinol (Lausanne) 2018; 9: 223.
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: the American Thyroid Association Guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid. 2016; 26: 1-133.
- Liu Z, Zeng W, Chen T, Guo Y, Zhang C, Liu C, Huang T. A comparison of the clinicopathological features and prognoses of the classical and the tall cell variant of papillary thyroid cancer: a meta-analysis. Oncotarget. 2017 Jan 24; 8(4): 6222-6232. doi: 10.18632/oncotarget.14055. Erratum in: Oncotarget. 2018 Mar 23; 9(22): 16271.