Estudio crítico del HOMA como método de pesquisa de resistencia insulínica en clínica
Ana María Salgado L1,2, Ana María Acosta3,4, Alberto Maiz G5, Pilar Vigil P6,7, Patricio Contreras C6,8.
A critical study of the HOMA test as a screening for insulin resistance
¹Biólogo.
2Laboratorio Fundación Médica San Cristóbal.
3Tecnólogo Médico
4Laboratorio de Nutrición, Pontificia Universidad Católica de Chile.
5Departamento de Nutrición y Diabetes, Pontificia Universidad Católica de Chile.
6Fundación Médica San Cristóbal.
7Unidad de Reproducción y Desarrollo, Departamento de Ciencias Fisiológicas, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile.
8Correspondencia a: Fundación Médica San Cristóbal, Luis Pasteur 5292, Vitacura. e-mail: pathomer@vtr.net
Recibido el 19 de Octubre, 2007.
Aceptado el 01 de Febrero, 2008.
Background: The hyperinsulinemic euglycemic clamp is the gold standard to measure directly insulin resistance. Unfortunately, the procedure is technically demanding, expensive and, unsuitable for clinical work. Clinicians are used to request an HOMA test (Homeostasis Model Assessment) to indirectly assess the presence of insulin resistance given that it is an inexpensive and readily performed test but it has several shortcomings. Aim: To study the diagnostic performance of the HOMA test as it is done in our country. Material and methods: We selected 32 women aged 32 ± 2 years and 18 men aged 42 ± 3 years. Half of them were categorized as insulin resistant by the Pancreatic Suppression Test with Octreotide, that is highly correlated with the euglycemic clamp but simpler to perform. Insulin was measured in two different laboratories in Santiago (Barnafi-Krause and Laboratorio de Nutrición, Universidad Católica) and HOMA results were calculated using serum fasting insulin and glucose levels. Results: The correlation coefficients between HOMA, calculated using insulin values of both laboratories, and the results of the pancreatic suppression test were 0.45 and 0.55 (p< 0.01). Only six of 25 subjects defined as insulin resistant by the pancreatic suppression test were detected with HOMA. Therefore, the sensitivity of the latter for insulin resistance was 24%. However all subjects defined as insulin resistant by HOMA (BK) had an abnormal pancreatic suppression test. Conclusions: Even though HOMA test was positively correlated with insulin resistance, it had a poor diagnostic sensitivity. Clinicians should be aware that the HOMA test is prone to under-diagnose the presence of insulin resistance.
La resistencia insulínica es un fenómeno de alta prevalencia en clínica1. Su pesquisa precoz permite implementar medidas eficaces para combatirla y así evitar o retrasar las múltiples patologías que derivan de ella.
La medición directa de la sensibilidad insulínica es compleja y poco aplicable a la clínica habitual por su alto costo y dificultad técnica. El estándar de oro de la medición de la sensibilidad insulínica es el clamp o pinza euglicémica hiperinsulinémica2. En él se induce, con insulina cristalina, una hiperinsulinemia suficiente para estimular la captación muscular de glucosa, a la vez que se mantiene fija la glicemia en el valor basal mediante el ajuste periódico de una infusión de glucosa. En estas condiciones, a mayor sensibilidad insulínica muscular, mayor será el consumo de glucosa exógena para evitar que la glicemia descienda de su valor basal. La técnica es de compleja ejecución, los algoritmos computacionales -que guían el ajuste periódico de la velocidad de infusión de la glucosa para mantener fija (“clampeada”) la glicemia en el valor basal- frecuentemente no dan el resultado esperado y, finalmente, el costo del procedimiento hace prohibitivo su uso en clínica. Nuestra experiencia con el clamp euglicémico3 es que es un procedimiento estrictamente de investigación.
Por su gran simplicidad y relativo bajo costo, se ha hecho enormemente popular el HOMA (Homeostasis Model Assessment), descrito en 1985 por un grupo de Oxford, Inglaterra4. Se sabe que la glicemia en ayunas es dependiente tanto de la resistencia tisular a la insulina como del déficit de secreción beta insular. Se construyó entonces un modelo matemático de las interacciones entre la insulinemia y la glicemia, partiendo de datos conocidos en fisiología humana. Los autores desarrollaron -a partir de este modelo- una prueba para estimar, con las concentraciones de glucosa e insulina en el suero en ayunas, tanto el grado de resistencia insulínica como el déficit en la secreción beta insular de insulina.
Una de las limitaciones más obvias del HOMA es su dependencia de la exactitud de las mediciones necesarias para su cálculo. Si bien la glicemia es una determinación muy confiable, la insulinemia no lo es, y el ensayo no ha podido ser estandarizado5. Con todo, el HOMA es profusamente informado en los laboratorios nacionales ya que, disponiendo de los valores de glicemia e insulinemia en ayunas, el calculo de la resistencia insulinica estimada es muy simple4: HOMA=glicemia en mg/dL * insulinemia en μU/mL / 405. Con el fin de determinar los limites normales del HOMA en una poblacion aparentemente no resistente a la insulina, un trabajo previo nacional determino los valores de HOMA en 120 sujetos jovenes de ambos sexos con indices de masa corporal normal y glicemias en ayunas y post sobrecarga oral a la glucosa normales6. Los autores usaron como tecnica para medir la insulina el radioinmunoensayo de DPC, probablemente el ensayo menos discutido dentro de las tecnicas comerciales. El valor promedio del HOMA fue de 1,96 ± 0,57 DE, fijando los autores el maximo normal en 2,53 (promedio mas 1DE). Sin embargo, este estudio no valido el HOMA contra una medicion directa de resistencia insulinica -vale decir, los autores no tenian prueba fehaciente de la ausencia de resistencia insulinica en los sujetos estudiados- sino que simplemente se baso en la aparente normalidad de la muestra, compuesta por sujetos normoglicemicos jovenes (19 a 40 anos) y de peso normal (indice de masa corporal de 16,9 a 23,9). Desafortunadamente, la triada de juventud, peso normal y normoglicemia, no descarta la presencia de resistencia insulinica. Ademas, al no contar con sujetos con resistencia insulinica conocida, no fue posible conocer el desempeno diagnostico de esta metodica para la pesquisa de resistencia insulinica.
Para superar las incertidumbres diagnosticas en resistencia insulinica, se implemento en la Fundacion Medica San Cristobal, la medicion directa de la sensibilidad insulinica con la Prueba de Supresion Pancreatica con Octreotido (PSPO), disenada originalmente por el grupo de Gerald Reaven en 1970 con epinefrina y propanolol, en vez de somatostatina u octreotido7.Esta tecnica es muy similar al clamp euglicemico con la diferencia que, a la vez de inducir una hiperinsulinemia exogena, se infunde glucosa en forma proporcional a la superficie corporal, mientras que se suprime la secrecion endogena de insulina con octreotido, un analogo de la somatostatina8. En estas condiciones la glicemia va variando a lo largo de la prueba (usualmente primero sube para luego descender) y los sujetos no-resistentes a la insulina exhiben una glicemia de equilibrio (GP, promedio de las ultimas 4 glicemias) menor de 150 mg/dL (> de 50 a < 150 mg/dL) los ultimos 30 minutos de las 3 horas de la prueba. Los resistentes a la insulina, por su parte, exhiben glicemias de equilibrio ≥ 150 mg/dL (caracteristicas del tercer tercil de una muestra representativa de la poblacion), hasta aproximadamente 400 mg/dL. La tecnica es muy reproducible, coeficiente de variacion <10%9; el coeficiente de correlacion con los resultados del clamp euglicemico es 0,9310 y en opinion de Ferrannini, constituye la mejor prueba despues del clamp11.
Sujetos y Metodos
350 sujetos de ambos sexos para determinar la presencia de resistencia insulínica y guiar la conducta terapéutica. Como el propósito de este estudio fue evaluar el desempeño diagnóstico del HOMA, se guardó a -20º C una muestra de suero obtenido al iniciar la PSPO, para la medición ulterior de insulina y cálculo del HOMA en un subgrupo de 50 sujetos de ambos sexos, la mitad de ellos resistente a la insulina (RI) de acuerdo a los resultados de la PSPO. De los 50 sujetos, 32 eran mujeres (32 ± 2 años) y 18 eran varones (41,7 ± 2,9 años). El predominio femenino refleja la composición global de los pacientes estudiados. De acuerdo a los resultados de la PSPO, de las mujeres 15 eran RI y 17 eran no-resistentes a la insulina (NRI); de los varones, 10 eran RI y 8 eran NRI.
La PSPO se realizó después de 12 horas de ayuno. Se colocó una vía venosa en el antebrazo para infundir una solución glucosada al 10% conteniendo octreótido e insulina cristalina.La superficie corporal se calculó por la fórmula de Dubois (√ (Peso (kg) * 100 * Estatura (m) / 3600). Se infundió octreótido (0,27 μg/m2/min), glucosa (267 mg/m2/min) e insulina cristalina (32 mU/m2/min) por 3 horas7 .Una segunda vía venosa se instaló en el otro antebrazo para obtener las muestras para monitorear las glicemias. La glicemia se determinó (con cinta y luego en el autoanalizador) cada 30 minutos (0-30-60-90-120 y 150 min) y luego cada 10 minutos (160-170 y 180 min) para el cálculo de la glicemia de equilibrio promedio (150-160-170 y 180 minutos, GP). Las GP menores de 150 mg/dL caracterizaron a los pacientes NRI; las GP iguales o mayores de 150 mg/dL permitieron el diagnóstico cuantitativo de RI.
Los sueros para la medición de insulina, fueron procesados en dos laboratorios, en un solo ensayo para evitar la variación interensayo. El Laboratorio de Nutrición de la Pontificia Universidad Católica de Chile procesó las muestras con un radioinmunoensayo de DPC (UC) y el Laboratorio Barnafi-Krause con una quimioluminiscencia Immulite de DPC (BK). El HOMA se calculó con la fórmula matemática simple tradicional4 y se consideró anormal cuando el valor era igual o mayor de 2,64. Los resultados se expresaron como promedio ± error estándar de la media (EE) y las comparaciones se hicieron con la prueba t de Student para muestras no pareadas o pareadas, según correspondió. Las correlaciones usaron el coeficiente de Pearson. El desempeño diagnóstico del HOMA se evaluó con análisis bayesiano: sensibilidad (porcentaje de RI con un HOMA patológico), especificidad (porcentaje de NRI con un HOMA normal), valor predictivo negativo (porcentaje de NRI en aquellos con un HOMA normal) y valor predictivo positivo (porcentaje de RI en aquellos con un HOMA patológico).
Resultados
Por diseño, el promedio ± EE de las GP fue significativamente mayor (p < 0,001, prueba t de Student) en los sujetos RI (243 ± 11,7 mg/dL; dispersión 158 a 375 mg/dl) comparado con los NRI (98 ± 6,6; dispersión 39 a 143 mg/dL). Intencionalmente se eliminó los pacientes con GP cercanas al límite de 150 mg/dL, dejando libre el tramo de 144 a 157 mg/dL para evitar la clasificación errónea de los sujetos. La edad promedio de los RI (33,7 ± 2,4 años) no fue distinta de la de los NRI (37,3 ±2,6 años, p= 0,319, NS). La GP estuvo positiva y significativamente correlacionada con el índice de masa corporal (IMC): r= 0,373, p=0,008. Las insulinemias UC fueron significativamente mayores que las insulinemias BK (8,6 ± 0,52 versus 6,2 ± 0,53 μU/mL, p=0,002, prueba t de Student pareada), pero, estuvieron significativamente correlacionadas entre si (r=0,745, p < 0,001).
Debido a que las insulinemias BK eran en promedio solo un 73,4% de las insulinemias UC, los valores de los HOMA-UC eran tambien mayores: 1,97 ± 0,14 (dispersion 0,88 a 5,89) versus 1,44 ± 0,13 (dispersion 0,40 a 5,21) para el HOMABK (p=0,007, prueba t de Student pareada). Los valores de HOMA-BK y HOMA-UC estuvieron significativamente correlacionados entre si (r=0,806, p <0.001), pero los primeros fueron en promedio, un 74,8% de los segundos. Ambos HOMA se correlacionaron positivamente y significativamente con la GP: HOMA-BK, r=0,52, p < 0.001 y HOMA-UC, r=0,459, p < 0,001. Ademas, ambos HOMA se correlacionaron positivamente y significativamente con el IMC: HOMA-BK, r=0,492 y HOMA-UC, r=0,552.
Valor diagnóstico del HOMA
HOMA-BK (Tabla 1)
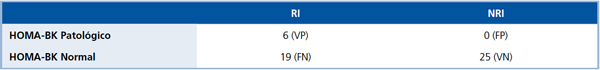
VP= Verdadero Positivo; FN= Falso Negativo; FP= Falso Positivo; VN= Verdadero Negativo. Sensibilidad= VP/(VP+FN)=24%; Especificidad= VN/(VN+FP)=100%; Valor Predictivo Positivo= VP/(VP+FP)=100%; Valor Predictivo Negativo= VN/(VN+FN)=56,82%.
La sensibilidad para pesquisar RI fue muy baja (24%) ya que sólo 6 de 25 sujetos RI tuvieron un HOMA-BK mayor de 2,6 (valor de corte generalmente usado). La especificidad alcanzó al 100% ya que los 25 sujetos NRI presentaron valores de HOMABK por debajo del valor de corte. Como todos los sujetos con un HOMA-BK resultaron ser RI en la PSPO, el Valor Predictivo Positivo del HOMA-BK fue de 100%. Pero, como 19 sujetos RI tuvieron un HOMA-BK normal (falsos negativos), el Valor Predictivo Negativo del HOMA-BK fue de sólo 56,8%. La más seria limitación de calcular el HOMA con la insulinemia de BK fue la baja sensibilidad, por lo que un 76% de los RI no fue pesquisado como tal.
HOMA-UC (Tabla 2)
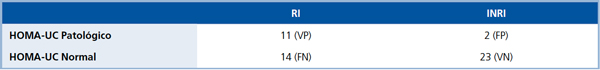 VP= Verdadero Positivo; FN= Falso Negativo; FP= Falso Positivo; VN= Verdadero Negativo.
VP= Verdadero Positivo; FN= Falso Negativo; FP= Falso Positivo; VN= Verdadero Negativo.
Sensibilidad= VP/(VP+FN)=44%; Especificidad= VN/(VN+FP)=92%; Valor Predictivo Positivo= VP/(VP+FP)=84,62%; Valor
Predictivo Negativo= VN/(VN+FN)=62,16%.
La sensibilidad para pesquisar RI del HOMA-UC fue mejor que la del HOMA-BK, ya que alcanzó el 44% al diagnosticar 11 de los 25 RI como tales. La especificidad fue alta (92%) ya que 23 de 25 sujetos NRI tuvieron un HOMA-UC normal (verdaderos negativos). El Valor Predictivo Positivo del HOMA-UC fue de un 86,4% ya que éste fue alto en 2 de 13 pacientes que eran NRI (falsos positivos). El Valor Predictivo Negativo del HOMA-UC fue de un 62,16% ya que 14 de 37 pacientes con un HOMAUC normal eran RI (falsos negativos). De nuevo, la más seria limitación del HOMA-UC fue una sensibilidad insuficiente, de 44%.
Discusión
El médico clínico asume que el HOMA es una prueba de pesquisa altamente correlacionada con los valores del clamp euglicémico, ya que en el reporte original4 los autores comunicaron un coeficiente de correlación entre el HOMA y los resultados del clamp de 0,88 en 23 sujetos (12 normales y 11 diabéticos). Posteriormente, la técnica fue validada por Bonora et al.12 en 115 sujetos con variados grados de sensibilidad insulínica y tolerancia a la glucosa, en los cuales el coeficiente de correlación entre el HOMA y el clamp euglicémico alcanzó la alta cifra de -0,82. Sin embargo, Reaven et al, comunicaron un coeficiente de correlación de 0,62 en 490 sujetos no diabéticos a los que se les midió la sensibilidad insulínica con la PSP con somatostatina13. Este valor es muy similar a los obtenidos en este trabajo con los dos HOMA estudiados (HOMA-BK, r =0,52, p < 0.001 y HOMA-UC, r =0,459, p < 0,001). En un trabajo posterior, el mismo autor hizo una transformación logarítmica del HOMA y lo correlacionó con la GP en sujetos de peso normal, con sobrepeso y en obesos y los coeficientes de correlación respectivos fueron de 0,36, 0,55 y 0,60, respectivamente. En nuestros pacientes hicimos una transformación logarítmica de los valores del HOMA y las correlaciones respectivas fueron: HOMA-BK, r =0,357 y HOMA-UC, r =0,477, muy similares a las correlaciones obtenidas sin esta transformación. Más aún, en un trabajo reciente de Diamanti-Kandarakis en portadoras del Síndrome de Ovario Poliquístico, no hubo correlación significativa entre el HOMA y los valores del clamp14. Todo lo anterior pone en duda las bondades de un HOMA patológico como medición sustituta de resistencia insulínica, siendo importante conocer sus limitaciones. Además, el HOMA evalúa la resistencia insulínica de un sujeto en ayunas y no determina lo que sucede cuando se induce una hiperinsulinemia, que es una situación más exigente en la definición del trastorno patológico.
La medición de insulina con kits de radioinmunoensayo de DPC (Diagnostic Products Corporation) ha sido aceptada en trabajos publicados por el New England Journal of Medicine y puede esperarse una cierta superioridad sobre los ensayos automatizados con quimioluminiscencia, aún del mismo DPC.
En los dos HOMA analizados, el principal problema fue la errónea clasificación de los pacientes RI (como NRI), a la vez que los sujetos NRI fueron en general, bien clasificados. El problema es que el HOMA se usa para afirmar o descartar una impresión clínica de resistencia insulínica, pero con los resultados de este estudio debe tenerse presente que con su aplicación se puede subdiagnosticar la resistencia insulínica. En estas circunstancias, los clínicos deben recurrir a otros marcadores de resistencia insulínica, tanto clínicos como de laboratorio15. Si nos preguntamos por qué nuestros resultados del HOMA son inferiores a los publicados por el grupo de Bonora et al.12 quizás la respuesta más sensata es que en este trabajo se replicó la situación clínica usual, con los laboratorios a los que el clínico puede acceder en su actividad diaria, alejada de la situación de un estudio académico, con estricto manejo de las técnicas de medición, especialmente del ensayo de insulina. La otra posibilidad, que los resultados de la PSPO sean poco confiables, es menos probable ya que ésta es una técnica ampliamente validada10,13, realizada por nosotros en forma idéntica a lo publicado por sus autores, en la que tenemos una experiencia de 3 años publicada16 y que, además, descansa exclusivamente en la medición automatizada de glicemias en el autoanalizador, ya que no requiere de la medición de insulina.
En síntesis, este trabajo sugiere que el HOMA —tal como se ejecuta en nuestro país— subdiagnostica el fenómeno de resistencia insulínica, hecho que debe estar en conocimiento de los clínicos interesados en el tema. Por su simplicidad, el HOMA puede ser un buen método en estudios de poblaciones o en el seguimiento de un paciente que haya presentado un valor elevado, pero tiene limitaciones para un diagnóstico más acucioso del trastorno de resistencia insulínica.
Referencias
- Contreras P, Mella I, Aguirre C, Zura ML, Pérez J 1993. Insulina resistencia, un fenómeno frecuente en clínica. Rev Méd Chile 121: 184–196.
- DeFronzo RA, Tobin JD, Andres R. 1979. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 237: E214–E223.
- Contreras P, Villanueva CL, Calvillán N, Morales H, Mella I, Pérez J, et al. 1991. Sensibilidad a la insulina: ausencia de diferencias sexuales al expresarla en función de la masa magra. Rev Méd Chile 119: 5-10.
- Matthews D, Hosker J, Rudenski A, Naylor B, Treacher D, Turner R.1985. Homeostasis model assessment: insulin resistance and B-cell function from fasting glucose and insulin concentrations in man. Diabetologia 28: 412-419.
- Marcovina S, Bowsher RR, Miller WG, Staten M, Myers G, Caudill SP, Campbell SE, et al (Insulin Standardization Work Group) 2007. Standardization of insulin immunoassays: report of the American Diabetes Association Workgroup. Clin Chem 53: 711-716.
- Acosta AM, Escalona M, Maiz A, Pollack F, Leighton F. 2002. Determinación del índice de resistencia insulínica mediante HOMA en una población de la Región Metropolitana de Chile. Rev Méd Chile 130: 1227-1231.
- Shen SW, Reaven GM, Farquhar JW. 1970. Comparison of impedance to insulin-mediated glucose uptake in normal subjects and in subjects with latent diabetes. J Clin Invest 49:2151-2160.
- Pei D, Jones CNO, Bhargava R, Chen YDI, Reaven GM. 1994. Evaluation of octreotide to assess insulin-mediated glucose disposal by the insulin suppression test. Diabetologia 37:843–845.
- Facchini F, Humphreys MH, Jeppesen J, Reaven GM. 1999. Measurements of insulin-mediated glucose disposal are stable over time. J Clin Endocrinol Metab 84:1567-1569.
- Green.eld MS, Doberne L, Kraemer F, Tobey T, Reaven G. 1981. Assessment of insulin resistance with the insulin suppression test and the euglycemic clamp. Diabetes 30:387-392.
- Ferrannini E, Mari A. 1999. How to measure insulin sensitivity. J Hypertens 16: 895-906.
- Bonora E, Targher G, Alberiche M, Bonadonna R, Saggiani F, Zerene MB, et al. 2000. Homeostasis model assessment closely mirrors the glucose clamp technique in the assessment of insulin sensitivity. Diabetes Care 23: 57-63.
- Yeni-Komshian H, Carantoni M, Abbasi F, Reaven GM. 2000. Relationship between several surrogate estimates of insulin resistance and quantification of insulin-mediated glucose disposal in 490 healthy nondiabetic volunteers. Diabetes Care 23: 171–175.
- Diamanti-Kandarakis E, Kouli C, Alexandraki K, Spina G. 2004. Failure of mathematical indices to accurately assess insulin resistance in lean, overweight, or obese women with polycystic ovary syndrome. J Clin Endocrinol Metab 89: 1273-1276.
- Contreras P. 2003. El síndrome de ovario poliquístico no es sinónimo de resistencia insulínica. Rev Colomb Menopausia 9: 203–212.
- Vigil P, Contreras P, Alvarado JL, Godoy A, Salgado AM, Cortés ME. 2007. Evidence of subpopulations with different levels of insulin resistance in women with polycystic ovary syndrome. Hum Reprod 22:2974-2980.