La terapia hormonal de reemplazo en la post menopausia después del estudio WHI
Dr. Eugenio Arteaga Urzúa
Departamento de Endocrinología,
Escuela de Medicina,
Pontificia Universidad Católica de Chile
Desde la publicación en el año 2002 de la primera rama del estudio Women`s Health Initiative (WHI)1, la terapia hormonal (TH) de reemplazo ha estado sujeta a gran controversia, la que aún continúa. Siguen publicándose artículos que destacan los riesgos de la TH y otros que resaltan sus beneficios.
¿Dónde está la verdad en esta controversia? ¿Tiene algún lugar la TH en el tratamiento de la mujer climatérica? Estas y otras interrogantes relacionadas serán analizadas en este artículo, partiendo del estudio WHI, en sus dos ramas, que constituye la mayor investigación realizada hasta la fecha sobre TH y que probablemente nunca será repetido por el alto costo económico involucrado.
1. Evidencia epidemiológica anterior al WHI
Los estudios observacionales de los últimos 30 años sugerían que la TH se asociaba a reducción de la enfermedad coronaria, de las fracturas de cadera y de otras localizaciones y del cáncer colo-rectal, pero con incremento del riesgo de accidente cerebro-vascular (ACV), de embolia pulmonar (EP) y de cáncer de mama. Los beneficios aparecían superando largamente a los riesgos2 (Figura 1).
Respecto al riesgo de enfermedad cardio-vascular (ECV), el análisis combinado de múltiples estudios de tipo observacional sugería que las mujeres que tomaban estrógenos después de la menopausia reducían en 35 a 50% el riesgo de desarrollar ECV, en comparación con las que no los tomaban3. El estudio de las Enfermeras Norteamericanas constituye el proyecto observacional prospectivo de mayor potencia por el gran tamaño de la muestra y su duración de 20 años4. En él, de 70.533 mujeres postmenopáusicas sin ECV, las usuarias de TH, en comparación con que las que nunca la recibieron, mostraron disminución de 39% de los eventos coronarios mayores (RR 0,61; 0,52-0,71).
Considerando que la ECV es la primera causa de muerte en el mundo occidental, esta notoria reducción del riesgo CV hizo recomendar entusiastamente el uso de TH.
2. Resultados principales del estudio WHI
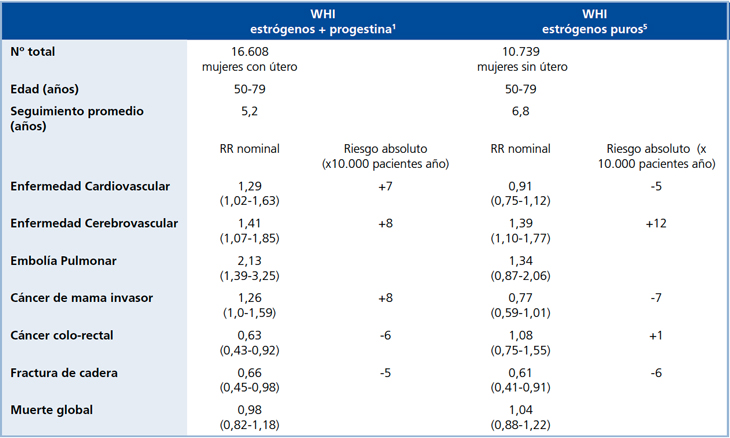
La Tabla 1 muestra los principales resultados de ambas ramas del estudio WHI. En la primera rama1 se estudió a 16.608 mujeres postmenopáusicas de 50 a 79 años de edad, divididas al azar en un grupo placebo y otro que recibió TH (estrógenos conjugados equinos [ECE] 0,625 mg y acetato de medroxiprogesterona [AMP] 2,5 mg, en esquema combinado continuo), demostrándose en los distintos objetivos estudiados, la misma tendencia de los estudios observacionales, a excepción del riesgo de enfermedad cardiovascular (ECV) que aumentó en 29% en el estudio WHI mientras se reducía entre 30 y 50% en los observacionales previos (Figura 1).
La segunda rama del estudio WHI5 estudió a 10.739 mujeres postmenopáusicas de 50 a 79 años, histerectomizadas, que recibieron estrogenoterapia sola (0,625mg de ECE) o placebo. Lo interesante de este grupo es que, a diferencia de la rama 1, los riesgos cardiovascular, de cáncer de mama y de embolia pulmonar no fueron diferentes al propio del grupo control, apuntando así a que la progestina, y específicamente la medroxiprogesterona utilizada en la primera rama del estudio, pudiera ser causante o facilitadora del aumento de riesgo de las tres patologías antes mencionadas6.
3. Comparación de las poblaciones ingresadas a los estudios observacionales y la primera rama del estudio WHI
Se han hecho muchos intentos para explicar la divergencia entre los resultados de estudios observacionales y la primera rama del estudio WHI7. En la Tabla 2 se resumen las mayores diferencias entre las pacientes del estudio observacional de las Enfermeras Norteamericanas y el WHI. Se observa que la edad de las mujeres del estudio WHI era mayor, con más de 10 años de postmenopausia en promedio; también eran más obesas, más fumadoras y utilizaron TH en esquema combinado continuo en contraste con el predominio de estrogenoterapia pura en el estudio de las Enfermeras. Como se mencionara, la segunda rama del estudio WHI demostró que la terapia estrogénica sola tenía menores riesgos que la TH combinada continua (Tabla 1).
4. Riesgo cardiovascular
El impacto de la TH sobre el riesgo cardiovascular es el aspecto de mayor controversia. La protección otorgada por la TH en los estudios observacionales (30-50%) contrasta con el 29% de incremento de riesgo comunicado en la primera rama del estudio WHI. ¿Qué explicaciones se han dado para esta diferencia? Para comprender este aspecto es importante analizar la Tabla 3 que presenta los principales mecanismos de protección cardíaca y los potenciales efectos adversos de los estrógenos, y la Figura 2 que grafica una posible explicación respecto a la importancia de la edad de inicio de la TH sobre el riesgo CV final. La edad y los años que han transcurrido desde la menopausia son factores que pueden modificar la acción de las hormonas sobre la enfermedad coronaria. Las mujeres norteamericanas, como las del estudio WHI, a los 35 años suelen tener en sus coronarias solo estrías lipídicas y mínimas placas ateroscleróticas8. Entre los 45 a 55 años de edad hay progresión activa de las lesiones ateroscleróticas en las coronarias9 y en las mayores de 65 años, estas lesiones empiezan a presentar complicaciones10. Es posible postular que en esta última etapa los efectos proinflamatorios y protrombóticos de la TH pueden predominar favoreciendo la complicación de las placas. En las más jóvenes, en cambio, la TH podría ser beneficiosa por los efectos lipídicos y endoteliales favorables de la TH, en ausencia de lesiones ateroscleróticas susceptibles de poder alterar.
En el mismo sentido, en mujeres con enfermedad cardiovascular establecida, la respuesta de vasodilatación mediada por flujo no difiere entre las usuarias de TH y las controles11; en las mujeres sin enfermedad coronaria ni factores de riesgo CV mayores, en cambio, el uso de TH se asocia a 40% de aumento en la vasodilatación respecto de las mujeres controles12. El estudio Estrogen in the Prevention of Atherosclerosis Trial (EPAT) aporta evidencia en este mismo sentido. En mujeres sanas sometidas a terapia estrogénica pura la progresión de aterosclerosis carotidea fue menor que en el grupo control sin tratamiento13.
Esta misma hipótesis ha sido corroborada en un modelo animal. En monas ooforectomizadas, aquellas que usan precozmente TH desarrollan 50% menos de placas coronarias en comparación con las controles; si la sustitución se inicia 2 años más tarde, lo que equivale a 6 años en humanos, la TH no detiene la progresión de las placas ateroscleróticas14.
Esta hipótesis también ha sido reafirmada por un análisis secundario del estudio WHI combinando las participantes de las dos ramas15. En él se estudió si el efecto de la TH sobre el riesgo CV variaba dependiendo de la edad de la mujer al inicio de la terapia, ya sea con terapia combinada continua o con estrógenos solos. Se comprobó que el riesgo CV aumentaba significativamente a mayor edad de inicio de la TH (Tabla 4).
Más aún, la segunda rama del WHI, en su publicación original5, sugería claramente que la estrogenoterapia pura tendía a ser protectora de enfermedad coronaria cuando la TH se iniciaba entre los 50-59 años (RR 0,56; 0,30-1,03), lo que estuvo al borde de la significancia estadística. En las mujeres que iniciaban mas tarde la TH, este beneficio desaparecía: entre 60-69 años (RR 0,92; 0,69-1,23) y entre 70-79 años (RR 1,04; 0,75-1,44). Debido a estos hallazgos, los investigadores responsables del estudio WHI decidieron hacer un sub estudio de seguimiento de la segunda rama -el estudio WHI-CACS- respecto del grupo de mujeres que había iniciado la estrogenoterapia sola entre los 50 y 59 años16. El universo fue de 1064 mujeres quienes habían recibido estrógeno o placebo por un promedio de 7.4 años y que llevaban 1.3 años desde el final del protocolo. En todas se realizó una tomografía computada de corazón para medir el contenido de calcio en las coronarias (“score” Agastston), medida que es un exponente de aterosclerosis de esas arterias. Se demostró que el “score” promedio fue significativamente menor en las mujeres con TH, lo que sugería protección cardiaca, respecto de las que recibieron placebo (“score” de 83,1 vs 123,1; p=0.02).
En conclusión, el efecto CV de la TH depende de la edad de su inicio, siendo protectora en las más jóvenes. También importa el uso o no de progestina, dado que la estrogenoterapia pura demostró un mejor impacto CV que aquella asociada a medroxiprogesterona. Estos resultados son importantes para elegir adecuadamente la mejor candidata a TH y seleccionar la TH más apropiada.
5. Otros riesgos cardiovasculares
El estudio WHI en sus dos ramas confirmó los hallazgos de los estudios observacionales relativo al aumento de riesgo de ACV y embolia pulmonar asociado a TH combinada o a estrogenoterapia pura17. Si se comparan las dos ramas del estudio WHI (Tabla 1), en ambas hubo aumento de ACV: (RR 1,41; 1,07-1,85) para la terapia combinada y (RR 1,39; 1,10-1,77) para los estrógenos solos. Sin embargo, respecto a embolia pulmonar, sólo hubo aumento significativo de eventos (RR 2,13; 1,39-3,25) en la primera rama con TH combinada continua y no en la segunda rama con estrógenos solos (RR 1,34; 0,87-2,06); ello enfatiza el concepto de que la asociación con progestinas puede potenciar el riesgo atribuible a la estrogenoterapia oral. Es importante destacar que otros estudios han demostrado que la TH vía transdérmica no incrementa el riesgo de enfermedad tromboembólica18, probablemente debido a que la ausencia de la primera pasada hepática evita el aumento de factores de coagulación y de la proteina C reactiva, propios de la vía oral que ingresa al hígado por vía portal (Tabla 3). De estos hallazgos puede concluirse que el riesgo de embolia pulmonar depende del uso de progestina y de la vía de administración de estrógenos.
6. Riesgo de cáncer de mama
El riesgo de cáncer de mama es el factor más determinante del temor de las pacientes y de la reticencia de sus médicos a utilizar TH y, especialmente, a prolongar dichos tratamientos. Para su mejor comprensión, es importante poner en perspectiva los hallazgos del estudio WHI. Los estudios observacionales y la primera rama del estudio WHI coincidían en demostrar un aumento moderado del riesgo de cáncer de mama invasor con TH (Figura 1). En el caso del estudio WHI, este incremento tuvo un RR 1,26 (1,0-1,5) cifra que aunque estuvo al borde de la significancia estadística, fue considerada como significativa por los autores de la publicación1. En términos de incremento absoluto, ello representa 8 pacientes extras con carcinoma mamario por cada 10.000 mujeres expuestas al tratamiento por cada año de uso. Según los autores1, este aumento se hacía significativo al cabo de 5 años de terapia. Sin embargo, si se analizan en detalle los resultados, se puede observar que un 26,1% de las pacientes que recibieron TH combinada habían estado expuestos a TH previo al estudio (6,4% eran usuarias actuales y 19,7% ex usuarias) por períodos variables de tiempo (1/3 por más de 5 años); sólo en dicho grupo hubo aumento significativo del riesgo de cáncer de mama a los 5 años. Ello implica que el riesgo de cáncer de mama se inicia bastante después de los 5 años comunicados en el resumen del trabajo.
Es importante destacar que los principales factores modificables de riesgo de cáncer de mama en la postmenopausia son la obesidad y la ingesta de alcohol, con tasas de incremento muy superiores a aquel asociado a TH.
Otro aspecto destacado es lo sucedido con la segunda rama del estudio WHI (Tabla 1). En ella la estrogenoterapia sola se asoció a reducción del riesgo de cáncer de mama al cabo de 6,8 años de tratamiento (RR 0,77; 0,59-1,01), lo que estuvo al borde de la significancia estadística. Ello pone nuevamente de relieve el riesgo mamario que agrega la progestina a la TH, específicamente la medroxiprogesterona.
Esta menor incidencia de cáncer de mama con estrogenoterapia pura en los primeros años de uso y el incremento de esta patología en las usuarias por mayor tiempo merece una mejor explicitación. Esto es lo que intentan hacer Santen y Allred en una publicación reciente19. Ellos proponen que debe haber una cantidad importante de cáncer mamario preexistente en mujeres que inician TH en la postmenopausia (entre 5 a 10%) y que el uso de estrogenoterapia por tiempo corto se asociaría a apoptosis de las células malignas inducida por la hormona. Tradicionalmente se ha considerado que los estrógenos se asocian a respuesta proliferativa en la mama y reducción de la tasa de apoptosis celular. Sin embargo, estudios in vitro han evidenciado que las células de cáncer mamario dependiente de hormonas y que han sido privadas de estrógenos por 6 a 24 meses, sufren procesos adaptativos que hacen que la reposición de estrógenos en el medio induzca apoptosis de ellas20. Si esta hipótesis es correcta quiere decir que la TH en mujeres privadas de estrógenos, tanto en el estudio WHI como en el de las enfermeras, habría inducido apoptosis, reducción y, eventualmente, erradicación de tumores mamarios ocultos, explicando la menor detección de cáncer en los primeros 5 a 9 años de estrogenoterapia pura. En contraste, el uso más prolongado de estrógenos pudiera favorecer la iniciación y promoción de tumores de novo, ya sea por aumento de la expresión de genes proliferantes de cáncer de mama o por acción genotóxica de algunos metabolitos de los estrógenos, tales como el 4-OH-estradiol. Esta hipótesis deberá ser confirmada o rechazada, pero parece atractiva para entender la aparente paradoja entre las dos ramas del estudio.
7. Efectos óseos
El beneficio sobre el sistema esquelético de los estrógenos se sustenta en el conocimiento de la fisiopatología de la osteoporosis postmenopáusica. Los estudios epidemiológicos observacionales también sugerían reducción del riesgo de fracturas (Figura 1). Sin embargo, fue el estudio WHI el que terminó por confirmar este beneficio. Si analizamos la protección respecto de la fractura de cadera, uno de los objetivos más “duros” de cualquier terapia para la osteoporosis, los estrógenos mostraron efectividad equivalente en ambas ramas del WHI y muy semejante a la comunicada para otros antiresortivos como alendronato21. En otro estudio con alendronato, en 3.658 mujeres con fractura vertebral previa o con osteoporosis de cuello femoral, esta droga redujo en 53% el riesgo de fractura de cadera en comparación al grupo control (RR 0,47; 0,26-0,79)22.
El risedronato aparece como menos potente que los estrógenos. En 5.445 mujeres con osteoporosis (T “score” entre -3 y -4 en cuello femoral, más un factor de riesgo no esquelético de fractura de cadera) de 70 a 79 años de edad, el uso de risedronato durante 3 años redujo el riesgo de fractura de cadera en 40% (RR 0,6; 0,4-0,9) en comparación a placebo. Sin embargo, en otro grupo de 3.886 mujeres mayores de 80 años, seleccionado por factores de riesgo de fractura de cadera distintos que la baja densidad mineral ósea, risedronato no previno la fractura de cadera. Esto último contrasta con la población del WHI, no seleccionada por osteoporosis y más joven, en el que ambas ramas se asociaron a reducción precoz y significativa de dicho riesgo en 34% para TH combinada y 39% en estrogenoterapia sola (Tabla 1).
En resumen, podríamos concluir que la TH es más efectiva que risedronato en la prevención de fractura de cadera y es equivalente con respecto al alendronato.
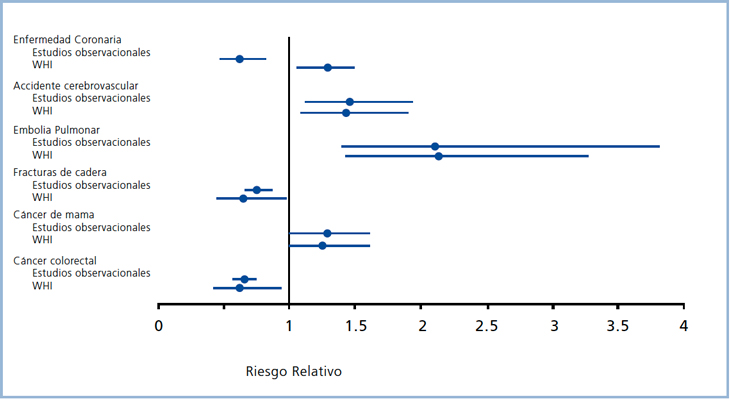
Figura 1. Relación entre la TH de la postmenopausia y varios objetivos clínicos en los estudios observacionales y en el estudio WHI con estrógenos más progestinas17
Tabla 1. Principales resultados del estudio WHI1,5.
8. Impacto sobre la calidad de vida
Este es un punto muy importante y frecuentemente mal analizado. Sin duda, la menopausia sintomática se asocia a deterioro de varios parámetros de calidad de vida. Tanto es así, que actualmente se le considera como una de las indicaciones más importantes de TH. El estudio WHI, que por definición ingresó sólo a mujeres asintomáticas, no demostró que la TH se asociara a mejoría de la calidad de vida, conclusión que era esperable23. Sin embargo, está establecido que la TH puede mejorar la calidad de vida al controlar los síntomas vasomotores e influir positivamente en el ánimo24. En mujeres asintomáticas no hay consenso respecto a los beneficios de la TH sobre su calidad de vida25.
Conclusiones y recomendaciones actuales
A pesar de las serias críticas al diseño y ejecución del estudio WHI, en especial por haber incorporado mujeres añosas que no son el objetivo primario de la TH, sus resultados han sido ampliamente difundidos, y también criticados. El impacto del estudio WHI fue devastador para la terapia hormonal de la postmenopausia. De una época pre WHI de gran optimismo por los múltiples beneficios asociados a TH, se pasó a un abandono generalizado de la terapia por miedo a sus efectos adversos. Una recomendación reciente de la North American Menopause Society (NAMS) concluye que “la evidencia actual apoya el uso de TH o estrogenoterapia para el tratamiento de los síntomas asociados a la menopausia y en la prevención de algunas enfermedades en poblaciones apropiadas ya sea en la peri o postmenopausia” 25.
Para el futuro, se espera la aparicion del estudio KEEPS26, proyecto multicentrico de 5 anos de duracion, aleatorio, doble ciego, placebo-control, que evaluara el efecto de TH sobre el desarrollo de aterosclerosis carotidea y coronaria en 720 mujeres norteamericanas de 42 a 58 anos con 6 a 36 meses de amenorrea. El estudio comenzo el ano 2005 y se espera que finalice en 2010. Se utilizan 2 esquemas: dosis bajas de ECE (0,45 mg/d) asociado a progesterona micronizada (PM) ciclica (200 mg/d por 12 dias), o estradiol transdermico (50 μg/d) asociado a PM ciclica (200 mg/d por 12 dias). Se evaluara en forma no invasiva la progresion de aterosclerosis en carotidas y coronarias, la funcion cognitiva y la calidad de vida (que incluye animo, fatiga, caracteristicas del sueno y la funcion sexual). Si bien este estudio no evaluara eventos cardiovasculares, se espera que su contribucion sea importante para esclarecer muchas incognitas dejadas por el estudio WHI.
Todas las evidencias analizadas en este trabajo dan sustento a las readecuaciones que se están estructurando en relación a la TH de la postmenopausia, los cuales se reseñan a continuación:
1. El inicio de TH debe ser en pacientes peri y posmenopáusicas recientes y sintomáticas
2. Uso de dosis hormonales reducidas27
3. Mayor utilización de la vía transdérmica
4. Cambio de progestinas. La medroxiprogesterona, altamente criticada por los hallazgos del estudio WHI, ha cedido terreno a otras progestinas agonistas puras del receptor de progesterona.
5. La duración de la terapia está sujeta a controversia. Algunos prefieran recomendar TH por el menor tiempo posible. Otros autorizan su uso por 5-7 años sin restricciones, con controles mamográficos anuales. Sin embargo, hay pacientes que podrían requerir TH prolongada. De acuerdo a la NAMS24 las siguientes podrían ser indicaciones de TH prolongada, siempre que la paciente este advertida de los riesgos y beneficios de esta decisión y dispuesta al control médico periódico:
• Para mujeres que, en opinión del tratante, los beneficios de controlar los síntomas menopáusicos superen los riesgos, especialmente después de haber fallado en el intento de suspender TH.
• Para mujeres en riesgo de osteoporosis y que presentan síntomas menopáusicos moderados a importantes.
• Para mayor protección de la pérdida ósea en mujeres con reducción de dicha masa, ya sea porque las terapias alternativas no son apropiadas para dicho caso o causan efectos secundarios, o cuando se desconocen los resultados a largo plazo de las terapias alternativas.
Tabla 2. Diferencias de las poblaciones estudiadas en el estudio de las Enfermeras Norteamericanas y la primera rama del estudio WHI.

Tabla 3. Efectos beneficiosos y potencialmente dañinos de los estrógenos administrados por vía oral30.

(#) efecto puede ser revertido por progestinas; (*) efecto compartido con la vía transdérmica
Tabla 4. Efecto de la edad de comienzo de la TH sobre el riesgo cardiovascular en ambas ramas del Estudio WHI compiladas15.

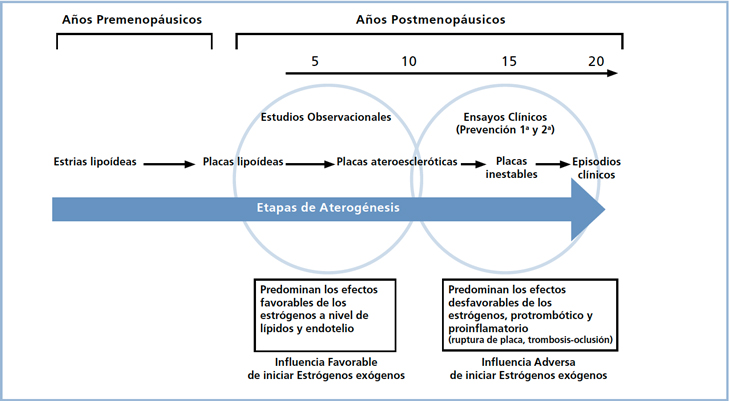
Figura 2. El impacto de la TH sobre el riesgo cardiovascular depende de la edad en que ella se inicia y del estado de progresión
de la ateroesclerosis. Análisis de los resultados divergentes entre estudios observacionales y los ensayos clínicos aleatoreos
como la primera rama del WHI30.
Referencias
- Writing Group for the Women´s Health Initiative Investigators 2002. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. JAMA 288:321-333.
- Grady D, Rubin SM, Petitti DB 1992.Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med 117:1016-1037.
- Grodstein F, Stampfer M. 2002. The epidemiology of postmenopausal hormone therapy and cardiovascular disease. En: Goldhaber SZ, Ridker PM; eds. Trombosis and Thromboembolism. N York Marcel Decker, 67-78.
- Grodstein F, Manson JE, Colditz GA, Speizer FE, Stampfer MJ 2000. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann Intern Med 133:933-941.
- The Women´s Health Initiative Steering Committee 2004. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy. JAMA 291:1701-1712.
- Huhl H, Stevenson J 2006. The effects of medroxyprogesterone acetate on estrogen-dependent risks and benefits – an attempt to interpret Women´s Health Initiative results. Gynecological Endocrinology 22:303-317.
- Grodstein F, Clarkson TG, Manson JE. 2003. Understanding the divergent data on postmenopausal hormone therapy. N Eng J Med 348:645- 650.
- Strong JP, Malcom GT, McMahan CA, Tracy RE, Newman WP 3rd, Herderick EE, et al, 1999. Prevalence and extent of atherosclerosis in adolescents and young adults: implications for prevention from the Pathobiological Determinants of Atherosclerosis in Youth Study. JAMA 281:727-735.
- McGill HC Jr, Stern MP 1979. Sex and atherosclerosis. Atheroscler Rev 4:157-242.
- Tejada C, Strong JP, Montenegro MR, Restrepo C, Solberg LA 1968. Distribution of coronary and aortic atherosclerosis by geographic location, race, and sex. Lab Invest 18:509-526.
- Herrington DM, Espeland MA, Crouse JR 3rd, Robertson J, Riley WA, McBurnie MA, et al. 2001. Estrogen replacement and brachial artery flow-mediated vasodilation in older women. Arterioscler Thromb Vasc Biol 21:1955-1961
- Herrington DM, Reboussin DM, Brosnihan KB, Sharp PC, Shumaker SA, Snyder TE, et al 2000. Effects of estrogen replacement on the progresión of coronary-artery atherosclerosis. N Eng J Med 343:522-529
- Hodis HN, Mack WJ, Lobo RA, Shoupe D, Sevanian A, Mahrer PR, et al. 2001. Estrogen in the prevention of atherosclerosis: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 135:939-953
- Mikkola TS, Clarkson TB 2002. Estrogen replacement therapy, atherosclerosis, and cardiovascular function. Cardiovasc Res 53:605-619
- Rossow JE, Prentice RL, Manson JA, Wu L, Barad D, Barnabei VM, et al 2007. Postmenopausal hormone therapy and risk of cardiovascular disease by age and years since menopause. JAMA 13:1465-1477
- Manson JE, Allison MA, Rossouw JE, Carr JJ, Langer RD, Hsia J, et al 2007. Estrogen therapy and coronary-artery calcification. N Eng J Med 356:2591-2602
- Michels KB y Manson JE 2003. Postmenopausal hormone therapy. A reversal of fortune. Circulation 107:1830-1833
- Canonico M, Oger E, Plu-Bureau G, Conard J, Meyer G, Lévesque H, et al; Estrogen and Thromboembolism Risk (ESTHER) Study Group 2007. Hormone therapy and venous thromboembolism among postmenopausal women: impact of the route of estrogen administration and progestogens: the ESTHER study. Circulation 115:840-845.
- Santen TJ, Allred DC 2007. The estrogen paradox. Nature Clinical Practice Endocrinology & Metabolism 3:496-497.
- Song RX et al 2001. Effect of long-term estrogen deprivation on apoptotic responses of breast cancer cells to 17 beta-estradiol. J Natl Cancer Inst 93:1714-1723.
- Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC et al, for the Fracture Intervention Trial Research Group 1996. Randomized trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Lancet 348:1535-1541.
- McClung MR, Geusens P, Miller, Zippel H, Bensen WG, Roux C et al., for the HIP Intervention Program Study Group 2001. Effect of Risedronate on the risk of hip fracture in elderly women. N Eng J Med 344:333-340.
- Hays J, Ockene JK, Brunner RL, Kotchen JM, Manson JE Patterson RE, et al. 2003. Effects of estrogen plus progestin on health–related quality of life. N Eng J Med 348:1839–1854.
- Hilditch JR, Lewis J, Ross AH, Peter A, van Maris B, Franssen E, et al. 1996 A comparison of the effects of oral conjugated equine estrogen and transdermal estradiol-17 beta combined with an oral progestin on quality of life in postmenopausal women. Maturitas 24:177-184.
- Position Statement. 2007. Estrogen and progestogen use in peri- and postmenopausal women: March 2007 position statement of the North American Menopause Society. Menopause 14:1-17.
- Harman SM, Brinton EA, Cedars M, Lobo R, Manson JE, Merriam GR, et al. 2005. KEEPS: The Kronos Early Estrogen Prevention Study. Climacteric 8:3-12.
- Ettinger B 2007. Rationale for use of lower estrogen dose for postmenopausal hormone therapy Maturitas 57:81-84.
- Grodstein F, Manson JE, Colditz GA, Willett WC, Speizer FE, Stampfer MJ 2000. A prospective, observational study of postmenopausal hormone therapy and primary prevention of cardiovascular disease. Ann Intern Med 133:933-941.
- Grodstein F, Stampfer MJ, Manson JE, Colditz GA, Willett WC, Rosner B, Speizer FE, Hennekens CH. 1996 Postmenopausal estrogen and progestin use and the risk of cardiovascular disease. N Engl J Med 335:453-461.
- Manson JE, Bassuk SS, Harman M, Brinton EA, Cedars MI, Lobo R, et al. 2006. Postmenopausal hormone therapy: new questions and the case for new clinical trials. Menopause 13:139-147.