Diabetes Mellitus tipo 2 e intolerancia a la glucosa en niños y adolescentes con obesidad: ¿Una epidemia moderna?
Francisca Eyzaguirre1,2, Rossana Román2,3, Ricardo Silva2 y Hernán García B.1,2
Frequency of diabetes mellitus and glucose intolerance among obese children and adolescents
1Unidad de Endocrinología Infantil,
Pontificia Universidad Católica de Chile.
2Centro Endocrinológico Clínica Santa María
(CSM), Santiago, Chile.
3Instituto de Investigaciones Materno Infantiles.
Universidad de Chile.
Correspondencia a:
Dr. Hernán García Bruce
Departamento de Pediatría
Pontificia Universidad Católica de Chile.
Lira 85, 5º piso, Santiago, Chile.
Código postal: 833-0074, Santiago.
Teléfono: 354 3402
E-mail: hgarciab@med.puc.cl
Recibido: 10 de Febrero de 2010
Aceptado: 12 de Marzo de 2010
Background: The prevalence obesity, type 2 diabetes (DM2) and glucose intolerance among
children is increasing worldwide. Aim: To assess the frequency of DM2 and GI among severely
obese children and adolescents. Patients and Methods: Cross sectional study of 69
children and adolescents aged 12 ± 3 years with a mean body mass index (BMI) z score of
2.9 ± 0.6. An oral glucose tolerance test (OGTT) was performed, measuring fasting and
120 minutes blood glucose and insulin. According to these results two patients had diabetes
mellitus and 4 had glucose intolerance. Previously studied patients, five with diabetes
mellitus and two with glucose intolerance were incorporated to the present study. These 13
participants were compared with the remaining 63 children without abnormalities in glucose
metabolism, considered as controls. Results: Body mass index among children with glucose
intolerance, diabetes mellitus and controls was 33.8 ± 6.4, 26.7 ± 5.1 and 29.4 ± 4.5 kg/m2,
respectively, p = 0.03. Basal and 120 min insulin levels were also significantly higher among
children with glucose intolerance compared with diabetics and controls. Homeostasis model
assessment for insulin resistance was significantly lower in controls than in children with diabetes
or glucose intolerance. Conclusions: Eight percent of this group of obese children and
adolescents had DM2 or glucose intolerance. Oral glucose tolerance test should be included
in the routine assessment of obese children to diagnose abnormalities of glucose metabolism.
Key words: ...
El notorio aumento de la obesidad en niños y adolescentes se ha convertido en un emergente problema de salud pública a nivel mundial. Una reciente comunicación mostró que aproximadamente el 18,4% de los niños norteamericanos son ya obesos a los 4 años de edad1 y un porcentaje similar de los escolares con índice de masa corporal (IMC) > percentil 95 de las curvas CDC; además, un 18% de ellos tienen sobrepeso (IMC entre percentiles 85y 952. Ambas condiciones se asocian a alteraciones en el perfil lipídico, metabolismo de los carbohidratos: intolerancia a la glucosa (prediabetes) y diabetes, hipertensión arterial, elevación de los niveles de insulina, así como a un mayor riesgo de obesidad, enfermedades cardiovasculares y mortalidad en la edad adulta3-5. En Estados Unidos la diabetes tipo 2 (DM2) ha aumentado su prevalencia en niños y adolescentes afectando más a etnias como la afro-americana, mexicano-americana y a nativos americanos, hecho explicado en parte por razones genéticas, pero también por la mayor prevalencia de obesidad que exhiben esas poblaciones6.
La resistencia a insulina (IR) es una condición que ha demostrado ser predictora de DM2 en estudios prospectivos realizados en comunidades de indios Pima7, en hijos de padres con DM28 y en otros grupos de riesgo como afroamericanos, aborígenes australianos9 y también mapuches. La obesidad, principalmente la de tipo abdominal, como tal es un estado de IR ya que el tejido adiposo secreta adipokinas como TNFalfa e IL-6 que juegan un papel directo en la IR, inhibiendo la acción insulínica10. En niños otros factores de riesgo para IR son el nacer pequeño o grande para la edad gestacional, aumentar mucho su peso durante los primeros años de vida11, tener acantosis nigricans y ovarios poliquísticos; la pubertad por si misma induce un estado de IR12 y también influye la historia familiar de DM2, prediabetes, dislipidemia o enfermedad ateroesclerótica en menores de 50 años13,14. En una cohorte de adolescentes obesos brasileños se demostró que la presencia de dos o más de estos factores riesgo se asocia a mayor IR15.
La IR propia de la obesidad abdominal precede por largo tiempo la aparición de IGT y DM2. Aproximadamente un 40% de los obesos con IR presentan además Síndrome Metabólico (SM), entidad descrita inicialmente en adultos y que agrupa componentes como obesidad abdominal, hipertensión arterial, dislipidemia y glicemia elevada, lo que en conjunto predice mejor el riesgo cardiometabólico que cada uno de sus componentes por separado16. La hiperglicemia en ayunas o posterior a la carga de glucosa es el criterio menos observado en los niños con SM17. En adultos, la herperglicemia se asocia a mayor riesgo cardiovascular18 y diabetes mellitus19. Aunque aún no existen criterios y puntos de corte universalmente aceptados para definir los criterios diagnósticos de SM en la edad pediátrica, progresivamente su uso se hace más habitual para lograr focalizar los esfuerzos preventivos en los niños y adolescentes obesos con mayor riesgo de desarrollar ITG o DM2 o enfermedad cardiovascular temprana20,21.
En Chile, la obesidad ha aumentado en forma importante en los últimos años. Según datos de la JUNAEB, el año 2008 el 20,8% de los niños que cursaban primero básico era obeso, una cifra que aumentó en casi 5% respecto del año 200022. Se espera que a la luz de estos índices veremos más casos de ITG y DM2 en población cada vez más joven, incluyendo niños y adolescentes, situación que de hecho se está observando en las consultas de Endocrinología pediátrica en todo el país.
El presente estudio tiene como objetivo establecer la incidencia de DM2 e ITG en una población de niños y adolescentes chilenos que consultan por obesidad importante y comparar sus características clínicas y de laboratorio con pacientes igualmente obesos, pero sin alteraciones del metabolismo de los hidratos de carbono.
Sujetos y Métodos
Se estudió mediante un corte transversal a 69 niños y adolescentes que consultaron por obesidad importante e ingresaron a un programa de manejo multidisciplinario de la obesidad en el Centro Endocrinológico de la Clínica Santa María, en un período de 24 meses. Se excluyeron pacientes con historia previa de diabetes, prediabetes hipercolesterolemia familiar, así como niños con desórdenes genéticos asociados a obesidad (ej. síndromes de Prader Willi, Turner). Todos los pacientes fueron evaluados por endocrinólogos pediatras, consignándose sus datos antropométricos; el peso fue medido con una balanza con precisión de 100 gr (Seca®), y la estatura con un estadiómetro Harpender fijo en la pared con precisión de 1 mm. Se calculó el IMC (kg/m2) y su desviación estándar (DS). Estos datos fueron clasificados usando las curvas del National Center for Health Statistics (NCHS), utilizadas en los Servicios de Salud para evaluar a la población chilena23,24. La etapa puberal se clasificó de acuerdo a los estadíos de Tanner25. Asimismo, se consignó la presencia de acantosis nigricans, estrías cutáneas violáceas, bocio o cualquier otra alteración al examen físico. La presión arterial (PA) se midió con un esfingomanómetro cuyo manguito era apropiado al largo del brazo y la edad de los pacientes; ellos se clasificaron como normotensos (PA sistólica o diastólica < p90), prehipertensos (> p90) o hipertensos (PA > p95), de acuerdo a los valores de normalidad publicados para edad, sexo y estatura por la Task Force en el año 200426.
En todos se realizó perfil bioquímico, perfil lipídico, T4, TSH y una prueba de tolerancia a la glucosa oral (TTGO) utilizando una carga de 1,75 gr/kg (máximo 75 g) con medición simultánea en sangre de glucosa e insulina en ayunas y a las 2 horas de ingerir la carga. Se consideró diagnóstico de diabetes una glicemia de ayunas repetida > 126 mg/dL o > 200 mg/dL a los120 minutos después de la carga oral de glucosa; consideramos ITG (prediabetes) a una glicemia basal repetida entre 100-125 mg/dL (hiperglicemia de ayunas) o entre 140-200 mg/dL a las dos horas de la carga de glucosa oral (hiperglicemia post carga)27. Aunque no existe un punto de corte establecido para los valores de insulinemia, basados en nuestra experiencia clínica (datos no publicados), consideramos en forma arbitraria como elevada una insulinemia basal > 35 uUI/mL o, después de la carga de glucosa > 60 uUI/ml en niños prepuberales o > 100 uUI/ml en adolescentes. Con los valores de glicemia e insulinemia basales se calculó en todos los pacientes el índice HOMA (glicemia (mg/dL) x insulinemia (uUI/mL)/ 405), índice que aunque tampoco cuenta con puntos de corte validados, ha sido validado con el Clamp Euglicémico en niños y adolescentes28.
Para estudiar las características clínicas y bioquímicas de los niños con DM2 o Prediabetes y compararlas con obesos sin alteraciones del TTGO los pacientes aquí identificados (n: 6) se consideraron en conjunto con 7 niños previamente diagnosticados en nuestra institución (n total: 13). En 3 de los pacientes con DM2 previamente diagnosticados no se dispuso del TTGO porque sus glicemias en ayunas sobrepasaban ampliamente el punto de corte para el diagnóstico de DM2. El grupo control estuvo constituido por los sujetos obesos restantes (n: 63) con TTGO normal. La investigación contó con la aprobación del comité de Ética de la CSM, y con el consentimiento informado de los padres de los niños.
Todos los exámenes de laboratorio se realizaron en el Laboratorio clínico de la Clínica Santa María. La Insulina se determinó mediante radioinmunoensayo (RIA) con el sistema Coat-a-Count kit de DPC (Diagnostic Products Corporation) al igual que la T4. La TSH se midió por el método de quimioluminiscencia con una sensibilidad de 0,002 uUI/mL. Las determinaciones de glicemia se realizaron por el método de glucosa oxidasa de Roche Diagnostics (Mannheim, Alemania), con coeficientes de variación intra e interensayo de 2,5%. El colesterol total, triglicéridos, HDL y LDL se cuantificaron con Reflotron™ System of Diagnosis (Roche™ Diagnostics).
Análisis Estadístico
Para las comparaciones de promedios entre grupos se utilizó el Análisis de la Varianza (ANOVA) y el Test de comparaciones múltiples de Bonferroni. La comparación de promedios entre 2 grupos (control e intolerantes + diabéticos) se hizo usando el test t de Student para muestras independientes. Para comparar porcentajes se usó el test de chi-cuadrado.
El análisis estadístico se realizó con el programa SPSS para Windows (versión 13.0; SPSS, Chicago, IL). Un valor de p < 0,05 fue considerado estadísticamente significativo.
Resultados
La edad promedio de los 69 niños y adolescentes
obesos estudiados fue: 12,1 ± 2,5 años y su IMC +2,9 ± 0,6
(dispersión:1,9-3,7) El TTGO permitió diagnosticar 2 (2,9%)
casos de diabetes asintomática y 4 (5,8%) de intolerancia a
la glucosa según los criterios establecidos para los 69 niños
asintomáticos que concurrieron al programa de tratamiento
de su obesidad, sin tener antecedentes de DM2. Hubo 2
niños con una glicemia de ayuno entre 100 y 126 mg/dL y
glicemia poscarga normal; en ellos una segunda glicemia
de ayunas fue normal por lo que se consideraron dentro del
grupo control; no obstante, se estableció un protocolo de
seguimiento especial en estos pacientes. Las características
de los pacientes al ingreso se resumen en la Tabla 1.
Las comparaciones clínicas y bioquímicas entre los 3 grupos (C, ITG y DM2), no mostraron diferencias para edad, sexo o estado puberal, pero sí para IMC (p < 0,001). El IMC fue significativamente más alto en los pacientes ITG respecto de los DM2 y C. Los DM presentaron una estatura significativamente menor que los controles. Además, se observó una tendencia, no significativa, respecto de la presencia de acantosis nigricans en el grupo de niños ITG (80% la presentaba al ingreso vs 37% de los C y 20% de los DM).
Al comparar los resultados del TTGO se observaron diferencias en los valores de glicemia e insulinemia basal y postcarga, así como en el índice HOMA. Los ITG tuvieron los niveles de insulinemia más elevados y tanto DM como ITG presentaron mayor HOMA. En la Tabla 2 se resumen los resultados de la comparación entre los 3 grupos.
Tabla 1. Características clínicas de los pacientes
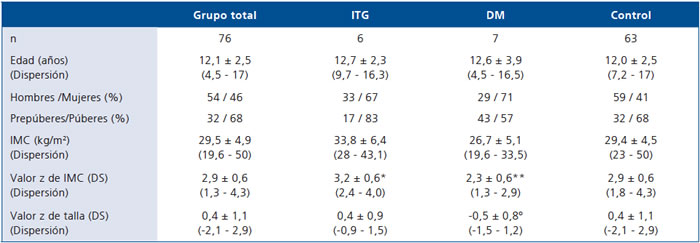
ITG = Intolerante a la glucosa; DM2 = Diabetes Mellitus tipo 2; IMC DS = índice de masa corporal y desviación estándar, M = masculino,
F = femenino.
*ITG > DM2 (p = 0,012) y DM2 < Control (p = 0,028). ºDM2 < Control (p = 0,034).
Tabla 2. Glicemia e insulinemia basales y post carga (TTGO) en niños y adolescentes obesos diabéticos, intolerantes a la glucosa y controles
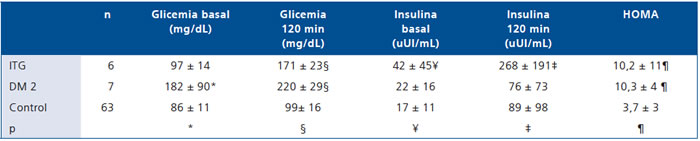
* DM2 > Control (p < 0,001) e ITG (p < 0,001). § DM2 > Control (p < 0,001) e ITG (p < 0,001). ¥ ITG > Control (p = 0,001).
‡ ITG > Control
(p = 0,001) y > DM2 (p = 0,04). ¶ ITG > Control (p = 0,001) y DM2 > Control (p = 0,006).
En los niños prepúberes y púberes la insulinemia basal fue 14,8 ± 8,4 uUI/mL y 21,1 ± 19,8 uUI/mL y la insulinemia postcarga 65,0 ± 50,4 uUI/mL y 120,0 ± 132,9 uUI/mL, respectivamente. Un niño prepuberal (4,2%) tenía insulina basal elevada y 9 (37,5%) presentaron valores de insulina elevados a los 120 minutos del TTGO. Por su parte en el grupo de los pacientes puberales, 6 (11,5%) presentaron insulinemia basal elevada y 20 (38,5%) también elevada después de la carga oral de glucosa. Al considerar el grupo C, un 6,4% de ellos (4 casos) presentaron insulinemia basal elevada y 38,1% (24 pacientes) niveles elevados postcarga según los parámetros establecidos arbitrariamente por nosotros de acuerdo a su desarrollo puberal.
Con respecto a los valores del perfil lipídico, los pacientes DM registraron un promedio de colesterol total y LDL levemente superiores a los ITG y OBC, pero sin ser significativo. No se observaron diferencias en los promedios de presión arterial sistólica ni diastólica; sin embargo, se diagnosticaron 7 pacientes con prehipertensión y 3 pacientes con hipertensión, los que se distribuyeron en todos los grupos. La función tiroidea no mostró diferencias significativas aunque se aprecia una tendencia a mayor TSH en los ITG y DM2 respecto de los C. No hubo pacientes con hipotiroidismo, pero 3 pacientes (1 en cada grupo) presentaron una TSH elevada pero < de 10 uUI/mL, compatible con hipotiroidismo subclínico (Tabla 3).
En la Tabla 4 se describen individualmente las características clínicas y de laboratorio de los 13 pacientes obesos que presentaron ITG (n: 6) o DM2 (n: 7) (6 diagnosticados en este estudio y 7 previamente). El diagnóstico de DM2 se estableció sobre bases clínicas y sólo en algunos pacientes se realizó estudio de reserva pancreática con medición de Péptido C o auto-anticuerpos, exámenes que apoyaron el diagnóstico de DM2.
Tabla 3. Perfil lipídico, TSH y presión arterial (PA) de los grupos estudiados
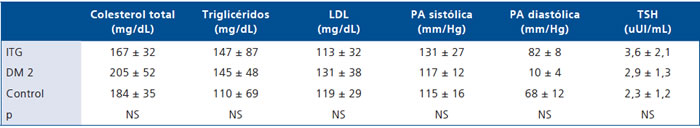
Tabla 4. Características de los niños y adolescentes con ITG y DM2
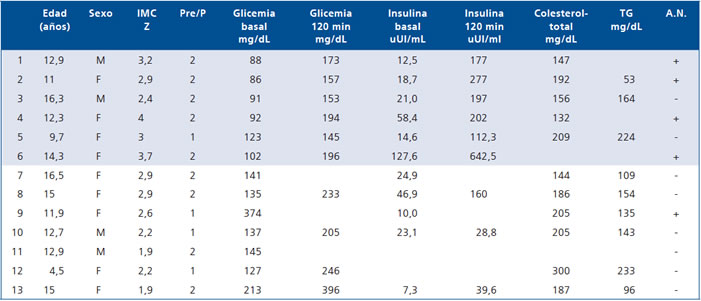
M: Masculino; F: Femenino; Pre/P: Razón Prepuberal y Puberal; TG:Triglicéridos. A.N.: Acantosis Nigricans. Pacientes ITG: 1 a 6 (achurado).
Pacientes DM2:
7 a 13 (blanco).
Discusión
Este estudio demuestra que un porcentaje significativo de los niños y adolescentes que consultan por obesidad ya ha desarrollado alteraciones del metabolismo de la glucosa, tales como DM2 e ITG. El TTGO permite identificarlos precozmente ya que muchos de ellos tienen glicemia en ayunas normal. La glicemia de ayunas sólo habría identificado a algunos DM2 y a los IGT con anormalidades en esa condición de muestreo.
En un estudio realizado en Estados Unidos en obesos de 4 a 18 años de edad con IMC entre 30 y 37 kg/m2, Sinha et al identificaron ITG en 21% y 25% de los niños y adolescentes obesos, respectivamente y DM silente en 4% de los adolescentes de esta serie29. Estos resultados muestran una prevalencia mayor a la nuestra lo que se debe probablemente al menor grado de obesidad y al distinto origen étnico de los niños de la serie que presentamos. Nuestros pacientes son étnicamente más homogéneos, la mayoría caucásicos, debido a que son de un nivel socioeconómico medio-alto, donde la mezcla amerindia es menor. Existen dos estudios chilenos publicados que estudiaron las alteraciones del metabolismo de los carbohidratos en niños obesos. En el primero Barja y cols, en una cohorte de 52 niños con obesidad marcada, cuyo IMC promedio era +4,7 ±1,6 DS, encontraron 6 (11,5%) con ITG (5 postcarga y 1 de ayunas) sin casos de DM230; en el segundo, Gallardo y cols, estudiando 186 niños y adolescentes obesos reportan 6 casos de ITG ( 2 de ayunas y 4 postcarga) y uno de DM2 (3,8% de la cohorte presentó alteraciones del metabolismo de los carbohidratos)31. Al comparar nuestros resultados con el primero de los estudios, se demostró una mayor prevalencia de ITG, pero menor de DM2 en ese estudio. Esos niños eran de edad y nivel socioeconómico semejante a los de nuestra cohorte, pero tenían una obesidad más avanzada; dicho autor no encontró, como si nosotros, diferencias en el IMC ni en las otras características físicas o bioquímicas con respecto a los obesos con tolerancia normal a la glucosa de su misma cohorte, aunque utilizaron un punto de corte de 110 mg/dL para glicemia en ayunas. Comparado con el otro trabajo chileno, que muestra una menor prevalencia tanto de ITG como de DM2, si bien esos pacientes tenían la misma edad promedio, y se utilizó el mismo punto de corte para glicemia en ayunas (100 mg/dL) que nuestro estudio, la obesidad era de menor cuantía; (IMC era +2,1 vs +2,9 DS), y el nivel socioeconómico más bajo, lo que podría contribuir a explicar estas diferencias.
Nuestra mayor prevalencia de niños con DM2 e intermedia
en IGT podría explicarse por el hecho que ellos
consultaron a un centro de manejo multidisciplinario de la
obesidad, en muchos casos motivados por la preocupación de
sus familias, algunas con casos de obesidad ITG o DM2, lo
que aumenta la probabilidad de diagnosticar las alteraciones,
respecto a un grupo de obesos de la comunidad. El paso
de ITG a DM tarda un período variable de 5 a 10 años en
estudios poblacionales en adultos, pero parece ser más breve
en niños. En nuestra serie, una paciente con ITG desarrolló diabetes 4 meses después, a pesar de haber bajado un kilo
de peso. Otra de las pacientes que fue diagnosticada como
intolerante a la glucosa durante el estudio de su obesidad y
que no ingresó al protocolo de tratamiento, fue reevaluada 14
meses después, estando más obesa que en el primer control
y con DM2 asintomática (glicemia de ayuno 294 mg/dL y
HbA1c 7,5%).
Identificar a estos niños con alto riesgo de desarrollar DM2 en el futuro obliga a un manejo responsable y multiprofesional de su obesidad, que permita prevenir la aparición de DM2. Está demostrado que cambios en el estilo de vida, con más ejercicios, menos televisión, alimentación saludable y baja de peso > 5% son medidas muy eficientes para prevenir las consecuencias cardiometabólicas de la obesidad32. En niños con ITG, ha sido demostrado que la mantención del peso durante la etapa de crecimiento puede revertir la hiperglicemia33. El uso de sensibilizantes a la insulina, como la metformina, que se utiliza con éxito en niños con DM234 puede retardar y quizás prevenir35,36 la instalación de la diabetes en niños con ITG. Resulta entonces crucial el adecuado entrenamiento de los pediatras que controlan a estos niños, para aumentar su índice de sospecha de ITG (prediabetes) entre sus pacientes obesos y así, una vez detectados manejarlos dirigidamente para detener o retrasar la aparición en ellos de DM2.
La relación de obesidad y alteraciones del metabolismo de los carbohidratos está mediada por niveles elevados de ácidos grasos libres, citoquinas inflamatorias derivadas del tejido adiposo, y los bajos niveles de adiponectina, que aceleran la falla de la célula β37.
Con respecto a la medición de las concentraciones de insulina basal y postcarga de glucosa en nuestra serie, los ITG presentaban los niveles más altos, a diferencia de los diabéticos que se encuentran en una fase insulinopénica y que por lo tanto, sus niveles son inferiores. Los ITG presentaban además una obesidad más importante que los DM2 y C, que repercute también en sus mayores niveles de insulina. El menor IMC de los DM2 con respecto a ITG podría explicarse porque han tenido períodos largos de diabetes asintomática con hiperglicemia, glucosuria y cetonuria ocasional. Esta fase de diabetes no tratada y parcialmente insulinopénica puede inducir un estado catabólico con perdida de peso al momento de su diagnóstico. En nuestros pacientes no pudimos objetivar su estado nutritivo meses o años antes del diagnóstico, aunque ninguno tenía signos de baja importante de peso reciente, ni historia o elementos clínicos de cetosis.
Otro hallazgo que llama la atención en nuestra serie es la alta proporción de niños prepuberales (43%) entre los DM2. Lo esperable hubiera sido encontrar un mayor porcentaje de adolescentes, dada la alta proporción de ITG en estos. Como el diagnóstico de DM2 se hizo fundamentalmente sobre definiciones clínicas, resulta imposible descartar que algunos de ellos correspondan a otros tipos de Diabetes como DM tipo 1 o MODY en sujetos obesos. Nuestro estudio tampoco permite responder esta interrogante ya que no se midieron en todos los niveles de Péptido C o anticuerpos, aunque su obesidad y el antecedente DM2 en familiares hace menos probable este diagnóstico. Sin embargo, en los pacientes número 9 y 13 del listado (Tabla 4) no se puede aseverar que su diabetes sea con seguridad del tipo 2.
Es posible que en nuestra serie la prevalencia de IGT y DM2 en niños obesos esté sobrevalorada, ya que estudiamos niños que consultan por obesidad importante, que provienen de familias con altos índices de diabetes y obesidad, las cuales tienden a consultar más por sus hijos que la población general, introduciendo un sesgo que autoselecciona una población de mayor riesgo lo que aumenta artificialmente su prevalencia.
Tanto la DM2 como la ITG están precedidas de un largo período de resistencia insulínica (IR); en general, los adolescentes con diabetes mellitus tipo 2 tienen familiares obesos, con IR subdiagnosticada, y comparten hábitos con alta ingesta de calorías unido a escasa actividad física38. Existe controversia con respecto al momento de la vida en que se expresa la IR y si ésta está mediada principalmente por factores genéticos, ambientales o de programación metabólica en el ambiente intrauterino. Hijos de madres con diabetes gestacional y pregestacional presentan valores tanto de glicemia como de insulinemia significativamente superiores al grupo control, con glicemia elevada a los 120 minutos del TTGO, de 1,2% en menores de 5 años, y 19,3% durante la pubertad. Aparentemente su ambiente fetal es el principal factor que predice alteraciones en el TTGO en su etapa puberal39.
En nuestra serie hubo una prevalencia de 14,4% (10/69) de presión arterial elevada y de 31,8% (22/69) con alguna alteración del metabolismo lipídico. Sin embargo, a diferencia de lo que se describe en la literatura, no encontramos mayor prevalencia de hipertensión arterial y dislipidemia en nuestros pacientes con DM e ITG comparados con obesos C, lo que puede deberse a un número insuficiente de individuos para alcanzar significancia estadística o que estas complicaciones sólo se expresen después de un mayor tiempo de evolución de la ITG o DM2. De hecho, en los niños DM2 se observó una tendencia a niveles más altos de colesterol total y LDL.
En la historia natural de la diabetes un individuo expuesto a factores de riesgo ambientales y/o genéticos38 primero desarrolla obesidad, luego IR con la consiguiente hiperinsulinemia compensatoria, hasta que esta no puede ser mantenida por la célula beta produciéndose entonces una deficiencia relativa de insulina, apareciendo la hiperglicemia postprandial. Más adelante aparecería la glicemia alterada de ayuno para finalmente instalarse la DM240, pero para efectos de prevención es importante considerar que las complicaciones microvasculares y el daño endotelial se empiezan a desarrollar desde que se desarrolla la hiperinsulinemia compensatoria, período que puede preceder por muchos años a la DM240. La historia natural de la diabetes en niños supondría que a mayor edad encontraríamos más niños afectados, pero esta premisa no fue tan categórica en nuestro estudio. Esperábamos encontrar todos los casos circuncritos al grupo de adolescentes, ya que en la pubertad se produce un significativo descenso en la sensibilidad a la insulina41, en parte mediado por el aumento en los pulsos de hormona de crecimiento. Sin embargo, nuestros resultados muestran que tanto ITG como DM2 deben buscarse también en niños obesos prepuberes especialmente en aquellos con factores de riesgo. Se ha demostrado que en niños obesos prepuberales los niveles de secreción de insulina de primera fase durante un test de tolerancia endovenosa a la glucosa son significativamente menores42.
En cuanto a las características clínicas de los pacientes que presentaron ITG o DM2 cabe destacar un predominio del sexo femenino, a pesar de que en el grupo total de obesos había un 54% de varones. Por su parte, el subgrupo de 2 pacientes con una glicemia de ayuno alterada no confirmada en la segunda determinación, debe ser seguido con atención ya que podrían desarrollar en el futuro alguna alteración más definitiva del metabolismo de la glucosa.
En conclusión, nuestros resultados, al igual que los de otros estudios en población chilena, establecen que un porcentaje significativo de niños y adolescentes obesos asintomáticos presentan ITG o DM2 al momento de la consulta.
Por ello sugerimos para poblaciones como estas realizar
un TTGO para pesquisar alteraciones en el metabolismo
de la glucosa, dado que la glicemia en ayunas diagnostica
la menor parte de los casos. Al igual que en publicaciones
extranjeras, los adolescentes presentaron mayor incidencia
de ITG que los niños prepuberales; sin embargo, sorprende
la prevalencia en esta serie de DM2 en prepúberes, por lo
que el índice de sospecha de esta patología debe extenderse
a etapas tempranas de la vida. Los ITG presentan mayores
niveles de insulina y de IMC; sin embargo, no encontramos
características clínicas definidas que nos orientaran a identificar
fenotípicamente a los niños con ITG o DM2. Sólo la
obesidad avanzada y la acantosis nigricans, sin ser patognomónicas
de esta condición, tuvieron mayor representatividad
en estos pacientes.
Por otra parte, existe un porcentaje importante de niños y adolescentes obesos con tolerancia a la glucosa normal, pero que presentan elevación de sus niveles de insulina basal o estimulada. Una intervención activa en el manejo de la obesidad debería ampliarse a este grupo, lo que justifica agregar la medición de insulina con un método confiable, a pesar de no contar con puntos de corte universalmente aceptados.
Referencias
- Anderson SE, Whitaker RC. 2009. Prevalence of obesity among US preschool children in different racial and ethnic groups. Arch Pediatr Adolesc Med 163: 344-348.
- Ogden CL, Carroll MD, Curtin LR, McDowell MA, Tabak CJ, Flegal KM. 2006. Prevalence of overweight and obesity in the United States, 1999-2004. JAMA 295: 1549-1555.
- Must A, Strauss RS.1999. Risks and consequences of childhood and adolescent obesity. Int J Obes Relat Metab Disord 23 Suppl 2: S2-11.
- Berenson GS, Srinivasan SR, Bao W, Newman WP 3rd, Tracy RE, Wattigney WA. 1998. Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults. The Bogalusa Heart Study. N Engl J Med 338: 1650-1656.
- 5. Engeland A, Bjørge T, Tverdal A, Søgaard AJ. 2004. Obesity in adolescence and adulthood and the risk of adult mortality. Epidemiology 15: 79-85.
- Lipton R, Keenan H, Onyemere KU, Freels S. 2002. Incidence and onset features of diabetes in African-American and Latino children in Chicago, 1985-1994. Diabetes Metab Res Rev 18: 135-142.
- Bogardus C, Tataranni PA. 2002. Reduced early insulin secretion in the etiology of type 2 diabetes mellitus in Pima Indians. Diabetes 51 Suppl 1: S262-64.
- Arslanian S. 2002. Type 2 diabetes in children: clinical aspects and risk factors. Horm Res 57 Suppl 1: 19-28.
- Braun B, Zimmermann MB, Kretchmer N, Spargo RM, Smith RM, Gracey M. 1996. Risk factors for diabetes and cardiovascular disease in young Australian aborigines. A 5-year follow-up study. Diabetes Care 19: 472-479.
- Diamond FB Jr, Eichler DC. 2002. Leptin and the adipocyte endocrine system. Crit Rev Clin Lab Sci 39: 499-525.
- Soto N, Bazaes RA, Peña V, Salazar T, Ávila A, Iñiguez G, et al. 2003. Insulin sensitivity and secretion are related to catch-up growth in small-for-gestational-age infants at age 1 year: results from a prospective cohort. J Clin Endocrinol Metab 88: 3645-3650.
- Pilia S, Casini MR, Foschini ML, Minerba L, Musiu MC, Marras V, et al. 2009. The effect of puberty on insulin resistance in obese children. Endocrinol Invest 32: 401-405.
- Whitaker RC, Wright JA, Pepe MS, Seidel KD, Dietz WH. 1997. Predicting obesity in young adulthood from childhood and parental obesity. N Engl J Med 337: 869-873.
- Wei JN, Li HY, Wang YC, Chuang LM, Lin MS, Lin CH, et al. 2009. Detailed family history of diabetes identified children at risk of type 2 diabetes: a population-based case-control study. Pediatr Diabetes 25 PMID: 19708906.
- da Silva RC, Miranda WL, Chacra AR, Dib SA. 2007. Insulin resistance, beta-cell function, and glucose tolerance in Brazilian adolescents with obesity or risk factors for type 2 diabetes mellitus. J Diabetes Complications 21: 84-92.
- Reaven GM. 1988. Banting lecture 1988. Role of insulin resistance in human disease. Diabetes 37: 1595-1607.
- 2001. Executive Summary of The Third Report of The National Cholesterol Education Program [NCEP] Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults [Adult Treatment Panel III] JAMA 285: 2486-2497.
- Somaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. 2001. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 24: 683-689.
- Haffner SM, Valdez RA, Hazuda HP, Mitchell BD, Morales PA, Stern MP. 1992. Prospective analysis of the insulin-resistance syndrome (syndrome X). Diabetes 41: 715-722.
- de Ferranti SD, Gauvreau K, Ludwig DS, Neufeld EJ,
Newburger JW, Rifai N. 2004. Prevalence of the metabolic
syndrome in American adolescents: findings from the Third
National Health and Nutrition Examination Survey. Circulation
110: 2494-2497. - Cook S, Weitzman M, Auinger P, Nguyen M, Dietz WH. 2003. Prevalence of a metabolic syndrome phenotype in adolescents: findings from the third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr Adolesc Med 157: 821-827.
- www.junaeb.cl
- Youlton R, Valenzuela C. 1990. Growth patterns in height and
weight in children aged 0 to 17 years and cranial circumference
in children aged 0 to 2 years from medium-high and high
socioeconomic status in Santiago. Comparison with growth in
children from medium-low and low status in the Northern area of
Santiago. Rev Chil Pediatr; Spec N°: 1-22.
- 24. www.cdc.gov/GrowthCharts/
- Tanner JM. 1981. Growth and maturation during adolescence. Nutr Rev 39: 43-55.
- Fernández JR, Redden DT, Pietrobelli A, Allison DB. 2004. Waist circumference percentiles in nationally representative samples of African-American, European-American and Mexican-American children and adolescents. J Pediatr 145: 439-444.
- Genuth S, Alberti KG, Bennett P, Buse J, Defronzo R, Kahn R, et al. 2003. The Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Follow-up report on the diagnosis of diabetes mellitus. Diabetes Care 26 : 3160-3167.
- Gungor N, Saad R, Janosky J, Arslanian S. 2004. Validation of surrogate estimates of insulin sensitivity and insulin secretion in children and adolescents. J Pediatr 144: 47-55.
- Sinha R, Fisch G, Teague B, Tamborlane WV, Banyas B, Allen K, et al. 2002. Prevalence of impaired glucose tolerance among children and adolescents with marked obesity. N Engl J Med 346: 802-810.
- Barja S, Hodgson MI, Acosta AM, Arteaga A. 2003. Glucose intolerance in obese children: a preliminary study. Rev Med Chile 131: 419-426.
- Gallardo T V, Ávila A A, Unuane M N, Codner E. 2006. Fasting glucose versus oral glucose tolerance test for detection of glucose intolerance in obese children. Rev Med Chile 134: 1146-1152.
- Miller J, Rosenbloom A, Silverstein J. 2004. Childhood obesity. J Clin Endocrinol Metab 89: 4211-4218.
- Weiss R, Taksali SE, Tamborlane WV, Burgert TS, Savoye M, Caprio S. 2005. Predictors of changes in glucose tolerance status in obese youth. Diabetes Care 28: 902-909.
- Jones KL, Arslanian S, Peterokova VA, Park JS, Tomlinson MJ. 2002. Effect of metformin in pediatric patients with type 2 diabetes: a randomized controlled trial. Diabetes Care 25: 89-94.
- Freemark M, Bursey D. 2001. The effects of metformin on body mass index and glucose tolerance in obese and adolescents with fasting hyperinsulinemia and a family history of type 2 diabetes. Pediatrics 107: e55.
- Knowler WC, Barrett-Connor E, Fowler SE, Hamman RF, Lachin JM, Walker EA, et al. 2002. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 346: 393-403.
- Cali AM, Caprio S. 2008. Prediabetes and type 2 diabetes in youth: an emerging epidemic disease? Curr Opin Endocrinol Diabetes Obes 15: 123-127.
- Pinhas-Hamiel O, Standiford D, Hamiel D, Dolan LM, Cohen R, Zeitler PS. 1999. The type 2 family: a setting for development and treatment of adolescent type 2 diabetes mellitus. Arch Pediatr Adolesc Med 153: 1063-1067.
- Silverman BL, Metzger BE, Cho NH, Loeb CA. 1995. Impaired glucose tolerance in adolescent offpring of diabetic mothers. Relationship to fetal hyperinsulinism. Diabetes Care; 18: 611-617.
- Ludwig D, Ebbeling C. 2001. Type 2 diabetes mellitus in
children, primary care and public health considerations. JAMA
286: 1427-1430. - Bloch CA, Clemons P, Sperling MA. 1987. Puberty decreases insulin sensitivity. J Pediatr 110: 481-487.
- Allen HF, Jeffers BW, Klingensmith GJ, Chase HP. 1993.
First-phase insulin release in normal children. J Pediatr 123:
733-738.