Síndrome metabólico en niñas púberes con hiperplasia
suprarrenal congénita clásica (HSRC-C)
Francisca Ugarte P.1,2, Vivian Gallardo T.3,4, Carolina Sepúlveda R.3,4, Ethel Codner D.1,4, Germán Iñiguez V.4,5, Soledad Villanueva T. 2 y Faustino Alonso T.6
Metabolic syndrome among puberal girls with classic congenital adrenal hyperplasia
1Endocrinóloga Infantil.
2Unidad de Endocrinología, Hospital Exequiel
González Cortés.
3Becada de Endocrinología Pediátrica, Escuela
de Postgrado, Universidad de Chile.
4Instituto de Investigaciones Materno Infantil
(IDIMI) Universidad de Chile y Hospital San
Borja-Arriarán.
5Químico Farmacéutico.
6Magíster en Salud Pública, Departamento
de Epidemiología, Escuela de Salud Pública,
Facultad de Medicina, Universidad de Chile.
Financiamiento compartido obtenido por
concurso:
- Sociedad Chilena de Endocrinología y
Diabetes, Proyecto SOCHED 2008-01
- Sociedad Chilena de Pediatría, Proyecto
SOCHIPE 2008004
Las instituciones financiadoras no participaron
en ninguna etapa del estudio.
No hay conflicto de intereses.
Correspondencia:
Dra. Francisca Ugarte P.
El Trovador 4280, of. 406, Las Condes.
Fax: 4325039
E-mail: ugartepalacios_fca@hotmail.com
Recibido: 22 de Enero de 2010
Aceptado: 16 de Marzo de 2010
Background: Adult women and with adrenal hyperplasia (AH) have a higher risk for insulin resistance, dyslipidemia, hypertension, high body mass index (BMI) and increased body fat. All these factors are associated with cardiovascular risk and metabolic syndrome (MS). Aim: To evaluate the presence of MS in pubertal classic AH girls (CAH) and a control group (C). Material and Methods: We studied 15 pubertal AH patients (12.0 ± 1.9 years) and 26 controls (11.7±0.3 years) matched by age and Tanner stage. Weight, height, BMI, waist/hip ratio, blood pressure and serum lipids were measured. An oral glucose tolerance test (OGTT) and insulin curve was performed in CAH girls whereas in controls basal insulin and glucose were determined. The homeostasis model assessment for insulin resistance (HOMA-IR) was calculated. Cook, Ferranti and international diabetes federation (IDF) criteria were used to determine the presence of MS. Results: CAH and C girls had similar BMI (22.0± 5.1 and 20.1 ± 3.6 kg/m2 respectively; p = 0,11). CAH girls had higher basal blood glucose (80.8±7.7 and 60.6±10.6 mg/dl respectively, p < 0.01) and controls had higher triglyceride levels (147.0±69.3 and 79.7±16.3 mg/dl respectively, p < 0.01) and lower HDL cholesterol levels (45.8 ± 12.8 and 56.9±17.5 mg/dl respectively, p = 0.02). According to Cook criteria 4% of CAH girls and 23% of controls had MS. These figures were 14 and 32% respectively according to Ferranti criteria and 0 and 5% respectively according to IDF criteria. Conclusions: CAH puberal patients do not have a higher prevalence of metabolic syndrome, compared with controls with similar Tanner stage and BMI.
Key words: ...
La Hiperplasia Suprarrenal Congénita (HSRC)1 es un conjunto de enfermedades de herencia autosómica recesiva causada por mutaciones en una de las cinco enzimas que participan en la síntesis de cortisol. La forma más frecuente es el déficit de 21-hidroxilasa, correspondiendo al 90-95% de las HSRC; esta falencia enzimática causa déficit de glucocorticoides y mineralocorticoides, lo que a través del mecanismo de retroalimentación negativo a nivel de hipotálamo-hipófisis, aumenta la síntesis de CRH y ACTH, respectivamente, estimulando la producción de andrógenos previos al bloqueo enzimático. El déficit de glucocorticoides y mineralocorticoides se manifiesta generalmente entre la 2ª a 3ª semana de vida con crisis caracterizadas por pérdida de sal. El aumento de andrógenos produce virilización de los genitales en el recién nacido de sexo femenino, pubarquia precoz en la niña y signos de hiperandrogenismo en la mujer adulta, como hirsutismo, oligoamenorrea e infertilidad. El tratamiento consiste en la sustitución adecuada de glucocorticoides y mineralocorticoides para prevenir la crisis suprarrenal y suprimir la secreción anormal de andrógenos desde la corteza suprarrenal. Muchas veces se requieren dosis suprafisiológicas de glucocorticoides para lograr este último objetivo.
El síndrome metabólico (SM) incluye un grupo de factores de riesgo cardiovascular, como resistencia a la insulina (RI) e intolerancia a la glucosa, dislipidemia, hipertensión arterial (HTA) y obesidad central. El SM fue descrito por Raeven2 como Sindrome X, autor que describe como sus componentes la obesidad central, hiperinsulinemia, HTA, hipertrigliceridemia y colesterol HDL bajo, destacando su asociación con alto riesgo de diabetes mellitus tipo 2 (DM2) e infarto al miocardio en el adulto.
Los criterios y definición de SM en niños y adolescentes aún son controvertidos, existiendo a la fecha múltiples propuestas3-6. La mayoría de los autores consideran los mismos factores de riesgo que los utilizados para adultos, pero el punto de corte para cada uno de ellos varía en las distintas propuestas. La Tabla 1 muestra algunos de los criterios más utilizados en la actualidad en niños y adolescentes3-6.
En mujeres adultas con HSRC-C se ha descrito mayor incidencia de obesidad, grasa visceral, hiperinsulinismo y RI7, mayor incidencia de síndrome y morfología de ovario poliquístico8-9, con el consiguiente riesgo metabólico cardiovascular y de infertilidad10-11. Muchos de estos elementos constituyen criterios del SM y recientemente algunos autores han señalado que niñas y mujeres adultas con HSRC tienen mayor riesgo metabólico y cardiovascular y por lo tanto de presentar SM12.
El objetivo del presente estudio es evaluar la presencia SM en niñas púberes con HSRC forma clásica, utilizando los criterios de Cook3, Ferranti4 e IDF5 para niños y adolescentes, y compararlas con un grupo control.
Tabla 1. Criterios diagnósticos de síndrome metabólico en niños y adolescentes
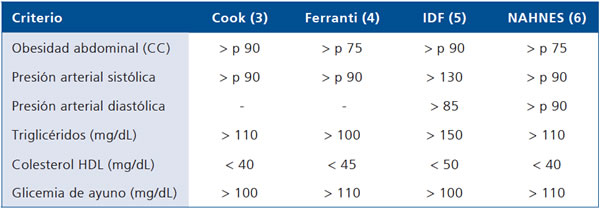
CC: circunferencia de cintura, ( ) referencia, p: percentil.
Sujetos y Métodos
Grupo de estudio (HSRC-C): Se estudiaron 15 niñas púberes y peripuberales (hasta 2 años post menarquia) portadoras de HSRC-C, de 12,0 ± 1,9 años (dispersión 9,5 a 15,7 años), controladas en la Unidad de Endocrinología del hospital Exequiel González Cortés (n = 12) y 3 provenientes de otros hospitales. Todas las pacientes fueron diagnosticadas en el período de recién nacidas por virilización de genitales externos y/o síndrome de pérdida de sal. Tenían al momento del diagnóstico un valor promedio de 17 hidroxiprogesterona de 221,8 ng/mL (VN: ng/mL) y virilización de distinto grado de acuerdo a Prader13 (grado 1: 2, Grado 2: 2, grado 3: 5; grado 4: 4 y grado 5: 2). Como tratamiento recibían hidrocortisona en dosis de 9,6 a 18,1 mg/m2/d. El desarrollo puberal se evaluó de acuerdo al estadio mamario de Tanner y Marshall14. El desarrollo puberal era Tanner II en 2, Tanner III en 7, Tanner IV en 3 y Tanner V en 3 pacientes. Dos niñas con HSRC-C habían presentado su menarquia a los 9 y 15,6 años de edad.
Controles: Se estudiaron 26 niñas controles (11,67 ± 1,34 años, entre 9,17 a 14,7 años) pareadas por edad y estadio puberal de Tanner, seleccionadas de una muestra de un colegio de Santiago, de nivel socioeconómico medio y medio bajo, similar a los casos en estudio.
Evaluación clínica: Se realizó antropometría midiendo el peso con una balanza Seca® con precisión 0,1 Kg, la talla con estadiómetro Genentech™ con precisión de 1 mm, IMC (peso/talla2), índice cintura/cadera (ICC), presión arterial con esfigmomanómetro de mercurio con manguito ad hoc15.
La talla se expresó como puntaje Z Talla /Edad de acuerdo a NCHS16 y el z-IMC de acuerdo a CDC17, la cintura en percentiles18 y la presión arterial en percentiles de acuerdo a edad, sexo y talla15, considerando hipertensión PA sobre p 90.
Se definió sobrepeso z IMC entre +1 y +2 DS y obesidad > 2 DS.
Evaluación de laboratorio: Se realizó test de tolerancia a la glucosa oral (TTGO) utilizando 1,75 g/Kg de glucosa con máximo de 75 g, midiendo glucosa por método de glucosa oxidasa; curva de insulina utilizando método RIA Kit comercial Immunotech en casos y glicemia e insulinemia basal en controles; se calculó HOMA-IR (Glicemia basal x insulinemia basal/405) y se realizó perfil lipídico.
Criterios de SM: Para la determinación de criterios de SM y su prevalencia, se utilizaron los criterios de Cook3, Ferranti4 e IDF5 para niños y adolescentes (Tabla 1).
Estadística: Se realizó un análisis descriptivo. Dada la normalidad de los datos, la cual fue evaluada mediante el test de curtosis y apuntalamiento, las variables cuantitativas fueron descritas mediante el promedio y la desviación estándar.
Para las variables cualitativas, se utilizaron frecuencias relativas (porcentajes). Se utilizó el test T de Student para evaluar la diferencia entre promedios, considerando si las varianzas eran iguales o desiguales. La comparación de las frecuencias relativas se realizó a través del test de Fisher. Los análisis estadísticos fueron realizados con el software STATA 10.119. Se definió como estadísticamente significativo un valor de p ≤ 0,05.
Comité de Ética
El presente estudio fue aprobado por el Comité de Ética del Servicio de Salud Metropolitano Sur. Los tutores y pacientes firmaron un consentimiento/asentimiento informado, respecto de la participación en el estudio.
Resultados
La Tabla 2 muestra las características generales, mediciones antropométricas y resultados de laboratorio, en grupo HSRC-C y controles. Los grupos eran comparables en edad, estadio puberal de Tanner e IMC (p NS).
Tabla 2. Características generales de los grupos, evaluación antropométrica y resultados de laboratorio
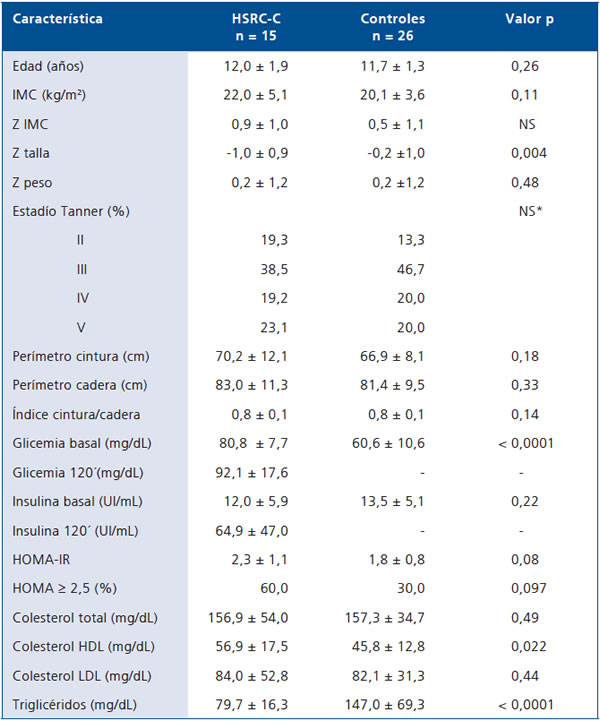
HSRC-C: grupo Hiperplasia Suprarrenal Congénita Clásica. NS: no significativo.
Tabla 3. Criterios de síndrome metabólico en niñas púveres con HSRC-C y controles
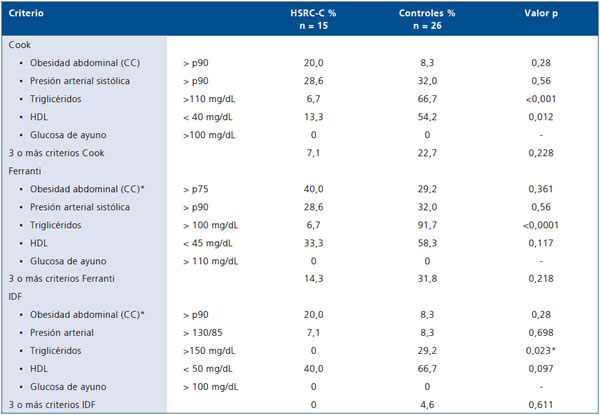
*CC: circunferencia de cintura.
Antropometría
Las mediciones antropométricas muestran que las HSRC-C tienen puntaje Z Talla/Edad menor que las controles (-1,0± 0,9 vs -0,2 ± 1,0 DS, p = 0,004). Ambos grupos presentan IMC similar (22,0 ± 5,1 vs 20,1 ± 3,6 kg/m2, p = 0,11), con puntaje z IMC de 0,7 ± 1,3 vs ± 1,1 en casos y controles. Destaca que 46,6% de casos y 38,5% de controles presentaban sobrepeso u obesidad. Sólo 2 niñas del grupo HSRC-C tenían puntaje z IMC entre 2 y 2,5; 1 de ellas con 3 criterios SM según Cook y Ferranti y 2 criterios por IDF; ninguna HSRC-C ni control tenía puntaje z IMC > 2,5.
El índice cintura/cadera (C/C) fue similar en ambos grupos (0,8 ± 0,1 vs 0,8 ± 0,1, p = 0,145). Presentaban perímetro de cintura entre p75-90 26,6 vs 19,3% de casos y controles, respectivamente; y sobre p90 20 vs 7,1% (p NS).
Sensibilidad a Insulina
Todas las glicemias tanto en casos como en controles fueron normales, aunque la glicemia de ayuno fue significativamente mayor en las HSRC-C (80,8 ± 7,7 vs 60,6± 10,6 mg/dL, p < 0,0001). Ninguna las pacientes y controles tuvo hiperglicemia de ayuno ni cumplía criterio de Cook, Ferranti o IDF. Dos niñas del grupo control tenían glicemias < 50 mg/dL.
No hubo diferencias significativas en los valores de insulinemia basal; sin embargo, la insulinemia basal fue > 15 UI/ml en 26,6% de las HSRC-C y 40% de los controles. El índice HOMA-IR fue de 2,3 ± 1,1 vs 1,8 ± 0,8 (p = 0,08). Tenían HOMA IR > 2,5 el 60% de las HSRC-C y 30% de las controles (p = 0,09).
Perfil lipídico
No hubo diferencias estadísticamente significativas para los valores promedios de colesterol total ni LDL entre el grupo HSRC-C y controles. Las controles tenían valores de triglicéridos significativamente más altos que las pacientes (147,0 + 69,3 vs 79,7 ± 16,3 mg/dL, p < 0,0001). De acuerdo a Cook, cumplen criterio para triglicéridos 6,7 vs 66,7% de casos y controles (p < 0,001) y para HDL 13,3 vs 54,2% (p = 0,012), respectivamente. Utilizando los criterios de Ferranti para triglicéridos 6,7 vs 91,7% (p < 0,0001) y para HDL 33,3 vs 58,3% (p = 0,117) en HSRC-C y controles respectivamente. Al considerar los criterios propuestos por IDF para triglicéridos 0 vs 29,2% (p = 0,023) y para HDL 40 vs 66,7% (0,097) de HSRC-C y controles, respectivamente.
Presión arterial
Presentaron PA sobre p 90 el 28,6% de las HSRC-C y 32% de las controles. Considerando los criterios de Cook y Ferranti para PA 28,6 vs 32% (p = 0,56) de casos y controles cumplían dicho criterio. Al considerar el criterio propuesto por IDF, 28,6 vs 32% de casos y controles (p = 0,5), llenaban ese criterio.
Síndrome metabólico
Considerando el criterio de Cook cumplen 3 o más criterios de SM el 4,1% de las HSRC y 22,7% de las controles (p = 0,228); según Ferranti el 14,3% en HSRC-C y 31,8% de las controles (p = 0,22) y según IDF 0% de los casos y 4,6% de los controles (p = 0,61).
Discusión
Los criterios y definición de SM en niños y adolescentes aún son controvertidos, existiendo a la fecha múltiples propuestas3-6. La mayoría de los autores consideran para los niños los mismos factores de riesgo que los utilizados para adultos. La Tabla 1 muestra algunos de los criterios más utilizados en la actualidad en niños y adolescentes3-6.
La prevalencia del SM de acuerdo al estudio NHANES 1999-20006 en adolescentes obesos quintuplica a la de los eutróficos (32,1% vs 6,4%), la de los blancos es 1,5 veces de la de los negros (7,1 vs 5,1,6%), la de los con IR duplica a la de los sensibles a insulina (50% vs 25%) y es 3 veces más frecuente en hombres (9,1 vs 3,7%). Durante la última década el SM aumentó tanto en población general (de 6,4% a 10%) como en obesos (28,7% a 32,1%)3,6. Por otra parte, Caprio y cols20, encontraron una prevalencia de SM en 38,7% de adolescentes moderadamente obesos (BMI entre 2 y 2,5 DS) y en 49,7% de los obesos avanzados (BMI sobre 2,5 DS). En Chile, el estudio de Burrows y cols21, encontró en 489 niños y adolescentes de 6 a 16 años, que consultaron en un Policlínico de Obesidad, una prevalencia de SM de 4% en niños con sobrepeso y 30% en los obesos. Por otra parte, Bustos y cols22, recientemente publicaron un estudio con una muestra de la comunidad de 25.100 niños y adolescentes de 10 a 18 años, encontrando una prevalencia de obesidad de 9,2% y en una muestra representativa de 461 obesos 37,5% de SM, siendo este más frecuente en hombres que en mujeres (OR 1,58) y destacando que 95,9% de los obesos tenía al menos 1 criterio de SM de acuerdo a los criterios propuesto por Cook.
Los pacientes con HSRC-C tienen una serie de factores de riesgo para desarrollar SM: el tratamiento con dosis suprafisiológicas de corticoides produce aumento de la neoglucogénesis, disminuyendo así la tolerancia a la glucosa23; por otra parte, se ha comunicado que adultas jóvenes con HSRC-C, presentan significativamente mayor masa grasa total y troncal24. Algunos autores han señalado que las pacientes con HSRC-C, además del déficit de glucocorticoides y mineralocorticoides, presentan insuficiencia medular suprarrenal con disminución de la secreción de catecolaminas, lo que disminuye la lipólisis y aumenta la secreción de insulina25,26, contribuyendo al aumento de masa grasa, hiperinsulinismo e RI. Otros estudios han reportado en mujeres adultas con HSRC-C menor sensibilidad a la insulina27.
En niños con HSRC-C hay pocos estudios que evalúen la presencia de estos factores, así como la implicancia en el desarrollo del SM.
En 2002, Charmandari y cols6, estudiaron niños de 2 a 12 años con HSRC-C encontrando que tenían niveles basales de insulina y leptina más elevados que los controles, así como un mayor índice HOMA-IR. En nuestro estudio ninguna paciente tenía glicemia elevada, aunque las HSRC-C mostraban mayor glicemia de ayuno y tendencia a mayor HOMAIR promedio que las controles, con 60% de HOMA-IR > 2,5; es posible que con un número mayor de pacientes esta diferencia se haga significativa.
La obesidad, especialmente la obesidad centrípeta, ha sido señalada como uno de los factores con mayor asociación a SM. Asenjo encontró una prevalencia de SM en 42% de adolescentes con z IMC entre 2 y 2,5 y en 70% en los con z IMC sobre 2,5. En nuestro estudio 2 paciente tenía z IMC sobre 2 DS, ambos con C/C sobre p 90 y sólo 1 tenía SM según criterios de Cook, Ferranti e IDF, y el otro sólo según Ferranti; ninguna de las controles tenía z IMC sobre 2 DS. Al comparar el perímetro de cintura las pacientes con HSRC-C no presentaron mayor perímetro que las controles, sin embargo, al considerar los criterios de SM, las pacientes cumplían 2,4 veces (según Cook e IDF) y 1,3 veces (según Ferranti) más dicho criterio que las controles. En ambas poblaciones estudiadas la prevalencia de malnutrición por exceso es elevada (46,7% en casos y 38,5 en controles), comparada con otros estudios chilenos22,30.
En el estudio de Roche y cols28, se realizó monitoreo continuo de PA de 24 h en niños y adolescentes con HSRC-C por déficit de 21-hidroxilasa, donde se encontró una prevalencia de 58% HTA sistólica y 24% HTA diastólica. El grado de obesidad, las altas dosis de glucocorticoides y/o mineralocorticoides, así como la RI, son factores que predisponen a HTA. En el grupo de nuestras pacientes estudiadas encontramos una prevalencia de HTA de 28%, no existiendo diferencia con el grupo control.
Un hecho a destacar es el alto porcentaje de dislipidemia encontrado tanto en las controles como en casos, con niveles significativamente más altos de triglicéridos y más bajos de HDL en el grupo control (147 vs 79,7 mg/dL y 45,8 vs 56,9, respectivamente). Burrows encontró hipertrigliceridemia en 39,1% y HDL bajo en 28,6% de niños obesos, utilizando los criterios de Ferranti; en nuestro grupo de casos y controles tenía hipertigliceridemia el 13,3 y 84,6%, respectivamente y HDL bajo 13,3 el 42,3%. No tenemos una explicación clara de este hallazgo en el grupo control, que siendo un grupo tomado de la comunidad debía acercarse a los valores considerados normales para este grupo etario; es probable que la mayor prevalencia de obesidad encontrada en los grupos estudiados respecto de otros estudios chilenos en puberes22-30, esté determinando este fenómeno.
En resumen, en nuestro estudio encontramos que las pacientes púberes con HSRC-C no presentan más SM que un grupo control pareado por edad, Tanner y con IMC comparable, utilizando los criterios de Cook, Ferranti e IDF. En las pacientes con HSRC-C observamos glicemias de ayuno más altas y tendencia a mayor HOMA IR. Se requerirán estudios con un número mayor de pacientes y seguimiento a largo plazo, para aclarar si estos hallazgos corresponden a las primeras manifestaciones de SM en niñas con HSRC-C. La detección precoz y el manejo adecuado de los distintos factores de riesgo cardiovascular detectado en estas pacientes, permitirá diseñar y realizar las intervenciones necesarias para evitar su progresión y la aparición de complicaciones a largo plazo.
Referencias
- Miller W, Achermann J, Flück C. 2008. The adrenal cortex and its disorders. En Pediatric Endocrinology, Ed M. Sperling, 3º Edición, Saunders Elsiever, Philadelphia.
- Reaven GM. 1988. Role of insulinresistance in human disease. Diabetes 37: 1595-607.
- Cook S, Weitzman M, Auinger P, Nguyen M, Dietz W. 2003. Prevalence of metabolic syndrome phenotype in adolescents. Arch Pediatr Adolesc Med 157: 821-827.
- Ferranti SD, Gauvreauuk, Ludwig DS, Neufeld EJ, Newburger JW, Rifai N. 2004. Prevalence of the metabolic syndrome in american adolescents. Circulation 110: 2494-2497.
- International Diabetes Federation. The IDF consensus worldwide definition of metabolic syndrome. 2005. http://www.idf.org/ webdata/docs/idf_Metasyndrome_definition.pdf.
- Duncan GE, Li SM, Zhou XH. 2004. Prevalence and trends of a metabolic syndrome phenotype among US adolescents, 1999-2000.Diabetes Care 27: 2438-2443.
- Charmandari E, Weise M, Bornstein SR, Eisenhofer G, Keil MF, Chrousos GP, et al. 2002. Children with classic CAH have elevated serum leptin concentrations and insulin resistance: potencial clinical implications. J Clin Endocrinol Metab 87: 2114-2120.
- Yen SSC. Chronic anovulation caused by peripheral endocrine disorders. 1986. En: Yen SSC, Jaffe RB, eds. Reproductive Endocrinology. Philadelphia, Saunders: 444-499.
- Hague WM, Adams J, Rodda C, Brook CG, de Bruyn R, Grant DB, et al. 1990. The prevalence of polycystic ovaries in patients with congenital adrenal hyperplasia and their close relatives. Clin Endocrinol (Oxf) 33: 501-511.
- Ehrmann DA. 2005. Polycystic Ovary Síndrome N Engl J Med 352: 1223-1236.
- Norman RJ, Dewailly D, Legro RS, Hickey TE. 2007. Polycystic ovary syndrome. Lancet 370 (9588): 685-697.
- Mooij CF, Kroese JM, Claahsen-van der Grinten HL, Tack CJ, Hermus AR. 2009. Unfavorable trends in cardiovascular and metabolic risk in pediatric and adult patients with congenital adrenal hyperplasia? Clin Endocrinol (Oxf) 2009 [Epub ahead of print].
- Von Prader A. 1954. Der genitalbefund beim pseudohermaproditus feminus des kongenitalen adrenogenitalen syndromes. Helv Pediatr Acta 9: 231-248.
- Marshall WA, Tanner JM. 1969. Variations in pattern of pubertal changes in girls. Arch Dis Child 44: 291-303.
- National Health, Lung and Blood Institute.1987. Report of second task force on blood pressure in children, Pediatrics 1987; 79: 1-2.
- 2000. CDC Growth Charts: United States. National Center Health Statistics. Accessed at http://www.cdc.gov/growthcharts/
- Children's BMI-percentile-for-age Calculator. http://www.bcm. edu/cnrc/bodycomp/bmiz2.html.
- Fernández JR, Redden DT, Pietrobelli A, Allison D. 2004. Waist circumference percentiles in nationally representative samples of Afroamerican. European-American and Mexican-American children and adolescence. J Pediatr 145: 439-444.
- Stata Statistical Software: Release 10 [computer program]. Version. TX: StataCorp LP; 2007.
- Weiss R, Dziura J, Burgert TS, et al. 2004. Obesity and the metabolic syndrome in children and adolescents. N Engl J Med 350: 2362-2374.
- Burrows R, Leiva L, Weistaub y cols. 2007. Síndrome metabólico en niños y adolescentes: asociación con sensibilidad insulínica y con magnitud y distribución de la obesidad. Rev Med Chile 135: 174-181.
- Bustos P, Sáez K, Gleisner A, Ulloa N, Calvo C, Asenjo S. 2009. Metabolic syndrome in obese adolescents. Pediatric Diabetes May 19. [Epub ahead of print].
- Zimmet P, Alberti G, Kaufman F, Tajima N, Silink M, Arslanian S, et al. 2007. International Diabetes Federation Task Force on Epidemiology and Prevention of Diabetes: The metabolic syndrome in children and adolescents. Lancet 369: 2059-2061.
- Stikkelbroeck NM, Oyen WJ, Van Der Wilt GJ, et al. 2003. Normal bone mineral density and lean body mass, but increased fat mass, in young adult patients with congenital adrenal hyperplasia. J Clin Endocrinol Metab 88: 1036-1042.
- Nonogaki K. 2000. New insights into sympathetic regulation of glucose and fat metabolism. Diabetologia 43: 533-549.
- Merke DP, Chrousos GP, Eisenhofer G, Weise M, Keil MF, Rogol AD, et al. 2000. Adrenomedullary dysplasia and hypofunction in patients with classic 21-hydroxylase deficiency. New England Journal of Medicine 343: 1362-1368.
- Sartorato P, Zulian E, Benedini S, Mariniello B, Schiavi F, Bilora F, et al. 2007. Cardiovascular risk factors and ultrasound evaluation of intima-media thickness at common carotids, carotid bulbs, and femoral and abdominal aorta arteries in patients with classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency. J Clin Endocrinol Metab 92: 1015-1018.
- Roche E, Charmandari E, Dattani MT, Hindmarsh PC. 2003. Blood pressure in children and adolescents with congenital adrenal hyperplasia-21- hydroxylase deficiency. Clin Endocrinol (Oxf) 58: 589-596.
- Vio F, Albala C, Kain J. Nutrition transition in Chile revisited: mid-term evaluation of obesity goals for the period 2000-2010. Public Health Nutrition 11: 405-412.
- Eyzaguirre F, Mericq V, Ceresa S, Youlton R, Zacarías J. 2005. Prevalencia de sobrepeso y obesidad en pediatría ambulatoria en Clínica Las Condes. Rev Chil Pediatr 76: 143-149.