Metformina asociada a insulinoterapia en pacientes diabéticos tipo 1
Lilian Sanhueza M.1,2, Pilar Durruty A.1,a, Claudia Rubio C.1,b y Manuel García de los Ríos A.1
Metformin associated with insulin therapy in type 1
1Unidad de Diabetes, Hospital San Juan de Dios, Servicio y Departamento de Medicina
Occidente. Facultad de Medicina Universidad de Chile.
2Servicio de Medicina, Hospital Barros Luco Trudeau. Facultad de Medicina, Universidad de Santiago de Chile.
aBioquímico.
bNutricionista.
Correspondencia a:
Lilian Sanhueza Maturana
Profesor Asociado Facultad de Medicina, Universidad de Santiago de Chile.
Fray Camilo Henríquez 175, Depto. 404. Santiago, Chile.
Teléfono: 85951069
Fax: 26817414
E mail: lilianllay@yahoo.es
Sin financiamiento.
No hay conflicto de interés.
Recibido: 26-01-2015
Aceptado: 10-03-2015
In patients with diabetes type 1 (T1D) glycemic control remains suboptimal, despite the availability of new insulin analogues and continuous infusion systems. Metformin may be a complementary therapy regarding to intensified insulin therapy since a significant percentage of T1D have insulin resistance (IR). Objective: To analyze the clinical, anthropometric and metabolic effects of the combination of metformin to insulin therapy in T1D patients. Subjects and Method: 34 T1D patients, 15 men and 19 women, mean age 41 years (range 20-64) metformin 850 mg / day was associated for 6 months (group 1) and retrospectively evaluated 18 T1D, 9 men and 9 women, age average 34 years (range 17-58), who received metformin for 36 months (group 2). It was recorded before and after treatment with metformin: nutritional status, waist circumference, index waist / hip, glucose fasting, glycosylated hemoglobin (HbA1c), HDL cholesterol, triglycerides, systolic and diastolic blood pressure (BP), glucose uptake (UG) and insulin dose (U/kg). Statistical analyses. Clinical and biochemical parameters were expressed as median, range or percentage (%). For the statistical significance were used chi2 and Fisher exact and Mann Whitney test; and was established as significant at p <0.05. Results: In group 1 significantly decreased waist circumference in men and women and improved fasting glucose, HbA1c, systolic blood pressure and triglycerides. In group 2, waist circumference and systolic blood pressure was also reduced. Conclusion: In T1D patients with clinical signs of IR the association of metformin to insulin therapy may be useful.
Key words: Type 1 diabetes mellitus, T1D, insulin resistance and metformin.
La diabetes mellitus tipo 1 (DM1) es una enfermedad autoinmune caracterizada por su dependencia vital a la insulina y su inestabilidad metabólica, con marcadas diferencias glicémicas durante las 24 h. Los pacientes DM1 son sensibles a la insulina, de manera que pequeños cambios en las dosis de ésta provoca variaciones importantes en los niveles de la glucosa sanguínea.
Es ampliamente conocido que los DM1 de cualquier edad, pese a los tratamientos insulínicos intensificados, uso de análogos de insulina y de sistemas contínuos de infusión, tienen crónicamente mal control metabólico; sus glicemias y hemoglobinas glicosiladas A1c (HbA1c) se encuentran habitualmente por encima de los objetivos terapéuticos1. Sin embargo, la insulinoterapia intensiva aplicada para lograr mejores cifras glicémicas en el estudio The Diabetes Control and Complication Trial, demostró el efecto beneficioso del control metabólico en disminuir las complicaciones crónicas de la DM12.
Puesto que la insulina es el único tratamiento efectivo en los DM1, y que mayoritariamente no se logran las cifras recomendadas, se ha buscado desde hace largos años la asociación con fármacos insulinosensibilizadores. Así, Lestradet et al3, en 1960, empleó en niños DM1 una biguanida, precursora de la metformina, sin resultados concluyentes.
Actualmente, han aparecido publicaciones que evalúan el asociar metformina a la terapia insulínica en DM1, en adolescentes y en adultos jóvenes; lo que tiene su fundamento en el hallazgo que un porcentaje importante de DM1 presenta RI4, causada por el sobrepeso y obesidad.
Nosotros, el año 20145, encontramos en una casuística de 150 adultos jóvenes DM1, al aplicar una fórmula de cuantificación de la captación de glucosa, que el 75% presentaba RI. Destacamos, además, que al utilizar el criterio The National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (NCEP/ATPIII) modificado6, que el 27% tenía síndrome metabólico (SM) y que el principal factor asociado a estos trastornos era la obesidad visceral.
La metformina disminuye la producción hepática de glucosa, aumentando la sensibilidad a la insulina, efectos independientes de la capacidad insulinosecretora de la célula beta. Debido a que los mecanismos de acción son diferentes, se fundamenta el empleo de metformina asociado a insulina en DM17.
En una publicación reciente, Nadeau et al8, demostraron, en una observación corta de 3 y 6 meses, que la metformina asociada a insulina disminuyó los requerimientos de ésta, el índice de masa corporal (IMC) y la circunferencia de cintura (cc), lo que atribuyen a la mejoría de la sensibilidad insulínica. Al mismo resultado había llegado Vella et al9, en una revisión sistemática del tema en el año 2010; en 9 estudios encontraron un menor requerimiento de insulina, pero sin mejoría de la HbA1c. Hamilton et al4, también confirmó que la asociación metformina/insulina disminuye la dosis de insulina sin ganancia de peso, y reduce la HbA1c en adolescentes DM1.
Los trabajos sobre el tema –todos con períodos de observación de tres a doce meses– muestran resultados dispares respecto a mejorar el control glicémico, el peso corporal y otros parámetros bioquímicos, aunque disminuyen los requerimientos insulínicos4,7-9.
Los resultados de las publicaciones no permiten una conclusión general y valedera respecto al uso de metformina asociada a insulina en el tratamiento de los pacientes DM1.
El propósito de este estudio fue analizar en adultos jóvenes DM1 los efectos clínicos y metabólicos de la asociación de metformina al tratamiento insulínico en dos grupos de pacientes, uno con una observación corta, 6 meses y el otro con un seguimiento largo, el que alcanzó a 36 meses.
Sujetos y Método
El estudio se realizó en 52 pacientes DM1 controlados en la Unidad de Diabetes del Hospital San Juan de Dios, Santiago. Se incluyeron individuos de ambos sexos, mayores de 18 años de edad y menores de 65. Todos firmaron el consentimiento informado.
Se analizaron dos grupos de DM1:
Grupo 1: Treinta y cuatro pacientes (15 hombres y 19 mujeres); edad promedio de 41 años (rango 20-64) y un seguimiento prospectivo de seis meses. Veinticinco sujetos recibieron asociado al tratamiento insulínico 850 mg de metformina en una dosis diaria nocturna. A los individuos que tenían marcados signos clínicos de RI (acantosis nigricans, acrocordones) recibieron 1.700 mg de metformina, 850 mg/2 veces al día (n = 9). El grupo total recibió en promedio 1.100 ± 393 mg/día, dosis menor que el grupo 2 (p < 0,01). Al finalizar el tiempo de observación a un paciente se les debió suspender el uso de metformina por intolerancia digestiva.
Este grupo presentaba niveles de HbA1c iniciales de 10,1 (6,7-11,3)% cifras similares a las del grupo 2, 10,7 (5,7-10,7)%.
Grupo 2: Dieciocho pacientes (9 hombres y 9 mujeres), edad promedio 34 años (rango 17-58); más jóvenes que el Grupo 1 p < 0,01. Estos pacientes en una observación retrospectiva mantuvieron durante 36 meses la asociación metformina/insulina, recibiendo en promedio 1.700 ± 714 mg de metformina al día.
Todos los pacientes tenían SM, aplicando el criterio NCEP/ATPIII modificado6, que considera los siguientes parámetros: circunferencia de cintura (cc) > 102 cm en el hombre y > 88 cm en la mujer, triglicéridos (TG) ≥ 150 mg/dl, presión arterial (PA) ≥ 130/85 mm Hg, colesterol HDL (col HDL) < 40 mg/dl en el hombre y < 50 mg/dl en la mujer y glicemia de ayunas ≥ 100 mg/dl. En consideración a que todos los pacientes son diabéticos se exigió dos de los restantes 4 criterios alterados.
Para el peso y la talla se utilizó una balanza marca Secca con podómetro. Se calculó el IMC (kg/m2) considerando sobrepeso el rango entre 25 y 29,9 y obesidad ≥ 30 kg/m2.
Las glicemias, el col-HDL y los TG se midieron con métodos enzimáticos colorimétricos en un equipo automatizado Architec 8.000, con coeficientes de variación (CV) < 5%.
Para las glicemias se usó hexoquinasa/6, para el col HDL un detergente acelerador selectivo y para los TG las enzimas glicerol fosfato deshidrogenasa (GPO) y peroxidasa (POD).
Las HbA1c se determinaron en columnas de cromatografía líquida de alta resolución (HPLC) con un CV < 5%, utilizando un equipo HPLC Variant 2000.
La PA se tomó con un esfingomanómetro de Hg, en dos repeticiones permaneciendo los pacientes sentados, sin haber fumado ni comido recientemente.
La circunferencia de cintura se midió con una cinta métrica flexible, en forma horizontal a nivel de la zona hendida entre el último arco costal y la cresta ilíaca, con el sujeto de pie y con la pared abdominal relajada (al final de una respiración normal). Para la circunferencia de cadera se utilizó la misma cinta, colocada en forma horizontal a nivel de la zona más prominente de los glúteos con el sujeto de pie y relajado. Con estas determinaciones se estableció la relación cintura/cadera (índice cc/cad).
A todos los pacientes se les calculó la RI, aplicando la fórmula de captación de glucosa (CG), que considera las siguientes variables clínicas:
CG= 24,3 –12,22 x cintura/cadera –3,29 x hipertensión arterial (HTA)– 0,57 x HbA1c.
En la fórmula se emplea: HTA = 0 si el paciente no es hipertenso. HTA=1 si el paciente tiene historia personal de hipertensión.
Esta fórmula se utiliza sólo en pacientes cuyas HbA1c sean < 11,4%.
Un valor de CG < 8,77 (mg/kg x min) es indicador de RI; las cifras más bajas de CG indican grados mayores de RI.
Los resultados de los exámenes se obtuvieron de las fichas clínicas de los pacientes.
Se registraron los parámetros antropométricos, clínicos y metabólicos antes y después del uso de metformina.
Análisis estadístico
Los parámetros clínicos y bioquímicos se expresaron como mediana y rango o porcentaje (%). Para el cálculo de la significancia estadística se usaron c2 y los tests exacto de Fisher y de Mann Whitney y se estableció como significativo un p < 0,05.
Resultados
En la Tabla 1 se presentan los parámetros antropométricos, clínicos y metabólicos de los pacientes DM1 (n = 34) que cumplieron seis meses de tratamiento asociado de metformina/insulina. En relación al estado nutricional se puede observar que no hubo cambio significativo entre el inicio versus el final. Se destaca que 9 DM1 pasaron de la categoría de obesos a sobrepeso (NS). La circunferencia de cintura disminuyó significativamente en hombres y mujeres (p < 0,05); sin embargo, no varió el índice cintura/cadera.
Es destacable que en este grupo tanto la glicemia de ayunas como la HbA1c disminuyeron significativamente; situación similar se encontró en las cifras de PA sistólica y en los niveles de triglicéridos. La PA diastólica y el col HDL no variaron.
Las dosis de insulina por kg peso fueron iguales antes y después de la asociación con metformina.
Por otra parte, la captación de glucosa aumentó de 6,2 (0,9-10,1) mg/kg x min a 7,1 (2,6-10,5) con una probabilidad < 0,05 (Figura 1); 27 pacientes tuvieron un cambio positivo en este parámetro y en sólo seis la captación de glucosa disminuyó (Figura 2).
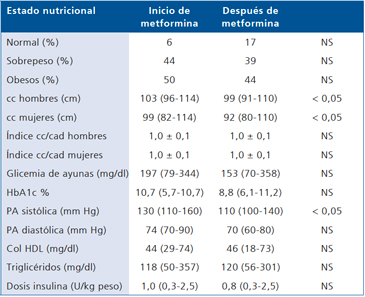
Los resultados del grupo 2 (n = 18) que tuvo un período de observación de 36 meses con la asociación de metformina/insulina aparecen en la Tabla 2. Aunque se puede apreciar una mejoría del estado nutricional de los pacientes, en 9 se logró normalidad (IMC < 25 kg/m2) y 14 dejaron de ser obesos; estos cambios expresados como porcentaje no fueron estadísticamente significativos.
Tal como se observó en el grupo 1, en el seguimiento de 36 meses del grupo 2, mejora la circunferencia de cintura en los hombres y en las mujeres (p < 0,05); no obstante, los índices cc/cad se mantuvieron iguales.
La glicemia de ayunas disminuyó de 197 (79-344) mg/ dl a 153,3 (70-358) sin significancia estadística; lo mismo ocurrió con la HbA1c que bajó de 10,7 (5,7-10,7) % a 8,8 (6,1-11,2) %. La presión sistólica se redujo significativamente, no así la presión diastólica. El col HDL y los triglicéridos no se modificaron.
La dosis de insulina por kg/peso, disminuyó de 1,0 a 0,8 (NS).
La captación de glucosa del grupo 2 se muestra en la Figura 3; se puede distinguir que este parámetro aumentó levemente al final del estudio respecto al inicio, 6,5 (3,5- 18,3) versus 6,7 (3,5-9,7) mg/kg x min (NS). Se aprecia en la Figura 4 que en 11 individuos la CG aumentó y en 6 disminuyó, de éstos en tres la caída es importante.
Tabla 1. Parámetros antropométricos, clínicos y metabólicos de 34 pacientes DM1 observados durante seis meses en tratamiento insulínico asociado a metformina
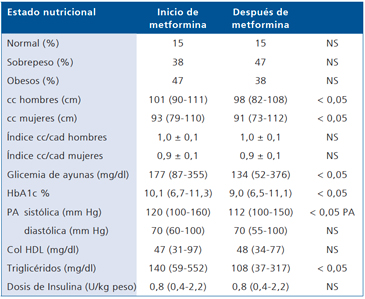
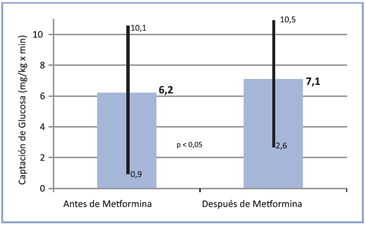
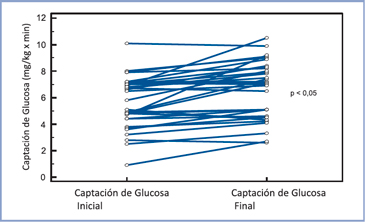 Figura 2. Valores individuales de la captación de glucosa en tratamiento asociado insulina/metformina en DM1 al inicio y al final de 6 meses de observación (n = 34).
Figura 2. Valores individuales de la captación de glucosa en tratamiento asociado insulina/metformina en DM1 al inicio y al final de 6 meses de observación (n = 34). 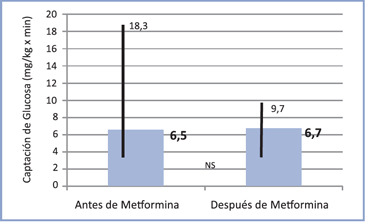 Figura 4. Valores individuales de la captación de glucosa en tratamiento asociado insulina/metformina al inicio y al final de 36 meses de observación (n = 18).
Figura 4. Valores individuales de la captación de glucosa en tratamiento asociado insulina/metformina al inicio y al final de 36 meses de observación (n = 18).
Discusión
El diseño de nuestro trabajo nos permite analizar por separado y comparativamente con la bibliografía, los resultados obtenidos con la asociación de insulina/metformina a los 6 y a los 36 meses de seguimiento.
En el grupo 1 (6 meses) encontramos una mejoría de la sensibilidad a la insulina, que se ve reflejado en la disminución de parámetros antropométricos (reducción significativa de la circunferencia de cintura en hombres y mujeres), así como metabólicos; menor glicemia de ayunas y HbA1c (p < 0,05), pero sin cambios en las dosis de insulina. Además, se apreció una disminución de la PA sistólica y de los triglicéridos (Tabla 1).
Nuestros hallazgos son similares a los informados por Särnblad et al10, en un seguimiento de sólo 3 meses; estos autores al igual que nosotros, tampoco observaron cambios en las dosis de insulina.
Por otra parte, Jacobsen et al7 y Lund et al11, no encontraron reducción de la HbA1c; dando cuenta de una menor dosis de insulina, lo que también han mostrado varios autores4,8,9,12.
Un meta-análisis reciente13, informa que la asociación insulina/metformina puede disminuir la dosis de insulina, el peso corporal y los niveles lipídicos, sin aumento de las hipoglicemias. En esta revisión no se encontró cambios en la HbA1c.
Resumiendo, en investigaciones cortas, todas menores a un año, los hallazgos en relación a cambios glicémicos y requerimientos de insulina son variados y no permiten en este sentido sacar conclusiones absolutas.
En nuestro estudio, el grupo 2; con 36 meses de terapia insulina/metformina –el seguimiento más largo publicado– mantuvo la mejoría de algunos resultados, como la disminución de la circunferencia de cintura (p < 0,05) y la reducción de la PA sistólica.
Contrariamente, pese a que la glicemia de ayunas se redujo de 197,0 a 153,3 mg/dl y la HbA1c de 10,7% a 8,8% se perdió la significancia estadística, lo que se debe probablemente al bajo número de casos estudiados y al amplio rango de los valores (Tabla 2).
Tabla 2. Parámetros antropométricos, clínicos y metabólicos de 18 pacientes DM1 evaluados durante 36 meses en tratamiento insulínico asociado a metformina
Es aceptado el hecho que en pacientes sometidos a protocolos de estudios cortos, la adhesión a los tratamientos es mayor que en seguimientos largos y por lo tanto, los resultados son más positivos en los primeros para los objetivos planteados.
El aumento de la captación de glucosa lo podríamos atribuir al efecto de la metformina que es un insulino-sensibilizador con un mecanismo demostrado de frenar la producción hepática de glucosa; situaciones que se presentan en los DM1 que recibieron el fármaco.
No es posible analizar los resultados del grupo 2 en forma comparativa con la bibliografía por no existir trabajos con seguimientos de 3 años o más.
En este trabajo encontramos una mejoría de la sensibilidad a la insulina al adicionar metformina en los primeros 6 meses de tratamiento; lo que se refleja en la disminución de algunos parámetros antropométricos y metabólicos. Sin embargo, el efecto benéfico no se mantiene a los 36 meses.
Los DM1 se caracterizan por su gran inestabilidad metabólica; podemos plantear, en base a los resultados de nuestro estudio, que en períodos de mal control metabólico el indicar junto a la insulinoterapia, metformina en dosis de 850 mg dos veces al día, podría lograr una disminución de las hiperglicemias y por lo tanto, de la HbA1c.
Nos ha llamado la atención en los estudios de resistencia a la insulina y/o síndrome metabólico en DM1 realizados por nosotros, el alto porcentaje de pacientes que presentan estas alteraciones. No podemos desconocer que en los casos estudiados, la existencia de estas situaciones amerita realizar acciones para enfrentarlas y una posibilidad fácil y de bajo costo sería indicar el uso de metformina.
La mejoría de algunos parámetros de riesgo cardiovascular (circunferencia de cintura, glicemia de ayunas, HbA1c, PA sistólica), hace pensar que la adición de metformina, sobre todo en DM1 obesos o con sobrepeso, se traduciría probablemente en una menor morbi-mortalidad coronaria. Esto ha sido demostrado por Saunders et al14 al mejorar el control metabólico en los DM1 con distintas medidas terapéuticas (metformina, estatinas, intensificación del tratamiento insulínico). Lo señalado tiene gran importancia dado que actualmente la primera causa de muerte en los DM1 son los accidentes coronarios.
Un estudio señero en este sentido es el iniciado en niños con DM1 por Anderson et al15, quienes han propuesto el uso de metformina como prevención del daño vascular en tratamiento asociado a la insulina, cuyos resultados se conocerán a futuro.
En las guías de tratamiento de los pacientes DM1 el uso de metformina no está recomendado, las publicaciones existentes no permiten llegar a una conclusión al respecto.
De nuestro trabajo podemos concluir que en pacientes DM1 con signos clínicos de RI, el asociar metformina a la terapia insulínica podría ser de utilidad en la mejoría de parámetros antropométricos y metabólicos, en períodos cortos de tratamiento.
Agradecimientos
Un reconocimiento especial a los internos de Medicina de la Universidad de Santiago de Chile Srta. Yancarla Maldonado y Sr. Javier Apablaza por su colaboración en este estudio.
Referencias bibliográficas
- Devries JH, Snock FJ, Heine RJ. 2004. Persistent poor glicaemia control in adult type 1 diabetes. A closer look at the problem. Diabetic Medicine 21: 1263-1268.
- The Diabetes Control and Complications Trial Research Group. 1993. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. NEJM 353: 2643-2653.
- Lestradet H, Besse J, Billaud L. 1960. Study of the action of a biguanide on a group of 235 diabetic children. La Presse Medicale 68: 391-393.
- Hamilton J, Cummings E, Zdraukovic V, Finegood D, Daneman D. 2003. Metformin as an adjunct therapy in adolescents with type 1 diabetes and insulin resistance. Diabetes Care 26: 138-143.
- Sanhueza L, Concha L, Durruty P, Rubio C, Wolff C, García de los Ríos M. 2014. Diabéticos tipo 1 portadores de síndrome metabólico: cuantificación de la resistencia a la insulina. Rev Chil Endocrinol. Diabetes 7: 89-93.
- Stone NJ, Bilek S, Rosenbaum S. 2005. Recent national cholesterol education program adult treatment panel III update: adjustment and options. Am J Cardiol 96 (4A): 53E-59E.
- Jacobsen IB, Henriksen JE, Beck-Nielsen H. 2009. The effect of metformin in overweight patients with type 1 diabetes and poor metabolic control. Basic Clin Pharmacol Toxicol 105: 145-149.
- Nadeau KJ, Chow K, Alam S, Linquist K, Campbell S, McFann K, et al. 2014. Effects of low dose metformin in adolescents with type 1 diabetes mellitus: a randomized, double-blinded placebo-controlled study. Pediatric Diabetes doi:10.1111/ pedi.12140.
- Vella S, Buetow L, Royle P, Livingstone S, Colhoun HM, Petrie JR. 2010. The use of metformin in type 1 diabetes: a systematic review of efficacy. Diabetologia 53: 809-820.
- Särnblad S, Kroon M, Aman J. 2003. Metformin as additional therapy in adolescents with poorly controlled type 1 diabetes: randomized placebo controlled trial with aspects on insulin sensitivity. Europ J of Endocrinol 149: 323-329.
- Lund SS, Tarnow L, Astrup AS, Hovinol P, Jacobsen PK, Alibegovic C, et al. 2008. Effect of adjunct metformin treatment in patient with type 1 diabetes and persistent inadequate glicaemic control. A Randomized Study. Plos One 3 (10): e 3363. doi: 10.1371/journal.pone.0003363.
- Khan AS, Mc Loughney CR, Ahmed AB. 2006. The effect of metformin on blood glucose control in overweight patients with type 1 diabetes. Diabet Med 23: 10791084.
- Liu C, Wu D, Zheng X, Li P, Li L. 2015. Efficacy and safety of metformin for patients with type 1 diabetes mellitus: a meta-analysis. Diabetes Technol Ther 17: 1140-1144.
- Saunders SA, Wallymhamed M, Farlane IA. 2009. Improvements in glycaemic control and cardiovascular risk factors in a cohort of patients with type 1 diabetes over a 5- year period. Q J Med 102: 29-34.
- Anderson J, Peña AS, Sullivan T, Gent R, D´Arcy B, Olds T, et al. 2013. Does metformin improve vascular health in children with type 1 diabetes? Protocol for a one year, double blind, randomized, placebo controlled trial. BMC Pediatrics 13: 108-117.