Trastorno de Identidad de Género. Parte II: Terapia endocrinológica en el proceso de readecuación corporal
Enzo Devoto C.1, Rafael Ríos S.2 y Lucía Aravena C.3
Gender Identity Disorder. Part II: endocrine therapy in the process of body readjustment
1Consulta privada: Hernando de Aguirre 194 of. 62.
2Hospital Clínico San Borja-Arriarán. Departamento de Medicina. Sección Endocrinología. Facultad de Medicina Universidad de Chile.
3Consulta privada: Nueva Providencia 1881 of. 2205.
No existen conflictos de interés en la realización de este trabajo de revisión.
Correspondencia a: Dr. Enzo Devoto: edevoto@vtr.net
Recibido: 23-12-2015
Aceptado: 01-03-2016
Endocrinology step of transgender readjustment therapy is made according to previously published in the part 1 of article: “gender identity disorder in rev.chil.endocrinol.diabetes 2015, 8 (4): 167-173. During started puberty in Tanner stage 2-3, the persistence of the experience that their identity male or female gender is not coherent with its bodily, authorize to start the endocrinological therapy, as an important step of body readjusting. In the process of transition from male to female or female to male, should stop pubertal development, what we do with GNRH analogues: intramuscle leuprolide or triptorelin 11.25 mg. every 12 weeks or with medroxyprogesterone acetate 150 mg. monthly. This process continues until 16 years, adding antiandrogen, preferably spironolactone in the process of body readjusting of male to female. At 16 years old, starts the cross hormonal therapy to masculinizing or feminizing. Maintaining gonadotrophin suppression, female to male, testosterone undecanoate or other injectable testosterone esters is administered, customizing the date of administration and in Male to female, daily use of oral estradiol valerate or transdermal gel. Plasma levels of estradiol and testosterone should not be located in high or supraphysiological range to avoid thromboembolism or polycythemia risk in those who receive testosterone. Should to be explained the time to obtain the bodily effects, achieving a realistic attitude of the goals and the need for regular checks. Attendance to emotional changes, mainly to meet the social gender role. The laboratory, metabolic, hormonal, hemogram and electrolytic changes are evaluated. To be indicated bone densitometry and study images of internal genitals and breasts are necesary. At 18 years old and with approximately 2 years of cross hormone therapy can refer to surgical stage. Determined the gonadectomy, GNRH and depot progestin are suspended and estradiol or testosterone is maintained at doses of hormone replacement.
Key words: Treatment transexual, Treatment gender identity disorder, Endocrine treatment.
El endocrinólogo debe ejercer su rol anteriormente señalado1 siguiendo las normas de la Endocrine Society2 complementadas con los Standars of Care de la WPATH3.
I. Niño prepuberal
No se indica terapia endocrina. El rol del endocrinólogo infantil es realizar el diagnóstico diferencial con Trastorno del Desarrollo Sexual (TDS), controlar al niño hasta etapa II de Tanner o mantener contacto con el pediatra para iniciar la terapia endocrinológica cuando esté indicada. Un gran porcentaje de los niños con síntomas de TIG, en el curso del desarrollo logran la concordancia entre su identidad y rol de género con su sexo biológico y civil. Los que persisten expresando su TIG experimentan al inicio de la pubertad una reafirmación de su identidad de género y el rechazo a su corporalidad, pudiéndose generar una intensa disforia de género, riesgo de suicidio, automutilación, etc.
La importancia de la participación del endocrinólogo pediatra es reciente, iniciándose el tratamiento del TIG púber y adolescente en Holanda4. En base a esta experiencia la WPATH3 y la Endocrine Society2 elaboraron las normas de tratamiento de esta etapa. En USA la participación de los pediatras endocrinólogos se inicia más tardíamente y según Houk y Spack encabezados por tratantes de centros de TDS5-8. El problema estaba sumergido y eclosionó fuertemente en los últimos años, planteando un desafío interesante al endocrinólogo pediatra9. Situación similar ocurre actualmente en Chile.
II. Púber (etapa II a V de Tanner)
En TIG persistente el objetivo es bloquear el desarrollo puberal cuyos cambios fisicos son odiados y causan gran dolor; en el TIG de femenino a masculino (F →M) detener o impedir el desarrollo mamario y la menstruación. En el TIG de masculino a femenino (M → F) evitar el cambio de voz, la pilosidad, contornos oseos faciales, etc. Se logra inhibiendo el eje hipotálamo hipofisis gonadal (HHG) con análogo del GnRH o progestina.
Criterios de elegibilidad para uso de análogo del GnRH o progestina.
- Cumplir con criterios de TIG.
- Etapa II de Tanner.
- Ausencia de comorbilidades psiquiátricas o estar en tratamiento que no contraindique la readecuación corporal.
- Contar con evaluación sicologica y apoyo social adecuado, comprension realista de resultados esperados, conocimiento de riesgos y beneficios de esta terapia.
El compromiso del púber y de su familia debe concretarse en un consentimiento informado de padres o tutores a objeto de respaldar legalmente al endocrinologo tratante.
Ventajas de esta terapia
- Totalmente reversible, al suspenderla el eje HHG se reactivara.
- Alivia la disforia.
- El TIG púber manifiesta su satisfacción por la supresion del avance de la pubertad, lo que confirma el diagnostico.
- Permite un periodo de tiempo (entre los 12 y 16 años) para evaluar la persistencia del deseo de reasignación corporal y alrededor de los 16 años iniciar la terapia hormonal cruzada (THC), fase parcialmente reversible. Consiste en administrar andrógenos al TIG F → M y estradiol al TIG M → F.
- Otorga una via de solución al problema evitando una peligrosa automedicación.
- Previene intentos suicidas o de automutilación y conductas sociales de riesgo.
Desventaja
El retardo puberal farmacológico retrasa la maduración osea permitiendo mayor crecimiento pero disminuye el contenido mineral oseo demostrable por densitometria, hecho recuperable con la THC. Lo mismo se ha senalado en terapia de pubertad precoz, en que al suspenderla se recupera la masa osea por el reinicio de la función gonadal2,10-15.
Frenación de gonadotrofinas y esteroides gonadales
1. Analogo del GNRH
Mecanismo de acción: actuando en el receptor del GnRH del gonadotropo primero estimula y luego desensibiliza suprimiendo la pulsatilidad de las gonadotrofinas. Esta acción se mantiene en el tiempo por una prolongada ligazon del análogo al receptor del GnRH generando un hipogonadismo hipogonadotropo.
Análogos utilizados: acetato de Leuprolide 3,75 mg en su forma depot, IM mensual o de 11,25 mg cada 12 semanas (Lupron depot) o acetato de Triptorelina (Decapeptyl) de 3,75 y 11,25 mg.
Control clínico de la frenación del desarrollo puberal y disminución de los valores de testosterona, LH y FSH en el TIG M → F y de FSH, LH y estradiol en el TIG F → M.
Efectos secundarios: en TIG M → F falta de energía y fuerza, desanimo, disminución de líbido y erección, disminución de masa osea.
El costo de financiar la terapia es muy elevado, utilizándose como alternativa progestinas de acción prolongada como medroxiprogesterona acetato de depósito (MPA).
2. Medroxiprogesterona acetato depot
La frenación con MPA 150 mg IM mensual (Depoprodasone®) no es tan completa y rápida como ocurre con análogos. En TIG F → M persisten valores de estradiol que estimulan el endometrio retardando obtener la amenorrea o aparece un goteo permanente por varios meses.
Debe vigilarse su efecto glucocoticoide por ligazón a esos receptores2. En caso de goteo o flujo rojo persistente puede agregarse un gestageno oral tipo nomegestrol (Lutenyl®, Numenor®) 5 mg o levonorgestrel (Microval®) 0,03 mg por vía oral diariamente, lo que contribuye a atrofiar el endometrio y frenar gonadotrofinas.
La frenación se combina con antiandrógenos en la readecuación corporal de TIG M → F.
Antagonismo del andrógeno en su receptor
Antiandrógeno
Impide la acción del andrógeno compitiendo por su receptor.
Ciproterona y Espironolactona además inhiben la enzima 5 alfa reductasa que transforma testosterona en dihidrotestosterona, hormona de mayor potencia androgénica que actúa especialmente en glándulas sebáceas y folículo piloso. Espironolactona también disminuiría la secreción de andrógenos a nivel testicular y dosis de Ciproterona pura de 100 a 200 mg diarios inhiben gonadotrofinas. Flutamida es de acción exclusiva en el receptor de andrógenos. Se inician desde etapa II de Tanner.
Dosis utilizadas
Flutamida: 250 mg por 2 veces al día. Espironolactona: de 100 a 200 mg por 2 veces al día.
Ciproterona: no recomendamos utilizar la combinación existente en Chile de etinilestradiol-acetato de ciproterona (Diane® y similares), ya que la dosis de ciproterona (2 mg) es muy inferior a los comprimidos de 50 a 100 mg de ciproterona pura (Androcur®) utilizados en Canada, Brasil y Europa; además la combinación disponible contiene 35 μg de etinilestradiol, estrógeno de riesgo trombogénico.
Se evalúan los efectos sobre vello sexual, secreción sebacea, voz y monitoreamos valores de potasio en espironolactona por riego de hiperkalemia, y pruebas hepáticas en flutamida por riesgo de hepatotoxicidad, igual que en terapia de hirsutismo16-18.
III. Adolescente
Antes de iniciar THC en el adolescente se debe discutir: a) fertilidad futura con el consultante y su familia. De existir interés en guardar gametos debe efectuarse en este momento, refiriéndolo a medicina reproductiva3,19; b) el efecto negativo sobre la talla final de existir aún cartílago de crecimiento; c) en el TIG de F → M informar sobre riesgo oncológico en ovario y útero de la terapia androgénica si no se extirpan posteriormente.
En el adolescente que consulta después de los 16 años sin previa frenación del eje HHG realizamos la terapia señalada anteriormente, antes o conjuntamente con THC. En el tratado con frenación antes de los 16 años conviene continuarla hasta que posteriormente la administración de estrógeno o andrógeno sea capaz de mantenerla al retirar el analogo o la MPA.
La frenación gonadotropica antes o en conjunto con la THC facilita masculinizar o feminizar con menores dosis de esteroides sexuales disminuyéndose los riesgos de su uso20.
Terapia hormonal cruzada
La experiencia en terapia de reemplazo estrogénica y androgénica en mujeres y varones biológicos no TIG ha servido de base a la THC.
TIG M → F
Objetivo: lograr desmasculinización con la terapia ya citada de análogos y antiandrógenos y feminizar administrando estrógeno.
Interrogar por antecedentes trombóticos personales y familiares u otras contraindicaciones de terapia estrogénica.
Evaluación de laboratorio: hormonal (testosterona, estradiol, gonadotropinas, prolactina) perfil lipídico y hepático, glicemia e insulinemia de ayunas.
Estrogenoterapia
Historicamente se uso etinilestradiol 100 microgramos al día, actualmente no recomendado por la alta frecuencia de fenomenos tromboembólicos, considerándose tambien una terapia inadecuada la administración de anticonceptivos orales (mezcla de progestagenos y estrógeno) o estrógenos inyectables que generan valores suprafisiológicos y tienen corto periodo de acción.
Vía oral: valerianato de estradiol de 2 a 6 mg al día, recomendandose iniciar con 2 mg. Es de bajo costo comparado con la vía transdérmica, pero el primer paso hepático conlleva riesgo de tromboembolismo, aunque mucho menor que con el etinilestradiol. También se ha usado estrogenos conjugados entre 0,625 y 2,5 mg al día21.
Vía transdérmica: parches de 50 a 100 mg al día de valerianato de estradiol, hoy superados por el estradiol gel administrado en sachet (SandrenaR) o mediante el dispensador en puff (Estreva®, Ginoderm®, Hormogel®). Se debe considerar el aporte de estradiol de cada puff o sachet de gel para alcanzar la dosis terapéutica. Se recomienda monitorear el estradiol plasmático y no superar los 200 pg/ml para evitar riesgos asociados. La testosterona plasmática debe encontrarse en rango femenino (< 55 pg/ml)2.
Instruir sobre la aplicación adecuada, evitando mamas, cara y genitales externos, esperar la absorción del gel (piel seca), evitar baño o deporte pos gel, lavarse las manos luego de su utilización, y recordar que el contacto piel-piel con otra persona pos aplicación traspasa la hormona.
Control clinico y seguimiento
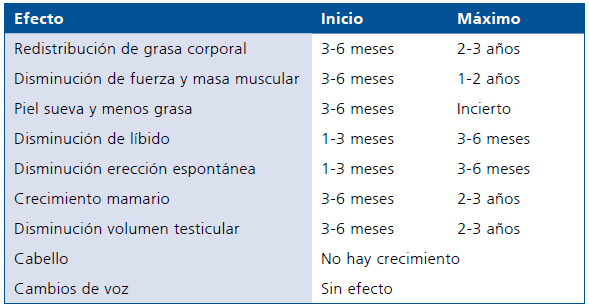
Realizar controles regulares con examen clínico: piel, mama, genitales, presión arterial, peso, redistribución de tejido graso. Laboratorio: estradiol plasmático, gonadotropinas, testosterona, prolactina (por riesgo de hiperprolactinemia), perfil lipídico y hepático, glicemia e insulinemia de ayunas. Según clínica y laboratorio ajustamos la dosis. Debe explicarse que los cambios fisicos demoran en presentarse (Tabla 1) y alguno de ellos, como el desarrollo mamario, puede no corresponder con lo deseado requiriendo prótesis mamaria; esta y otras medidas cosméticas se pueden realizar en este periodo. Controlar densitometría osea.
Tabla 1. Efectos y tiempos observados en el proceso de feminización con la terapia hormonal en persona transexual M → F
Modificado de Hembree2 y WPATH3.
El crecimiento mamario debe ser vigilado ya que se ha descrito fibroadenomas y cáncer mamario bajo estrogenoterapia.
Se aconseja apoyo sicoterapéutico para asimilar los cambios corporales y los sociales, ya que en esta etapa terapéutica se debe realizar conjuntamente el ejercicio del rol de género femenino en la vida familiar y social.
Al cumplir 18 años se discute si se desea pasar a terapia quirúrgica de reconstrucción genital, enfatizando que permanecera la prostata, que al igual que la mama deben ser objeto de control en el curso de la vida. De ser extirpados los testículos y no continuar con la estrogenoterapia se producirá un hipogonadismo y compromiso de la masa osea2,3.
Es poco usada la administración concomitante de progesterona o progestágeno cíclico por su discutible efecto en crecimiento mamario y riesgo asociado al uso crónico de algunos progestagenos.
TIG F → M
Objetivo: desfeminizar frenando la producción de estradiol con análogo del GnRH o MAP y masculinizar administrando testosterona.
Evaluación previa a la terapia
De existir trastornos menstruales (amenorrea-oligomenorrea- metrorragia) y clínica de hiperandrogenismo (acne-seborrea-hirsutismo) se debe descartar el síndrome de ovario poliquístico (SOP). Se ha comunicado mayor frecuencia de SOP (25 a 58%) previo a la terapia androgénica en TIG de F → M. Además durante la terapia androgénica se ha comprobado la aparición de cambios histopatológicos en el ovario compatibles con este cuadro22,23. Otro autor no ha encontrado diferencia significativa en la prevalencia de SOP comparado con población normal24. Existiendo SOP se debe estudiar y tratar la resistencia insulínica y el síndrome metabólico.
Frenación del eje HHG: se siguen los mismos criterios senalados anteriormente en TIG M → F. El no usar el análogo del GnRH y preferir MAP por motivo economico retarda el inicio de la amenorrea en TIG F → M y se produce sangramiento prolongado en el 30% de los casos cuando se utiliza solo testosterona19.
Androgenoterapia
Enantato de testosterona (ampollas de 250 mg). Actualmente nuevamente disponible en Chile.
Mezcla de esteres de testosterona: propionato, fenilpropionato, isocaproato y decanoato en ampolla de 250 mg (Sustenan depot®).
Ambos se administran por vía IM recomendándose cada 15 días. Es necesario individualizar la terapia ya que originan niveles fluctuantes suprafisiológicos en los primeros días y su duración es variable. En nuestra experiencia monitoreando los valores plasmáticos de testosterona en varones no TIG sustituidos con enantato de testosterona, a los 7, 15, 21 y 28 días se encontró que el 82% a los 7 días tenían valores suprafisiológicos y el 55% requerían administración cada 15 días para mantenerla en rango normal; sólo un porcentaje menor logró normoandrogenemia hasta los 21 días. Concluimos que pese a la personalización de la terapia no se evita la dosis suprafisiológica inicial, pero sí permite asignar la adecuada frecuencia de administración25.
Undecanoato de testosterona (Nebido®) en ampolla de 1.000 mg. Se utilizan dosis IM cada 12 ± 2 semanas de acuerdo a la duración del nivel plasmático de testosterona que debe ser monitorizado. Algunos recomiendan que ante una baja testosterona plasmática previa a la nueva inyección, se utilice en estos días gel de testosterona como alternativa a inyectar cada 10 semanas. El undecanoato produce niveles de testosterona en el rango medio normal, lo que sería una protección contra la policitemia generada por los niveles suprafisiológicos obtenidos con los otros esteres de testosterona. También evita los efectos clínicos que estos últimos producen por los altos niveles y caídas abruptas que generan26.
Vía transdérmica. Se descartaron los parches de testosterona por los fenómenos irritativos cutáneos, utilizándose la testosterona en gel al 1%. Existen sachet y dispensador que permiten dosificar este gel administrándolo generalmente a la dosis de 50 mg al día equivalente a 1 sachet de 5 g (Actiser T®, Testogel®). La rutina diaria de administración y las medidas al aplicarlos limita su utilización.
Por motivo económico en consulta privada y al no disponerse de estos farmacos de elevado costo en el sector público (agonista del GnRH, Nebido®, gel de testosterona, gel de estradiol), el endocrinólogo se enfrenta a la dificultad de no poder realizar una potente frenación gonadotrópica e impedido de indicar la mejor vía de administración de andrógenos o estradiol. Valoramos el esfuerzo realizado por el Ministerio de Salud en la elaboración del documento "Via clínica para la readecuación corporal en personas con incongruencia entre sexo fisico e identidad de genero"27 (2010), en el que tuvo participación uno de nosotros (R.R.). Es el primer documento de una politica de salud respecto al TIG pero es discutible en el acapite "redes asistenciales", lo senalado "que los fármacos requeridos son usualmente de bajo costo y su disponibilidad será responsabilidad de cada establecimiento". Esperamos que en el futuro se disponga de un programa de atención del TIG realizado por equipo multiprofesional con financiamiento de exámenes y terapias de mayor costo, tanto en la salud pública como privada.
Otros fármacos a utilizar: Dihidrotestosterona (DHT) gel al 2,5% (Andractim®). Basado en la terapia del micropene se ha sugerido el uso local de DHT gel para maximizar el crecimiento del clitoris que favorece un mejor resultado de la faloplastía y vida sexual. De resultados variables, no se dispone del medicamento en el pais.
Finasteride. De producirse alopecía androgénica se recomienda su uso en dosis de 1 mg/día. Este fármaco inhibe la 5 alfa reductasa que transforma testosterona en DHT.
Inhibidores de la aromatasa. Durante la terapia androgénica la aromatasa presente principalmente en el tejido adiposo puede convertir la testosterona en estradiol impidiendo alcanzar el objetivo de mantener el estradiol en rango masculino. En TIG F → M obeso con estradiol elevado, indicar dieta, ejercicio, baja de peso e inhibidores de la aromatasa: Anastrazol 1 mg al día, (Arimidex®, Trozolet®) y Letrozol 2,5 mg al día (Femara®) contrarrestando la aromatización periférica.
Control clínico y seguimiento
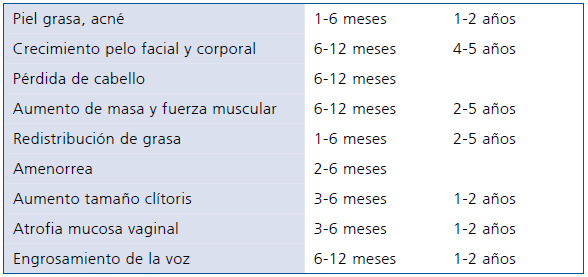
Vigilar la aparición de los cambios corporales que indiquen desfeminización y masculinización. Debe advertirse que el inicio del efecto de la testosterona y el tiempo para que su acción se manifieste y alcance su máximo varía según el efector29 (Tabla 2).
Tabla 2. Efectos y tiempos observados en el proceso de masculinización con la terapia hormonal en persona transexual F → M
Modificado de Hembree2 y WPATH3.El examen físico incluye control de presión arterial, peso, circunferencia abdominal y cambios en redistribución de grasa y masa muscular. Examinar glándula mamaria pre mastectomía y pos mastectomía pues se ha descrito cáncer de mama en tejido residual. Exámenes de laboratorio: metabólicos (glicemia e insulinemia, perfil lipídico y hepático, hemograma); hormonales: FSH–LH–Estradiol para evaluar frenación y posteriormente estradiol y testosterona durante la THC.
El análogo del GnRH o la MPA pueden disminuir la densidad mineral osea, aunque se ha comunicado que la administración de andrógenos es favorable para mantener la masa osea29.
Bajo terapia androgénica debe solicitarse ecotomografía ginecológica por riesgo oncológico uterino y ovárico o aparición de imagen de SOP no existente previamente.
Complicaciones de la THC
La THC prolongada se ha vinculado a riesgos de osteoporosis, cardiovasculares (especialmente tromboembolismo) y aparición de tumor: hipofisiario (prolactinoma en TIG M → F), ovarico y mamario, discutiéndose posibles riesgos en prostata y endometrio. Se recomienda revisar la amplia literatura existente2,3,19-21,30.
Los factores de riesgo en morbimortalidad de la terapia de readecuación corporal deben explicarse previo a la obtención del consentimiento informado y vigilarlos durante el seguimiento clínico. En TIG M → F en la época en que se utilizaba etinilestradiol en dosis altas, la morbimortalidad fue mayor que en la población general; esto no ocurre con la actual terapia estrogénica. Solo en TIG M → F se ha documentado aumento de mortalidad por razones no dependientes de la THC como mayor tasa de suicidios, SIDA, abuso de drogas, posiblemente relacionados con factores sicosociales31.
Terapia en adultos
Se aplican los mismos criterios para frenación del eje HHG, uso de antiandrógenos y THC que lo senalado anteriormente.
Se obtiene inferiores resultados a los cambios físicos alcanzados en adolescente y exige prudencia en el uso de las dosis de estradiol o testosterona por mayor riesgo por la edad y comorbilidades. Es recomendable indicar testosterona por vía transdérmica para retirarla prontamente si hay poliglobulia o aumento del antígeno prostático.
Terapia en pre y pos operatorio de cirugía de readecuación corporal
Antes de la gonadectomia de continuar utilizándose la frenación en ambos tipos de TIG y el antiandrógeno en TIG M → F, deben suspenderse. Después de la cirugía se mantiene la THC, reduciendo las dosis si se han logrado los cambios físicos esperados.
Referencias bibliográficas
- Devoto E, Martinez A, Aravena L. 2015. Trastorno de identidad de genero. Parte I: Definición, epidemiologia, etiologia, rol del endocrinologo en diagnostico y tratamiento. Rev Chil Endocrinol Diabetes 8: 167-173.
- Hembree WC, Cohen-Kettenis P, Delamarre-van de Waal HA, Gooren LJ, Meyer WJ, Spack NP, et al. 2009. Endocrine treatment of transsexual persons: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 94: 3132-3154.
- The World Professional Association for Transgender Health. Standars of Care for the Health of Transsexual, Transgender, and Gender Nonconforming People. 7th Version.
- Delemarre-van de Waal HA, Cohen-Kettenis PT. 2006. Clinical management of gender identity disorder in adolescents: a protocol in psychological and paediatric endocrinology aspects. Eur J Endocrinol 155: 131-137.
- Houk CP, Lee PA. 2006. The diagnosis and care of transsexual children and adolescents: a pediatric endocrinologist perpective. J Pediatric Endocrinol Metab 19: 103-109.
- Spack NP, Edwards-Leeper L, Feldman HA, Leibowitz S, Mandel F, Diamond DA, et al. 2012. Children and adolescents with gender identity disorder referred to a pediatric medical center. Pediatrics 129: 418-425.
- Schumer DE, Spack NP. 2013. Current management of gender identity disorder in childhood and adolescence: guidelines, barriers and areas of controversy. Curr Opin Endocrinol Diabetes Obes 20: 69-73.
- Lee PA, Houk CP. 2013. Evaluation and management of children and adolescents with gender identification and transgender disorders. Curr Opin pediatr 521-527.
- Meyer III WJ. 2012. Gender identity disorder: an emerging problem for pediatricians. Pediatrics 129: 571-573.
- Baudewijntje PCK, Cohen-Kettenis P. 2011. Puberty suppression in gender identity disorder: the Amsterdam experience. Nat Rev Endocrinol 7: 468-472.
- Garcia H, Youlton R, Burrows R, Catanni A. 2003. Consenso sobre el diagnostico y tratamiento de la pubertad precoz central. Rev Med Chile 131: 95-110.
- Eugstre E. 2015. The use of gonatropin-realeasing hormone analogs beyond precocious puberty. J Pediatrics 167: 481-484.
- de Vries ALC, Steensma TD, Doreleijers TAH, Cohen Kettenis P. 2011. Puberty suppression in adolescents with gender identity disorder: a prospective follow-up study. J Sex Med 8: 2276-2283.
- Leibowitz SF, Telingator C. 2012. Assessing gender identity concerns in children and adolescence: evaluation, treatments, and outcomes. Curr Psychiatry Rev 14: 111-120.
- Spack NP. 2013. Management of transgenderism. JAMA 309: 478-484.
- Devoto E, Aravena L. 2006. Actualización de la terapia del hirsutismo. Rev Chil Obstet Ginecol 71: 425-431.
- Devoto E. Aravena L, Rios R. 2000. Tratamiento del hirsutismo con espironolactona y con espironolactona mas dexametasona. Rev Med Chile 128: 868-875.
- Devoto E, Aravena L. 2004. Eficacia de la flutamida en el tratamiento del hirsutismo. Contribución del uso combinado con anticonceptivos orales en mujeres normoandrogénicas. Rev Med Chile 132: 845-852.
- Gooren LJ. 2014. Management of female -to- male transgender persons: medical and surgical management, life expectancy. Curr Opin Endocrinol Diabetes Obes 21: 233-238.
- Moore E, Wisniewski A, Dobs A. 2003. Endocrine treatment of transsexual people: a review of treatment regimens, outcomes, and adverse effects. J Clin Endocrinol 88: 3467-3473.
- Frade Costa EM, Mendonca BB. 2014. Clinical mangement of transsexual subjects. Arq Bras Endocrinol Metab 58: 88-96.
- Futterweit W, Deligdich L. 1986. Histopathological effects of exogenously administered testosterone in 19 female to male transsexuals. J Clin Endocrinol Metab 62: 16-21.
- Baba T, Endo T, Honnma H, Kitajima Y, Hayashy T, Ikeda H, et al. 2007. Association between polycystic ovary síndrome and female -to- male transsexuality. Human Reproduction 22: 1011-1016.
- Mueller A, Gooren LJ, Naton-Schotz S, Cupisti S, Beckmann M, Diettrich R. 2008. Prevalence of polycystic ovary syndrome and hyperandrogenemia in female -to- male transsexuals. J Clin Endocrinol Metab 93: 1408-1441.
- Devoto E, Aravena L. 2013. Andropausia. Endocrinología Ginecológica. Inés de la Parra, Cortelezzi M. 1ª Ed Buenos Aires. Ed Ediciones Jornal Capítulo 7, 6. Pág 287-294.
- Mueller A, Kiesewetter F, Binder H, Beckmann W. 2007. Long-term administration of testosterone undecanoate every 3 month for testosterone supplementation in female -to- male transsexual. J Clin Endocrinol Metab 92: 3470-3475.
- Ministerio de Salud. Subsecretaría de Salud Pública. División de prevención y control de enfermedades. Vía clínica para la adecuación corporal en personas con incongruencia entre sexo físico e identidad de género. Junio 2010.
- Saad F, Aversa A, Isidori AM, Zafalon L, Zitzmann M, Gooren L. 2011. Onset of effects of testosterone treatment and time span until maximum effects are achieved. Eur J Endocrinol 165: 675-685.
- van Kesteren P, Lips P, Gooren L, Asscheman H, Megens J. 1998. Long -term follow up of bone mineral density and bone metabolism in transsexual treated with cross- sex hormones. Clin Endocrinol (Oxf) 48: 347-354.
- Gooren LJ, Giltay EJ, Bunck MC. 2008. Long-term treatment of transsexual with cross- sex hormones: extensive personal experience. J Clin Endocrinol Metab 93: 19-25.
- . Ascheman H, Gitay E, Mejens J, de Ronde W, van Trotsenburg M, Gooren L. 2011. Along -term followup study of mortality in transsexuals receiving treatment with cross- sex hormones. Eur J Endocrinol 164: 635-642.