Estudio e identificación de microRNA en exosomas urinarios en hipertensión arterial mineralocorticoide
Alejandra Tapia-Castillo1,3, Carolina Valdivia P.1, Carmen Campino J.1,4, Fidel Allende2, Sandra Solari2, David Ortiz1, Eric Barros1, Andrea Vecchiola1,4, Rene Baudrand1, Carlos Fardella1,4 y Cristian Carvajal M.1,4
Study and identification of microRNA in urinary exosomes in mineralocorticoid arterial hypertension
1Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
2Departamento de Laboratorios Clínicos, Facultad de Medicina, Pontificia Universidad Católica de Chile.
3Centro Genética y Genómica, Facultad de Medicina, Universidad del Desarrollo.
4Instituto Milenio de Inmunología e Inmunoterapia (IMII).
Fuentes de financiamiento: Este trabajo fue apoyado por SOCHED 2015-10, CONICYT-FONDECYT 1150437,
1160695, 1160836, CONICYT-FONDEQUIP EQM150023, IMII P09/16-F, CETREN-UC.
Declaración: Los autores declaran no tener conflictos de interés.
Correspondencia:
Cristian A. Carvajal, PhD. Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
Diagonal Paraguay 362, 4° piso, Santiago Centr, 8330077, Santiago, Chile.
Teléfono: (56-2) 2354-3639
Fax: (56-2) 2638-5675
ccarvaja@med.puc.cl
Recibido: 04-01-2018
Aceptado: 27-01-2018
About 15% of the essential hypertensive patients would have a low activity of the 11βHSD2 enzyme, which inactivates cortisol (F) to cortisone (E). Gene expression can be negatively regulated by miRNA. Urinary exosomes and their specific content (miRNA/
proteins) represent a valuable tool as a biomarker for the diagnosis and prognosis
of the disease. Aim: To evaluate the expression of miRNA specific for 11βHSD2 in samples
of urinary exosomes and to determine its association with biochemical variables
associated with mineralocorticoid metabolism. Subjects and Methods: Cross-sectional
study in subjects between 10-60 years. They were classified into subjects with high F/E (> p75) and low cortisone (< p25) and control subjects. The urinary exosomes were
isolated with the Invitrogen kit. Bioinformatic analysis was performed with MirWalk to
identify specific miRNAs of HSD11B2. The expression of miRNA was evaluated by qRTPCR.
The comparisons were made with the Mann-Whitney test. Results: 7.1% of the
subjects are suggestive of a partial deficiency of 11βHSD2 (NC-AME). The expression
of miR-488 was higher in NC-AME than in controls (5839 ± 1719 vs 3,437 ± 2,581;
p = 0.01). We found positive associations between mir-615 and ARP; miR-488 and the sodium/potassium ratio; miR-1205 with age and urinary sodium excretion; miR-494 with age, activity MMP9 and NGAL. Conclusion: We identified high expression of miR-
488 in NC-AME subjects and associations of miRNAs with biochemical variables associated with mineralocorticoid metabolism. Thus, exosomes and their miRNA content could be potential regulators and biomarkers of 11βHSD2 activity.
Key words: Hypertension, 11βHSD2, mineralocorticoid receptor, microRNA, exosomes
La hipertensión arterial es una enfermedad de alta prevalencia en Chile, alcanzando al 27% de la población (ENS 2017) y se considera una de las primeras causas de muerte a nivel mundial, por accidente cerebrovascular y enfermedad cardíaca1.
Estudios previos muestran que alrededor de un 15% de los hipertensos esenciales tendrían una inadecuada metabolización de cortisol (F) a su metabolito inactivo cortisona (E), lo cual podría activar la vía mineralocorticoide a nivel renal y vascular2. Se ha planteado que este fenómeno puede tener su origen etiológico en un déficit de la enzima 11β-hidroxisteroide deshidrogenasa tipo 2 (11βHSD2). Cuando está enzima esta inactiva en forma parcial o total, ya sea por una alteración genética de HSD11B2 (NG_016549; OMIM 614232; ENSG00000176387)3 o ingesta de inhibidores exógenos (Ej. licorice y carbenoxolona)4, o endógenos (GALFs, factores tipo ácido B-glicirriténico), el cortisol que circula en concentraciones 1.000 veces más altas que la aldosterona, puede activar al receptor de mineralocorticoide (MR) y producir los mismos efectos que la aldosterona5.
Nuestro grupo previamente ha demostrado que la enfermedad hipertensiva asociada al déficit 11βHSD2 podría ser más frecuente de lo esperado, sugiriendo que una alta frecuencia de estos trastornos no están siendo diagnosticados. A nivel poblacional la frecuencia de mutaciones en las regiones codificantes del gen de HSD11B2 son extremadamente baja. Así, otros mecanismos deberían ser capaces de explicar la regulación de la expresión de la enzima 11βHSD2, entre ellos, las modificaciones epigenéticas serían potenciales reguladores de la actividad de la 11βHSD2 mediante el control transcripcional y traduccional del gen HSD11B26,7.
La metilación, modificación de las histonas y los RNA no codificantes son los principales mecanismos de modificaciones epigenéticas, y son elementos claves en la regulación post-transcripcional de la expresión génica. En los últimos años, se ha prestado cada vez más atención al papel de los miRNAs circulantes en la enfermedad hipertensiva. Los miRNAs circulantes podrían desempeñar un papel importante como biomarcadores y comunicadores intercelulares en la predicción, diagnóstico y tratamiento personalizado de pacientes hipertensos8,9. Sin embargo, la regulación epigenética por miRNA de la 11βHSD2 aún no ha sido bien elucidado. Solo dos estudios en animales han evaluado la relación entre la expresión de miRNA y 11βHSD2 in vivo, los cuales aportan las primeras evidencias de la asociación entre miRNA, 11βHSD2 y presión arterial10. Por otro lado, el contenido tejido-específico de tales modificaciones epigenéticas es un desafío actualmente. En este contexto, los exosomas, pequeñas vesículas de membrana, liberadas desde diferentes tipos celulares para comunicación celular, reflejan el estado fisiológico de las células de origen y su contenido específico de RNA, miRNA y proteínas; pueden ser una valiosa herramienta biomédica para identificar potenciales mecanismos fisiopatológicos implicados en la génesis y desarrollo de hipertensión arterial mineralocorticoide11. Así, resulta relevante determinar un perfil de expresión de miRNA que afecten la expresión de la enzima 11βHSD2, en exosomas de fluidos como la orina y que den cuenta del metabolismo local y de la condición fisiopatología del tejido renal.
Materiales y Métodos
Sujetos
Se estudió una cohorte de 127 sujetos chilenos, de ambos sexos, entre 10 y 60 años, reclutados para un estudio previo. Todos los pacientes hipertensos que ingresaron al estudio cumplían los siguientes criterios: Ser hipertensos con valores de presión arterial > 140/90 mmHg (JNC-VI) o mayor al p95 de HTA sisto-diastólica en niños (Task Force 4). Ausencia de antecedentes de patología crónicas como insuficiencia renal, insuficiencia cardíaca, diabetes mellitus, daño hepático crónico o endocrinopatías. Los sujetos que habían recibido glucocorticoides (cortisol, prednisona, entre otros) o mineralocorticoides (fludrocortisona) en los 2 meses previos al inicio del estudio, fueron excluidos. Dado que la mayoría de los pacientes hipertensos podrían haber estado recibiendo algún antihipertensivo al momento del estudio, se les exigió un período libre de fármacos de 15 días (como habitualmente se realiza en clínica) bajo estricta supervisión médica. En los sujetos que presentaban enfermedad hipertensiva severa (estado 3 de la clasificación de JNVC) no se realizó dicha suspensión o se usaron bloqueadores alfa-adrenérgico (doxasosina, ej: Cardura XL) que no interfieren en la medición de la actividad renina plasmatica (ARP).
El protocolo seguido en este estudio se escribió de acuerdo con las directrices de la Declaración de Helsinki y fue aprobado por el Comité Ético de la Facultad de Medicina de la Pontificia Universidad Católica de Chile. El estudio y el protocolo se explicaron a todos los participantes y se obtuvo el consentimiento informado por escrito y asentimiento en el caso de los niños.
Análisis bioquímicos
Todos los pacientes seleccionados tienen una ficha clínica donde se consignaron los datos más relevantes de la historia clínica y del examen físico, así como los exámenes generales que se realizan habitualmente en el programa de hipertensión y que son perfil bioquímico, hemograma VHS, creatininemia, creatinuria, electrolitos plasmáticos, aldosterona, actividad de renina plasmática En todos los sujetos se realizó la determinación de los niveles de cortisol (F) y cortisona (E), mediante HPLC-MS/MS. Además, de estos sujetos se disponen muestras de sangre y orina 24 h y matinal para determinar diferentes analitos incluidos en el estudio.
Aislamiento de exosomas
Desde las muestras de orina matinal de todos los participantes, se aislaron exosomas urinarios con el kit de Invitrogen (Total exosome isolation kit, cat#4484452) de acuerdo al protocolo del fabricante, y posteriormente se aisló RNA total, miRNA y proteínas con el kit de life Technologies (Total Exosome RNA & Protein Isolation Kit, cat # 4478545). La caracterización de exosomas fue realizada mediante microscopía electrónica y se identificó por western-blot proteínas específicas de exosomas (CD63, TSG101).
Análisis bioinformático
Se realizó una búsqueda bioinformática a partir de bases de datos como NCBI, DianaLab, MirBASE y MirWalk 2.0 para identificar miRNA blancos de unión en el 3’UTR de la HSD11B2 en humanos, y un análisis bibliográfico de potenciales miRNA asociados a HTA y HSD11B2 en humanos.
Análisis de expresión
La transcripción reversa se realizó para cada miRNA, en específico, utilizando el kit TaqMan MicroRNA RT (Applied Biosystems, Foster City, CA). Se usó la expresión del RNA-U6 como un control de normalización interno. Los niveles de expresión de los miRNA se evaluaron con el kit TaqMan Micro RNA Assay en el equipo RotorGene 6000 (Corbett Research, Sydney, Australia).
Análisis estadístico
Los resultados se expresan como promedio ± desviación estándar o mediana (rango intercuartil, (Q1-Q3)). Las comparaciones estadísticas se realizaron usando el test de Mann-Whitney. Las asociaciones se analizaron mediante correlación de Pearson (r) con el software GraphPad Prism v5.0. Las diferencias y asociaciones se consideraron significativas a P < 0,05.
Resultados
De los 127 sujetos estudiados, identificamos 9/127 sujetos (7,1%) que presentan una alta razón F/E (> p75) y cortisona baja (p < 25) predefinidos como potenciales o sugerentes de tener un síndrome de exceso aparente de mineralocorticoides (SEAM) o conocido en ingles como “Apparent mineralocorticoid excess” AME “No clásico” (NC-AME )12 (Figura 1). Las características clínicas y bioquímicas son mostradas en la Tabla 1. Ambos grupos fueron comparables en términos de edad, sexo, aldosterona y cortisol. Los sujetos con NC-AME en comparación con sujetos sin NC-AME tienen una PA sistólica significativamente más alta (140,7 [119,5-156,8] vs 126,5 [115,0-135,8]; p = 0,03), FEK + (8,2 [6,1-10,7] vs 6,6 [5,1-8,2]; p = 0,01), una ARP menor (1,6 [1,1-2,4] vs 1,6 [0,9-2,7]; p = 0,01) y una MAC más alta (mg/24 h) (18,5 [9,4-117,8] vs 7,3 [5,0-11,6]; p < 0,0001).
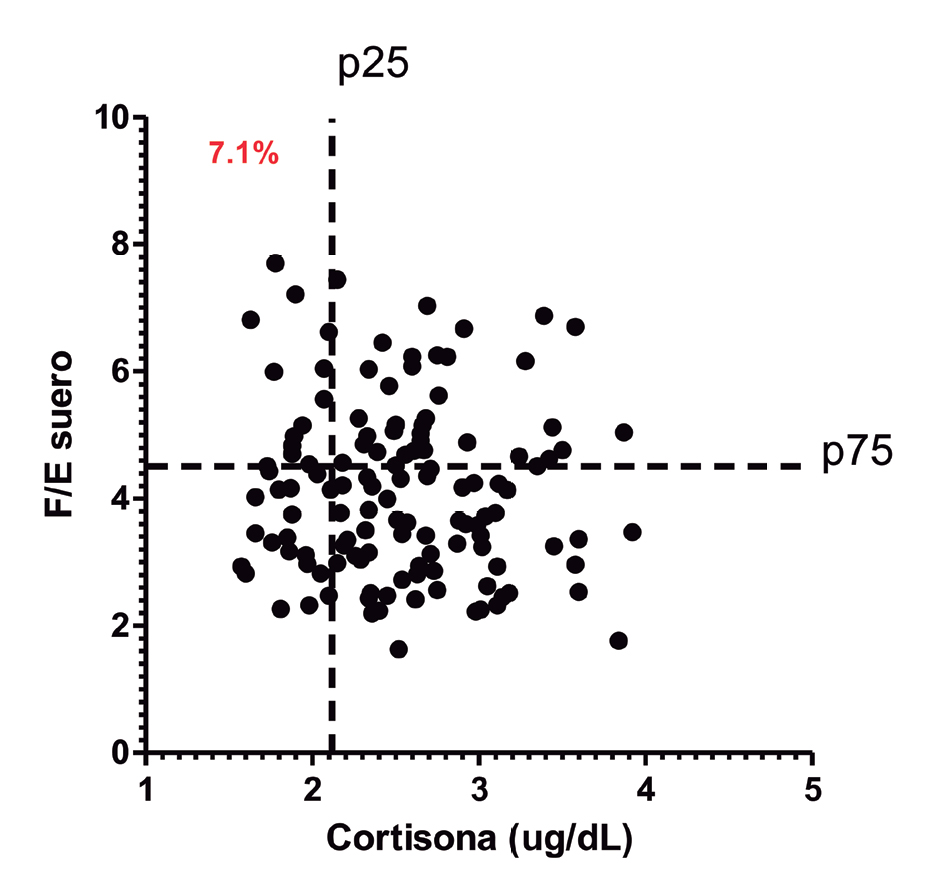 Figura 1. Clasificación de sujetos con sugerente NC-AME. Asociación de la relación F/E y los niveles de cortisona en la población total de estudio (n = 127). Los sujetos NC-AME fueron clasificados de acuerdo a: razón F/E > p75 y cortisona < p25, representando un 7,1% de la población de estudio.
Figura 1. Clasificación de sujetos con sugerente NC-AME. Asociación de la relación F/E y los niveles de cortisona en la población total de estudio (n = 127). Los sujetos NC-AME fueron clasificados de acuerdo a: razón F/E > p75 y cortisona < p25, representando un 7,1% de la población de estudio.
Caracterización de exosomas urinarios en sujetos con alteraciones en la actividad de la 11HSD2 y sujetos controles
Los exosomas fueron aislados de muestras de orina matinal de todos los sujetos. El tamaño y la morfología de estas nanovesículas fueron adecuada según lo descrito en exosomas urinarios (Figura 2A). La distribución del tamaño de partículas es similar entre ambos grupos de sujetos (Figura 2B), encontrando que un 73% de las nanovesículas urinarias obtenidas tienen un tamaño entre 50-150 nm en ambos grupos de sujetos y el 27% corresponde a nanovesículas con un tamaño mayor a 150 nm (Figura 2C). El porcentaje de nanovesículas menor a 50 nm corresponde a menos del 0,025% (Figura 2C). Así también, el análisis de distribución de tamaño de vesículas mostró un tamaño promedio de partículas de 121 ± 51 nm vs 124 ± 54 nm y una moda de 92,3 nm vs 97,5 nm, para el grupo NC-AME vs controles, respectivamente.
Tabla 1. Características clínicas y bioquímicas de sujetos con AME no clásico y sin AME no clásico
Características |
Sujetos NC-AME |
Sujetos sin NC-AME |
Valor p |
n |
9 |
118 |
-- |
edad |
34,2 [12,4-47,74] |
36,9 [14,1-46,77] |
0,96 |
Hombres, % |
33% |
45% |
0,73 |
Hipertensión, % |
66,7% |
51,7% |
0,38 |
Índice de masa corporal, kg/m 2 |
29,1 [27,6-32,45] |
26,18 [22,8-29,3] |
0,001 |
Presión arterial sistólica, mm Hg |
140,7 [119,5-156,8] |
126,5 [115,0-135,8] |
0,03* |
Presión arterial diastólica, mm Hg |
78,3 [66,1-94,7] |
80,0 [72,6-88,1] |
0,85 |
Aldosterona sérica, ng/dl |
4,8 [4,2-9,3] |
7,9 [5,15-12,85] |
0,17 |
Actividad renina plasmática, ng/mL*h |
1,6 [1,1-2,4] |
1,6 [0,9-2,7] |
0,01* |
Sodio sérico, mEq/L |
140,0 [138,5-140,5] |
140,0 [139,0-141,0] |
0,33 |
Potasio sérico, mEql/L |
4,2 [3,7-4,4] |
4,3 [4,1-4,6] |
0,12 |
Microalbuminuria, mg/24 h |
18,5 [9,4-117,8] |
7,3 [5,0-11,6] |
< 0,0001* |
Sodio urinario, mEq/24 h |
178,5 [132,3-213,5] |
141,0 [101,0-191,0] |
0,20 |
Potasio urinario, mEq/24 h |
50,0 [46,2-63,7] |
48,0 [33,0-61,0] |
0,06 |
FEK, 24 h |
8,16 [6,1-10,7] |
6,6 [5,1-8,2] |
0,01* |
Cortisol sérico, ug/dl |
11,5 [10,3-13,7] |
9,4 [7,0-12,7] |
0,35 |
Cortisona sérico, ug/dl |
1,9 [1,7-2,1] |
2,5 [2,2-2,9] |
< 0,0006* |
Razón cortisol/cortisona sérica |
6,0 [5,3-7,0] |
3,8 [2,9-4,7] |
< 0,0001* |
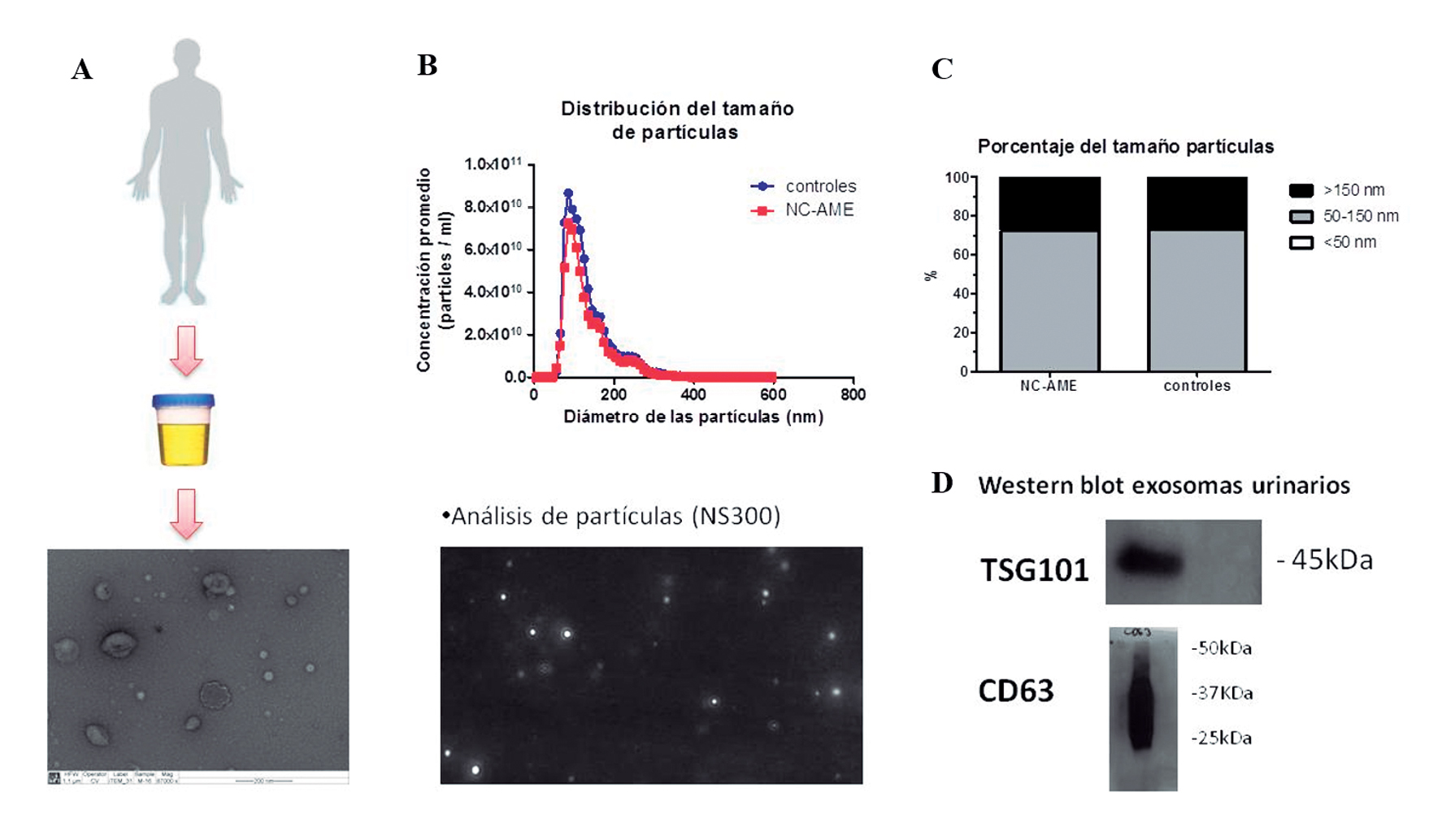 Figura 2. Caracterización de exosomas. Los exosomas fueron aislados desde orina matinal mediante ultracentrifugación y el análisis de partículas se realizó con el instrumento NanoSight NS500. A) Identificación de exosomas mediante microscopia electrónica. B) Distribución del tamaño de partículas de los dos grupos de sujetos estudiados. C) Porcentajes de partículas en 3 rangos de tamaño (< 50 nm; 50-150 nm; > 150 nm). D) Westernblot de proteínas exosomales.
Figura 2. Caracterización de exosomas. Los exosomas fueron aislados desde orina matinal mediante ultracentrifugación y el análisis de partículas se realizó con el instrumento NanoSight NS500. A) Identificación de exosomas mediante microscopia electrónica. B) Distribución del tamaño de partículas de los dos grupos de sujetos estudiados. C) Porcentajes de partículas en 3 rangos de tamaño (< 50 nm; 50-150 nm; > 150 nm). D) Westernblot de proteínas exosomales.
Expresión diferencial de miRNA específicos para HSD11B2 en exosomas urinarios de sujetos con alteraciones en la actividad de la 11HSD2 y sujetos controles
A partir del análisis bioinformático se identificaron 8 miRNA con alto “score” que, potencialmente, se unen a la región 3’UTR de HSD11B2 (Tabla 2). De los 8 miRNA seleccionados por el análisis bioinformático solo amplificaron 4 microRNA en más de un 50% de las muestras (miR-615, miR-488, miR-1205 y miR-494). De los 4 miRNA analizados, solo observamos diferencias significativas en la expresión de miR-488, el cual resultó estar mayormente expresado en sujetos NC-AME vs controles (5.889 [3.746-7.487] vs 2.607 [1.576-5.290] UR; p = 0,01) (Figura 3).
Tabla 2. Selección de microRNA con potencial unión a la región 3’UTR en HSD11B2
Gene Name |
RefseqID |
MicroRNA |
Seed length |
Start |
Position |
End |
Region |
Pvalue |
HSD11B2 |
NM_000196 |
hsa-miR-615-5p |
10 |
1704 |
1 |
1695 |
3 UTR |
0,0006 |
HSD11B2 |
NM_000196 |
hsa-miR-1205 |
9 |
1587 |
2 |
1579 |
3 UTR |
0,0023 |
HSD11B2 |
NM_000196 |
hsa-miR-488 |
9 |
1643 |
2 |
1635 |
3 UTR |
0,0023 |
HSD11B2 |
NM_000196 |
hsa-miR-101 |
8 |
1833 |
1 |
1826 |
3 UTR |
0,0092 |
HSD11B2 |
NM_000196 |
hsa-miR-193b* |
8 |
1408 |
2 |
1401 |
3 UTR |
0,0092 |
HSD11B2 |
NM_000196 |
hsa-miR-431 |
8 |
1626 |
2 |
1619 |
3 UTR |
0,0092 |
HSD11B2 |
NM_000196 |
hsa-miR-101 |
7 |
1832 |
2 |
1826 |
3 UTR |
0,0363 |
HSD11B2 |
NM_000196 |
hsa-miR-1205 |
7 |
1657 |
1 |
1651 |
3 UTR |
0,0363 |
HSD11B2 |
NM_000196 |
hsa-miR-494 |
7 |
1546 |
1 |
1540 |
3 UTR |
0,0363 |
HSD11B2 |
NM_000196 |
hsa-miR-637 |
7 |
1411 |
2 |
1405 |
3 UTR |
0,0363 |
Análisis bioinformático realizado en miRWalk 2.0. Los miRNAs asociados a HSD11B2 estan ordenados de acuerdo a su estabilidad termodinámica predicha por el análisis bioinformático (p value).
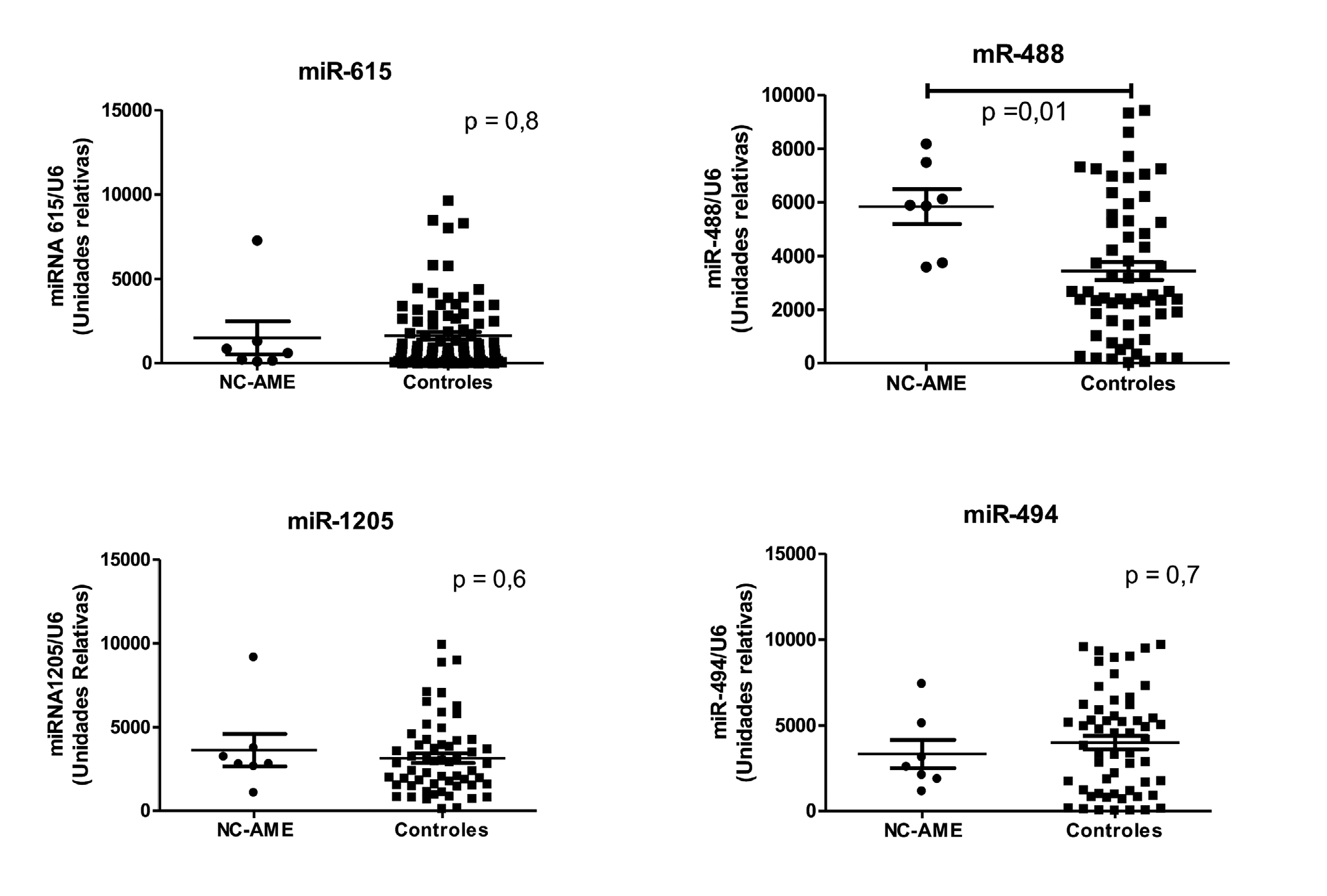 Figura 3. Expresión de miRNA en sujetos NC-AME y controles. Las comparaciones de grupos fueron realizadas con Mann-Whitney test considerando significativo p < 0,05.
Figura 3. Expresión de miRNA en sujetos NC-AME y controles. Las comparaciones de grupos fueron realizadas con Mann-Whitney test considerando significativo p < 0,05.
Estudio de asociación entre la expresión de miRNA y las diferentes variables clínicas y bioquímicas de los sujetos estudiados
En el total de los sujetos estudiados, realizamos análisis de asociación entre la expresión de los microRNA y los diferentes parámetros bioquímicos estudiados (Tabla 3). Observamos que miR-615 se asocia positivamente con la ARP (r = 0,25;
p = 0,02); miR-488 se asocia positivamente con la razón sodio/potasio urinario (r = 0,26; p = 0,04); miR-1205 se asoció positivamente con la edad (r = 0,26; p = 0,03) y la excreción de sodio urinario (r = 0,32; p = 0,01) y; miR-494 se asocia positivamente con la edad (r = 0,32; p = 0,01), actividad MMP9 (r = 0,28; p = 0,04) y NGAL (r = 0,66; p = 0,02) (Tabla 3).
Tabla 3. Correlación de variables clínicas/bioquímicas y miRNAs
|
miR-615 |
miR-488 |
miR-1205 |
miR494 |
||||
|
Valor p |
Rho |
Valor p |
Rho |
Valor p |
Rho |
Valor p |
Rho |
Edad, año |
0,43 |
-0,08 |
0,74 |
-0,04 |
0,03 |
0,26 |
0,01 |
0,32 |
IMC, Kg/m2 |
0,38 |
-0,09 |
0,93 |
0,01 |
0,09 |
0,22 |
0,16 |
0,18 |
PA sistólica, mmHg |
0,88 |
-0,02 |
0,78 |
0,03 |
0,61 |
0,06 |
0,75 |
0,04 |
PA diastólica, mmHg |
0,48 |
0,07 |
0,21 |
-0,16 |
0,58 |
0,07 |
0,51 |
0,08 |
Aldosterona, ng/dl |
0,62 |
0,05 |
0,56 |
-0,07 |
0,17 |
-0,17 |
0,79 |
-0,03 |
ARP, ng/ml*h |
0,02* |
0,25 |
0,82 |
-0,03 |
0,55 |
-0,08 |
0,52 |
-0,08 |
Sodio urinario, mEq/24h |
0,53 |
0,07 |
0,23 |
-0,15 |
0,01* |
0,32 |
0,55 |
0,08 |
Na/K urinario |
0,65 |
0,05 |
0,04* |
0,26 |
0,20 |
0,17 |
0,61 |
-0,07 |
PCRus, mg/L |
0,57 |
-0,06 |
0,81 |
-0,03 |
0,25 |
0,15 |
0,57 |
0,07 |
MAC, mg/24h |
0,66 |
0,05 |
0,11 |
0,21 |
0,67 |
0,06 |
0,89 |
-0,02 |
MDA, µM |
0,61 |
0,05 |
1,00 |
0,00 |
0,67 |
0,05 |
0,89 |
0,02 |
MMP-9, veces de cambio |
0,06 |
0,21 |
0,38 |
0,11 |
0,54 |
0,08 |
0,04* |
0,28 |
MMP-2, veces de cambio |
0,09 |
0,18 |
0,37 |
-0,11 |
0,36 |
0,12 |
0,18 |
0,18 |
PAI-I, ng/ml |
0,13 |
-0,16 |
0,41 |
-0,10 |
0,17 |
0,17 |
0,60 |
0,07 |
TNF-alfa, pg/ml |
0,35 |
0,10 |
0,97 |
-0,01 |
0,24 |
0,15 |
0,35 |
0,12 |
IL-6, pg/ml |
0,49 |
0,08 |
0,36 |
0,13 |
0,35 |
-0,14 |
0,36 |
-0,13 |
Cortisol sérico, ug/dl |
0,34 |
0,10 |
0,76 |
0,04 |
0,55 |
-0,07 |
0,93 |
-0,01 |
Cortisona sérica, ug/dl |
0,17 |
0,14 |
0,77 |
-0,04 |
0,61 |
-0,06 |
0,72 |
0,05 |
Razón F/E sérica |
0,86 |
0,02 |
0,73 |
0,04 |
0,61 |
-0,06 |
0,72 |
-0,05 |
NGAL, ng/mL |
0,09 |
-0,27 |
0,63 |
0,09 |
0,30 |
0,19 |
0,11 |
0,27 |
NGAL/MMP9, ng/mL |
0,38 |
-0,19 |
0,26 |
0,31 |
0,78 |
0,07 |
0,62 |
0,16 |
NGAL Total |
0,19 |
-0,28 |
0,61 |
0,14 |
0,26 |
0,28 |
0,02* |
0,66 |
Correlación de pearson. *p < 0,05.
Discusión
En este estudio identificamos que el 7,1% de los sujetos presenta déficit parcial de la enzima 11βHSD2 (razón F/E alta y cortisona baja) y observamos que estos sujetos presentan una elevada expresión de miR-488, el cual regularía negativa y postranscripcionalmente la traducción del mRNA de 11βHSD2.
Recientemente, numerosos estudios han demostrado que los miRNA están emergiendo como una nueva clase de biomarcadores en hipertensión arterial8,9. Los miRNA exosomales se han identificado en todo tipo de fluidos corporales, incluidos el plasma, las lágrimas, la saliva, el líquido peritoneal y la orina. De estas fuentes candidatas, la orina es una fuente particularmente deseable de biomarcadores para hipertensión mineralocorticoide, ya que podrían ser indicadores directos de la condición fisiopatológica a nivel renal. En 2013, Gildea et al. estudiaron el miARNoma de exosomas urinarios en sujetos sal sensible y encontraron que 45 miRNAs, probablemente, sean potenciales biomarcadores de la sensibilidad a la sal y la presión arterial13.
Cuando exploramos las asociaciones de miRNA y los diferentes parámetros clínicos y bioquímicos asociados a HTA, encontramos que miR-615 se asocia positivamente con la ARP, lo cual sugeriría ser un biomarcador clínico no invasivo del sistema RAA asociado a la actividad de 11βHSD2. Por otro lado, miR-1205, miR-494 y miR-488, se asociaron con parámetros como la edad, excreción de sodio, razón excreción sodio/potasiourinaria, mayores niveles de MMP9 y NGAL, los cuales serían sugerentes biomarcadores y reguladores de la vía de señalización mineralocorticoide.
Previamente, nuestro grupos demostró que la razón cortisol/cortisona aumenta con la edad, pero disminuye con la cortisona, sugiriendo una disminución de la actividad de 11βHSD2 con el tiempo14, lo cual explicaría en parte el aumento de la presión arterial en sujetos ancianos. La expresión de la enzima 11β-HSD2 puede ser regulada negativamente por diferentes mecanismos epigenéticos tales como la metilación del DNA, modificación de histonas y expresión de miRNA. El presente estudio muestra que los miRNA se asocian positivamente con la edad, sugiriendo que la expresión de 11βHSD2 disminuiría con la edad por un aumento en la expresión de miRNA.
Previamente, han sido identificados los miRNA como potenciales biomarcadores de hipertensión sal sensible13. La alta ingesta de sodio tiene efectos nocivos sobre la presión arterial. Recientemente, describimos que un alto consumo de sal se asocia con hipertensión arterial, resistencia a la insulina, dislipidemia e hipoadiponectinemia y esto podría estar relacionado con la desregulación del cortisol15. Hemos observado que la expresión miR-1205 en exosomas urinarios se asocia positivamente con la excreción de sodio, indicativo de una alta ingesta de sodio. Consecuentemente con estos hallazgos, Gildea et al, demostró que los miRNA posiblemente derivados de las células del túbulo renal podrían alterarse o incluso utilizarse como biomarcadores de las vías reguladoras de sodio aberrantes en hipertensión13. En la nefrona distal del riñón, la vía mineralocorticoide tiene un papel fundamental en la regulación homeostática de los electrolitos, el volumen de líquido y la presión arterial. En el presente estudio, las evidencias sugieren que miR-488 se asocia positivamente con la razón Na/K urinaria, indicativo de una activación de la vía mineralocorticoide. Varios estudios apoyan los resultados observacionales en donde la razón Na/K se asocia mejor con la presión arterial más que el sodio o potasio por sí solo16. Nosotros sugerimos que una alta ingesta de sodio podría estar induciendo una mayor expresión de miR-1205 que conllevaría a una disminución en la actividad de HSD11B2 como se observa en sujetos con déficit parcial de la enzima 11βHSD2, esto estaría de acuerdo con estudios previos que indican que una alta ingesta de sal en sujetos normotensos con déficit parcial de 11β-hidroxisteroide deshidrogenasa tipo 2 (HSD11B2) inducen una activación no regulada del receptor de mineralocorticoides (MR) por glucocorticoide y responden a un aumento en la presión arterial17,18.
Por otro lado, recientemente, nuestro grupo mostró que, en población pediátrica, existe una fuerte asociación entre hipertensión y la razón F/E en suero y la actividad de MMP-9, más allá de los efectos del BMI y la edad. Marchesi et al. demostró que metaloproteinasa 9, un biomarcador del remodelamiento cardiovascular, es mayormente expresada en pacientes hipertensos19. Estos estudios apoyan nuestros resultados en donde observamos que miR-494 se asocia positivamente con MMP-9, resultando ser ambos biomarcadores importantes de la remodelación cardiovascular y el deterioro de la actividad 11β-HSD2. Así también, observamos que miR-494 se asoció con NGAL, una lipocalina expresada en neutrófilos, la cual es un gen blanco del receptor mineralocorticoide20. NGAL se une a MMP9 estabilizando su actividad y este complejo NGAL/MMP9 tiene un rol fundamental en el remodelamiento de la matriz extracelular, fibrosis vascular y aumento de la presión arterial mediada por el receptor de mineralocorticoide21.
En resumen, encontramos que miR-488 está elevado en sujetos con déficit parcial de la enzima 11βHSD2 y que miR-615 miR-1205, miR-488 y miR-494 se asocian con parámetros de HTA mineralocorticoide. Nuestros resultados proporcionan nueva evidencia sobre la utilidad de los exosomas y su contenido de miRNA como reguladores y biomarcadores potenciales de la actividad 11βHSD2 a nivel renal. Sin embargo, se requieren más estudios para confirmar estos hallazgos.
Referencias
- Kearney PM, Whelton M, Reynolds K, Muntner P, Whelton PK, He J. 2005. Global burden of hypertension: analysis of worldwide data. Lancet. 365: 217-23.
- Campino C, Carvajal CA, Cornejo J, San Martín B, Olivieri O, Guidi G, et al. 2010. 11beta-Hydroxysteroid dehydrogenase type-2 and type-1 (11beta-HSD2 and 11beta-HSD1) and 5beta-reductase activities in the pathogenia of essential hypertension. Endocrine 37: 106-14.
- Carvajal CA, González AA, Romero DG, González A, Mosso LM, Lagos ET, et al. 2003. Two homozygous mutations in the 11 beta-hydroxysteroid dehydrogenase type 2 gene in a case of apparent mineralocorticoid excess. J Clin Endocrinol Metab 88: 2501-7.
- Harahap IS, Sasaki N, Gunadi, Yusoff S, Lee MJ, Morikawa S,
et al. 2011. Herbal Medicine Containing Licorice May Be Contraindicated for a Patient with an HSD11B2 Mutation. Evid Based Complement Alternat Med 2011:646540. - Arriza JL, Weinberger C, Cerelli G, Glaser TM, Handelin BL, Housman DE, et al. 1987. Cloning of human mineralocorticoid receptor complementary DNA: structural and functional kinship with the glucocorticoid receptor. Science 237: 268-75.
- Friso S, Carvajal CA, Fardella CE, Olivieri O. 2015. Epigenetics and arterial hypertension: the challenge of emerging evidence. Transl Res 165: 154-65.
- Pizzolo F, Friso S, Morandini F, Antoniazzi F, Zaltron C,
Udali S, et al. 2015. Apparent Mineralocorticoid Excess by a Novel Mutation and Epigenetic Modulation by HSD11B2 Promoter Methylation. J Clin Endocrinol Metab 100: E1234-41. - Romaine SP, Charchar FJ, Samani NJ, Tomaszewski M. 2016. Circulating microRNAs and hypertension-from new insights into blood pressure regulation to biomarkers of cardiovascular risk. Curr Opin Pharmacol 27: 1-7.
- Butterworth MB. 2015. MicroRNAs and the regulation of aldosterone signaling in the kidney. Am J Physiol Cell Physiol 308: C521-7.
- Rezaei M, Andrieu T, Neuenschwander S, Bruggmann R,
Mordasini D, Frey FJ, et al. 2014. Regulation of 11beta-hydroxysteroid dehydrogenase type 2 by microRNA.
Hypertension 64: 860-6. - Barros ER, Carvajal CA. 2017. Urinary Exosomes and Their Cargo: Potential Biomarkers for Mineralocorticoid Arterial Hypertension? Front Endocrinol (Lausanne) 8: 230.
- Tapia-Castillo A, Baudrand R, Campino C, Vaidya A, Allende F, Valdivia C, et al. 2018. Clinical, biochemical and genetic characteristics of “Non-classical” Apparent Mineralocorticoid Excess Syndrome. Circulation. 2018: in press.
- Gildea JJ, Carlson JM, Schoeffel CD, Carey RM, Felder RA. 2013. Urinary exosome miRNome analysis and its applications to salt sensitivity of blood pressure. Clin Biochem 46: 1131-4.
- Campino C, Martínez-Aguayo A, Baudrand R, Carvajal CA, Aglony M, García H, et al. 2013. Age-related changes in 11beta-hydroxysteroid dehydrogenase type 2 activity in normotensive subjects. Am J Hypertens 26: 481-7.
- Baudrand R, Campino C, Carvajal CA, Olivieri O, Guidi G, Faccini G, et al. 2014. High sodium intake is associated with increased glucocorticoid production, insulin resistance and metabolic syndrome. Clin Endocrinol (Oxf) 80: 677-84.
- Pérez V, Chang ET. 2014. Sodium-to-potassium ratio and blood pressure, hypertension, and related factors. Adv Nutr 5: 712-41.
- Ferrari P, Sansonnens A, Dick B, Frey FJ. 2001. In vivo 11beta-HSD-2 activity: variability, salt-sensitivity, and effect of licorice. Hypertension 38: 1330-6.
- Lovati E, Ferrari P, Dick B, Jostarndt K, Frey BM, Frey FJ, et al. 1999. Molecular basis of human salt sensitivity: the role of the 11beta-hydroxysteroid dehydrogenase type 2. J Clin Endocrinol Metab 84: 3745-9.
- Martínez-Aguayo A, Campino C, Baudrand R, Carvajal CA, García H, Aglony M, et al. 2016. Cortisol/cortisone ratio and matrix metalloproteinase-9 activity are associated with pediatric primary hypertension. J Hypertens 34: 1808-14.
- Latouche C, El Moghrabi S, Messaoudi S, Nguyen Dinh Cat A, Hernández-Díaz I, Álvarez de la Rosa D, et al. 2012. Neutrophil gelatinase-associated lipocalin is a novel mineralocorticoid target in the cardiovascular system. Hypertension 59: 966-72.
- Tarjus A, Martínez-Martínez E, Amador C, Latouche C, El Moghrabi S, Berger T, et al. 2015. Neutrophil Gelatinase-Associated Lipocalin, a Novel Mineralocorticoid Biotarget, Mediates Vascular Profibrotic Effects of Mineralocorticoids. Hypertension 66: 158-66.