Cinética de muerte de linfocitos en diabetes mellitus tipo 1 y su posible asociación con miR-146a y miR-155
Lissette Duarte S.1, Georthan Mancilla A.1, Diego F García-Díaz1, Néstor Soto I.2 y Francisco Pérez B.1
Kinetics of cell death in type 1 diabetes mellitus and their possible association with miR-146a and miR-155
1Laboratorio de Nutrigenómica. Departamento de Nutrición. Facultad de Medicina. Universidad de Chile.
2Unidad de Endocrinología y Diabetes. Hospital San Borja-
Arriarán.
Correspondencia:
Dr. Francisco Pérez Bravo
Av. Independencia 1027, Santiago.
Teléfono: + 56 2 2978 61 35
fperez@med.uchile.cl
Recibido: 11-01-2018
Aceptado: 02-03-2018
Aim: Analyze mi-146a and miR-155 expression and its correlation with the apoptosis of lymphocytes
T in T1D and control patient. Patients and Methodology: 17 T1D patients (5 children between 8-14
yr and 12 adults between 19-29 yr). Activated and not activated peripheral mononuclear cells were
studied were studied. Cellular activation with anti-CD3 and primary culture with interleukyne-2 by
5 days. Apoptosis assays through flow cytometry. miRNA through Taqman probes. Statistical analysis
through Kruskal-Wallis and post-hoc Dunn’s test. Results: Composition of virgin and memory T CD4 cells showed significant differences for stimulus response in control group (p = 0,0004). Increased
memory cells count in control group activated by 7 days than basal (p = 0,0047). For early apoptosis
differences were observed in days 3 and 7 with and without activation (p = 0,001). AICD apoptosis
showed increases in control group after re-stimulation through TCR (p = 0,03). miR-146a expression
was lower in recent-onset T1D children vs recent-onset DM1 adults (p = 0,0167). Conclusion: This study shows a differential miR-146a expression in T1D children with respect to T1D adult patients, diminished AICD mechanism in T1D and altered CD4+CD45RA-CD45R0+ memory cells generation
in T1D adult patients.
Key words: Type 1 Diabetes; Apoptosis; Immune System.
Introducción
La diabetes mellitus tipo 1 (DM1) es un trastorno autoinmune crónico que se presenta en individuos genéticamente susceptibles, gatllado por factores genéticos y ambientales1. Se caracteriza por la destrucción autoinmune de las células β pancreáticas2. La DM1 se ha asociado a la región de antígenos leucocitarios humanos (HLA) y otros 40 loci3,4. Sin embargo, el análisis de asociación alélica refleja valores modestos incluso para esta región5. Dentro del componente ambiental en DM1, se encuentran las infecciones virales6, la composición bacteriana del intestino7 y factores alimentario-nutricionales, como la ingesta temprana de leche de vaca, el consumo de proteínas del trigo y el estatus de vitamina D3, entre otros8.
Los microRNA (miRNAs) son pequeñas moléculas mono-hebras no codificantes de RNA (aproximadamente de 22 nucleótidos) que ejercen una función represiva sobre RNAs mensajeros (mRNA)9. Los miRNAs participan en la regulación inmune, diferenciación celular y plasticidad celular10. miR-146a ha demostrado tener un importante rol en la patogenia del lupus (SLE) observándose que su baja expresión induce la hiperactivación de la vía del Interferón tipo I (I-INF)11. En artritis reumatoide (RA), miR-146a se encuentra sobreexpresado en varios tipos celulares y se ha propuesto que cumple una función reguladora negativa sobre citoquinas proinflamatorias como TNF-α e IL-1712. En DM1, la evidencia indica que, en la etapa inmediatamente posterior al debut clínico, la expresión de miR-146a disminuye en células mononucleares periféricas (PBMCs)13 y que miR-146a estaría involucrado en las complicaciones de la diabetes y la producción de proteínas de matriz extracelular14. En cuanto al miR-155 se ha demostrado que tiene participación en numerosos procesos biológicos, incluyendo la hematopoyesis, inflamación e inmunidad15. De esta forma, miR-155 controla la diferenciación de células T CD4 en los subgrupos de células colaboradoras tipo 1, 2 y 17 (Th1, Th2 y Th17)16 afectando el desarrollo de células T reguladoras (Treg)17, y regulando las células T CD818 siendo esencial para la normal diferenciación de células B y la producción de anticuerpos19.
El objetivo de este estudio fue analizar la cinética de muerte de linfocitos en pacientes con DM1 y su relación con la expresión génica de miR-146a y miR-155 en un modelo de células activadas y no activadas.
Pacientes y Metodología
En este estudio participaron cinco niños (8-14 años), doce adultos (19-29 años) y diez controles adultos sanos (21-28 años), provenientes del Instituto de Investigación Materno Infantil (IDIMI) y la Sección de Endocrinología y Diabetes del Hospital Clínico San Borja Arriarán. La investigación fue aprobada por el Comité de Ética en Investigación Humana de la Facultad de Medicina de la Universidad de Chile, y del Servicio de Salud Metropolitano Central (CEC) del Hospital San Borja Arriarán. Todos los pacientes, padres y/o apoderados de los niños y adolescentes, participantes firmaron consentimiento informado.
Extracción y activación celular
Se tomaron 12 mL de muestra de sangre periférica por punción venosa. Las muestras con anticoagulante fueron diluidas en solución salina tamponada con fosfato PBS, homogeneizada y depositada sobre una solución de Ficoll-Hypaque. La separación por gradiente de densidad se realizó mediante centrifugación por 30 min a 410 g, sin freno, a 4 °C. Los PBMCs fueron transferidos a un tubo con PBS y lavados 2 veces, mediante centrifugación a 730 g por 10 min. Finalmente, el precipitado celular fue resuspendido en RPMI-1640 y cultivado en RPMI-1640 suplementado con 10% de suero bovino fetal inactivado por calor, 10 mM de HEPES, 2 mM de L-glutamina, 5 uM de 2-mercaptoetanol, 100 U/mL de penicilina y 100 ug/mL de estreptomicina. Las incubaciones se realizaron por 8 h, 3 días y 8 días a 37 °C con 5% CO2, en placas de 96 pocillos a una concentración de 1 x 106 células/mL.
Las células fueron incubadas con 50 µL de solución de PBS con 5 µg/mL de anti-CD3 (clon OKT3, eBioscience Inc., San Diego, EE. UU.) durante toda la noche a 4 °C, y luego lavadas 3 veces con 200 µL de PBS. Las PBMCs fueron cultivados en alicuotas de 200 µL por pocillo y coestimuladas con 2 µg/mL de anti-CD28 (clon 28.2, eBioscience Inc., San Diego, EE. UU.) por 72 h. Luego fueron lavadas 2 veces con 200 µL de PBS a 37 °C y transferidas a una placa de 96 pocillos sin anticuerpos, suplementadas con 200 UI/mL de IL-2 (Human IL-2 Recombinant Protein, eBioscience Inc., San Diego, EE. UU.) y cultivadas hasta completar 7 días 1 x 106. PBMCs procedentes de los cultivos activados por 7 días fueron reestimuladas por 8 h con 5 µg/mL de anti-CD3 unidas a la placa, suplementado con 100 UI/mL de IL-2 o expuestas a anti-FAS (clon EOS9.1, eBioscience Inc., San Diego, USA) durante 8 h (la condición control fue suplementada con IL-2). Todas las determinaciones de concentración y viabilidad para ajustes de concentraciones de cultivos celulares, fueron realizadas usando el kit de Muse™ Count & Viability (Merck, Sao Paulo, Brasil).
Determinación de apoptosis, citometría de flujo y porcentaje de subpoblaciones
La apoptosis fue analizada mediante el kit de Muse™ Annexin V & Dead Cell (Merck, Sao Paulo, Brasil), para cuantificar las concentraciones y porcentajes de: células sin apoptosis (LL), en apoptosis temprana (EA), en apoptosis tardía (LA) o muertas. Todos los anticuerpos utilizados, anti-CD4 (clon OKT-4) conjugado a Isocianato de fluoresceína (FITC), anti-CD8a (clon HIT8a) conjugado a Ficoeritrina (PE), anti-CD3 (clon UCHT1) conjugado a Cianina 5R-PE (Cy5-PE), anti-CD45RA (clon HI100) conjugado a PE y anti-CD45R0 (clon UCHL1) conjugado a PE-Cy5, fueron obtenidos de eBioscience. La cuantificación de linfocitos T reguladores (CD3+CD4+CD8-), linfocitos T citotóxicos (CD3+CD4-CD8+), linfocitos T CD4 naïve (CD4+CD45RA) y linfocitos T CD4 de memoria (CD4+CD45R0+) fue realizada a través de inmuno-marcaje. Las distintas fluorescencias de subpoblaciones fueron cuantificadas por el equipo FACSAriaIIITM y, posteriormente, analizadas en el programa FlowJo vX (Tree Star’s Inc., Oregon, EE. UU.).
Extracción de RNA total y síntesis de cDNA de miRNAs
La extracción de RNA total fue realizada por el método de TRIzol. La integridad del RNA fue evaluada visualizando bandas ribosomales 28S y 18S. Su cuantificación se realizó por espectrofotómetro (Infite NanoQuant M200). Se sintetizó cDNA de miR-146a, miR-155 y rnU6 a partir de 10 ng/reacción utilizando el ensayo TaqMan Small RNA Assays (Applied Biosystems, Life Technologies, California, EE. UU.), utilizando los partidores TaqMan diseñados contra las secuencias maduras (Tabla Suplementaria 1). La expresión relativa fue analizada por qPCR (Applied Biosystem, Foster City, EE. UU.). Se utilizaron sondas TaqMan MGB y Universal PCR Master Mix II (2x) no UNG, en duplicado en el equipo Agilent Mx3005P (Agilent Technologies, California, EE. UU.). La normalización se llevó a cabo respecto al grupo no diabético, utilizando como control endógeno a U6 snRNA.
Análisis estadístico
El análisis de la curva de crecimiento celular, respecto a las variables “concentración de células vivas”, “porcentaje de células en apoptosis temprana”, “porcentaje de células en apoptosis tardía”, “expresión relativa de miRNAs” se realizó mediante la prueba de Kruskal-Wallis. Las comparaciones entre grupos se realizaron con análisis “post-hoc” de Dunn. La expresión relativa de los miRNAs fue calculada en base al método del ΔΔct, considerando como condición basal al grupo de controles sanos en tiempo cero. Finalmente, la determinación de asociación fue realizada mediante r de Spearman con una significancia de p < 0,05. Los gráficos, correlaciones y otros análisis fueron realizados con programa de análisis estadístico GraphPad Prism 6.01 (GraphPad Software, Inc., San Diego, EE. UU.).
Resultados
La determinación de los componentes de memoria inmunológica, a través de la composición de células T CD4 vírgenes y de memoria (Figura 1), mostró diferencias estadísticamente significativas para la respuesta al estímulo en el grupo control (p = 0,0004). La comparación entre grupos reveló un incremento de la cantidad de células de memoria en el grupo control para la condición de activación por 7 días respecto al basal (p = 0,0047). Este incremento fue menor en el grupo con DM1 (p = 0,0133). El análisis de la apoptosis temprana (Figura 2A), no mostró diferencias significativas al comparar el grupo control con respecto al grupo DM1 en condiciones basales, sin embargo, las diferencias se presentaron al día 3 y 7 de cultivo tanto en la condición activa, como no activa entre DM1 y controles (p = 0,001, Figura 2B). La apoptosis tardía, no mostró diferencias estadísticamente significativas entre los grupos DM1 y control.
La apoptosis autoinducida por sobre activación (AICD) o la sensibilidad a la muerte inducida por la interacción Fas-FasL se resume en la Figura 3. Se observó un aumento de la apoptosis en el grupo control tras la reestimulación vía TCR (p = 0,03).
Finalmente, la expresión relativa de miR-146a durante la reestimulación no fue diferente entre el grupo DM1 y control. La expresión relativa de miR-155 durante la curva de crecimiento mostró un aumento para las condiciones de activación en ambos grupos, pero estas diferencias no fueron significativas. Al analizar la expresión relativa de ambos miRNAs en condiciones basales en niños con reciente diagnóstico de DM1 (n = 5), adultos con DM1 (n = 12) y en el grupo control (n = 15), se observó que mir-146a mostró diferencias significativas entre niños DM1 y DM1 adultos (p = 0,0167), y que mir-155 no mostró diferencias entre los grupos (Figura 4). Finalmente, al analizar la correlación entre la expresión relativa de miR-146a y miR-155 vs apoptosis no se observó correlación entre estos miRNAs y apoptosis temprana (miR-146a r = 0,137; p = 0,287; miR-155 r =-0,175; p = 0,167). Sólo se observó asociación entre miR-155 y apoptosis total (r = -0,4121; p = 0,0009).
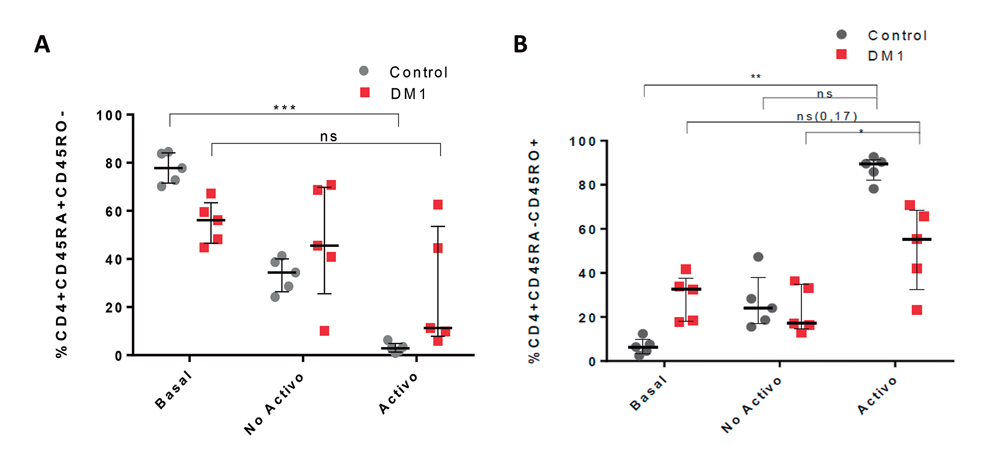 Figura 1. A: composición de linfocitos T CD4 vírgenes y B: composición de linfocitos T CD4 de memoria respecto a la población de linfocitos de CD4. Células marcadas CD4+CD45RA+CD45R0- y CD4+CD45RA+CD45R0+, respectivamente, en condición basal, cultivo sin activar por 7 días; cultivo activado por 7 días. Valores expresados como mediana y rango intercuartílico *p = 0,0133; **p = 0,0047; ***p = 0,0004
Figura 1. A: composición de linfocitos T CD4 vírgenes y B: composición de linfocitos T CD4 de memoria respecto a la población de linfocitos de CD4. Células marcadas CD4+CD45RA+CD45R0- y CD4+CD45RA+CD45R0+, respectivamente, en condición basal, cultivo sin activar por 7 días; cultivo activado por 7 días. Valores expresados como mediana y rango intercuartílico *p = 0,0133; **p = 0,0047; ***p = 0,0004
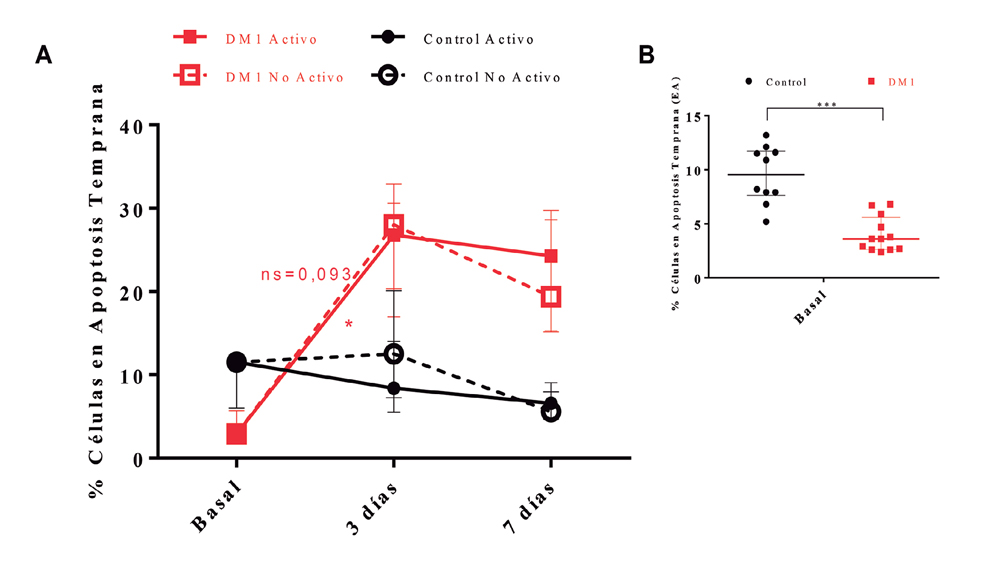 Figura 2. Porcentaje de células en apoptosis temprana. A: conjunto de las curvas de crecimiento celular de los grupos DM1 y control en condiciones de activación y sin activación. B: comparación entre el grupo DM1 y control en condiciones basales. Valores expresados como mediana y rango intercuartílico. *p = 0,0013. ***p < 0,001.
Figura 2. Porcentaje de células en apoptosis temprana. A: conjunto de las curvas de crecimiento celular de los grupos DM1 y control en condiciones de activación y sin activación. B: comparación entre el grupo DM1 y control en condiciones basales. Valores expresados como mediana y rango intercuartílico. *p = 0,0013. ***p < 0,001.
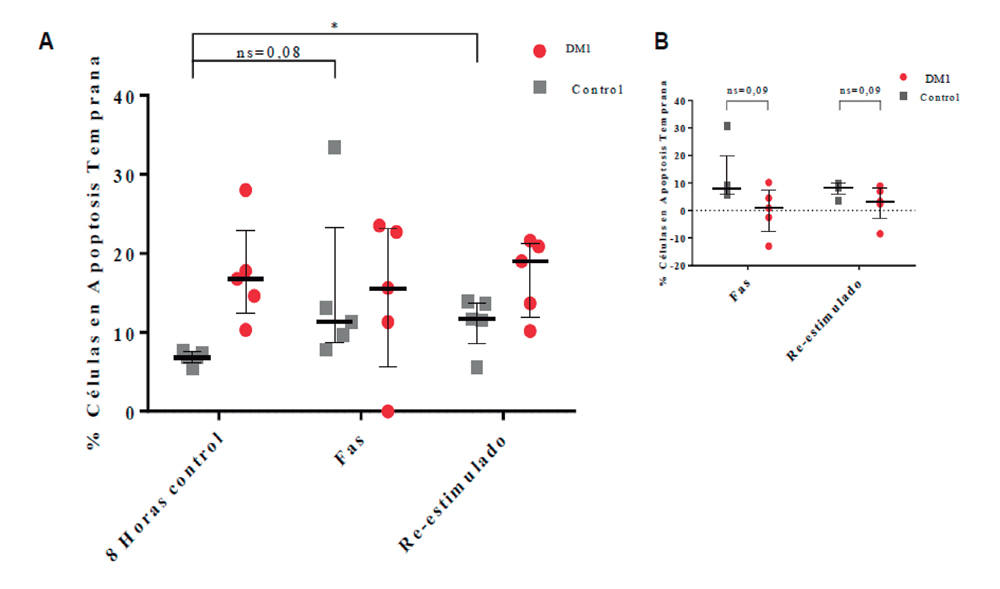 Figura 3. Gráficos de apoptosis bajo condiciones de reestimulación. A: resumen de la apoptosis derivadas del cultivo celular por 8 h, en condiciones control, de exposición a FasL y de reestimulación. B: apoptosis específica bajo condiciones de exposición a FasL y de reestimulación. Valores expresados como mediana y rango intercuartílico. *p = 0,03.
Figura 3. Gráficos de apoptosis bajo condiciones de reestimulación. A: resumen de la apoptosis derivadas del cultivo celular por 8 h, en condiciones control, de exposición a FasL y de reestimulación. B: apoptosis específica bajo condiciones de exposición a FasL y de reestimulación. Valores expresados como mediana y rango intercuartílico. *p = 0,03.
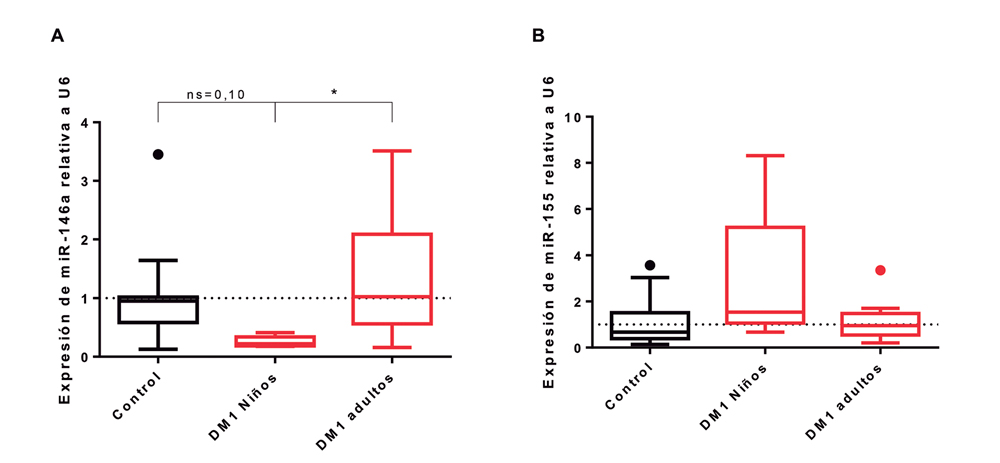 Figura 4. Comparación de expresión relativa de miR-146a y miR-155 en adultos y niños con DM1. A: expresión relativa de miR-146a; B: expresión relativa de miR-155. Valores expresados como mediana y rango intercuartílico.
Figura 4. Comparación de expresión relativa de miR-146a y miR-155 en adultos y niños con DM1. A: expresión relativa de miR-146a; B: expresión relativa de miR-155. Valores expresados como mediana y rango intercuartílico.
Discusión
Estudios previos han mostrado cambios en las etapas del inicio clínico de la DM1, describiéndose una disminución persistente de la razón CD4/CD8 en pacientes que presentan esta patología20. Nuestro estudio no mostró esta diferencia, lo cual podría explicarse por una desaceleración inmune presente en nuestros pacientes con DM1 los cuales, en su mayoría, tenían un estadio de enfermedad más avanzada. Se podría especular que la falla en los receptores periféricos, derivada de procesos tales como: oxidación, nitración y glicación de proteínas consecuencia de glicemias crónicas elevadas21, sea el fenómeno que conduzca a esta desaceleración, al alterar la eficiencia de unión de agonistas a sus receptores tales como TCR, teniendo un efecto neto de aumento del umbral de activación como se ha observado en diabetes tipo 222. Esto sugiere la existencia de adaptaciones que buscan compensar la hipersensibilidad de los linfocitos en pacientes bajo cuadros autoinmunes avanzados23.
Los resultados respecto a la generación de células T de memoria tras una activación vía TCR (con anti-CD3, anti-CD28 y suplementado con IL-2) en el grupo de adultos con DM1 y controles sin DM1, mostró un aumento significativo en las células activadas respecto a las no activadas en el grupo control, fenómeno no observado en el grupo de adultos con DM1. Esta característica, sumada a la pérdida del marcador de condición naive, daría cuenta de una respuesta alterada, que se condice con el condicionamiento a nivel sistémico de individuos con enfermedades autoinmunes en etapas avanzadas24.
Nuestro estudio mostró una menor apoptosis basal en pacientes adultos con DM1 respecto al grupo control, fenómeno que cambió rápidamente luego de 3 días de cultivo celular, aumentando la apoptosis tanto en cultivos activados, como no activados. Esto podría evidenciar una mayor sensibilidad de los linfocitos del grupo con DM1 a perturbaciones originadas por el cultivo in vitro (al día 3 se le suministró IL-2), que posiblemente se explique por el fenómeno de sensibilidad compensatoria que se traduce en mayores requerimientos de señales de sobrevida, lo que es coherente con lo observado al día 7 donde se evidenció una disminución de la apoptosis respecto al tercer día.
Las fallas en el término de la tolerancia periférica han sido vinculadas a numerosas enfermedades autoinmunes, en particular, el AICD pareciera ser la forma más crítica en el desarrollo de una autoinmunidad25. Esto, debido a que en un núcleo inflamatorio donde se concentran las señales que permiten a los linfocitos actuar en la destrucción controlada de blancos inmunes, se genera estrés tisular y esta destrucción se desarrolla de forma controlada o no dependiendo de la magnitud de la infección o daño (insulitis). Si en este escenario, las células en necrosis superan la capacidad de macrófagos en el núcleo inflamatorio se exponen epítopes intracelulares como la maquinaria de procesamiento de RNA RISC, que es altamente inmunogénica26 y que en un contexto inflamatorio daría como resultante la generación de linfocitos de memoria.
En pacientes con DM1 en etapas iniciales, se ha reportado que los linfocitos presentan una resistencia a AICD comparado a sujetos controles a través de la vía Fas27. Esta resistencia a AICD vía Fas también se observó en nuestro estudio en adultos con DM1. Para el caso de la apoptosis en linfocitos, el factor NF-kB es uno de los más estudiados, por su versatilidad de respuesta y su participación en vías de señalización de apoptosis que lo describen como integrador de señales28. Tanto miR-146a como miR-155, han demostrado participar en la regulación de la apoptosis en variados tipos celulares por medio de la regulación de vías de señalización que convergen en NF-kB28,29. Nuestro estudio mostró una expresión disminuida de miR-146a en condiciones basales en niños con DM1, lo que es concordante con lo descrito por Yang et al13. La expresión de miR-146a en adultos, siguió una tendencia al aumento en grupos no activados y una disminución en los grupos activados. Esto posiblemente se deba a que miR-146a en su regulación de retroalimentación negativa sobre NF-kB tiene un efecto neto pro-apoptótico, lo que en el grupo control se ajusta bastante bien al modelo de sensibilización a la apoptosis producto de la activación vía TCR. Además, la expresión de miR-146a durante la reestimulación mostró un aumento en ambos grupos, sin ser éste un cambio significativo. Una cinética similar en la expresión de miR-146a se ha descrito en modelo de cicatrización de heridas en diabéticos, donde se ha propuesto que la expresión de miR-146a podría ser un predictor sistémico de patologías vinculadas al término de la respuesta inmune vía TLR30. Por último, nuestro estudio mostró correlaciones negativas significativas entre la expresión de miR-146a y apoptosis en el grupo con DM1 en AICD. Esto podría relacionar a miR-146a con el fenómeno de apoptosis en la DM1.
En conclusión, este estudio mostró que niños con diagnóstico reciente de DM1 presentan una expresión reducida de miR-146a en condiciones basales; que AICD como mecanismo de contracción de la respuesta inmune, está disminuido en niños y adultos con DM1; y que la generación de células de memoria CD4+CD45RA-CD45R0+ se encuentra reducida en pacientes adultos DM1.
Agradecimientos
Los autores agradecen a todos los pacientes y controles participantes en esta investigación. Este proyecto fue financiado por FONDECYT 1130240.
Referencias bibliográficas
- Todd JA. 2010. Etiology of Type 1 Diabetes. Immunity 32 (4): 457-467.
- Van Belle TL, Coppieters KT, Von Herrath M. 2011. Type 1 Diabetes: Etiology, Immunology, and Therapeutic Strategies. Physiol Rev. 91 (1): 79-118.
- Pociot F, Akolkar B, Concannon P, Erlich HA, Julier C, Morahan G, et al. 2010. Genetics of Type 1 Diabetes: What’s Next? Diabetes 59 (7): 1561-1571.
- Noble JA, Valdés AM. 2011. Genetics of the HLA Region in the Prediction of Type 1 Diabetes. Current diab rep 11 (6): 533-542.
- Gillespie KM, Bain SC, Barnett AH, Bingley PJ, Christie MR, Gill GV, et al. 2004. The rising incidence of childhood type 1 diabetes and reduced contribution of high-risk HLA haplotypes. The Lancet 364 (9446): 1699-1700.
- Rodríguez-Calvo T, Sabouri S, Anquetil F, von Herrath MG. 2016. The viral paradigm in type 1 diabetes: Who are the main suspects? Autoimmun Rev. 15 (10): 964-9.
- Vaarala O, Atkinson MA, Neu J. 2008. The “Perfect Storm” for Type 1 Diabetes: The Complex Interplay Between Intestinal Microbiota, Gut Permeability, and Mucosal Immunity. Diabetes 57 (10): 2555-2562.
- Virtanen SM. 2016. Dietary factors in the development of type 1 diabetes. Pediatr Diabetes 17 Suppl 22: 49-55.
- Carthew RW, Sontheimer EJ. 2009. Origins and Mechanisms of miRNAs and siRNAs. Cell 136 (4): 642-655.
- Baumjohann D, Ansel KM. 2013. MicroRNA Regulation of T Helper Cell Differentiation and Plasticity. Nature reviews. Immunology 13 (9): 666-678.
- Tang Y, Luo X, Cui H, Ni X, Yuan M, Guo Y, et al. 2009. MicroRNA-146a contributes to abnormal activation of the type I interferon pathway in human lupus by targeting the key signaling proteins. Arthritis Rheum 60 (4): 1065-1075.
- Pauley KM, Satoh M, Chan AL, Bubb MR, Reeves WH, Chan EK. 2008. Upregulated miR-146a expression in peripheral blood mononuclear cells from rheumatoid arthritis patients. Arthritis Res Ther 10 (4): R101-R101.
- Yang M, Ye L, Wang B, Gao J, Liu R, Hong J, et al. 2015. Decreased miR-146 expression in peripheral blood mononuclear cells is correlated with ongoing islet autoimmunity in type 1 diabetes patients. J Diabetes 7 (2): 158-165.
- Bhatt K, Kato M, Natarajan R. 2016. Mini-review: emerging roles of microRNAs in the pathophysiology of renal diseases. Am J Physiol Renal Physiol. 310 (2): F109-18.
- Faraoni I, Antonetti FR, Cardone J, Bonmassar E. 2009. miR-155 gene: A typical multifunctional microRNA. Biochim Biophys Acta 1792 (6): 497-505.
- O’Connell RM, Kahn D, Gibson W, Round J, Scholz RL, Chaudhuri A, et al. 2010. MicroRNA-155 promotes autoimmune inflammation by enhancing inflammatory T cell development. Immunity 33 (4): 607-619.
- Kohlhaas S, Garden OA, Scudamore C, Turner M, Okkenhaug K, Vigorito E. 2009. Cutting Edge: The Foxp3 Target miR-155 Contributes to the Development of Regulatory T Cells. J Immunol 182 (5): 2578-2582.
18. Lind EF, Elford AR, Ohashi PS. 2013. Micro-RNA 155 Is Required for Optimal CD8+ T Cell Responses to Acute Viral and Intracellular Bacterial Challenges. J Immunol 190 (3): 1210-1216. - Thai TH, Calado DP, Casola S, Ansel KM, Xiao C, Xue Y, et al. 2017. Regulation of the Germinal Center Response by MicroRNA-155. Science 316 (5824): 604-608.
- Al-Sakkaf L, Pozzilli P, Tarn AC, Schwarz G, Gale E, Bottazzo GF. 1989. Persistent reduction of CD4/CD8 lymphocyte ratio amd cell activation before the onset of Type 1 (insulin-dependent) diabetes. Diabetologia 32 (5): 322-325.
- Méndez J, Xie J, Aguilar-Hernández M, Méndez-Valenzuela V. 2010. Trends in advanced glycation end products research in diabetes mellitus and its complications. Mol Cell Biochem 341 (1-2): 33-41.
- Shah BR, Hux JE. 2003. Quantifying the Risk of Infectious Diseases for People With Diabetes. Diabetes Care 26 (2): 510-513.
- Maddur MS, Vani J, Lacroix-Desmazes S, Kaveri S, Bayry J. 2010. Autoimmunity as a Predisposition for Infectious Diseases. PLoS Pathog
- Pender MP. 1999. Activation-induced apoptosis of autoreactive and alloreactive T lymphocytes in the target organ as a major mechanism of tolerance. Immunol Cell Biol 77 (3): 216-223.
- Ceribelli A, Satoh M, Chan EK. 2012. MicroRNAs and autoimmunity. Curr opin immunol 24 (6): 686-691.
- Richiusa P, Pizzolanti G, Misiano G, Mattina A, Citarrella R, Galluzzo A, Giordano C. 2004. Up-regulation of c-FLIPshort and reduction of activation-induced cell death in T-cells from patients with Type 1 diabetes. Diab. Nutr. Metab 17 (1): 6-11.
- Bonizzi G, Karin M. 2004. The two NF-κB activation pathways and their role in innate and adaptive immunity. Trends Immunol 25 (6): 280-288.
- Aalaei-andabili SH, Rezaei N. 2013. Toll like receptor (TLR)-induced differential expression of microRNAs (MiRs) and immune response against infection: A systematic review. J Infect 67 (4): 251-264.
- Xu J, Wu W, Zhang L, Dorset-Martin W, Morris MW, Mitchell ME, Liechty K. 2012. The Role of MicroRNA-146a in the Pathogenesis of the Diabetic Wound-Healing Impairment: Correction With Mesenchymal Stem Cell Treatment. Diabetes 61 (11): 2906-2912.
- Dasu MR, Martin SJ. 2014. Toll-like receptor expression and signaling in human diabetic wounds. World Journal of Diabetes 5 (2): 219-223.