Terapia complementaria a la Insulina en el tratamiento de niños y adolescentes con Diabetes Mellitus tipo 1- (DM1)
María Fernanda Ochoa M.1, Hernán García B.1
Therapies complementaries to insulin in the treatment of children and adolescents with Type 1 Diabetes Mellitus (T1DM)
1Departamento de Endocrinología Pediátrica Pontificia Universidad Católica de Chile. Santiago de Chile.
Correspondencia: María Fernanda Ochoa M,
Residente de Endocrinología Pediátrica,
Pontificia Universidad Católica
Avenida Diagonal Paraguay #362 octavo piso
Servicio de Pediatría, comuna de Santiago Centro
Teléfono: +56965880569
Dirección electrónica mfochoa@uc.
Recibido: 12-12-2018
Aceptado: 17-01-2019
Resumen: La diabetes mellitus tipo 1 (DM1), es una enfermedad crónica caracterizada por la deficiencia de insulina debido a la pérdida de células β pancreáticas, las alteraciones hormonales en la DM 1 no se limitan a la deficiencia de insulina; existiendo también secreción inadecuadada de glucagón en el período postprandial. Aunque el control glucémico con terapias intensivas con insulina ha reducido la incidencia de complicaciones microvascular y macrovasculares. La mayoría de las personas con DM1 tienen un control glucémico subóptimo; Por lo tanto, el uso de farmacoterapia adyuvante para mejorar el control ha sido de interés clínico. El uso de estos nuevos medicamentos brindaría la oportunidad de imitar más de cerca la fisiología pancreática normal, y contrarrestar otros mecanismos fisiopatológicos diferentes a Insulinopenia; contribuyendo a lograr un mejor control metabólico y expectativa de vida.
Palabras claves: Agonistas del Receptor del Péptido 1 Glucagón (GLP-1), Diabetes Tipo 1, Inhibidores de Dipeptidil Peptidasa-4 (DPP-4), Insulina, Metformina, SGLT2: Co-Transportadores de Sodio-Glucosa, Tratamiento adyuvante sin insulina.
Abstract: Type 1 diabetes mellitus (T1DM), is a chronic disease characterized by insulin deficiency due to the loss of pancreatic β cells, the hormonal alterations in T1DM are not limited to insulin deficiency; there is also a deregulated glucagon secretion in the postprandial period. Although glycemic control with intensive therapies with insulin has reduced the incidence of microvascular and macrovascular complications, most people with T1DM1 glycemic control; therefore, the use of adjuvant pharmacotherapy to improve control has been of clinical interest. The use of these new drugs would offer the opportunity to imitate more closely the normal pancreatic physiology, and to counteract other physiopathological mechanisms different from insulinopenia; contributing to achieve better metabolic control and life expectancy.
Keyword: Dipeptidyl Peptidase-4 (DPP-4) Inhibitors, Glucagon-Like Peptide 1 (GLP-1) Receptor Agonists Insulin Therapy, Metformin, SGLT2: Sodium- Glucose Co-Transporters, Non-insulin adjunct therapy, Type 1 Diabetes.
La Diabetes mellitus tipo 1 (DM1) es una enfermedad auto inmune que se caracteriza por hiperglicemia e insulinopenia como consecuencia de la destrucción progresiva de la células beta pancreáticas1.
La patogénesis de la DM1 es un continuo que se inicia con la presencia de auto anticuerpos y progresa hacia la destrucción de células β, disglicemia y finalmente, el debut con los síntomas asociados a la hiperglucemia y cetoacidosis2.
En menores de 18 años de edad la DM1 es la más frecuente y > 500,000 niños a nivel mundial viven actualmente con esta condición3.
Su incidencia está aumentando en todo el mundo y se estima que casi 90,000 nuevos casos son diagnosticados cada año3. La tasa de incidencia varía marcadamente entre los países3, siendo más alta en los países escandinavos, y las mas bajas en regiones de China4,5. Esta variación podría estar relacionado con la susceptibilidad genética otorgada por los antígenos de histocompatibilidad (HLA) así como a factores ambientales y de estilo de vida4,5.
En Chile también se observa un aumento muy importante en la incidencia de DM1 en menores de 20 años con un incremento del 10,1/100.000 menores de 20 años, en el año 2006 a 16,5/ 100.000 menores de 20 años, en el año 20146.
Evolución en el manejo de la DM1.
La diabetes se transformó desde una sentencia de muerte a una condición tratable con el descubrimiento de insulina en 1921. Con la implementación de esta terapia se empezaron a conocer las complicaciones asociadas con hiperglucemia crónica como alteraciones microvasculares (retinopatía, neuropatía y nefropatía), y macrovasculares (angina, infarto, accidente cerebrovasculares). A pesar de los múltiples adelantos logrados en el manejo de la DM1, desde los beneficios demostrados por el tratamiento intensificado en el Ensayo de Control y Complicación de la Diabetes (DCCT), que claramente estableció su utilidad de retrasar o prevenir las complicaciones microvasculares
tempranas de la enfermedad7 Los nuevos avances como insulinas análogas de acción mas corta, más prolongadas y los dispositivos de infusión continua de insulina subcutánea (CSII) han evolucionado desde dispositivos rudimentarios para infundir insulina a computadoras sofisticadas capaces de una serie de cálculos automáticos, siendo la última versión de ellas, denominada “páncreas artificial”8,9 no han logrado una mejoría muy significativa en el control metabólico y este sigue siendo difícil de alcanzar, especialmente para adolescentes y jóvenes, como lo muestra los datos obtenidos del estudio Diabetes Exchange (T1DX) Clinic Network10, cuyo objetivo fue describir la situación del control metabólico de los DM1 en el mundo real de Norteamérica. Participaron 25.833 pacientes de todas las edades de 76 centros de Norteamérica, en los datos analizados 2/3 de los cuales completaron el protocolo de control hasta el año 2014, reportaba que los menores de 18 años, correspondían a 14.593 pacientes (57%). La media de HbA1c en todos los participantes fue del 8,4%; pero menos de un tercio de los participantes cumple los objetivos glicémicos recomendados por la Asociación Americana de Diabetes11,12, siendo el promedio más alto de HbA1c observada en la cohorte de adolescentes (9.0%).
Un 5%, de estos pacientes había presentado al menos 1 episodio de hipoglicemia severa en los últimos 3 meses, aun aquellos con buen control metabólico (HbA1c <7%), y 4% presentó al menos un episodio de cetoacidosis diabética (DKA), complicación que fue 10 veces más frecuente en el grupo mal controlado (HbA1c > 9%)13.
Por lo tanto, las complicaciones agudas del tratamiento de la diabetes, la hipoglucemia grave y la cetoacidosis diabética, siguen siendo un peligro permanente para las personas que viven con la enfermedad.
Si bien lo descrito por si solo justifica intentar optimizar el tratamiento de la DM1 con medicamentos adicionales a la insulina, existen al menos otras 2 razones para considerar los tratamientos coadyuvantes como una buena alternativa en adolescentes y jóvenes con esta patología.
a) Memoria Metabólica: El seguimiento efectuado hasta la actualidad de los participantes de DCCT, permitió demostrar menor mortalidad general y cardiovascular tardía en los pacientes pertenecientes al grupo tratado inicialmente en forma intensivo por un periodo de 7 años, al final de este periodo los pacientes tratados en forma convencional cambiaron a tratamiento intensivo y desde entonces se manejan todos de la misma forma. Esto demuestra que el control metabólico de los primeros años de la DM1 incide posteriormente en la mortalidad por todas las causas.
b) DM1 como enfermedad bi-hormonal: presentando simultáneamente deficiencia de Insulina y aumento paradójico del glucagón.
¿Porqué es tan difícil para la mayoría de pacientes con DM1 alcanzar los objetivos de control metabólico recomendados?
1. Administración no fisiológica de insulina: la insulina endógena producida en las célula beta del páncreas se libera a la circulación portal, la insulina exógena en cambio es administrada por vía subcutánea, sin lograr concentración adecuada en la circulación portal. Además su liberación no es regulada por la glucosa plasmática con el consiguiente riesgo de hipoglicemias.
La hiperinsulinemia periférica (no portal) lleva a un aumento de peso con el riesgo asociado de desarrollar síndrome metabólico14.
2. Control estricto de glicemia no controla la
hiperglucagonemia: Como se ha señalado, las alteraciones hormonales
en la DM1 no se limitan a la deficiencia de insulina;
existiendo también secreción desregulada de glucagón
en el período postprandial se ha documentado no solo
en adultos sino también en jóvenes debutantes15.
En DM1 se pierde la supresión de la secreción de
glucagón mediada por la insulina lo que resulta en
niveles elevados de glucagón. La hiperglicemia eleva paradójicamente la secreción de glucagón, el cual
aumenta la producción hepática de glucosa y agrava
la hiperglicemia ya que agrega glucosa endógena a
la ingerida, especialmente en el periodo postprandial.
Esto otorga la necesidad de explorar la utilización de
medicamentos capaces de suprimir esta aberrante
secreción de glucagón: de hecho los antagonistas
del receptor de glucagón están en proceso de
investigación como terapia adicional para DM116.
En un modelo murino de DM1, el tratamiento exclusivo
(sin insulina) con un antagonista del receptor de
glucagón, normalizó la glucosa plasmática y niveles
de HbA1c en rangos no diabéticos en un tiempo
observado de 30 días17. Existen ya estudios clínicos
Fase 2 en humanos que demuestran disminuir glicemia
en pacientes con DM2 tratados con antagonistas del
receptor de glucagón18,19; pero ningún medicamento
de esta clase ha llegado aún al mercado para el
tratamiento de DM2; en parte porque que se ha
descrito elevación de transaminasas hepáticas19,20 aumento de grasa hepática, de peso corporal presión, arterial sistólica, niveles de colesterol de lipoproteínas de baja densidad e hiperplasia de las células-alfa.
El rol de las terapias adyuvantes en el manejo de niños y adolescentes con DM1
Siendo el objetivo del tratamiento de la DM1, no solo la mejoría de la HbA1c, terapias complementarias también pueden resultar beneficiosas para disminuir la dosis diaria total de insulina (DDT); la variabilidad glicémica, peso corporal y mejorar HbA1c sin mayor riesgo de hipoglucemia y disminuir también las ecursiones glucémicas postprandiales, que son un gran reto en el tratamiento de la DM121.
La investigación de las terapias complementarias se justifica pues extiende el manejo de la DM1, mas allá de la administración de insulina.
Si bien se han desarrollado y aprobado varios agentes farmacológicos para el tratamiento de la diabetes tipo 2 en adultos, existe mucho menos investigación validada para su uso en DM1 y mas aún en niños y adolescentes.
Tipos de fármacos
No consideraremos en esta revisión los fármacos que
tienen poca cabida en este grupo etario como: Sulfonilureas,
por producir hipoglicemias y reducir el número de células
beta; a-glucosidasa (acarbosa), debido a que hay acuerdo
en que las molestias gastrointestinales, superan sus
beneficios, las tiazolidinedionas, que han reportado serios
riesgos hepáticos y los análogos de Amilina que retrasan
vaciamiento gástrico y disminuyen la secreción de glucagón,
pero debe administrarse subcutáneo 3 veces al día.
Los fármacos que podrían ser considerados en adolescentes y sus características principales se mencionan en la tabla 1, Estos están orientados a mejorar control metabólico, reducir síndrome metabólico, obesidad y riesgo vascular.
Tabla 1. Fármacos posibles adyuvantes para el manejo de Diabetes tipo 1.
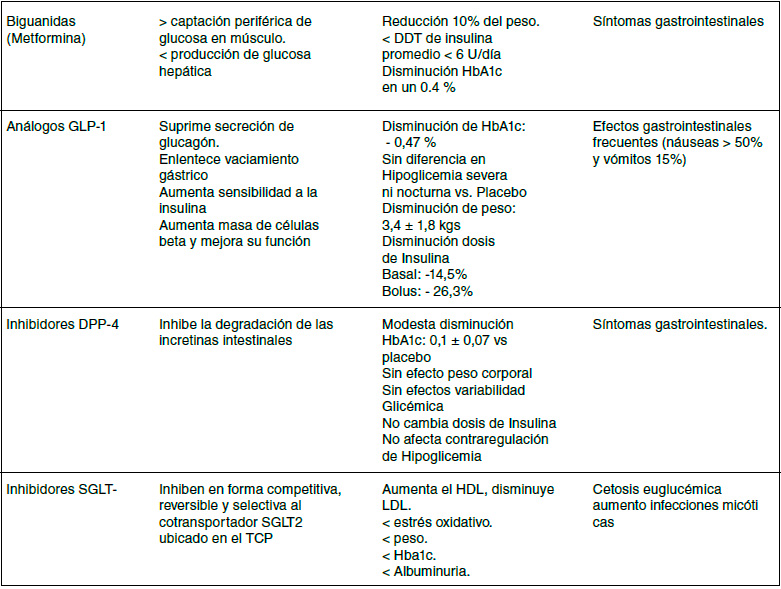
Biguanidas
La Metformina es un fármaco oral, aprobada por FDA en mayores de 10 años, ha sido utilizado como un pilar para el tratamiento de la diabetes tipo 2 con y sin obesidad. Es un medicamento de bajo costo con amplia disponibilidad,utilizado largamente desde el año 1950. Su principal mecanismo de acción es aumentar la utilización periférica de la glucosa (músculo) y disminuir la producción hepática de glucosa; no produce hipoglicemia22.
Se ha considerado que este fármaco también puede ser eficaz como terapia adyuvante en pacientes con DM1, aunque los datos han sido mixtos.
Un metaanálisis publicado por Vellas sobre el uso de la
metformina como complemento de la terapia con insulina
en la diabetes tipo 122, no encontró diferencias significativas
en disminución de HbA1c en el grupo de metfromina versus
placebo22. Metformina sin embargo se asoció con disminución
significativa del requerimiento diario de insulina, en promedio
de 6.6 unidades por día, y una tendencia a la disminución
de peso en promedio 1,7 kg (p= 0,03). Pero, solo uno de
los estudios incluidos en el metanálisis tuvo una duración
de 1 año22.
Otro estudio clinico randomizado utilizando Metformina
o placebo en DM1 adolescentes con sobrepeso y obesidad28 que reclutó 140 niños, con una duración de 26 semanas,
tampoco observó una reducción significativa de HbA1c a
las 13 semanas23, pero si demostró reducción en la DDT
de insulina a favor del grupo de metformina así como una
disminución mayor al 10% del IMC en 24% de los tratados
vs solo 7% del grupo placebo (p= 0.01).
Podemos concluir que si bien la adición de metformina no mejora el control metabólico en niños y adolescentes, si logra disminuir la dosis de Insulina y el IMC en forma significativa que no es un resultado menor en jóvenes con DM1, especialmente aquellos que presentan sobrepeso y síndrome metabólico.
Inhibidores Co-transportadores de sodio-glucosa
(iSGLT)
 Figura 1: Químicos que descubrieron los iSGLT en el siglo XIX.
Figura 1: Químicos que descubrieron los iSGLT en el siglo XIX.Actúan en los enterocitos del intestino delgado para absorber glucosa, sin embargo, también se expresan en el músculo esquelético, los riñones y el corazón24. SGLT-2 ejerce sus efectos principalmente sobre el túbulo proximal renal y es responsable de la reabsorción del 90% de la glucosa filtrada en el riñón24. Los bloqueadores de SGLT, se descubrieron desde el siglo XIX por químicos franceses (Figura 1) quienes describieron que la florizina, una sustancia extraída de la corteza del manzano, originaba glucosuria25.
El interés en el compuesto se inició en los años 50, al demostrarse que bloqueaba el transporte de glucosa en varios tejidos, incluido el riñón.
Inicialmente se utilizó la florizina con fines terapéuticos; sin embargo, su uso no fue posible por efectos adversos y baja biodisponibilidad. La investigación se orientó entonces a derivados de la florizina25, obteniéndose compuestos con potente selectividad, mayor estabilidad, biodisponibilidad y con adecuada tolerancia dando origen a este nuevo grupo de fármacos inhibidores selectivos de SGLT2 (iSLGT2).
Estos compuestos inhiben al cotransportador SGLT2
ubicado en el túbulo contorneado proximal del riñón; su acción
es independiente de la secreción o acción de la insulina y de
la etapa de evolución de la diabetes26.
La inhibición “resetea” el sistema reduciendo el umbral de saturación para la glucosuria de manera que esta se inicie con niveles de glicemia menores a 60-80 mg/dl, lo cual aumenta la excreción urinaria de glucosa en 60-80 gr/día27. Como resultado se reduce la hiperglicemia y adicionalmente se produce pérdida de peso debido a la pérdida extra de calorías (4 kcal/gr de glucosa excretada), pudiendo perderse > 240cal/día27.
Actualmente hay tres fármacos SGLT2 aprobados por la FDA y la EMA: canaglifozina (CANA) (2013), dapagliflozina (DAPA) (2014) y empagliflozina (EMPA) (2014).
Existen otros, que se encuentran en distintas etapas de desarrollo (ertugliflozin, remogliflozin y sotagliflozina28,29.
Los estudios publicados hasta la fecha30,31 que comparan el efecto de esta terapia en el control metabólico en los pacientes con DM1 vs placebo todos realizados en adultos muestran resultados promisorios , en cuanto a disminuir los niveles de HbA1c, reducir IMC, Hipertensión arterial y Dislipidemia así como la reducción de la DDT de insulina.
También se ha publicado efectos beneficiosos en la actividad inflamatoria del tejido graso visceral30,31.
Como efectos adversos se ha descrito aumento de la incidencia de infecciones del tracto urinario producida por hongos. Una complicación mas temible es la cetoacidosis diabética (CAD) normoglicémica que se ha descrito en algunos pacientes, provocada por la reducción en las dosis, por mejoría de la glicemia insulino-independiente.
Esto es aún más preocupante, ya que los pacientes no son
alertados de la cetosis, por la hiperglicemia como es habitual
en Diabéticos, ya que glucosuria aumentada compensa la
hiperglicemia esperada. Por lo tanto, CAD se presenta con
elevaciones leves de glicemia o euglucémica.
Los mecanismos propuestos para este efecto adverso
son la deshidratación, insulinopenia, y como también menor
excreción de cuerpo cetónicos en el riñón.
Aunque los trabajos muestran escasas diferencias en la
incidencia de CAD entre iSGLT2 y placebo en estudios fase 3,
con pacientes cuidadosamente seleccionados y motivados32,33,
un número creciente de reportes de pacientes con CAD y sus
respectivas advertencias de seguridad asociado con el uso
de iSGLT2 se encuentran en la literatura.
Actualmente no existe una recomendacion respecto a la
frecuencia de la monitorización de cetonemia en pacientes
que usan iSGLT2.
Investigaciones recientes han descrito que la utilización de
un inhibidor doble (de la absorción intestinal y renal) de SGLT1
y 2 (sotagliflozina), puede mejorar aún más el control glicémico
y disminuir dosis de insulina, obteniendo mayor reducción
en peso corporal34; pero mantiene el riesgo de CAD, aunque
los pocos casos ocurrieron en un contexto de hiperglicemia
franca y como consecuencia de problemas relacionados con
la bomba de infusión de insulina34.
Con las debidas precauciones los iSGLT que corrigen un nuevo defecto fisiopatológico independiente de la Insulinopenia; podría ser de utilidad en algunos casos de niños y adolescentes bien entrenados y que pertenezcan a familias responsables.
Incretinomimeticos
Agonistas del receptor de péptido 1 similar a la insulina (GLP-1)
Son secretado por las células L intestinales en respuesta a la ingestión de alimentos35,36. El GLP-1 incrementa la secreción de insulina con la ingesta de glucosa, suprime la liberación de glucagón y retrasa el vaciamiento gástrico, produciendo saciedad35-37. (Figura 2). El GLP-1 endógeno tiene una vidamedia relativamente corta, se han desarrollado agonistas de este receptor con un perfil de acción más prolongado.
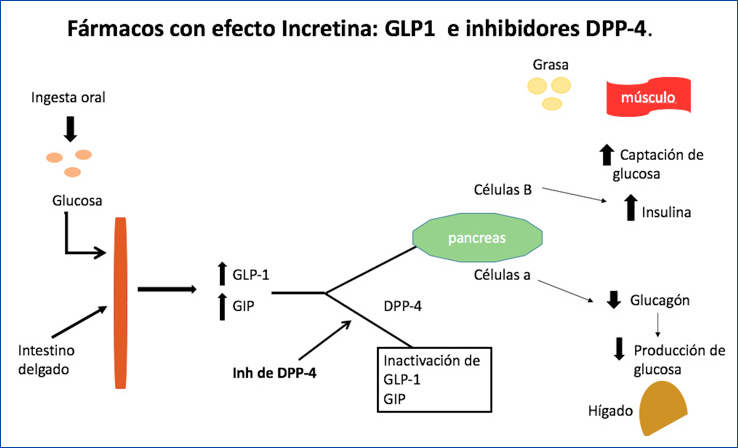 Figura 2. Mecanismo de acción de los fármacos con efecto incretina.
Figura 2. Mecanismo de acción de los fármacos con efecto incretina.Hasta el momento la evaluación de los GLP-1 se limitan
a exenatida o liraglutida. Los pocos estudios disponibles
todos en adultos parecen confirmar que su uso como terapia
coadyuvante está asociado con discreta reducción de DDT
insulina y disminución del peso corporal, sin embargo los
efectos sobre el control glucémico han sido más contradictorios.
Algunos estudios demuestran una disminución de 0.4-0.9%
en HbA1c38,39 mientras que otros no demuestran beneficio en
comparación con la monoterapia con insulina40-42.
Una revision sistemática reciente39 que evaluó los efectos
de agonistas de aGLP-1 en el tratamiento de DM1, incluyó 7
estudios clínicos randomizados con población adulta, demostró
mayor reducción en los niveles de HbA1c el grupo con GLP-
1 e insulina, vs el grupo control (diferencia de media -0.21;
p=0.03), reducción de peso(-3.53 Kgs), p=0.05]; pero no
influyó significativamente en la DDT de insulina ajustada al
peso [-0.11 (-0.23, 0) p = 0,05].
Esta terapia ha sido explorada como beneficiosa para
prolongar la vida de las células β e inducir su propagación.
Asimismo se ha obtenido su aprobación en personas con
obesidad y sin DM1.
Existen variadas formulaciones para tratamiento de DM2;
sin embargo, todavía no existe una indicación formal para
aquellos con DM1, aunque existen varios estudios en curso.
Los agentes actualmente en el mercado incluyen exenatida (dos
veces al día), liraglutida (diaria y semanal), que corresponden a
albiglutida, dulaglutida y exenatida de liberación prolongada).
Este medicamento se inyecta por via subcutánea, lo que lo
hace difícil de aceptar por niños y adolescentes diabéticos; pero
tiene la gran ventaja de producir perdida de peso y como su
efecto es dependiente de glucosa no aumenta significativamente el riesgo de hipoglicemia. Podría tener cabida en casos muy
bien individualizados de adolescentes con DM1 y Obesidad
importante.
Los GLP-1 oral, como la semaglutida, mas aceptable para pacientes se encuentran actualmente en desarrollo43-44.
Dado su efecto a nivel central para promover la saciedad,
no es sorprendente que sus efectos secundarios comunes
incluyen síntomas gastrointestinales como náuseas, diarreas
y vómitos.
Inhibidores de la dipeptidil peptidasa-4 (iDPP-4)
La dipeptidil peptidasa 4: es una glicoproteína que se encuentra ampliamente expresada en la superficie celular de varios tejidos, en forma soluble y activa en la circulación45,46. Esta aminopeptidasa, a través de degradación catalítica, inactiva a las incretinas intestinales GLP-1 y GIP (polipéptido insulinotropo dependiente de glucosa) reduciendo su concentración y limitando sus acciones fisiológicas, por lo tanto su inhibición produce un aumento de las incretinas intestinales (Figura 3).
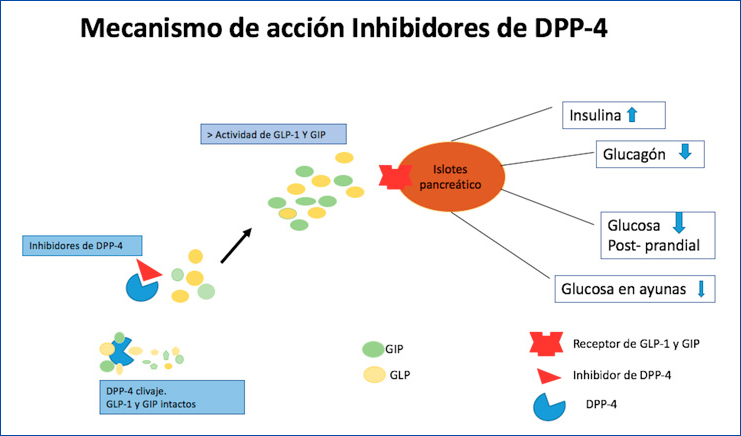 Figura 3: Mecanismo de acción de los Inhibidores de DPP-4.
Figura 3: Mecanismo de acción de los Inhibidores de DPP-4.
La identificación de la DPP4 como la enzima responsable
de la vida media corta de las incretinas llevó a plantear que la
inhibición de su acción, podría tener un rol en la terapia de la
DM2, al aumentar los niveles de GLP1 y prolongar su acción
insulinotrópica47. Estudios preclínicos y clínicos demostraron
que la inhibición de la enzima mejoraba el control glicémico
en pacientes diabéticos47, llevando al desarrollo de la familia
de fármacos iDPP-4. Estos compuestos aumentan los niveles
y potencian la acción de las incretinas endógenas, lo que
lleva a aumento de la secreción de insulina y a disminución
de la secreción de glucagón de forma dependiente de los
niveles plasmáticos de glucosa45,47 lo cual corrige otro defecto fisiopatológico de la DM1 independiente de la Insulinopenia.
En modelos animales se ha observado que, al igual que
con los análogos de GLP-1, contribuyen a preservar la masa
y la función de las células B de los islotes pancreáticos48. Existen en la actualidad aprobados varios iGLP-1 y otros
están en diferentes fases de desarrollo49. Los iDPP-4 que están
globalmente disponibles (sitagliptina en uso clínico desde el
2006, vildagliptina 2007, saxagliptina, 2010, linagliptina 2011
y alogliptina 2013, todos aprobados por la FDA y/o por la
agencia europea EMA49. Existen otros (en uso solo en Corea y
Japón49. Estos compuestos se diferencian en sus propiedades
farmacodinámicas y farmacocinéticas, sin embargo, son
similares en su eficacia hipoglicemiante, y todos se administran
por vía oral48,49.
Los iDPP-4 no se han estudiado en niños, los estudio derivan
de población adulta, los eventos adversos son escasos46-49, lo
que los hace atractivo para jóvenes. Debido a pocos casos de
pancreatitis, insuficiencia renal y reacciones alérgicas graves,
estos agentes deben usarse con precaución o evitar en ciertas
poblaciones46. La disminución de HbA1c lograda con el uso
de inhibidores de DPP-4 en adultos es de aproximadamente
0.75%50. Posiblemente tengan utilidad en niños y adolescentes
DM1 al inicio de su enfermedad cuando aún preservan cierta
masa de células beta.
Conclusiones
Los pacientes con DM1 se benefician de la terapia
insulínica intensiva para disminuir las complicaciones micro y
macrovasculares así como su mortalidad, especialmente si
esta se aplica durante los primeros años de su enfermedad.
Sin embargo, el aumento de peso y la hipoglucemia son
frecuentes lo que puede contribuir a un bajo cumplimiento de
metas de HbA1c en la población de DM1.
El tratamiento de los pacientes con DM1 está cambiando
con la aprobación comercial de nuevos fármacos, los mismos
que buscan no tan solo un mejor control de la glicemia, también
proteger la salud cardiovascular, y disminuir riesgo de Obesidad. Por ello se está prestando mucha atención a la asociación de
algunos medicamentos que están aprobados para pacientes
con DM2 para ser utilizados también en aquellos con DM1.
El uso de estos nuevos medicamentos brindaría la
oportunidad de imitar más de cerca la fisiología pancreática
normal y contrarrestar otros mecanismos fisiopatológicos
diferentes a Insulinopenia; contribuyendo a lograr un mejor
control metabólico y expectativa de vida.
Una variedad de medicamentos están disponibles para terapia de combinación; sin embargo, se debe considerar que la evidencia clínica es muy limitada para cada uno de estos medicamentos en la población pediátrica. Entre los agentes adicionales que por su perfil de seguridad se podrían intentar con precaución en niños y especialmente en adolescentes con DM1 incluyen los incretino-mimeticos: inhibidores de DPP-4 y agonistas de GLP-1; los glucosúricos: Inhibidor de SGLT2 y duales y la más antigua y conocida Metformina, aunque esta última no ha demostrado claramente mejorar el control metabólico de adolescentes con DM1, sin embargo logra disminución del peso y de la dosis de Insulina, por lo que puede ser de utilidad en algunos casos. Los eventos adversos, las dosis, la administración y el tipo de monitoreo deben tenerse en cuenta al tomar la decisión de agregarlos como terapia adyuvante.
En resumen
- Pacientes con DM1 se benefician de terapia intensiva para prevenir complicaciones micro y macrovasculares y disminuir mortalidad.
- Aumento de peso e hipoglicemia son consecuencia frecuente del tratamiento intensificado y atentan contra buen control metabólico.
- Inhibición del glucagón ha demostrado ser muy efectivo en reducir hiperglicemias postprandiales.
- En pequeña escala agonistas de GLP1, e inhibidores de SGLT2 han demostrado cierta mejoría en control glicémico, disminución variabilidad glicémica, utilizando menores dosis de Insulina y pérdida de peso sin riesgo de hipoglicemia.
- SGLT1/2 (duales) permite menores excursiones postprandiales x inhibición absorción de glucosa en el intestino.
- Metformina logra disminución de dosis de insulina y de peso, pero sus efectos sobre el control metabólico no están demostrados.
- Inhibidores de DPP4; GLP1 y SGLT2 no están aprobados en DM1, ni en menores de edad. Metformina se encuentra aprobado desde los 10 años por la FDA
- Todos ellos podrían constituir alternativas promisorias para un grupo seleccionado de jóvenes con DM1.
Referencias
- SEARCH Study Group. SEARCH for Diabetes in Youth: A multicenter study of the prevalence, incidence and classification of diabetes mellitus in youth. Control Clin Trials. 2004;25(5):458-471. doi:10.1016/j. cct.2004.08.002
- Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet (London, England). 2014; 383(9911): 69-82. doi:10.1016/S0140- 6736(13)60591-7
- Diaz-Valencia PA, Bougnères P, Valleron A-J. Global epidemiology of type 1 diabetes in young adults and adults: a systematic review. BMC Public Health. 2015; 15: 255. doi:10.1186/s12889-015-1591-y
- Harjutsalo V, Sund R, Knip M, Groop P-H. Incidence of Type 1 Diabetes in Finland. JAMA. 2013;310(4):427. doi:10.1001/jama.2013.8399
- Silink M. Childhood Diabetes: A Global Perspective. Horm Res Paediatr. 2002;57(1):1-5. doi:10.1159/000053304
- C. Garfias, A. Borzutzky, J. Cerda, F. Ugarte, Y. San Martin, C. Escobar, H. Garcia. Dramatic increase of type 1 diabetes mellitus incidence in Chilean children between 2006 and 2014 ISPAD2014_Conference Resources _Abstracts Library. http://react-profile.org/ebook/ispad2014/Conference Resources_Abstracts Library/files/assets/basic-html / page273.html. Accessed September 17, 2018.
- Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group DM, Nathan DM, Zinman B, et al. Modern-day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983-2005). Arch Intern Med. 2009;1 69(14): 1307-1316. doi:10.1001/archinternmed.2009.193
- Diabetes Control and Complications Trial Research Group, Nathan DM, Genuth S, et al. The Effect of Intensive Treatment of Diabetes on the Development and Progression of Long-Term Complications in Insulin-Dependent Diabetes Mellitus. N Engl J Med. 1993; 329(14): 977-986. doi:10.1056/NEJM199309303291401
- Effect of intensive diabetes treatment on the development and progression of long-term complications in adolescents with insulindependent diabetes mellitus: Diabetes Control and Complications Trial. Diabetes Control and Complications Trial Research Group. J Pediatr. 1994;1 25(2): 177-188. http://www.ncbi.nlm.nih.gov/pubmed/8040759. Accessed September 17, 2018.
- Miller KM, Foster NC, Beck RW, et al. Current state of type 1 diabetes treatment in the U.S.: updated data from the T1D Exchange clinic registry. Diabetes Care. 2015; 38(6): 971-978. doi:10.2337/dc15-0078
- American Diabetes Association AD. 5. Glycemic Targets. Diabetes Care. 2016;39 Suppl 1(Supplement 1): S39-46. doi: 10.2337/dc16-S008
- American Diabetes Association AD. 11. Children and Adolescents. Diabetes Care. 2016; 39 Suppl 1(Supplement 1): S86-93. doi: 10.2337/ dc16-S014
- Campbell MS, Schatz DA, Chen V, et al. A contrast between children and adolescents with excellent and poor control: the T1D Exchange clinic registry experience. Pediatr Diabetes. 2014; 15(2): 110-117. doi: 10.1111/pedi.12067
- Lovshin JA, Drucker DJ. Incretin-based therapies for type 2 diabetes mellitus. Nat Rev Endocrinol. 2009; 5(5): 262-269. doi: 10.1038/ nrendo.2009.48
- Dinneen S, Alzaid A, Turk D, Rizza R. Failure of glucagon suppression contributes to postprandial hyperglycaemia in IDDM. Diabetologia. 1995; 38(3): 337-343. http://www.ncbi.nlm.nih.gov/pubmed/7758881. Accessed September 17, 2018.
- Lotfy M, Kalasz H, Szalai G, Singh J, Adeghate E. Recent Progress in the Use of Glucagon and Glucagon Receptor Antagonists in the Treatment of Diabetes Mellitus. Open Med Chem J. 2014;8(1):28-35. doi:10.2174/1874104501408010028
- Lee YH, Wang M-Y, Yu X-X, Unger RH. Glucagon is the key factor in the development of diabetes. Diabetologia. 2016;59(7):1372-1375. doi:10.1007/s00125-016-3965-9
- Kazda CM, Ding Y, Kelly RP, et al. Evaluation of Efficacy and Safety of the Glucagon Receptor Antagonist LY2409021 in Patients With Type 2 Diabetes: 12- and 24-Week Phase 2 Studies. Diabetes Care. 2016;39(7):1241-1249. doi:10.2337/dc15-1643
- Bergman A, Tan B, Somayaji VR, Calle RA, Kazierad DJ. A 4-week study assessing the pharmacokinetics, pharmacodynamics, safety, and tolerability of the glucagon receptor antagonist PF-06291874 administered as monotherapy in subjects with type 2 diabetes mellitus. Diabetes Res Clin Pract. 2017;126:95-104. doi:10.1016/j.diabres.2017.01.019
- Guzman CB, Zhang XM, Liu R, et al. Treatment with LY2409021, a glucagon receptor antagonist, increases liver fat in patients with type 2 diabetes. Diabetes, Obes Metab. 2017;19(11):1521-1528. doi:10.1111/ dom.12958
- Haedersdal S, Lund ; Asger, Knop FK, Vilsbøll T. The Role of Glucagon in the Pathophysiology and Treatment of Type 2 Diabetes. Mayo Clin Proc. 2018;93:217-239. doi:10.1016/j.mayocp.2017.12.003
- Vella S, Buetow L, Royle P, Livingstone S, Colhoun HM, Petrie JR. The use of metformin in type 1 diabetes: a systematic review of efficacy. Diabetologia. 2010;53(5):809-820. doi:10.1007/s00125-009-1636-9
- Libman IM, Miller KM, DiMeglio LA, et al. Effect of Metformin Added to Insulin on Glycemic Control Among Overweight/Obese Adolescents With Type 1 Diabetes. JAMA. 2015;314(21):2241. doi:10.1001/jama.2015.16174
- Zambrowicz B, Ogbaa I, Frazier K, et al. Effects of LX4211, a Dual Sodium-Dependent Glucose Cotransporters 1 and 2 Inhibitor, on Postprandial Glucose, Insulin, Glucagon-like Peptide 1, and Peptide Tyrosine Tyrosine in a Dose-Timing Study in Healthy Subjects. Clin Ther. 2013;35(8):1162-1173.e8. doi:10.1016/j.clinthera.2013.06.011
- Oku A, Ueta K, Arakawa K, et al. T-1095, an inhibitor of renal Na+- glucose cotransporters, may provide a novel approach to treating diabetes. Diabetes. 1999;48(9):1794-1800. http://www.ncbi.nlm.nih. gov/pubmed/10480610.
- DeFronzo RA, Davidson JA, Del Prato S. The role of the kidneys in glucose homeostasis: a new path towards normalizing glycaemia. Diabetes, Obes Metab. 2012;14(1):5-14. doi:10.1111/j.1463-1326.2011.01511.x
- Bays H. Sodium Glucose Co-transporter Type 2 (SGLT2) Inhibitors: Targeting the Kidney to Improve Glycemic Control in Diabetes Mellitus Diabetes Ther. 2013;4(2):195-220. doi:10.1007/s13300-013-0042-
- Handelsman Y. POTENTIAL PLACE OF SGLT2 INHIBITORS IN TREATMENT PARADIGMS FOR TYPE 2 DIABETES MELLITUS. Endocr Pract. 2015;21(9):1054-1065. doi:10.4158/EP15703.RA
- Perkins BA, Cherney DZI, Partridge H, et al. Sodium-Glucose Cotransporter 2 Inhibition and Glycemic Control in Type 1 Diabetes: Results of an 8-Week Open-Label Proof-of-Concept Trial. Diabetes Care. 2014;37(5):1480-1483. doi:10.2337/dc13-2338
- Pieber TR, Famulla S, Eilbracht J, et al. Empagliflozin as adjunct to insulin in patients with type 1 diabetes: a 4-week, randomized, placebocontrolled trial (EASE-1). Diabetes, Obes Metab. 2015;17(10):928-935. doi:10.1111/dom.12494
- Scheen AJ. SGLT2 inhibition: efficacy and safety in type 2 diabetes treatment. Expert Opin Drug Saf. 2015;14(12):1879-1904. doi:10.1517 /14740338.2015.1100167
- Rosenstock J, Ferrannini E. Euglycemic Diabetic Ketoacidosis: A Predictable, Detectable, and Preventable Safety Concern With SGLT2 Inhibitors. Diabetes Care. 2015;38(9):1638-1642. doi:10.2337/dc15- 1380
- Taylor SI, Blau JE, Rother KI. SGLT2 Inhibitors May Predispose to Ketoacidosis. J Clin Endocrinol Metab. 2015;100(8):2849-2852. doi:10.1210/jc.2015-1884
- Sands AT, Zambrowicz BP, Rosenstock J, et al. Sotagliflozin, a Dual SGLT1 and SGLT2 Inhibitor, as Adjunct Therapy to Insulin in Type 1 Diabetes. Diabetes Care. 2015;38(7):1181-1188. doi:10.2337/dc14-2806
- Holst JJ. The Physiology of Glucagon-like Peptide 1. Physiol Rev. 2007;87(4):1409-1439. doi:10.1152/physrev.00034.2006
- Theodorakis MJ, Carlson O, Michopoulos S, et al. Human duodenal enteroendocrine cells: source of both incretin peptides, GLP-1 and GIP. Am J Physiol Metab. 2006;290(3):E550-E559. doi:10.1152/ ajpendo.00326.2004
- Holst JJ. Incretin hormones and the satiation signal. Int J Obes (Lond). 2013;37(9):1161-1168. doi:10.1038/ijo.2012.208
- Kuhadiya N, Malik R, Bellini N, et al. Liraglutide as Additional Treatment to Insulin in Obese Patients with Type 1 Diabetes Mellitus. Endocr Pract. 2013;19(6):963-967. doi:10.4158/EP13065.OR
- Wang W, Liu H, Xiao S, Liu S, Li X, Yu P. Effects of Insulin Plus Glucagon-Like Peptide-1 Receptor Agonists (GLP-1RAs) in Treating Type 1 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Diabetes Ther. 2017;8(4):727-738. doi:10.1007/s13300-017-0282-3
- Kielgast U, Krarup T, Holst JJ, Madsbad S. Four Weeks of Treatment With Liraglutide Reduces Insulin Dose Without Loss of Glycemic Control in Type 1 Diabetic Patients With and Without Residual -Cell Function. Diabetes Care. 2011;34(7):1463-1468. doi:10.2337/dc11-0096
- Dejgaard TF, Frandsen CS, Hansen TS, et al. Efficacy and safety of liraglutide for overweight adult patients with type 1 diabetes and insufficient glycaemic control (Lira-1): a randomised, double-blind, placebo-controlled trial. lancet Diabetes Endocrinol. 2016;4(3):221- 232. doi:10.1016/S2213-8587(15)00436-2
- Frandsen CS, Dejgaard TF, Holst JJ, Andersen HU, Thorsteinsson B, Madsbad S. Twelve-Week Treatment With Liraglutide as Add-on to Insulin in Normal-Weight Patients With Poorly Controlled Type 1 Diabetes: A Randomized, Placebo-Controlled, Double-Blind Parallel Study. Diabetes Care. 2015;38(12):2250-2257. doi:10.2337/dc15-1037
- Ahrén B, Masmiquel L, Kumar H, et al. Efficacy and safety of onceweekly semaglutide versus once-daily sitagliptin as an add-on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): a 56-week, double-blind, phase 3a, randomised trial. Lancet Diabetes Endocrinol. 2017;5(5):341-354. doi:10.1016/S2213- 8587(17)30092-X
- Shi F-H, Li H, Cui M, Zhang Z-L, Gu Z-C, Liu X-Y. Efficacy and Safety of Once-Weekly Semaglutide for the Treatment of Type 2 Diabetes: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Front Pharmacol. 2018;9:576
- Drucker DJ. Dipeptidyl Peptidase-4 Inhibition and the Treatment of Type 2 Diabetes: Preclinical biology and mechanisms of action. Diabetes Care. 2007;30(6):1335-1343. doi:10.2337/dc07-0228
- Chen X-W, He Z-X, Zhou Z-W, et al. Clinical pharmacology of dipeptidyl peptidase 4 inhibitors indicated for the treatment of type 2 diabetes mellitus. Clin Exp Pharmacol Physiol. 2015;42(10):999-1024. doi:10.1111/1440-1681.12455
- Groop P-H, Del Prato S, Taskinen M-R, et al. Linagliptin treatment in subjects with type 2 diabetes with and without mild-to-moderate renal impairment. Diabetes, Obes Metab. 2014;16(6):560-568. doi:10.1111/ dom.12281
- Ba J, Han P, Yuan G, et al. Randomized trial assessing the safety and efficacy of sitagliptin in Chinese patients with type 2 diabetes mellitus inadequately controlled on sulfonylurea alone or combined with metformin. J Diabetes. 2017;9(7):667-676. doi:10.1111/1753-0407.12456
- Deacon CF, Lebovitz HE. Comparative review of dipeptidyl peptidase-4 inhibitors and sulphonylureas. Diabetes, Obes Metab. 2016;18(4):333- 347. doi:10.1111/dom.12610
- Sherifali D, Nerenberg K, Pullenayegum E, Cheng JE, Gerstein HC. The Effect of Oral Antidiabetic Agents on A1C Levels: A systematic review and meta-analysis. Diabetes Care. 2010;33(8):1859-1864. doi:10.2337/dc09-1727