Quiste de bolsa de Rathke e hiperprolactinemia, una causa infrecuente de amenorrea primaria
Irasel Martínez Montenegro1*, Claudia Borges Alonso2.
Rathke cleft cysts and hyperprolactinemia, an uncommon cause of primary amenorrhea
1 .Especialista en Endocrinología.
Máster en Infectología. Profesor
Instructor. Servicio Endocrinología
Hospital Teodoro Maldonado Carbo.
Guayaquil, Guayas, Ecuador.
2 Especialista en Endocrinología.
Servicio Endocrinología Hospital
General del Norte de Guayaquil Los
Ceibos. Guayaquil, Guayas, Ecuador.
*Correo electrónico: Irasel Martínez Montenegro irasel051283@gmail.com.
Dirección: Guayacanes, Manzana 203 Solar 1, Guayaquil, Guayas, Ecuador.
Recibido: 14-10-2019
Aceptado: 09-01-2020
Resumen: El quiste de la bolsa de Rathke es una lesión epitelial benigna de la
región selar, formada a partir de remanentes embrionarios. La mayoría de los casos
son asintomáticos, aunque pudiera presentarse con cefalea, disfunción hipofisaria y
trastornos visuales, muy infrecuentemente como apoplejía hipofisaria. Se presenta
el caso de una paciente que, habiendo presentado amenorrea primaria, se le realiza
el diagnóstico de quiste de la bolsa de Rathke con hiperprolactinemia, logrando
menarquia luego del tratamiento con cabergolina.
Palabras clave: Amenorrea, Hiperprolactinemia, Quiste de Rathke.
Abstract: Rathke’s cyst is a benign epithelial lesion of the sellar region, formed from
embryonic remnants. Most cases are asymptomatic although it could present with
headache, pituitary dysfunction and visual disorders, very infrequently as pituitary
stroke. We present the case of a patient who, having presented primary amenorrhea,
is diagnosed with Rathke’s cyst with hyperprolactinemia, achieving menarche after
treatment with cabergoline.
Key words: Amenorrhea, Hyperprolactinemia. Rathke cyst.
El quiste de la bolsa de Rathke es la lesión selar no adenomatosa más frecuente1,2. Descrita por Martin Heinrich Rathke (1793-1860), a quien debe su nombre3, su formación está dada por una obliteración inadecuada de la bolsa de Rathke que produce quistes o restos quísticos en la superficie de contacto entre los lóbulos anterior y posterior de la hipófisis4.
Por lo general se localiza en la región selar y supraselar5, inusualmente también se ha encontrado en la región del seno esfenoidal y ocasionalmente asociado a otras lesiones como adenomas hipofisarios, hamartomas y craneofaringioma6,7.
Se presenta generalmente en niños y adultos jóvenes7, con edades comprendidas entre 10 y 29 años, predominando en mujeres6. La mayoría de los quistes de Rathke son asintomáticos durante toda la vida de los individuos y son hallados de manera incidental en el 4-33% de las autopsias, por estudios de neuro-imagen de tomografía computarizada (TC) y resonanciamagnética (RM) de cráneo8.
Los pacientes que presentan clínica usualmente se manifiestan con cefalea, disfunción pituitaria y trastornos visuales secundarios a la extensión supraselar de la lesión. Raramente, pueden presentarse de manera similar a una apoplejía de un tumor pituitario9. El tamaño de estos quistes puede ser variable y en ocasiones presentan insuficiencia hipofisaria10 e hiperprolactinemia por efecto compresivo sobre el tallo hipofisario. La elevación de prolactina en presencia de una masa selar, se puede relacionar con alteraciones menstruales y galactorrea.
Mientras los quistes de Rathke asintomáticos son típicamente seguidos por estudios de imagen seriados, los sintomáticos son manejados mediante descompresión quirúrgica, usualmente a través de un corredor transesfenoidal alcanzado a través del uso de un microscopio quirúrgico o un endoscopio5.
El caso que se presenta a continuación nos muestra una lesión no adenomatosa en la hipófisis que provoca una asociación poco frecuente de hiperprolactinamia y amenorrea primaria.
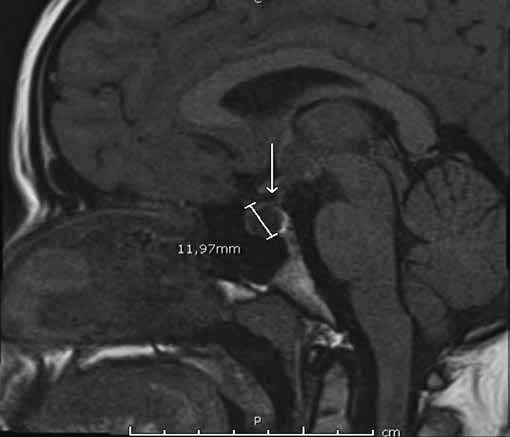
Figura 1a. RM de si a lla turca contrastada con gadolinio. Corte sagital en T1. Cortes 2.5 mm. Se señala región selar.
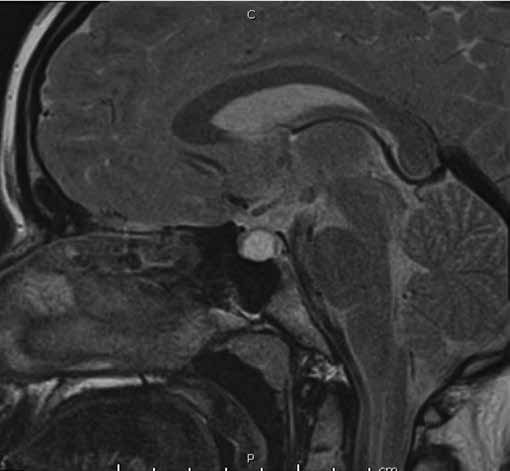
Figura 1b. RM de si a lla turca contrastada con gadolinio. Corte sagital en T2. Cortes 2.5 mm.
Caso clínico
Paciente femenina de 17 años de edad acude a consulta, referida del servicio de ginecología, por presentar amenorrea primaria. Al examen físico: aspecto normolíneo, ausencia de galactorrea, no presencia de signos dismórficos, desarrollo mamario estadio Tanner V.
En exámenes de laboratorio: hormona folículo estimulante (FSH) 5,97 mUI/ml (3,5-12,5 mUI/ml), hormona luteinizante (LH) 7,45 mUI/ml (2,4-12,6 mUI/ml), 17-beta estradiol 26,11 pg/ ml (24,5-195 pg/ml), testosterona 0,09 ng/ml (0,06-0,86 ng/ ml), hormona estimulante del tiroides (TSH) 3,8 ulU/ml (0,4 - 4,0 ulU/ml), hormona adrenocorticotropa (ACTH) 16,7 pg/ml (hasta 46 pg/ml), prolactina (PRL) (primera muestra) 374 ng/ ml, (segunda muestra) 97,4 ng/ml (1,9 - 25 ng/ml).
Se informa a continuación los estudios de imagen. Ecografía ginecológica (estudio previo indicado por ginecología): útero de forma y tamaño normal que mide 52 x 21 x 29 mm, endometrio de 5 mm, ovario derecho 25 x 18 mm, ovario izquierdo 28 x 17 mm. RM de silla turca: glándula hipofisaria aumentada de tamaño que mide 1,0 cm de altura, 1,9 cm de ancho, 1,2 cm anteroposterior, imagen de comportamiento quístico en las diferentes secuencias con realce homogéneo del parénquima glandular que rodea la lesión quística y se mantiene hipointensa en T1 (Figura 1a), tallo hipofisario en la línea media, quiasma óptico y estructuras vasculares sin compresión. En T2 se aprecia parénquima glandular hiperintenso (Figura 1b). Campo visual sin alteraciones.
Se diagnostica hiperprolactinemia por efecto compresivo de quiste de la bolsa de Rathke. Se inició tratamiento con cabergolina 1 mg semanal por vía oral. Se repitió la prolactina un mes después de comenzado el tratamiento, evidenciando su disminución a 34,9 ng/ml. Se logró menarquia luego del primer mes de tratamiento.
Discusión
En el diagnóstico del quiste de la bolsa de Rathke, la RM con gadolinio muestra masas hiper o hipodensas en las imágenes potenciadas en T1 o T2, y la TC revela áreas hipodensas homogéneas, que se pueden diferenciar de los adenomas hipofisarios11.
La RM con gadolinio resulta fundamental para definir la localización exacta de la lesión: el patrón de realce de gadolinio, la presencia de vacíos vasculares o regiones quísticas, y el edema vasógeno en el tejido cerebral circundante12.
Además, distingue con facilidad los adenomas hipofisarios de otro tipo de masas, como hiperplasias, craneofaringiomas, meningiomas, cordomas, quistes y lesiones metastásicas13.
Las lesiones no adenomatosas más frecuentes de la hipófisis son el quiste de la bolsa de Rathke, el craneofaringeoma y el meningeoma1 y el primero de estos representa hasta el 40% del total2.
Una elevación mínima a moderada de PRL puede ser indicativa de interrupción secundaria del tallo hipofisario por una masa hipofisaria. La concentración de PRL superior a 500 ng/ml fuera del período de embarazo se considera patognomónica de prolactinoma14.
Por el contrario, una concentración de PRL inferior a 200 ng/ml en un paciente con macrotumor hipofisario indica que es probable que el tumor no produzca PRL, por lo que la hiperprolactinemia puede originarse como consecuencia de la presión de la masa sobre el tallo hipofisario o la circulación portal, interrumpiendo probablemente el control inhibidor de la dopamina15.
La PRL elevada provoca alteraciones del eje gonadotrópico, inhibiendo la secreción pulsátil de Gn-RH (hormona liberadora de gonadotropina). Ha habido informes de un efecto inhibitorio directo sobre la función testicular y ovárica. Además, la inhibición de la LH debido al aumento del tono opioide observado en la hiperprolactinemia, también se ha implicado como causa de amenorrea en pacientes con PRL alta11.
Estas alteraciones aparecen en mujeres adolescentes: pubertad tardía (48%), amenorrea primaria (14-41%), amenorrea secundaria (29-45%) y oligomenorrea (hasta 29%). La galactorrea no es un signo constante en pacientes pediátricos, se ha informado entre el 30 al 50% de las niñas16,17. Lo anterior contrasta con la prevalencia de galactorrea en mujeres adultas, que representa hasta el 80%18.
Es posible que la galactorrea solo se ponga de manifiesto con la manipulación manual de los pezones. Tras la reducción de las concentraciones séricas de PRL suele producirse la progresión de la pubertad y una función menstrual normal en las mujeres.
Referencias
- Famini P, Maya MM, Melmed S. Pituitary magnetic resonance imaging for sellar and parasellar masses: ten-year experience in 2598 patients. J Clin Endocrinol Metab. 2011; 96: 1633-1641.
- Valassi E, Biller BM, Klibanski A, Swearingen B. Clinical features of nonpituitary sellar lesions in a large surgical series. Clin Endocrinol (Oxf). 2010; 73: 798-807.
- Megdiche-bazarbacha H, Ben Hammouda K, Aicha A y col. Intrasphenoidal Rathke Cleft Cyst. American Journal Neuroradiology 2006; 27: 1098-100.
- el-Mahdy W, Powell M. Transsphenoidal management of 28 symptomatic Rathke’s cleft cysts, with special reference to visual and hormonal recovery. Neurosurgery. 1998; 42: 7-16: discussion 17.
- Han SJ, Rolston JD, Jahangiri A, Aghi MK. Rathke’s cleft cysts: review of natural history and surgical outcomes. J Neurooncol. 2014; 117: 197-203.
- Moreno Leyva K, Ortíz Plata A, García Navarro V, Tena Suck ML. Quiste de Rathke roto a adenohipófisis. Arch Neurocien (Mex). 2007; 12(2): 129-33.
- Gutiérrez Alvarado RA, Romo Bonilla G, Pacheco F. Quiste de Rathke. EvidMedInvest Salud. 2013; 6(3): 95-99.
- Pinto Rafael JI, Vázquez-Barquero A, Sanz F, Figols J, Izquierdo JM, Canga A, et al. Quiste sintomático de la bolsa de Rathke: presentación de un caso y revisión de la literatura. Neurocirugía. 1998; 9: 163-167.
- Ealmaan K. A Rathke’s cleft cyst presenting with apoplexy. J Korean Neurosurg Soc. 2012;52(4): 404-406. DOI:10.3340/jkns.2012.52.4.404.
- Freda PU, Wardlaw SL, Post KD. Unusual causes of sellar/parasellar masses in a large transsphenoidal surgical series. J Clin Endocrinol Metab.1996; 81: 3455-3459.
- Mukherjee JJ, Islam N, Kaltsas G, et al. Clinical, radiological and pathological features of patients with Rathke’s cleft cysts: tumors that may recur. J Clin Endocrinol Metab. 1997; 82: 2357-2362.
- Melmed S, Kleinberg DL: Anterior pituitary; in Larsen PR, Kronenberg HM, Melmed S, Polonsky KS (eds): Williams Textbook of Endocrinology. Philadelphia, Saunders, 2002; p 177-237.
- Issa N, Poggio ED, Fatica RA, et al. Nephrogenic systemic fibrosis and its association with gadolinium exposure during MRI. Cleve Clin J Med. 2008; 75: 95-97.
- Karavitaki N, Thanabalasingham G, Shore HC, et al. Do the limits of serum prolactin in disconnection hyperprolactinaemia need re-definition? A study of 226 patients with histologically verified non-functioning pituitary macroadenoma. Clin Endocrinol (Oxf). 2006; 65: 524-529.
- Arafah BM, Nekl KE, Gold RS, Selman WR. Dynamics of prolactin secretion in patients with hypopituitarism and pituitary macroadenomas. J Clin Endocrinol Metab. 1995; 80: 3507-3512.
- Fideleff HL, Boquete HR, Sequera A, Suárez M, Sobrado P, Giaccio A: Peripubertal prolacinomas: clinical presentation and long-term outcome with different therapeutic approaches. J Pediatr Endocrinol Metab 2000; 13: 261-267.
- Colao A, Loche S, Cappa M, Di Sarno A, Landi ML, Sarnacchiaro F, Facciolli G, Lombardi G: Prolactinomas in children and adolescents. Clinical presentation and long-term follow-up. J Clin Endocrinol Metab 1998; 83: 2777-2780.
- Casanueva FF et al: Guidelines of the pituitary of the pituitary society for the diagnosis and management of prolactinomas. Clin Endocrinol 2006; 65: 265-273.