Enfermedades hepáticas y su relación con hiperglicemia
Paulina Vignolo1, Karina Elgueta2, Gloria López3 , Pilar Durruty2, Patricia Gómez3, Gabriela Sanzana3.
Macro TSH as a cause of refractory hypothyroidism. Based on two clinical cases
1 Sección Diabetes, Unidad Medicina Interna, Hospital Padre Hurtado. Santiago de Chile.
2 Bioquímico. Unidad Diabetes, Hospital San Juan de Dios. Santiago de Chile
3 Sección Endocrinología y Diabetes, Hospital Clínico Universidad de Chile. Santiago de Chile.
Correspondencia: Paulina Vignolo
paulinavignoloa@gmail.com.
Santos Dumont 999.
Sin financiamiento ni conflicto de intereses
Recibido: 08-09-2019
Aceptado: 22-11-2019
Resumen: La Diabetes Mellitus tipo 2 (DM2) y las enfermedades crónicas del hígado(ECH), definida para esta revisión como cualquier alteración funcional o estructural de este órgano, desde inflamación hasta fibrosis, son patologías que frecuentemente se asocian, y su coexistencia se relaciona con peor pronóstico y mayores complicaciones de ambas entidades. El objetivo de este artículo es describir la relación entre hiperglicemia y enfermedades del hígado, sus procesos fisiopatológicos comunes y tratamiento, distinguiendo las patologías más relevantes, entre ellas la Diabetes Hepatogénica (DH), la enfermedad hepática por Virus Hepatitis C (VHC) y la Enfermedad Hepática Grasa No Alcohólica (EHGNA). La DH es aquella diagnosticada en pacientes con cirrosis asociada a insuficiencia hepática, sin antecedentes previos de alteración de la glicemia. En la actualidad el diagnóstico se realiza en etapas tardías de la enfermedad. El VHC tiene un efecto diabetogénico conocido. Algunas terapias antivirales usadas para VHC evidencian mejoría de las alteraciones metabólicas al lograr respuestas virológicas sostenidas. En DM2, la EHGNA es frecuente, con mayor incidencia de fibrosis, hepatocarcinoma (HCC) y riesgo cardiovascular (RCV). Es necesario realizar una pesquisa e intervención precoz de EHGNA a los pacientes con DM2. En el manejo de éstos, la baja de peso ha demostrado ser efectiva en el control glicémico y en la mejoría histológica. Dentro de las terapias antidiabéticas, además del uso de metformina, debería considerarse aquellas que han demostrado a la fecha beneficios en EHGNA, como son tiazolidinedionas (pioglitazona) y/o análogos de GLP-1 (liraglutide) y optimizar el control de otros factores de RCV.
Palabras clave: Enfermedades crónicas del hígado, Enfermedad Hepática Grasa no Alcoholica, Diabetes mellitus, Hepatitis C crónica.
Abstract: Type 2 Diabetes Mellitus (DM2) and chronic liver diseases (CLD) defined
in this revision as any functional or structural alteration in the organ, covering
from inflammation to fibrosis, are pathologies that are frequently associated, and
when found together are related to worse prognosis and higher complications in
both conditions. The objective of this article is to describe the relationship between
hyperglycemia and liver diseases, their common physio-pathological processes
and treatments, identifying the most important pathologies, including Hepatogenic
Diabetes (HD), Hepatitis C Virus (HCV) liver disease and Non-Alcoholic Fatty Liver
Disease (NAFLD). Hepatogenic diabetes (HD) is diagnosed in patients with liver
failure associated to cirrhosis with no previous record of impaired glycemia. Currently,
diagnosis is made during the late stages of the disease. Hepatitis C virus (HCV)
has a known diabetogenic effect. Some antiviral therapies used for HCV show improvement
in metabolic alterations by achieving sustained virological responses. Non-alcoholic fatty liver disease (NAFLD) in DM2 patients is
common, presenting higher risk for fibrosis, hepatocellular
carcinoma (HCC) and increased cardiovascular risk (CVR).
Early screening and interventions for NAFLD in DM patients
are necessary. Weight loss has been shown to be effective in
glycemic control and histological improvement. Anti-diabetic
therapies, in addition to the use of metformin, should consider
therapies that have shown benefits for managing NAFLD, such
as thiazolidinedione (pioglitazones) and/or aGLP-1 (Liraglutide),
and optimally controlling other cardiovascular risk (CVR) factors.
Key words: Diabetes mellitus, chronic hepatitis C, End-stage
liver disease, Non-alcoholic fatty liver disease
La Diabetes Mellitus (DM2) es una enfermedad crónica con alta prevalencia a nivel mundial y nacional, reportándose en un 12,3% de la población adulta chilena1. La ECH definida para esta revisión como cualquier alteración funcional o estructural de este órgano, desde inflamación hasta fibrosis tiene un 2,8% de prevalencia2, la que se estima podría ser mayor por el alto porcentaje de adultos que presentan transaminasas elevadas: gamma glutamil transferasa (GGT)17% y glutámico pirúvica (GPT) 15,3%, como lo reporta la encuesta nacional de salud 2010 en nuestro país1.
Ambas entidades presentan altas tasas de mortalidad, siendo la DM2 responsable de 20 muertes por 100.000 habitantes y la cirrosis de 24 muertes por 100.000 habitantes en Chile2. En EE.UU., la DM se ubica en el 7° lugar de causas de muerte y la cirrosis en el lugar 123.
Estas patologías se encuentran unidas fisiopatológicamente por el metabolismo hepático de la glucosa.
El hígado es un órgano central en la regulación de la glicemia, siendo el responsable de un 90% de la producción endógena de glucosa a través de la gluconeogénesis y glicogenolisis. En estados de ayuno genera la glucosa necesaria para el metabolismo celular. En períodos post prandiales el hígado aumenta la formación de glicógeno, suprime glicogenolisis, logrando así el equilibrio entre la carga de glucosa proveniente de la ingesta y los niveles plasmáticos de ésta4.
Comprendiendo este rol fundamental del hígado en la homeostasis de la glicemia, es esperable que cualquier enfermedad que lo afecte, tenga la potencialidad de producir alteraciones en el metabolismo glucídico tanto en personas sanas como en aquellos con DM2.
Se plantea que la DM2 se asocia fuertemente a la ECH, en todo el espectro, desde alteraciones de enzimas hepáticas hasta cirrosis y hepato carcinoma (HCC)5, y que los pacientes con ECH tienen una prevalencia aumentada de DM2, pudiendo incluso considerarse una complicación de la cirrosis6. Por otro lado, el diagnóstico de DM2 en pacientes con cirrosis es un factor de riesgo independiente de mal pronóstico y se asocia a mayores complicaciones y mortalidad7.
Las alteraciones en la glicemia de los pacientes con ECH, principalmente con cirrosis, son variadas y más frecuentes que en la población general, lo que se ha evidenciado al realizar una prueba de tolerancia a la glucosa oral (PTGO) a ambos grupos encontrándose un 30-50% de intolerancia a la glucosa y 30-45% de DM2 en el grupo con cirrosis en comparación con 23% y 8% en población general8-10.
De los pacientes con cirrosis diagnosticados de DM2 con PTGO, el 23% tiene glicemias de ayuno normales. Por lo tanto, el uso de glicemia basal como examen único de pesquisa en este grupo de pacientes puede generar subdiagnóstico8, por lo que se recomienda la realización de PTGO para aumentar la sensibilidad de la pesquisa. Si bien el diagnóstico de DM2 por hemoglobina glicosilada (A1c) en ésta, como en toda la población chilena, no se realiza por la falta de estandarización del método, el seguimiento también se ve afectado en pacientes cirróticos ya que la menor vida media de los glóbulos rojos la subestima, por lo tanto, su utilidad es escasa. La fructosamina podría ser utilizada en estos casos, pero esta determinación no está disponible en nuestro país9.
La asociación de estas enfermedades ejerce un efecto sumatorio. Pacientes con enfermedad hepática y alteración de la glicemia, ya sea DM2 o prediabetes, tienen mayor mortalidad y, así como más complicaciones propias de la cirrosis, independiente de la causa de la enfermedad10,11.
Los pacientes con DM2 tienen más riesgo de muerte por causas digestivas, principalmente ECH y sus complicaciones. Esta relación se evidencia en el estudio Verona, que siguió 7.148 pacientes con DM2 durante 5 años, encontrándose un aumento del riesgo de muerte por cirrosis y HCC con un ratio de mortalidad estandarizado de 2,5 (IC 1,9- 3,2) al compararlos con población no DM212.
El tratamiento de la DM2 en pacientes con ECH, es en ocasiones complejo. En casos de daño avanzado puede producirse alteración del metabolismo y excreción de la mayoría de los fármacos antidiabéticos.
Por todo lo anterior, es importante analizar las principales asociaciones entre hígado y alteraciones metabólicas. Revisaremos la diabetes hepatogénica (DH), como complicación de la ECH avanzada, la relación entre el virus hepatitis C (VHC) y alteraciones de la glicemia, y la enfermedad hepática grasa no alcohólica (EHGNA) como complicación del síndrome metabólico y la DM2.
Diabetes hepatogénica
Se define como la alteración en la regulación de la glucosa, causada por la pérdida de función del hígado, como consecuencia de la cirrosis7. Aparece, por tanto, luego del diagnóstico de cirrosis descompensada, sin historia previa de alteración de la glicemia. Se presenta con más frecuencia en pacientes cirróticos por alcohol, VHC y criptogénica. Se considera un indicador de enfermedad hepática avanzada. En general, existe ausencia de factores de riesgo clásicos como historia familiar de DM2, obesidad o dislipidemia y en su evolución presentan con menos frecuencia complicaciones microvasculares13,14. Sin embargo la ADA (Asociación Diabetes Americana) no reconoce esta entidad dentro de su clasificación, como tampoco en su momento se reconocía la diabetes post trasplante15. En cuanto a su fisiopatología (Figura 1), la DH se produce por resistencia a la insulina (RI) y déficit de secreción de la hormona, al igual que en la DM2 clásica, pero sus mecanismos son algo diferentes y aún no están bien dilucidados7,8.
La sarcopenia, provocada por la cirrosis disminuye la captación de glucosa en el músculo y tejido adiposo, característica clave de RI periférica; existe, además, aumento de la producción de glucosa por el hígado. La RI provoca hiperinsulinemia compensatoria por parte de las células beta, sumado a la disminución de depuración de la insulina por disfunción de las células hepáticas y existencia de derivaciones porto-sistémicas que evitan su paso por el hígado7.
Se produce un deterioro progresivo de la función beta celular, al igual que en la DM2, hecho fundamental para el desarrollo de DH. El efecto tóxico de varias sustancias producidas o no eliminadas por el hígado, como los productos de glicación avanzada podrían potenciar esta alteración8. De manera que, la respuesta secretora de insulina es insuficiente para compensar el defecto en la acción de la hormona, elevándose la glicemia en forma progresiva.
La distinción entre DH y DM2 preexistente no diagnosticada es difícil.No existe un estudio en particular que nos permita diferenciar ambas entidades, son los criterios clínicos (Tabla 1) fundamentales para el diagnóstico. Esta distinción es de relevancia clínica para el enfoque terapéutico de la DH que se basará en el control metabólico evitando riesgos de los antidiabéticos asociados a la pérdida de la funcionalidad hepática, como la hipoglicemia por alteración en la producción hepática de glucosa en estados avanzados y eventual mayor riesgo de acidosis láctica con el uso de metformina por la alteración del metabolismo hepático del lactato 6. Basándonos en la fisiopatología de la DH, el trasplante hepático podría favorecer a la reversión de esta condición, no así de la DM2, aunque se requiere literatura que avale esta teoría.
La DH es una entidad creciente dada la prevalencia aumentada de ECH, y debe ser buscada de forma activa ya que la glicemia de ayuno puede ser normal8.
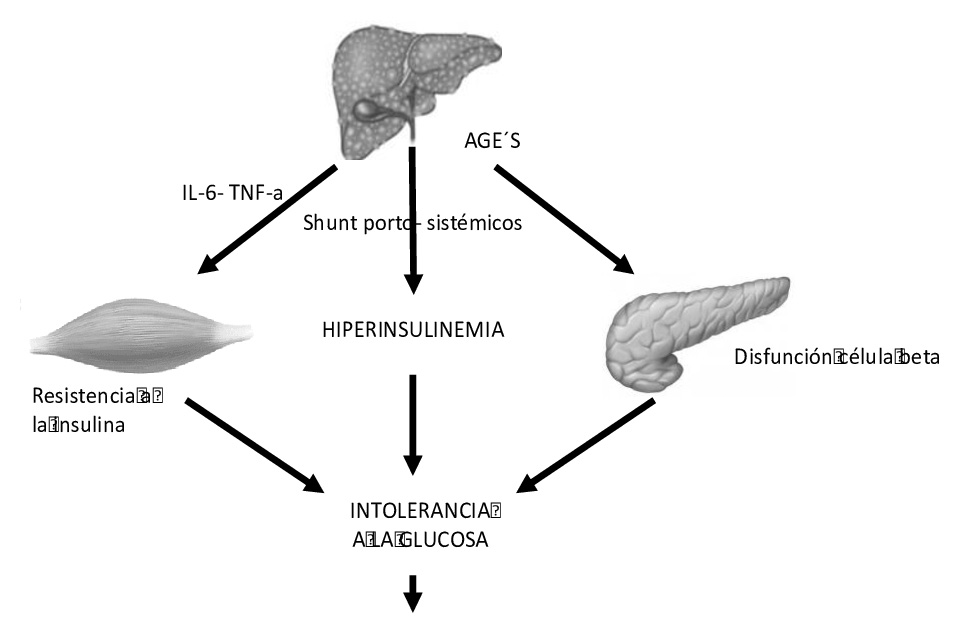 Figura 1: Fisiopatología de DM hepatogénica. El aumento de factores inflamatorios, la no depuración de AGES y la presencia de shunt portosistémicos, producto
de la cirrosis, genera resistencia a la insulina, disfunción célula beta e hiperinsulinemia, favoreciendo el desarrollo de intolerancia a la glucosa y diabetes.
AGES: productos de glicosilación avanzada, IL -6:interleuquina 6, TNF: factor de necrosis tumoral alfa. Adaptado de Orsi et al.
Figura 1: Fisiopatología de DM hepatogénica. El aumento de factores inflamatorios, la no depuración de AGES y la presencia de shunt portosistémicos, producto
de la cirrosis, genera resistencia a la insulina, disfunción célula beta e hiperinsulinemia, favoreciendo el desarrollo de intolerancia a la glucosa y diabetes.
AGES: productos de glicosilación avanzada, IL -6:interleuquina 6, TNF: factor de necrosis tumoral alfa. Adaptado de Orsi et al.| DM hepatogénica | DM2 | |
| Diagnóstico | Luego del diagnóstico de cirrosis | Antes del diagnóstico de cirrosis |
| Presentación clínica | Asintomáticos o encubierta por síntomas de DHC | Asintomáticos o síntomas clásicos |
| Laboratorio | GA pudiera estar nomal y A1C(falsamente disminuida), Glicemia post carga elevada | Alteración GA y A1C |
| Hipoglicemia y acidosis láctica | Alto riesgo | Bajo riesgo |
| Efecto de THO | Revierte o atenúa | Persiste |
| FR tradicionales | Menos frecuentes | Frecuentes |
| Complicaciones DM2 | Baja incidencia | Alta incidencia |
| Complicaciones enfermedad hepática | Mayor que cirróticos no DM2 | Mayor que cirróticos no DM2 |
| Mortalidad | Mayor que cirróticos no DM2 | Mayor que cirróticos no DM2 |
Adaptado de Orsi el al 7. DM2: DM tipo 2; GA: glicemia ayunas; HbA1c: A1C; PTGO: prueba tolerancia a la glucosa; THO: trasplante hepático ortotópico.
Diabetes Mellitus tipo 2 y Virus Hepatitis C
La prevalencia mundial de la infección por VHC es aproximadamente 1,6%16. Es una enfermedad sistémica con múltiples manifestaciones extra hepáticas, dentro de las cuales la DM2 es una de las más prevalentes, puesto que afecta hasta un 15% de los pacientes infectados con VHC17. Se describe un riesgo relativo de DM2 de 1,81 (IC 95% 1,15-2,89) al comparar con población general18, independiente de la presencia de cirrosis, lo que sugiere una conexión entre VHC e IR/DM2.
Shruti et al. evaluaron una cohorte de 9.841 pacientes mayores de 20 años del estudio NHANES II, evidenciando que aquellos VHC (+) tuvieron una mayor incidencia de DM2, con un “odds ratio” de 3,77, que aumentaba en forma sostenida en pacientes mayores de 40 años19,20. En la fisiopatología de esta relación, se ha observado que el VHC produce una serie de anormalidades metabólicas denominadas síndrome dismetabólico asociado al VHC, que se caracteriza por obesidad visceral, hígado graso, hiperuricemia, hipercolesterolemia, IR e HTA21. Se ha demostrado que proteínas del core del VHC producen una IR hepática y extrahepática vía directa y a través de citoquinas proinflamatorias, principalmente factor de necrosis tumoral alfa (TNFα) e interleuquina 6 (IL6). Estos provocan interferencia con la señalización de insulina en la vía de la proteína quinasa B, lo que lleva a supresión de la actividad del transportador de glucosa 4 (GLUT-4)22. La sobreproducción de TNF-α también aumenta la fibrosis hepática.
El VHC podría además provocar daño a la célula beta por un efecto citotóxico directo, que produciría reducción de la liberación de insulina mediada por glucosa, y a través de un efecto indirecto, mediado por mecanismos autoinmunes, que se asocian a alteraciones gonadales y tiroídeas y fenómenos como crioglobulinemia. Se postula que la estimulación masiva del sistema inmune por el VHC activa linfocitos que destruyen a las células beta23. Lo anterior, hace que la presencia del VHC sea considerada diabetogénica.
La asociación entre DM2 e infección crónica por VHC tiene importancia pronóstica, ya que eleva fuertemente el riesgo de progresión a fibrosis24,25, por lo que un buen control metabólico y baja de peso sería beneficioso26. La aparición de DM2 en los pacientes con VHC, es además un predictor independiente de descompensación de la enfermedad hepática, describiéndose mayores complicaciones de la cirrosis27, severidad de ascitis, peritonitis bacteriana espontánea, disfunción renal y HCC28,29, así como menor respuesta a tratamiento antiviral30 y mayor RCV31. Se ha descrito que la erradicación VHC con terapia antiviral disminuye la prevalencia de DM223, observándose que el tratamiento con interferón puede mejorar la IR y la función de la célula beta32. En diversos estudios, pacientes tratados con antivirales y que logran respuesta virológica sostenida, presentan menos incidencia de anormalidades de la glucosa a 3 años de seguimiento, comparados con pacientes que no logran esta respuesta33. Existen pocos estudios con los nuevos antivirales, pero algunos preliminares muestran que su uso reducen la glucosa y A1c en pacientes con DM2 y VHC34.
Enfermedad hepática grasa no alcohólica
Se define según los siguientes criterios: 1) presencia de esteatosis hepática (más de 5% de los hepatocitos comprometidos por histología o más de 5,6% por resonancia nuclear magnética (RNM), 2) ausencia de consumo de alcohol significativo (<30 g hombre/ <20 g mujer por semana) y 3) ausencia de otra etiología más probable.
Incluye un espectro de presentaciones de diversa gravedad, desde la esteatosis, esteatohepatitis, necrosis, fibrosis, cirrosis y la eventual aparición de HCC36-38. La prevalencia de EHGNA ha ido en aumento los últimos años y varía según el método de pesquisa: alrededor de 25% en la población general y 59% en pacientes con DM2. Estos tienen una enfermedad más severa y una alta progresión a HCC35. Además de asociarse con peor control metabólico y a mayor RCV, caracterizado por mayor prevalencia de enfermedad coronaria y cerebrovascular39-42. EHGNA y la DM2 comparten mecanismos fisiopatológicos similares como son el aumento de tejido adiposo con el consecuente aumento de ácidos grasos libres (AGL), triglicéridos y TNFα, la activación de la vía del diacilglicerol/proteína quinasa C con la disminución de la señalización intracelular de la insulina y el efecto incretina disminuido, favoreciéndose la IR y gluconeogénesis (Figura 2). Por lo tanto la presencia de EHGNA en cualquiera de sus etapas, favorece la aparición de DM2 en individuos susceptibles y el mal control metabólico en aquellos con la enfermedad7,36. Por la alta asociación de ambas patologías y el mayor riesgo de progresión de la EHGNA en DM2, Bril et al37 sugieren estudio rutinario de EHGNA en los pacientes con DM2 con exámenes no invasivos (transaminasas y/o ecografía abdominal). Cabe destacar la baja sensibilidad de ambos métodos, principalmente en pacientes DM2, por lo que su uso en conjunto podría aumentar pesquisa38. En pacientes de alto riesgo (DM2 >10 años, hipertrigliceridemia, A1C >8,5%, genética susceptible), se debe buscar en forma dirigida y precozmente la fibrosis a través de elastografía39 (Figura 3).
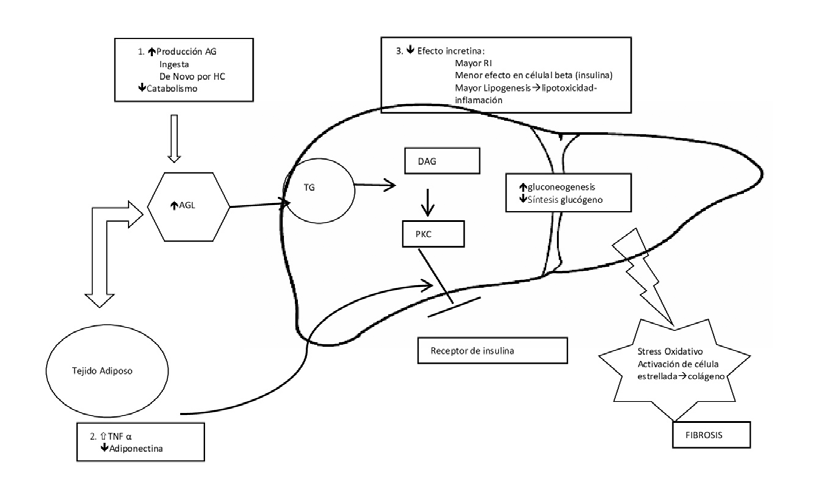 Figura 2: Fisiopatología EHGNA: El aumento del tejido adiposo asociado a la obesidad, favorece la produccion de CK proinflamatorias y AGL. Esto general
alteración de la sensibilidad a insulina, mediada por receptor. El aumento de AGL contribuye a la esteatosis hepática, generando RI. El efecto incretina disminuído,
intrínseco de EHGNA y de la diabetes, contribuye a RI, disminuye la oxidación lipídica, produciendo lipotoxicidad. Así la RI generada más el efecto incretina
disminuido llevan a aumento de gluconeogenesis y disminución de síntesis de glicógeno. La lipotoxicidad y glucotoxicidad hepáticas, aumentan es estrés oxidativo
que promueve el desarrollo de fibrosis
Figura 2: Fisiopatología EHGNA: El aumento del tejido adiposo asociado a la obesidad, favorece la produccion de CK proinflamatorias y AGL. Esto general
alteración de la sensibilidad a insulina, mediada por receptor. El aumento de AGL contribuye a la esteatosis hepática, generando RI. El efecto incretina disminuído,
intrínseco de EHGNA y de la diabetes, contribuye a RI, disminuye la oxidación lipídica, produciendo lipotoxicidad. Así la RI generada más el efecto incretina
disminuido llevan a aumento de gluconeogenesis y disminución de síntesis de glicógeno. La lipotoxicidad y glucotoxicidad hepáticas, aumentan es estrés oxidativo
que promueve el desarrollo de fibrosis
Adaptado de Orsi el al 7.:AG: ácidos grasos, AGL: ácidos grasos libres, CK: citoquinas, HC: hidratos de carbono, TNF : factor necrosis tumoral alfa; TG: triglicéridos, DAG: diacilglicerol, PKC: proteinquinasa C, RI: Resistencia a la insulina
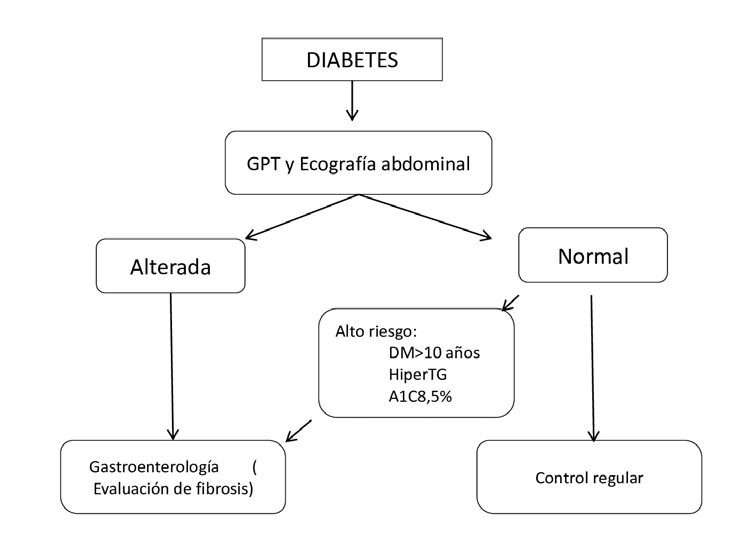 Figura 2: Esquema pesquisa EHGNA en DM. A todo paciente con DM se le debe realizar una pesquisa de EHGNA inicialmente con GPT y ecografía abdominal.
Si alguna de ellas resulta alterada debe derivarse para evaluación de fibrosis. En todo paciente con alto riesgo, independiente del resultado de los estuios iniciales
debiera derivarse para estudio de fibrosis. Adaptado de Bril et al 36: GPT: glutamato piruvato transaminasa, TG:triglicéridos, A1C: hemoglobina glicosilada.
Figura 2: Esquema pesquisa EHGNA en DM. A todo paciente con DM se le debe realizar una pesquisa de EHGNA inicialmente con GPT y ecografía abdominal.
Si alguna de ellas resulta alterada debe derivarse para evaluación de fibrosis. En todo paciente con alto riesgo, independiente del resultado de los estuios iniciales
debiera derivarse para estudio de fibrosis. Adaptado de Bril et al 36: GPT: glutamato piruvato transaminasa, TG:triglicéridos, A1C: hemoglobina glicosilada. Manejo general y antidiabéticos en EHGNA y DM2
La asociación fisiopatológica y epidemiológica entre las dos entidades hace pensar que el tratamiento de una, favorece el control y resultado de la otra. El beneficio conocido de la disminución de peso en pacientes con DM2 también está presente en la EHGNA, puesto que una reducción de peso de 5-7% disminuyen la presencia de esteatosis en alrededor de un 5%, con más de 8% se evidencia regresión de esteatohepatitis y con más de 10% del peso, incluso regresión de fibrosis40.
Biguanidas: la metformina es un fármaco de primera línea para el tratamiento de la DM2. Su efecto principal es la disminución de la producción hepática de glucosa y mejoría de la IR hepática y periférica40. En un meta-análisis del año 2013 que reúne 9 estudios (5 de ellos incluían DM2), que evaluó a pacientes con EHGNA y uso de metformina, no se demostró mejorías en la histología de la EHGNA con el uso del fármaco. Los pacientes con DM2 que desarrollan cirrosis hepática bajo tratamiento con metformina, presentan mayor sobrevida independiente del Child y su uso estuvo libre de complicaciones41.
Tiazolinedionas: la pioglitazona, agonista de PPARγ, disminuye la IR favoreciendo la diferenciación del adipocito y disminuyendo los AGL, acciones relevantes en la patogenia de esta enfermedad40. Estudios iniciales con pioglitazona 30 mg en pacientes no DM2 con EHGNA, evidenciaron una significativa resolución de la esteatohepatitis (47% vs 21%) comparado con placebo, pero sin efecto en fibrosis42. En un estudio de 101 pacientes DM2 o prediabéticos con EHGNA diagnosticada con biopsia, el uso de pioglitazona 45 mg demostró mejoría de la histología, con reversión de la esteatohepatitis (58 vs 19%), disminución significativa del score de fibrosis y de la progresión de ésta a los 18 meses (12% vs 28%) sin efectos adversos significativos43.
Incretinas: fármacos que estimulan la secreción de insulina mediada por la ingesta. Incluye análogos de péptido similar a glucagón tipo 1 (aGLP1) e inhibidores de dipeptidilpeptidasa 4 (iDPP4). Liraglutide, un tipo de aGLP1, ha demostrado beneficios cardiovasculares en pacientes con DM244. En el estudio LEAN45 se evaluó el efecto de liraglutide (1,8 mg/ día) en pacientes con EHGNA con DM2 (30%) y sin DM2, se observó resolución significativa de la esteatohepatitis por biopsia (39% vs 9%,RR 4,3 [95% CI: 1,0 to 17,7] P=0,019) y menor progresión a fibrosis en el grupo tratado con liraglutide en comparación con placebo (9% vs 36%), sin diferencias significativas en efectos adversos excepto en los síntomas gastrointestinales. Evaluaciones “post-hoc” indican que beneficio sería una combinación de efecto directo en la modulación del transporte lipídico en el hepatocito y la baja de peso. Un estudio en pacientes con EHGNA y DM2, obesos con mal control metabólico tratados con liraglutide (1,2 mg/día) por 6 meses, evidenció una disminución de 31% (p<0.0001) de la esteatosis hepática medida por espectroscopía por resonancia magnética de protón (1H-RM), independiente de la baja de peso y de la reducción de A1C46. Sitagliptina (iDDP4) no mostró ser mejor que placebo en la disminución de esteatosis hepática en pacientes con pre diabetes y DM247.
Inhibidores del cotrasportador sodio glucosa (iSGLT2): antidiabéticos que inhiben la reabsorción de glucosa a nivel tubular renal. Estudios en animales con tofogliflozina han evidenciado disminución de esteatosis, fibrosis y aparición de HCC48. En humanos hay evidencia preliminar en estudio prosprectivo, no controlado, pequeño (n=9) con canagliflozina que demuestra mejoría histológica en todos los pacientes y reducción de puntaje de fibrosis en el 33%49.
Discusión
Con esta revisión, queremos enfatizar que existe mayor prevalencia de DM en pacientes con ECH por cualquier causa, pero a pesar de esta clara asociación, la pesquisa de alteraciones de la glicemia en este grupo es escasa. El uso de PTGO en los pacientes con ECH podría aumentar la detección de la enfermedad, ya que sabemos actualmente que la glicemia de ayuna, examen más usado en nuestro medio, es insuficiente.
La importancia del diagnóstico radica en la existencia de mayores complicaciones y peores resultados de ambas enfermedades, independiente de la etiología de la ECH.
La DM2 y la ECH son patologías prevalentes y altamente asociadas. Ambas subdiagnosticadas. El aumento de la pesquisa en población con fatores de riesgo puede cambiar el pronóstico de ambas entidades.
Si bien la DH aún no es considerada como una nueva entidad y que puede ser difícil diferenciar de DM2 no diagnosticada en la práctica clínica, ésta tiene características fisiopatológicas propias generadas por la pérdida de la funcionalidad hepática que se debe tener en consideración al iniciar terapia antidiabética.
La prevalencia de EHGNA ha aumentado, así como los casos de DM2, lo que hace necesario establecer algoritmos de su búsqueda, en población de alto riesgo. Creemos que el esquema propuesto (Figura 3), ayudaría al diagnóstico precoz de EHGNA, lo que se podría llevar a cabo en atención primaria, donde se atienden la mayoría de los pacientes diabéticos en nuestro país, logrando una derivación precoz al especialista, y así evitar el avance hacia la cirrosis y sus complicaciones.
En cuanto al tratamiento, se debe enfatizar la importancia del control de peso y los cambios del estilo de vida. Con respecto al control glicémico y manejo de la EHGNA, existe evidencia que avala el uso de pioglitazona, demostrando su seguridad y eficacia, pero se requieren estudios específicos en población diabética y con mayor número de sujetos. Esto podría llevar a recuperar un fármaco actualmente en desuso en nuestro medio43. Dentro de las nuevas terapias los iSGLT2 tendrían un rol potencial49 pero se necesitan estudios randomizados de mayor seguimiento y población. La razón de los resultados contradictorios entre los fármacos con efecto incretina es aún motivo de estudio, podría deberse a los efectos en baja de peso y grasa viceral como propios de la molécula a nivel hepático. Los aGLP-1 serían fármacos promisorios para el tratamiento de EHGNA, lo que ha sido demostrado estudios recientes46, generando una posible nueva herramienta terapéutica.
Referencias
- Ministerio de Salud del Gobierno de Chile. ENCUESTA NACIONAL DE SALUD 2016-2017 Primeros resultados. 2017.
- Información DDEEIDS. Chile 2011. Minsal. 2011.
- Xu J, Murphy SL, Kochanek KD, Bastian B, Arias E. Death: Final Report for 2016. Natl Vital Stat Rep. 2018; 67(2): 1-76.
- Petersen MC, Vatner DF, Shulman GI. Regulation of hepatic glucose metabolism in health and disease. Nat Rev Endocrinol. 2017; 13(10): 572-587.
- Tolman KG, Fonseca V, Dalpiaz A, Tan MH. Spectrum of liver disease in type 2 diabetes and management of patients with diabetes and liver disease. Diabetes Care. 2007 Mar; 30(3): 734-743.
- Garcia-Compean D. Liver cirrhosis and diabetes: Risk factors, pathophysiology, clinical implications and management. World J Gastroenterol. 2009; 15(3): 280.
- Orsi E, Grancini V, Menini S, Aghemo A, Pugliese G. Hepatogenous diabetes: Is it time to separate it from type 2 diabetes? Liver Int. 2017; 37(7): 950-962.
- Bragança ACC, Álvares-Da-Silva MR. Prevalence of diabetes mellitus and impaired glucose tolerance in patients with decompensated cirrhosis being evaluated for liver transplantation: The utility of oral glucose tolerance test. Arq Gastroenterol. 2010; 47(1): 22-27.
- Schnedl WJ, Wallner SJ, Piswanger C, Krause R, Lipp RW. Glycated hemoglobin and liver disease in diabetes mellitus. Wien Med Wochenschr. 2005 Sep; 155(17-18): 411-415.
- García-Compeán D, Joquez-Quintana JO, Lavalle-González FJ, González- González JA, Muñoz-Espinosa LE, Villarreal-Pérez JZ, et al. Subclinical abnormal glucose tolerance is a predictor of death in liver cirrhosis. World J Gastroenterol. 2014; 20(22): 7011-7018.
- Calzadilla-Bertot L, Vilar-Gomez E, Torres-Gonzalez A, Socias-Lopez M, Diago M, Adams LA, et al. Impaired glucose metabolism increases risk of hepatic decompensation and death in patients with compensated hepatitis C virus-related cirrhosis. Dig Liver Dis. 2016; 48(3): 283-290.
- De Marco, Locatelli Z. Cause-Specific Mortality in Type 2 Diabete s. Diabetes Care. 1999; 22(October 1998): 756-761.
- Garcia-Compean D, Jaquez-Quintana JO, Lavalle-Gonzalez FJ, Reyes- Cabello E, Gonzalez-Gonzalez JA, Munoz-Espinosa LE, et al. The prevalence and clinical characteristics of glucose metabolism disorders in patients with liver cirrhosis. A prospective study. Ann Hepatol. 2012; 11(2): 240-248.
- Holstein A, Hinze S, Thiessen E, Plaschke A, Egberts E-H. Clinical implications of hepatogenous diabetes in liver cirrhosis. J Gastroenterol Hepatol. 2002 Jun; 17(6): 677-681.
- Care D, Suppl SS. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2018. Diabetes Care. 2018; 41(Supplement 1): S13-S27.
- Gower E, Estes C, Blach S, Razavi-Shearer K, Razavi H. Global epidemiology and genotype distribution of the hepatitis C virus infection. J Hepatol. 2014 Nov; 61(1): S45-S57.
- Younossi Z, Park H, Henry L, Adeyemi A, Stepanova M. Extrahepatic Manifestations of Hepatitis C: A Meta-analysis of Prevalence, Quality of Life, and Economic Burden. Gastroenterology. 2016 Jun; 150(7): 1599- 1608.
- Antonelli A, Ferri C, Fallahi P, Pampana A, Ferrari SM, Goglia F, et al. Hepatitis C virus infection: evidence for an association with type 2 diabetes. Diabetes Care. 2005; 28(10): 2548-2550.
- Mehta SH. Prevalence of Type 2 Diabetes Mellitus among Persons with Hepatitis C Virus Infection in the United States. Ann Intern Med. 2000; 133(8): 592.
- White DL, Ratziu V, El-Serag HB. Hepatitis C infection and risk of diabetes: a systematic review and meta-analysis. J Hepatol. 2008 Nov; 49(5): 831- 844.
- Lonardo A, Adinolfi LE, Restivo L, Ballestri S, Romagnoli D, Baldelli E, et al. Pathogenesis and significance of hepatitis C virus steatosis: An update on survival strategy of a successful pathogen. World J Gastroenterol. 2014 Jun 21; 20(23): 7089.
- Banerjee S, Saito K, Ait-Goughoulte M, Meyer K, Ray RB, Ray R. Hepatitis C Virus Core Protein Upregulates Serine Phosphorylation of Insulin Receptor Substrate-1 and Impairs the Downstream Akt/Protein Kinase B Signaling Pathway for Insulin Resistance. J Virol. 2008 Mar 15; 82(6): 2606-2612.
- García-Compeán D, González-González JA, Lavalle-González FJ, González- Moreno EI, Villarreal-Pérez JZ, Maldonado-Garza HJ. Current Concepts in Diabetes Mellitus and Chronic Liver Disease: Clinical Outcomes, Hepatitis C Virus Association, and Therapy. Dig Dis Sci. 2016; 61(2): 371-380.
- Fartoux L, Poujol-Robert A, Guéchot J, Wendum D, Poupon R, Serfaty L. Insulin resistance is a cause of steatosis and fibrosis progression in chronic hepatitis C. Gut. 2005 Jul 1; 54(7): 1003-1008.
- Petta S, Cammà C, Marco V Di, Alessi N, Cabibi D, Caldarella R, et al. Insulin Resistance and Diabetes Increase Fibrosis in the Liver of Patients With Genotype 1 HCV Infection. Am J Gastroenterol. 2008 May; 103(5): 1136-1144.
- Hickman IJ, Clouston AD, Macdonald GA, Purdie DM, Prins JB, Ash S, et al. Effect of weight reduction on liver histology and biochemistry in patients with chronic hepatitis C. Gut. 2002; 51(1): 89-94.
- Nkontchou G, Bastard JP, Ziol M, Aout M, Cosson E, Ganne-Carrie N, et al. Insulin resistance, serum leptin, and adiponectin levels and outcomes of viral hepatitis C cirrhosis. J Hepatol. 2010 Nov; 53(5): 827-833.
- Veldt BJ, Chen W, Heathcote EJ, Wedemeyer H, Reichen J, Hofmann WP, et al. Increased risk of hepatocellular carcinoma among patients with hepatitis C cirrhosis and diabetes mellitus. Hepatology. 2008 Jun; 47(6): 1856-1862.
- Hung CH, Wang JH, Hu TH, Chen CH, Chang KC, Yen YH, et al. Insulin resistance is associated with hepatocellular carcinoma in chronic hepatitis C infection. World J Gastroenterol. 2010 May 14; 16(18): 2265-2271.
- Dai CY, Huang JF, Hsieh MY, Hou NJ, Lin ZY, Chen SC, et al. Insulin resistance predicts response to peginterferon-alpha/ribavirin combination therapy in chronic hepatitis C patients. J Hepatol. 2009 Apr; 50(4): 712-718.
- Adinolfi LE, Zampino R, Restivo L, Lonardo A, Guerrera B, Marrone A, et al. Chronic hepatitis C virus infection and atherosclerosis: Clinical impact and mechanisms. World J Gastroenterol. 2014 Apr 7; 20(13): 3410.
- Kawaguchi T, Ide T, Taniguchi E, Hirano E, Itou M, Sumie S, et al. Clearance of HCV Improves Insulin Resistance, Beta-Cell Function, and Hepatic Expression of Insulin Receptor Substrate 1 and 2. Am J Gastroenterol. 2007 Mar; 102(3): 570-576.
- Simó R, Lecube A, Genescà J, Esteban JI, Hernández C. Sustained virological response correlates with reduction in the incidence of glucose abnormalities in patients with chronic hepatitis C virus infection. Diabetes Care. 2006;29(11): 2462-2466.
- Pavone P, Tieghi T, d’Ettorre G, Lichtner M, Marocco R, Mezzaroma I, et al. Rapid decline of fasting glucose in HCV diabetic patients treated with direct-acting antiviral agents. Clin Microbiol Infect. 2016 May; 22(5): 462. e1-462.e3.
- Hazlehurst JM, Woods C, Marjot T, Cobbold JF, Tomlinson JW. Non-alcoholic fatty liver disease and diabetes. Metabolism. 2016; 65(8): 1096-1108.
- García-Compeán D, Jáquez-Quintana JO, González-González JA, Lavalle- González FJ, Villarreal-Pérez JZ, Maldonado-Garza HJ. Diabetes in liver cirrhosis. Gastroenterol Hepatol. 2013; 36(7): 473-482.
- Bril F, Cusi K. Management of nonalcoholic fatty liver disease in patients