Incremento de la proteína C reactiva ultrasensible en pacientes con hipotiroidismo subclínico y su posible relación con el desarrollo de daño cardiovascular
Diego Tene S1, Nelson Muñóz C2, Jesús Mosquera S3, PhD. Adriana Pedreáñez S4*.
Increase in high sensitivity C-reactive protein in patients with subclinical hypothyroidism and its possible relationship to the development of cardiovascular damages
- Licenciado en Laboratorio Clínico e Histopatología. Laboratorio Clínico del Hospital General IESS. Riobamba. Ecuador.
- Magister Scientiarum en Bioanálisis y diagnóstico de laboratorio. Universidad Nacional del Chimborazo. Facultad de Ciencias de la Salud. Riobamba. Ecuador.
- Médico. Doctor en Ciencias Médicas. Instituto de Investigaciones Clínicas “Dr. Américo Negrette”, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela.
- Magister Scientiarum en Biología. Doctora en Inmunología. Cátedra de Inmunología, Escuela de Bioanálisis, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela.
*Correspondencia
MgSc. Adriana Pedreáñez, PhD
Email: apedreanez@gmail.com
Apartado Postal: 23. Maracaibo 4001-A
Zulia, Venezuela
ORCID: https//orcid.org/0000-0002-
3937-0469
Conflicto de interés: Los autores declaran no tener conflicto de intereses en la redacción del artículo y no haber recibido apoyo de la industria para su elaboración.
No hubo fuentes de financiamiento para el desarrollo de esta investigación.
Recibido: 17-11-2020
Aceptado: 07-01-2021
Resumen: Introducción: El hipotiroidismo subclínico (HSC) se define bioquímicamente por una elevación en la concentración sérica de la hormona estimulante de la tiroides (TSH), con niveles normales de tiroxina libre (T4L). La asociación entre el HSC y el daño cardiovascular ha sido un tema controversial. Objetivo: determinar la asociación entre el HSC y el desarrollo de la enfermedad cardiovascular mediante la cuantificación de la proteína C reactiva ultrasensible PCR-us y la determinación de lípidos circulantes asociados a la enfermedad cardiovascular y la ateroesclerosis. Métodos: Estudio descriptivo, correlacional de corte transversal realizado en el Hospital IESS de Riobamba, Ecuador en el periodo comprendido desde enero a diciembre de 2019. Se estudiaron 70 individuos (40 pacientes con HSC y 30 controles) con edades entre 18 y 75 años. Se realizaron las historias clínicas y el examen físico a cada paciente y la toma de las muestras sanguíneas para determinar la concentración sérica de los siguientes parámetros bioquímicos y hormonales: colesterol total, triglicéridos, HDL colesterol y LDL colesterol, TSH, T4L y PCR-us. Resultados: Se encontró un incremento significativo en la concentración de colesterol total (p<0.0001), LDL colesterol (p<0.01) y PCR-us (p<0.0001) en los pacientes con HSC vs los controles. Se observó una correlación positiva (p<0.0001; r=0.9148) entre la TSH y la PCR-us en los pacientes con HSC. Conclusión: los pacientes con HSC experimentan una elevación en los niveles séricos de PCR-us la cual está correlacionada con un incremento en la concentración sérica de TSH. Estos parámetros asociados a un aumento del colesterol total y de la LDL colesterol sugieren un estado inflamatorio de bajo grado que podría estar asociado con el desarrollo de aterosclerosis y daño cardiovascular.
Palabras clave: Aterosclerosis; Daño cardiovascular; Hipotiroidismo subclínico; Proteína C reactiva; TSH.
Abstract: Introduction: Subclinical hypothyroidism (SH) is defined biochemically by an elevation in serum thyroid stimulating hormone (TSH) concentration, with normal levels of free thyroxine (T4L). The association between SH and cardiovascular damage has been a controversial issue. Objective: to determine the association between SH and the development of cardiovascular disease through the quantification of the high sensitivity C-reactive protein (hs-PCR) and the determination of circulating lipids associated to cardiovascular disease and atherosclerosis. Methods: Observational, correlational cross-sectional study with patients captured in the internal medicine office as well as those attending screening activities at the IESS Hospital in Riobamba- Ecuador, in the period from January to December 2019. Seventy individuals (40 patients with SH and 30 controls) between the ages of 18 and 75 years were studied. Each patient’s medical history and physical examination were performed, and blood samples were taken to determine the serum concentration of the following biochemical and hormonal parameters: total cholesterol, triglycerides, HDL cholesterol and LDL cholesterol, TSH, T4L and hs-PCR. Results: A significant increase in the concentration of total cholesterol (p<0.0001), LDL cholesterol (p<0.01) and hs-PCR (p<0.0001) was found in patients with SH vs. controls. A positive correlation (p<0.0001; r=0.9148) was observed between TSH and hs-PCR in patients with SH. Conclusion: patients with SH experience an elevation in serum hs-PCR levels which is correlated with an increase in serum TSH concentration. These parameters associated with an increase in total cholesterol and LDL cholesterol suggest a low-grade inflammatory state that may be associated with the development of atherosclerosis and cardiovascular damage.
Keywords: Atherosclerosis; Cardiovascular damage; C reactive protein; Subclinical Hypothyroidism; TSH.
El hipotiroidismo subclínico (HSC) es una condición definida bioquímicamente por un incremento en la concentración sérica de la hormona estimulante de la tiroides (TSH), con niveles normales de tiroxina libre (T4L). Es un trastorno muy común en la población general, especialmente entre los pacientes de mediana edad y de edad avanzada1,2.
En la mayoría de los casos, los pacientes con HSC no presentan síntomas, por lo que el diagnóstico se basa en los hallazgos de laboratorio. Afecta del 4-20% de la población adulta y está influido por factores como la edad, el sexo, la raza, el índice de masa corporal y la ingesta de yodo en la dieta 2. Múltiples estudios asocian al HSC con un mayor riesgo de enfermedad cardiovascular y cada vez cobra más importancia el papel proinflamatorio de la hormona TSH en este proceso. Varios mecanismos pueden estar involucrados en esta interacción, siendo uno de ellos el elevado riesgo de aterosclerosis y enfermedad coronaria3,4.
La inflamación juega un papel importante en la progresión y en las complicaciones de la aterosclerosis (desde el reclutamiento inicial de leucocitos hasta la eventual rotura de la placa aterosclerótica inestable) y también se ha considerado el vínculo entre los factores de riesgo tradicionales y las modificaciones evidentes en la pared arterial5. Numerosos marcadores inflamatorios circulantes están asociados con un mayor riesgo de eventos coronarios, y pueden ser herramientas potenciales para predecir dichos eventos6.
La proteína C reactiva, es un marcador muy sensible utilizado para evaluar la respuesta inflamatoria debido a que su concentración se eleva significativamente durante la respuesta de fase aguda inducida por daño tisular o infección. En los últimos años se ha utilizado esta proteína, para predecir el riesgo cardiovascular tanto en sujetos sanos como en personas con diversos trastornos7,8.
En la última década, se han puesto a disposición ensayos de alta sensibilidad con tiempos de respuesta rápidos para su medición. Técnicas como la inmunonefelometría, la inmunoturbidimetría y el ensayo inmunoabsorbente ligado a enzimas (ELISA) pueden detectar concentraciones muy bajas de PCR con un rango de sensibilidad de 0,01 a 10 mg/L por lo cual ha sido denominada Proteína C reactiva ultrasensible (PCR-us)9. Estos ensayos de alta sensibilidad ayudan a cuantificar bajos niveles de PCR en la inflamación sistémica, en ausencia de trastornos inflamatorios o inmunológicos evidentes. El objetivo de esta investigación fue determinar la asociación entre el HSC y el desarrollo de la enfermedad cardiovascular en estos pacientes mediante la cuantificación de PCR-us y la determinación de lípidos circulantes asociados a la enfermedad cardiovascular y la ateroesclerosis.
Materiales y métodos
Se realizó una investigación de tipo descriptiva, correlacional. Con un diseño no experimental de corte transversal, en el periodo comprendido desde enero a diciembre de 2019.
Sujetos
Se evaluaron 70 pacientes hombres y mujeres que acudieron a la consulta de Medicina Interna y a las actividades de tamizaje desarrolladas por dicha unidad en el Hospital IESS de Riobamba – Ecuador, los cuales se dividieron en dos grupos (40 pacientes con hipotiroidismo subclínico y 30 controles) con edades comprendidas entre 18 y 75 años.
El muestreo fue de tipo intencional no probabilístico. Se excluyeron del estudio los pacientes con patología tiroidea diagnosticada (hipotiroidismo manifiesto, hipertiroidismo, cáncer de tiroides), sujetos con diabetes mellitus, insulinorresistencia, pacientes con procesos infecciosos o inflamatorios, pacientes con un índice de masa corporal (IMC) >30 y pacientes que estuviesen recibiendo tratamiento con beta-bloqueadores, esteroides y amiodarona.
El protocolo del estudio siguió las pautas éticas dadas en la Declaración de Helsinki y se obtuvo el consentimiento informado de todos los participantes. Todo el procedimiento fue aprobado por la dirección de investigación del Hospital IESS de Riobamba.
Se realizaron las respectivas historias clínicas y el examen físico a cada paciente y se procedió a la toma de las muestras sanguíneas para determinar los parámetros bioquímicos y hormonales.
Para la determinación de colesterol total, triglicéridos, HDL colesterol y LDL colesterol y PCR-us se utilizó el equipo Cobas C501 (Laboratorios Roche Diagnostics; USA). El cual se basa en un método colorimétrico que utiliza un fotómetro multicanal.
La cuantificación de las hormonas (TSH y T4L) se realizó mediante el método de electro-quimioluminiscencia (ECLIA) usando el equipo Cobas E601 (Laboratorios Roche Diagnostics; USA). Se tomaron como valores de referencia de T4L: 0.3-1.7 ng/dl y de TSH 0.270-4.20μUl/L.
El análisis estadístico se realizó utilizando el software GraphPadInstat 3.1 y Graph Pad Prism 6.0. Los datos se expresaron como media ± desviación estándar (DE). La diferencia entre los grupos estudiados se analizó mediante la prueba de Mann–Whitney. La correlación fue analizada mediante el test de correlación de Pearson. Se consideró un valor de p <0,05 como estadísticamente significativo.
Resultados
No se observaron diferencias significativas en el IMC entre los grupos estudiados. Al comparar los parámetros bioquímicos analizados, se encontró diferencia estadísticamente significativa en la concentración de colesterol total y LDL colesterol entre los pacientes con HSC y los controles. Así mismo se observó una diferencia significativa en la concentración de TSH entre ambos grupos (Tabla 1).
Con respecto a la concentración de PCR-us se encontró un incremento significativo en los pacientes con HSC versus los controles (p<0.0001) (Figura 1).
Al correlacionar la concentración de TSH con la concentración de PCR-us, se encontró una correlación positiva entre ambas (p<0.0001; r=0.8978) (Figura 2).
Tabla 1. Valores de IMC, parámetros bioquímicos y hormonales en pacientes con HSC y controles.
*Significancia estadística; NS= no significativo estadísticamente; IMC= índice de masa corporal.
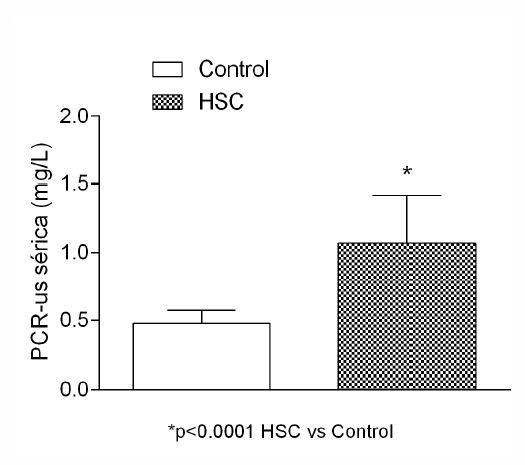
Figura 1: Valores de PCR-us en suero. Se encontraron altos niveles de PCRus en los pacientes con HSC al compararlos con los controles. El análisis estadístico se realizó utilizando la prueba de Mann-Whitney. Control (N= 30); HSC: hipotiroidismo subclinico (N=40).
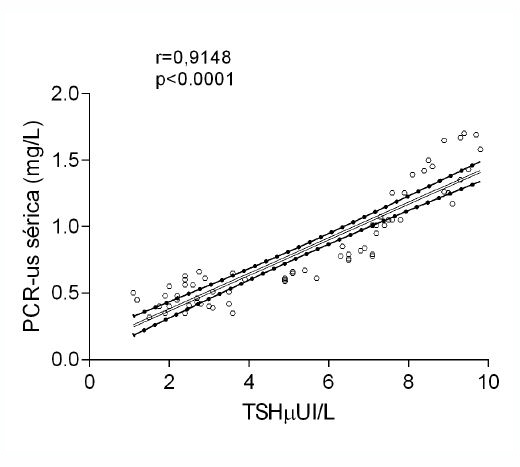
Figura 2: Se encontró una alta correlación positiva entre los niveles de TSH sérico y el contenido de PCR-us en los pacientes con HSC. Correlación de Pearson.
Discusión
Nuestros resultados demuestran un incremento significativo en la concentración sérica de PRC-us en los pacientes con HSC con respecto a los eutiroideos. La proteína C reactiva es un reactante de fase aguda sintetizada principalmente en el hígado. Su síntesis en los hepatocitos es inducida principalmente por la interleucina-6 (IL-6), y puede potenciarse con la interleucina-1β (IL-1β)10. Es un biomarcador muy sensible, cuyos niveles séricos se elevan rápidamente en respuesta a infecciones, afecciones inflamatorias y traumatismos11.
Los participantes en este estudio no presentaban alguna condición inflamatoria o enfermedad infecciosa manifiesta al momento de la toma de la muestra. Por lo tanto la elevación en los niveles de PCR-us en los pacientes con HSC no es el resultado de estas condiciones patológicas.
La elevación de la PCR-us en los pacientes con HSC es un hallazgo interesante debido a que en los últimos años, una serie de estudios poblacionales han documentado que el HSC se asocia con un mayor riesgo de enfermedad cardiovascular (ECV)12,13, y en las últimas décadas la PCR-us ha sido considerada un predictor muy sensible de enfermedad coronaria14,15,16,17. En este sentido, se ha descrito que los niveles séricos de PCR-us, predicen el riesgo vascular con un efecto estimado tan grande como el del colesterol total o HDL colesterol. Los datos de ensayos aleatorizados que abordan la PCR-us han sido fundamentales para comprender los efectos antiinflamatorios de varias terapias y han demostrado consistentemente que los niveles de PCR-us durante el tratamiento son un predictor muy poderoso del riesgo cardiovascular18.
Sin embargo, algunas investigaciones relacionadas con el comportamiento de la PCR-us durante el HSC son contradictorias. Mientras algunos trabajos han informado un incremento de esta proteína en los pacientes con HSC19, otros estudios no han encontrado diferencia significativa20.
En este estudio se encontró un incremento significativo en la concentración sérica de PCR-us, colesterol total y LDL colesterol en los pacientes con HSC. Las hormonas tiroideas tienen un impacto significativo en el metabolismo de los lípidos. En este sentido, la conexión entre el HSC, la dislipidemia y el aumento del riesgo de aterosclerosis ha sido ampliamente documentada21,22. La aterosclerosis es descrita como una enfermedad progresiva caracterizada por la acumulación de lípidos y elementos fibrosos en las grandes arterias, lo cual conlleva a la formación de placas formadas por depósitos de lípidos en la pared arterial y está relacionada con una alta incidencia de enfermedades cardiovasculares23.
La gran mayoría de los estudios publicados hasta el momento, sugieren que el HSC acelera la disfunción endotelial. En particular, el HSC se asocia con un aumento del colesterol- LDL, de la presión arterial diastólica y del incremento en la concentración de marcadores de inflamación como la proteína C reactiva y la IL-624, y se ha descrito la existencia de un estado proinflamatorio y procoagulante en estos pacientes1.
Se ha sugerido que los pacientes con HSC tienen un mayor riesgo de hipercolesterolemia y enfermedades cardiovasculares, incluida la aterosclerosis. Estos pacientes tienen niveles de T3 y T4 normales con niveles elevados de TSH. Esto sugiere que la TSH puede desempeñar un papel en la inducción de aterosclerosis independientemente de su influencia sobre las hormonas tiroideas25.
El receptor de la TSH (TSHR) se expresa en una variedad de células además de los tirocitos, como por ejemplo los hepatocitos26, adipocitos27 y osteoclastos28. Esto indica que la función de la TSH no se limita a la regulación de la función tiroidea. Es posible que la elevación de la TSH pueda alterar las funciones de las células no tirocitarias que expresan el receptor de TSH (TSHR). En este sentido, se ha demostrado que la TSH puede unirse al TSHR en los hepatocitos y modular la síntesis y transformación del colesterol en el hígado, contribuyendo así directamente a la hipercolesterolemia29.
Por lo expuesto anteriormente, los datos encontrados en este estudio sugieren que la TSH podría estimular directa o indirectamente la producción de PCR en ciertas células, puesto que, encontramos una correlación positiva entre la elevación de la TSH y la elevación de PCR-us en los pacientes con HSC (r=0.9148; P<0.0001). Al respecto se ha descrito que la TSH posee un efecto inmunomodulador, debido a que los macrófagos también se ven afectados directamente por esta hormona. Estudios in vitro han demostrado que los macrófagos estimulados con TSH, experimentan un incremento en la síntesis de TNF-alfa e IL-6, dos marcadores implicados en la inflamación aguda30, siendo la IL-6 un potente inductor de PCR en el hígado31.
Basados en los antecedentes previamente descritos y en los resultados de ésta investigación, podemos concluir que los pacientes con HSC experimentan una elevación en los niveles séricos de PCR-us la cual está correlacionada con un incremento en la concentración sérica de TSH. Estos parámetros asociados a un aumento del colesterol total y de la LDL colesterol sugieren un estado inflamatorio de bajo grado en estos pacientes que podría estar asociado con el desarrollo de aterosclerosis y daño cardiovascular.
Agradecimientos: Los autores agradecen especialmente a los pacientes que participaron en esta investigación así como al personal técnico del Hospital IESS de Riobamba, Ecuador por su valiosa colaboración.
Referencias
- Cooper DS, Biondi B. Subclinical thyroid disease. Lancet. 2012; 379(9821): 1142-1154. doi:10.1016/S0140-6736(11)60276-6.
- Surks MI, Ortiz E, Daniels GH, et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. JAMA. 2004; 291(2): 228-238. doi:10.1001/jama.291.2.228.
- Hak AE, Pols HA, Visser TJ, Drexhage HA, Hofman A, Witteman JC. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study. Ann Intern Med. 2000; 132(4): 270-278. doi:10.7326/0003-4819-132-4- 200002150-00004.
- Cappola AR, Ladenson PW. Hypothyroidism and atherosclerosis. J Clin Endocrinol Metab. 2003; 88(6): 2438-2444. doi:10.1210/jc.2003- 030398.
- Libby P. Inflammation in atherosclerosis. Arterioscler Thromb Vasc Biol. 2012; 32(9): 2045-2051. doi:10.1161/ATVBAHA.108.179705.
- Welsh P, Packard CJ, Sattar N. Novel antecedent plasma biomarkers of cardiovascular disease: improved evaluation methods and comparator benchmarks raise the bar. Curr Opin Lipidol. 2008; 19: 563-571. doi: 10.1097/MOL.0b013e32831551e0.
- Buckley DI, Fu R, Freeman M, Rogers K, Helfand M. C-reactive protein as a r isk f ator f or c oronary h eart d isease: a s ystematic r eview a nd meta-analyses for the U.S. Preventive Services Task Forces. Ann Intern Med. 2009; 151: 483-495. doi: 10.7326/0003-4819-151-7-200910060- 00009.
- Moutachakkir M, Lamrani Hanchi A, Baraou A, Boukhira A, Chellak S. Immunoanalytical characteristics of C-reactive protein and high sensitivity C-reactive protein. Caractéristiques immunoanalytiques de la protéine C-réactive et de la protéine C-réactive ultrasensible. Ann Biol Clin (Paris). 2017; 75(2): 225-229. doi:10.1684/abc.2017.1232.
- Roberts WL. CDC; AHA. CDC/AHA Workshop on Markers of Inflammation and Cardiovascular Disease: Application to Clinical and Public Health Practice: laboratory tests available to assess inflammation-performance and standardization: a background paper. Circulation. 2004; 110(25): e572-e576. doi: 10.1161/01.CIR.0000148986.52696.07.
- Kushner I, Jiang SL, Zhang D, Lozanski G, Samols D. Do posttranscriptional mechanisms participate in induction of C-reactive protein and serum amyloid A by IL-6 and IL-1? Ann N Y Acad Sci. 1995; 762: 102-107. doi:10.1111/j.1749-6632.1995.tb32318.x.
- Black S, Kushner I, Samols D. C-reactive Protein. J Biol Chem. 2004; 279(47): 48487-48490. doi: 10.1074/jbc.R400025200.
- Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP, Asvold BO, Iervasi G, Imaizumi M, Collet TH, Bremner A, Maisonneuve P, Sgarbi JA, Khaw KT, Vanderpump MP, Newman AB, Cornuz J, Franklyn JA, Westendorp RG, Vittinghoff E, Gussekloo J; Thyroid Studies Collaboration. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 2010 Sep 22; 304(12): 1365-1374. doi: 10.1001/jama.2010.1361.
- Razvi S, Weaver JU, Vanderpump MP, Pearce SH. The incidence of ischemic heart disease and mortality in people with subclinical hypothyroidism: reanalysis of the Whickham Survey cohort. J Clin Endocrinol Metab. 2010; 95(4): 1734-1740. doi:10.1210/jc.2009-1749.
- Roberts WL, Moulton L, Law TC, et al. Evaluation of nine automated high-sensitivity C-reactive protein methods: implications for clinical and epidemiological applications. Part 2 [published correction appears in Clin Chem 2001 May; 47(5): 980]. Clin Chem. 2001; 47(3): 418-425.
- Whelton SP, Roy P, Astor BC, et al. Elevated high-sensitivity C-reactive protein as a risk marker of the attenuated relationship between serum cholesterol and cardiovascular events at older age. The ARIC Study. Am J Epidemiol. 2013; 178(7): 1076-1084. doi:10.1093/aje/kwt086.
- Markozannes G, Koutsioumpa C, Cividini S, et al. Global assessment of C-reactive protein and health-related outcomes: an umbrella review of evidence from observational studies and Mendelian randomization studies [published online ahead of print, 2020 Sep 25]. Eur J Epidemiol. 2020;10.1007/s10654-020-00681-w. doi: 10.1007/s10654-020-00681-w.
- Xie M, Xie D, Yang Y, et al. Association of high-sensitivity C-reactive protein in middle-aged and elderly Chinese people with hyperuricaemia and risk of coronary heart disease: a cross-sectional study. BMJ Open. 2019; 9(10): e028351. Published 2019 Oct 18. doi: 10.1136/ bmjopen-2018-028351.
- Ridker PM. From C-Reactive Protein to Interleukin-6 to Interleukin-1: Moving Upstream To Identify Novel Targets for Atheroprotection. Circ Res. 2016; 118(1): 145-156. doi:10.1161/CIRCRESAHA.115.306656.
- Tuzcu A, Bahceci M, Gokalp D, Tuzun Y, Gunes K. Subclinical hypothyroidism may be associated with elevated high-sensitive c-reactive protein (low grade inflammation) and fasting hyperinsulinemia. Endocr J. 2005; 52(1): 89-94. doi:10.1507/endocrj.52.89.
- Marchiori RC, Pereira LA, Naujorks AA, et al. Improvement of blood inflammatory marker levels in patients with hypothyroidism under levothyroxine treatment. BMC Endocr Disord. 2015; 15: 32. Published 2015 Jun 23. doi: 10.1186/s12902-015-0032-3.
- Zhang X, Shao S, Geng H, Yu Y, Wang C, Liu Z, Yu C, Jiang X, Deng Y, Gao L, Zhao J. Expression profiles of six circulating microRNAs critical to atherosclerosis in patients with subclinical hypothyroidism: a clinical study. J Clin Endocrinol Metab. 2014 May; 99(5): E766-74. doi: 10.1210/jc.2013-1629.
- Yasar HY, Demirpence M, Colak A, et al. Serum irisin and apelin levels and markers of atherosclerosis in patients with subclinical hypothyroidism. Arch Endocrinol Metab. 2019; 63(1): 16-21. doi: 10.20945/2359-3997000000106.
- Lusis AJ. Atherosclerosis. Nature. 2000 Sep 14; 407(6801): 233-241. doi: 10.1038/35025203.
- . La Vignera S, Condorelli R, Vicari E, Calogero AE. Endothelial dysfunction and subclinical hypothyroidism: a brief review. J Endocrinol Invest. 2012; 35(1): 96-103. doi:10.3275/8190.
- Collet TH, Bauer DC, Cappola AR, et al. Thyroid antibody status, subclinical hypothyroidism, and the risk of coronary heart disease: an individual participant data analysis. J Clin Endocrinol Metab. 2014; 99(9): 3353-3362. doi: 10.1210/jc.2014-1250.
- Tian L, Song Y, Xing M, et al. A novel role for thyroid-stimulating hormone: up-regulation of hepatic 3-hydroxy-3-methyl-glutaryl-coenzyme A reductase expression through the cyclic adenosine monophosphate/ protein kinase A/cyclic adenosine monophosphate-responsive element binding protein pathway. Hepatology. 2010; 52(4): 1401-1409. doi:10.1002/hep.23800.
- Ma S, Jing F, Xu C, et al. Thyrotropin and obesity: increased adipose triglyceride content through glycerol-3-phosphate acyltransferase 3. Sci Rep. 2015;5:7633. Published 2015 Jan 6. doi:10.1038/srep0763399.
- Abe E, Marians RC, Yu W, et al. TSH is a negative regulator of skeletal remodeling. Cell. 2003; 115(2): 151-162. doi: 10.1016/s0092- 8674(03)00771-2.
- Song Y, Xu C, Shao S, et al. Thyroid-stimulating hormone regulates hepatic bile acid homeostasis via SREBP-2/HNF-4α/CYP7A1 axis. J Hepatol. 2015; 62(5): 1171-1179. doi: 10.1016/j.jhep.2014.12.006.
- Yang C, Lu M, Chen W, et al. Thyrotropin aggravates atherosclerosis by promoting macrophage inflammation in plaques. J Exp Med. 2019; 216(5): 1182-1198. doi: 10.1084/jem.20181473.
- Sproston NR, Ashworth JJ. Role of C-Reactive Protein at Sites of Inflammation and Infection. Front Immunol. 2018; 9: 754. Published 2018 Apr 13. doi: 10.3389/fimmu.2018.00754