Análisis comparativo de respuesta glicémica y de péptido C, tras la ingesta de estevia y D-tagatosa, según habitualidad de consumo de edulcorantes no nutritivos y preferencias alimentarias reportadas por mujeres con resistencia a la insulina
Catalina Lara1, Verónica Sambra3, Kathleen Priken2, Isabella Vicuña2, Claudia Vega2*.
Comparative analysis of glicemic response and c peptide, after comsumption of stevia and d tagatosa, According to regular compsumtion of not nutritive sweeteners andnourish preferences reported by woman with insuline resistance
- Carrera de Nutrición y Dietética, Facultad de Farmacia, Universidad de Valparaíso.
- Centro del Comportamiento Alimentario, Escuela de Nutrición y Dietética, Facultad de Farmacia, Universidad de Valparaíso.
- Departamento de Nutrición, Facultad de Medicina, Universidad de Chile.
*Correspondencia:
claudia.vega@uv.cl
Casilla: 2360102, Avda. Gran Bretaña N° 1093, Playa Ancha, Valparaíso, Chile.
Sub-análisis de ensayo clínico (Clinical trial): NCT04327245.
Financiamiento: El estudio fue financiado por la Sociedad Chilena de Endocrinología y Diabetes (SOCHED 17-10).
Recibido: 06-10-2021
Aceptado: 28-12-2021
Resumen: Introducción: El consumo de edulcorantes no nutritivos (ENN) ha ido en aumento. A pesar de ello, se desconoce el efecto entre el consumo habitual de ENN y las preferencias alimentarias con parámetros bioquímicos en pacientes con resistencia a la insulina. Objetivo: Comparar la respuesta glicémica y de péptido C, según habitualidad de consumo de edulcorantes y preferencias alimentarias reportados por mujeres con resistencia a la insulina tras la ingesta de estevia y D-tagatosa. Métodos: Treinta y tres mujeres con RI se sometieron a una encuesta de opción múltiple sobre preferencias alimentarias y ETCC modificada de edulcorantes. Aleatoriamente recibieron una precarga de control o experimental (estevia y D-tagatosa) donde se midió glicemia y péptido C en los tiempos -10, 30, 60, 90, 120, 180. Resultados: Se encontró un ABC de péptido C más alto después de la ingesta de D-tagatosa (p = 0,02) en pacientes que prefieren alimentos ricos en proteínas en comparación con aquellos que prefieren alimentos ricos en grasas o en carbohidratos simples. Se observó un mayor ABC de péptido C (p = 0,04) para la prueba control en quienes prefieren el sabor salado y consumen menor cantidad de ENN, sin diferencias significativas entre quienes prefirieron sabor dulce. Conclusiones: Al comparar las respuestas glicémicas e insulinémicas entre habitualidad de consumo de edulcorantes y preferencias alimentarias reportados por las pacientes tras la ingesta de agua, estevia y D-Tagatosa, no se obtuvieron diferencias significativas. Salvo en quienes preferían alimentos ricos en proteínas tras la ingesta de D- tagatosa y quienes preferían sabor salado con menor consumo habitual de ENN tras ingesta control.
Palabras clave: Consumo habitual; Edulcorantes no nutritivos; Hábitos alimentarios; Glicemia; Péptido-C.
Abstract: Introduction: The consumption of non-nutritive sweeteners (NNS) has been
increasing. Despite this, the effect between the habitual consumption of ENN and
food preferences with biochemical parameters in patients with insulin resistance is
unknown. Objective: To compare the glycemic and C-peptide response, according
to the habitual consumption of sweeteners and food preferences reported by women
with insulin resistance after ingesting stevia and D-tagatose. Methods: Thirty-three
women with IR underwent a multiple choice survey on food preferences and modified
ETCC for sweeteners. They randomly received a control or experimental preload
(stevia and D-tagatose) where glycemia and peptide C were measured at times -10,
30, 60, 90, 120, 180. Results: A higher C-peptide AUC was found after ingestion of D-tagatose (p = 0.02) in patients who prefer foods rich in protein compared to those who prefer foods rich in fat or simple carbohydrates.
A higher AUC of peptide C (p = 0.04) is performed for the control test in those who prefer a salty taste and consume a
lower amount of ENN, without significant differences between those who prefer a sweet taste. Conclusions: When comparing the
glycerol and insulin responses between the habitual consumption of sweeteners and the food preferences reported by the patients
after the ingestion of water, stevia and D-Tagatose, no significant differences were obtained. Except in those who prefer foods rich
in protein after ingesting D-tagatose and those who prefer salty taste with less habitual consumption of NNS after control intake.
Keywords: C-peptide; Eating habits; Glycemia; Habitual consumption; Non-nutritive sweeteners.
Los edulcorantes no nutritivos (ENN) son utilizados como sustitutos del azúcar dado su bajo o nulo aporte calórico. La Stevia Rebaudiana Bertoni es un ENN 300 veces más dulce que la sacarosa1, Por otro lado, D-Tagatosa es un edulcorante natural derivado de la lactosa, bajo en calorías y con un poder de dulzor de 0.92. Ambos ENN fueron generalmente reconocido como seguro para su uso en alimentos por la FDA3,4.
La habitualidad de consumo de ENN en sujetos con alteraciones del metabolismo glucídico se ha determinado en diferentes estudios a través del consumo de bebidas dietéticas5,6. Pepino et al. definieron consumo habitual de ENN como la ingesta de una cucharadita de ENN, la cantidad equivalente en alimentos o una lata de refresco de 12 oz (350 ml) con ENN a la semana en pacientes con obesidad7. Sin embargo, no hay estudios que relacionen dicha habitualidad de consumo con respuestas metabólicas agudas en pacientes con RI.
Se ha evidenciado que las personas consumidoras habituales de bebidas con edulcorantes presentan mayor preferencia y tolerancia al sabor dulce, mayor riesgo de obesidad y de RI8. Por otra parte, los receptores de sabor dulce en células b pancreáticas estimulan la secreción de insulina en ratas con obesidad y DM 2, condición no favorable en pacientes con RI9.
Sobre preferencias alimentarias, se ha estudiado que en sujetos con obesidad y sanos quienes consumían más alimentos después de las 15:00 horas tenían mayor liberación de insulina en ayunas y HOMA10, cabe destacar que se presenta escasa evidencia en pacientes con RI. Por otra parte, estudios en sujetos con diabetes han demostrado la ansiedad como punto clave en el tratamiento clínico11 con consecuencias en la motivación excesiva de consumo de alimentos12.
El propósito de este estudio fue comparar la respuesta glicémica y de péptido C, según habitualidad de consumo de edulcorantes y preferencias alimentarias reportados por mujeres con resistencia a la insulina tras la ingesta de estevia y D-tagatosa.
Material y métodos
Sujetos
Treinta y tres mujeres con RI formaron parte de este análisis. El diagnóstico de RI se hizo a través de un examen de glicemia de ayuno (glucosa oxidasa/peroxidasa, LED Technology/ BA 400 BioSystems) e insulinemia de ayuno (ensayo de quimioluminiscencia) en el Laboratorio Clinico Endoclin®, Chile. Se definió RI cuando HOMA-IR fue ≥2.5. Se incluyó voluntarias de sexo femenino con edad entre 18 y 35 años, índice de masa corporal (IMC) entre 18.5 a 34.9 kg/m2. Se excluyó a: i) mujeres embarazadas o en periodo de lactancia; ii) voluntarias con enfermedades, condiciones o medicamentos que provoquen hiperinsulinismo o que alteren el metabolismo glucídico, la respuesta hormonal postprandial, apetito y/o saciedad; iii) aquellas que realicen actividad física moderada a intensa tres o más veces por semana durante más de 30 minutos; iv) aquellas con uso de suplementos vitamínicos o antioxidantes; v) voluntarias con alergia o aversión a los edulcorantes usados en el estudio. Este estudio fue autorizado por el comité de bioética para la investigación de la Facultad de Farmacia, Universidad de Valparaíso. Todos los sujetos dieron su consentimiento informado por escrito.
Diseño experimental
Este estudio corresponde a un sub-análisis de un ensayo clínico cruzado, ciego simple. Las voluntarias asistieron a un screening en la Facultad de Farmacia de la Universidad de Valparaíso para la medición de antropometría básica según técnicas estandarizadas. Un Nutricionista capacitado aplicó una ETCC modificada de edulcorantes y una encuesta de selección múltiple de preferencias alimentarias.
El estudio estuvo conformado por tres intervenciones explicado en la figura 1, cada una realizada en una ocasión diferente, separadas por un período de lavado mínimo de 7 días. Las voluntarias fueron su propio control, ingirieron 60 ml de agua desionizada en la primera intervención (prueba control) y posteriormente al azar ingirieron 15.3 mg de estevia (prueba estevia) o 5 g de D-tagatosa (prueba D-tagatosa), ambas en 60 ml de agua. Posteriormente las voluntarias se sometieron a una carga de glucosa oral de 75 g de glucosa en la prueba D-tagatosa y 77.1 g de glucosa en las pruebas control y estevia, con el fin de equiparar el aporte de hidratos de carbono entre ambos edulcorantes.
Se solicitó a las voluntarias mantener sus patrones habituales de estilo de vida durante todo el estudio, y que se abstuvieran de hacer ejercicio intenso, ingerir alcohol y consumir tabaco durante 24 horas antes de cada prueba. Las voluntarias asistieron con un ayuno de 8 horas. La prueba comenzó solo si las voluntarias cumplían las condiciones estandarizadas solicitadas.
Se recolectó una muestra de sangre venosa basal al “tiempo -10”. Inmediatamente, bebieron 60 ml de agua con o sin ENN. Después de 10 minutos, cada voluntaria recibió una carga de glucosa oral. Posteriormente se realizaron extracciones de sangre a los 30, 60, 90, 120 y 180 minutos.
Conducta alimentaria habitual
Durante el screening, se aplicó una encuesta de selección múltiple sobre: preferencia de sabor, alimentos de preferencia en momentos de mayor sensación de hambre, horario de mayor ingesta y se indagó respecto a la motivación al momento de comer (Figura 2).
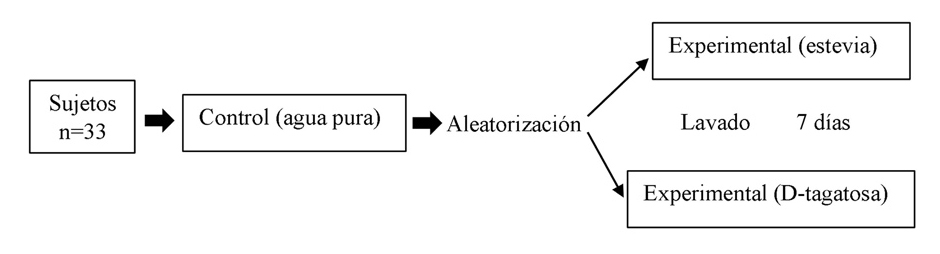
Figura 1: Intervención general de los pacientes.
Figura 2: Encuesta sobre preferencias alimentarias aplicadas a pacientes.
Habitualidad de consumo
Se utilizó un catastro de 858 productos disponibles en el mercado que reportaran la inclusión de ENN (sucralosa, estevia, D-tagatosa, acesulfame K, sacarina y aspartamo), se extrajo desde el etiquetado nutricional el nombre del producto, características, tipo de ENN y cantidad de ENN por 100 g y por porción de alimento. El punto de corte de habitualidad de consumo de ENN se definió según el estudio de Pepino et al.: equivalente a 48 mg de sucralosa a la semana7. Se realizó el cálculo de punto de corte de cada ENN en base a la homologación de azúcar con el poder edulcorante de cada uno. Para ello se consideró un poder edulcorante para estevia de 300, D-tagatosa de 0,92 y sucralosa de 60013 (Tabla 1).
Glicemia y péptido C
La glicemia plasmática se midió usando un ensayo enzimático colorimétrico, método GOD-PAP (Human®, Alemania; sensibilidad 0.84 mg/dl; rango normal 75-115 mg/dl en ayunas; CV intraensayo 1.7-3.8%; CV interensayo 2.2-3.9%; según datos del fabricante). Péptido-C se midió usando un inmunoensayo enzimático colorimétrico “C-peptide ELISA” (ALPCO®, EE. UU; sensibilidad 2.95 pmol/ l; CV intraensayo 2.9-4.5%; CV interensayo 7.9-11%; según datos del fabricante).
Análisis estadístico
Las variables se expresaron como media ± desviación estándar o mediana más intervalo intercuartílico (Q1-Q3), además se dividió la muestra en cuartiles por habitualidad de consumo de ENN.
Para las diferencias entre habitualidad de consumo de ENN y las distintas conductas alimentarias evaluadas se utilizó ANOVA de una vía post hoc Bonferroni o test de Kruskal- Wallis seguido de Mann-Whitney. Se utilizó el programa estadístico SPSS versión 26 ® y se consideró significativo un p<0.05. Se calculó Área Bajo la curva (ABC) de glicemia y péptido C usando el método trapezoidal calculado por el programa GraphPad PRISM 6.0 (San Diego, CA)14.
Resultados
La tabla 2 presenta las características de la muestra (n=33), la edad de las voluntarias tuvo una media de 23,4 ± 3,8 años comprendida entre 18 y 32 años. El rango del perímetro de cintura fue entre 73 y 113 cm, el IMC presentó un valor mínimo de 22,9 y un valor máximo de 35 kg/m2 y la glicemia de ayunas un valor mínimo de 78 y máximo de 115 mg/dl.
La mediana de ingesta de ENN fue de 50,9 (Q1:28,3 -Q3:157,4) mg/semana de estevia según equivalencia de poder de dulzor, con un mínimo de 0 y un máximo de 540,5 equivalente a mg de estevia/semana. Se calculó el punto de corte para habitualidad de consumo, resultando sólo siete pacientes con consumo no habitual de ENN, los resultados se presentaron en función de cuartiles de consumo habitual de ENN. El Q1 correspondió a 0-28,3; Q2 28,4-62,1; Q3 62,2 -157,4; Q4 157,5-540,5 mg/ semana de estevia según equivalencia de poder de dulzor.
Tabla 1. Punto de corte de consumo habitual semanal y diario equivalente a diferentes edulcorantes no nutritivos.
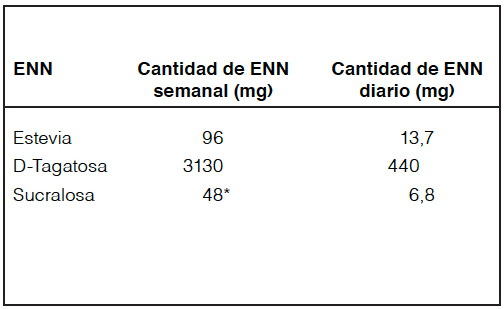
ENN: edulcorantes no nutritivos *Valor obtenido de Pepino et.al7
Tabla 2. Características de las pacientes estudiadas. 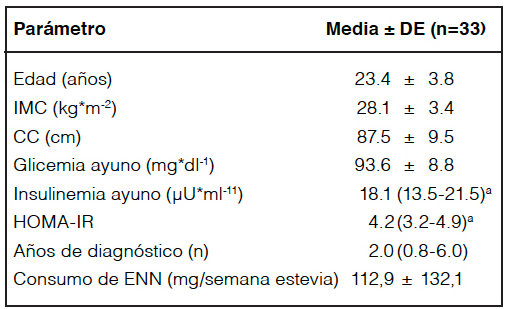
IMC: índice de masa corporal; CC: circunferencia de cintura; HOMAIR: Modelo homeostático para evaluación de resistencia a la insulina. Valores expresados como media ± DE, amediana (Q1-Q3).
La tabla 3 muestra las respuestas glicémicas y de péptido C tras la ingesta de agua, estevia y D-tagatosa en función de la habitualidad de consumo de ENN de las pacientes. No se encontraron diferencias significativas entre los cuartiles de habitualidad de consumo de ENN, respecto al ABC de glicemia y péptido C.
En la tabla 4 se muestra la descripción de preferencias alimentarias de las voluntarias estudiadas. Respecto a las preferencias de sabor, las voluntarias en su mayoría eligieron el sabor dulce (51,5%; n=17) o salado (45%%; n=15). Los horarios de mayor ingesta reportados por las voluntarias correspondieron a los horarios de tarde (42,4%; n=14) y noche (33,3%; n=11). La mayoría de las voluntarias estudiadas (48,4%; n=16) reportó seleccionar alimentos ricos en CHO complejos (pastas, pan, pizzas, etc) en el momento de mayor sensación de hambre. La percepción de “ansiedad” fue la que reportaron como principal motivación al momento de comer (36,3%; n=12).
No se encontraron diferencias significativas entre las preferencias de sabor dulce y salado, y entre los horarios de mayor ingesta reportado por las pacientes para las variables respuesta glicémica y péptido C, tanto para la prueba control (agua) como para las pruebas de ENN (Tablas 5 y 6). No se encontraron diferencias significativas para las variables respuesta glicémica y péptido C en las tres pruebas al comparar las pacientes en cuartil de consumo 1 y 2 versus aquellas en cuartil de consumo 3 y 4 de ENN, y que sólo preferían sabor dulce. Al realizar el mismo análisis en pacientes que sólo preferían sabor salado, se encontró diferencia significativa para respuesta de péptido C (p=0,04) luego de la ingesta de agua (prueba control).
En la tabla 7 se muestran las diferencias entre preferencias de alimentos en el momento de mayor sensación de hambre reportadas por las pacientes para respuesta glicémica y de péptido C en las tres pruebas evaluadas. Se encontró diferencia significativa para ABC de péptido C tras la ingesta de D-tagatosa (p=0,02) entre quienes preferían alimentos ricos en proteínas vs. quienes preferían alimentos ricos en lípidos (p=0,03), como también entre quienes preferían alimentos ricos en proteínas vs aquellos que preferían alimentos ricos en hidratos de carbono simples (p=0,02).
La tabla 8 muestra las diferencias en la respuesta glicémica y de péptido C tras las tres pruebas aplicadas en función de la motivación al momento de comer reportadas por las voluntarias, no se encontraron diferencias entre los grupos con los tratamientos control, estevia y D-tagatosa.
Tabla 3. ABC de glicemia y péptido C tras la ingesta de edulcorantes y habitualidad de consumo de ENN de las pacientes estudiadas.
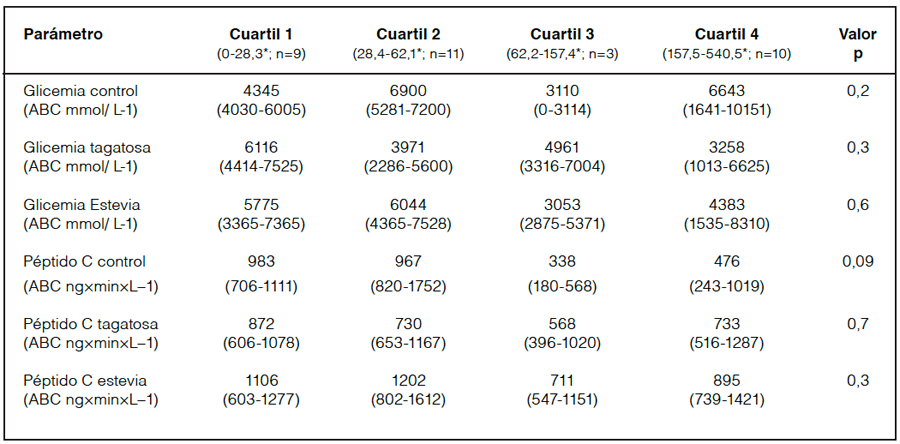
ABC: Área bajo la curva. *Rango de ingesta por cuartil, expresado como mg/semana de estevia. Valores expresados como mediana (rango intercuartílico) (n=33). ANOVA de medidas repetidas o Kruskal-Wallis.
Tabla 4. Descripción de conductas y preferencias alimentarias (n=33).

CHO: carbohidratos, RI: Resistencia a la Insulina. *El n de este grupo incluyen algunas pacientes (n=9) que reportaron preferencias por más de un grupo de alimentos (incluidos alimentos ricos en CHO complejos).
Tabla 5. ABC glicemia y péptido C tras la ingesta de edulcorantes y preferencia de sabor de las pacientes estudiadas.
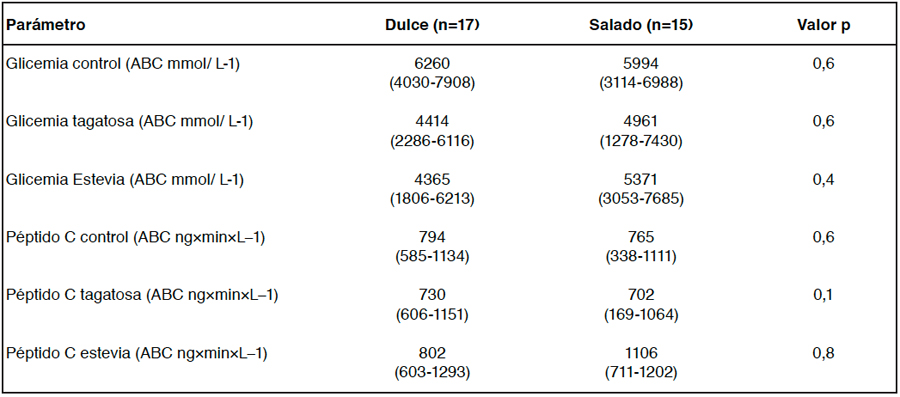
ABC: Área bajo la curva. Valores expresados como mediana (rango intercuartílico) (n=32). ANOVA de medidas repetidas o Mann Whitney.
Tabla 6. ABC glicemia y péptido C tras la ingesta de edulcorantes y horario de mayor ingesta de las pacientes estudiadas.
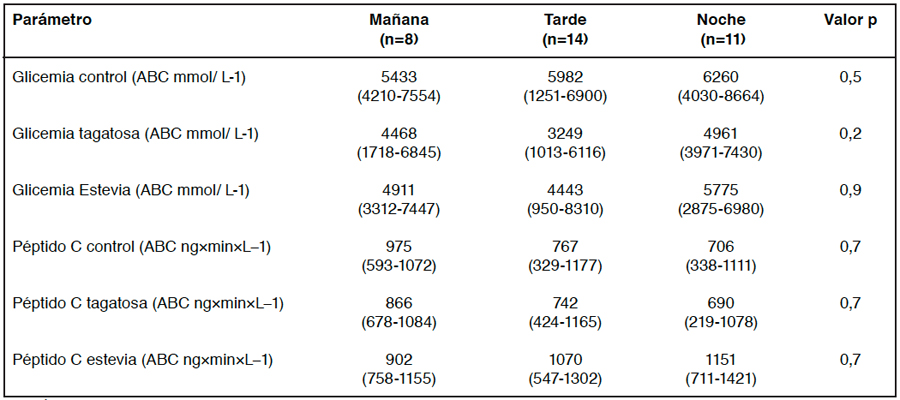
ABC: Área bajo la curva. Valores expresados como mediana (rango intercuartílico) (n=33). ANOVA de medidas repetidas o Kruskal-Wallis.
Tabla 7. ABC glicemia y péptido C tras la ingesta de edulcorantes y alimentos preferidos en momentos de mayor hambre en las pacientes estudiadas.
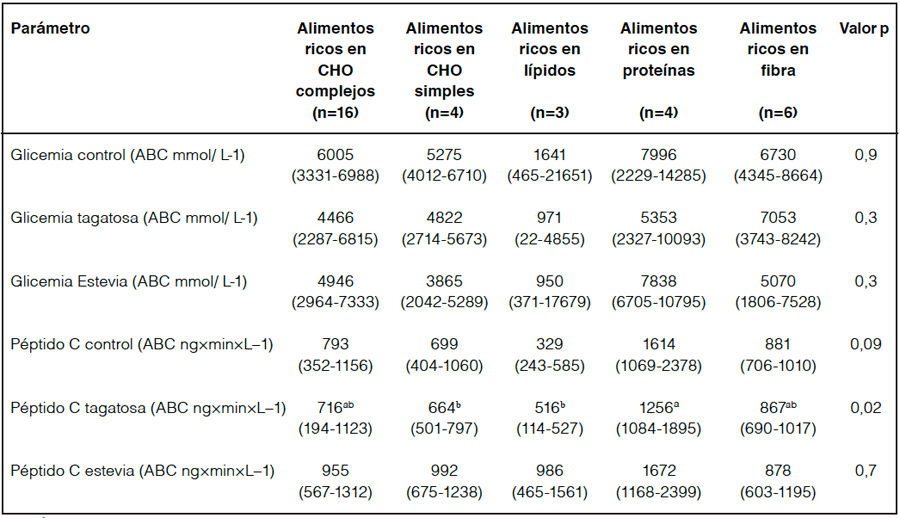
ABC: Área bajo la curva. CHO: Carbohidratos Valores expresados como mediana (rango intercuartílico) (n=33). Diferencias significativas entre las medianas de las variables se expresan con letras distintas.
Tabla 8. ABC glicemia y péptido C tras la ingesta de edulcorantes y motivación al momento de comer de las pacientes estudiadas.
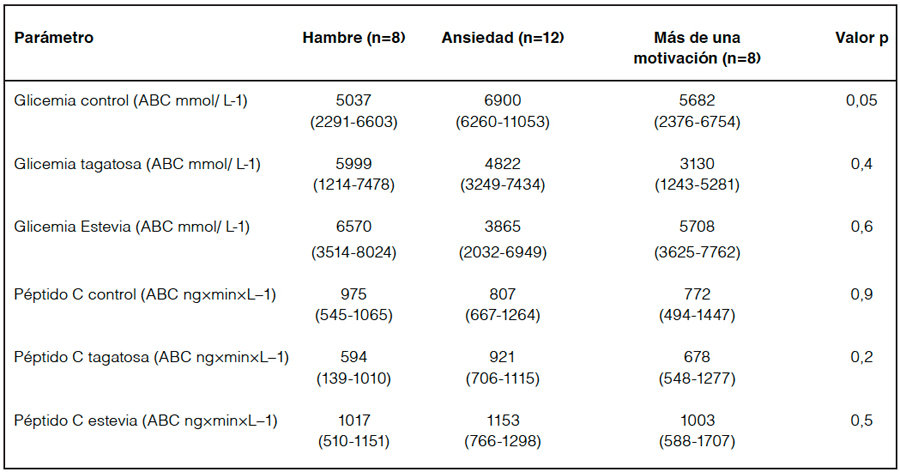
ABC: Área bajo la curva. Valores expresados como mediana (rango intercuartílico) (n=28).
ANOVA de medidas repetidas o Kruskal-Wallis.
Discusión
Según el punto de corte de habitualidad de consumo de ENN utilizado en este estudio, solo siete pacientes no reportaron un consumo habitual de ENN. En los últimos años ha aumentado el consumo de ENN, especialmente en Chile15, situación reflejada en los resultados de este estudio.
No hubo diferencias significativas para la respuesta glicémica y de péptido C en ninguna de las pruebas aplicadas entre los distintos cuartiles de habitualidad de consumo de ENN. La evidencia en cuanto a este hallazgo es controversial. Una investigación con suplementación de 28 mg/kg/semana (1,6 g/semana para un individuo de 60 kg de peso) de estevia durante 24 semanas demostró una disminución de HOMA IR, glicemia postprandial y basal16. Por otra parte, el consumo de 45 g de D-tagatosa/día durante 10 meses disminuyó la glicemia de ayuno a partir del sexto mes de intervención17. Estos hallazgos no coinciden con lo reportado por este estudio, lo que se puede explicar por las dosis elevadas, respecto al consumo habitual, de estevia y D-tagatosa utilizadas en los ensayos clínicos longitudinales.
Se ha evidenciado que las elecciones de alimentos se realizan principalmente en función de su sabor18,19, las personas quienes prefieren sabor dulce pueden aumentar el consumo de alimentos azucarados y bebidas20 y quienes tienen un consumo habitual de edulcorantes presentan un alto deseo de consumir alimentos con carbohidratos en vez de grasas21. A partir de esto, se esperaba un aumento de glicemia y péptido C en las pacientes que prefirieron alimentos dulces, sin embargo, no se encontraron diferencias significativas. Esto puede explicarse, en parte, por la presencia de fructosa en algunos alimentos dulces, nutriente que no afecta la respuesta glicémica y que no utiliza insulina para ser metabolizada22. En contraste, se observó una mayor respuesta de péptido C en la prueba control para aquellas pacientes que preferían el sabor salado y que reportaron bajo consumo habitual de ENN. Se ha reportado asociación entre una alta ingesta de sal y síntesis de fructosa en hígado, lo que contribuye a la resistencia a la leptina que conduciría finalmente a un hiperinsulinismo23.
No se encontraron diferencias significativas entre los horarios de mayor ingesta para las respuestas glicémicas y de péptido C en las tres pruebas evaluadas, la evidencia ha demostrado que en pacientes con intolerancia a la glucosa oral (IGO) que consumen comidas ricas en grasas en la mañana y altas en carbohidratos en la tarde no así en pacientes que consumieron el tratamiento inverso, tienen como efecto respuestas glicémicas desfavorables a diferencia de las personas sin IGO, por otro lado, la medición de péptido C demuestra que la secreción no dependía de la hora del día24.
Las pacientes que prefieren alimentos ricos en proteínas, específicamente carnes, presentaron mayor respuesta de péptido C tras la prueba D-tagatosa. No hay evidencia que permita explicar este hallazgo. Algunos estudios indican la relación entre la ingesta de carnes rojas y la inflamación, siendo un factor de riesgo de hiperinsulinismo, explicado por el aporte de grasas de estos alimentos25,26. Sin embargo, en este estudio el grupo que prefería grasas de origen distinto a carnes no presentó diferencias en respuestas glicémicas e insulinémicas.
La motivación al momento de comer más prevalente fue ansiedad, el cual se asocia positivamente con RI27, sin embargo, no se encontraron diferencias significativas para respuesta glicémica y de péptido C.
Las fortalezas de este estudio son el uso de variables preferencias alimentarias y habitualidad de consumo en pacientes con RI, aspectos poco estudiados actualmente. Respecto a las debilidades del estudio, importante aclarar que se aplicó un cuestionario no validado para conocer preferencias alimentarias, con escaso detalle respecto al tipo de alimentos que preferían las pacientes en cada categoría estudiada. Respecto a las proyecciones, se requieren estudios poblacionales que investiguen un punto de corte de consumo habitual de ENN y los posibles mecanismos que contribuyeron a cambios significativos entre pruebas.
Conclusión
No se encontraron diferencias significativas para la respuesta glicémica y de péptido C en las tres pruebas evaluadas (control, estevia y D-tagatosa) entre pacientes con diferente habitualidad de consumo de ENN, diferentes preferencias de sabor, diferente horario de consumo en el momento de mayor ingesta de alimentos y diferente motivación para comer. Tras la ingesta de la precarga de D-tagatosa hubo un aumento significativo de la respuesta de péptido C entre quienes reportaron preferir alimentos ricos en proteínas en el momento de mayor ingesta del día. Sólo en aquellas pacientes que preferían sabor salado, se encontró mayor respuesta de péptido C en la prueba control entre quienes reportaban menor consumo de ENN.
Agradecimientos. A las profesoras Leticia Luna y Victoria Novik, a las alumnas de pregrado que participaron en análisis experimental y al Laboratorio clínico Endoclin. Declaración de interés. Los autores no tienen conflicto de interés alguno respecto a este estudio.
Referencias
- Jarma O CE, Cleves J, et.al. Aspectos nutricionales y metabolismo de Stevia rebaudiana (Bertoni). Agron colomb. 2010; 28(2): 199-208.
- Espinosa I, Fogelfeld L. Tagatose: from a sweetener to a new diabetic medication? Expert Opin Investig Drugs. 2010; 19(2): 285-294.
- Almeida J FC, Gracia M.ª, Garcia J. Una visión global y actual de los edulcorantes: aspectos de regulación. Nutr Hosp Madrid. 2013; 28(4): 17-31.
- Joint, FAO/WHO. D-Tagatose: Chemical and Technical Assessment (CTA). In: JECFA, editor. 2008.
- Klein DA, Boudreau GS, Devlin MJ, Walsh BT. Artificial sweetener use among individuals with eating disorders. Int J Eat Disord. 2006; 39(4): 341-345.
- Fowler SP, Williams K, Hazuda HP. Diet soda intake is associated with long-term increases in waist circumference in a biethnic cohort of older adults: The San Antonio Longitudinal Study of Aging. J Am Geriatr Soc. 2015; 63(4): 708-715
- Pepino MY, Tiemann CD, Patterson BW, Wice BM, Klein S. Sucralose affects glycemic and hormonal responses to an oral glucose load. Diabetes Care. 2013; 36(9): 2530-2535.
- HM G. La paradoja de los endulzantes sin calorías. Med IntMex. 2017; 33(2): 204-208.
- Kyriazis GA, Smith KR, Tyrberg B, Hussain T, Pratley RE. Sweet taste receptors regulate basal insulin secretion and contribute to compensatory insulin hypersecretion during the development of diabetes in male mice. Endocrinology. 2014; 155(6): 2112-2121.
- Dashti HS, Gómez-Abellán P, Qian J, Esteban A, Morales E, Scheer FAJL, et al. Late eating is associated with cardiometabolic risk traits, obesogenic behaviors, and impaired weight loss. Am J Clin Nutr. 2020; 113(1): 154-161.
- Shaban C BJ, kerr D, et al. The prevalence of depression and anxiety in adults with type 1 diabetes. Diabetic Medicine. 2006; 23(12): 1381-1384.
- Salazar D CT, Pastor MP, et al. Ansiedad, depresión y actividad física asociados a sobrepeso /obesidad en estudiantes de dos universidades mexicanas. Hacia Promoc Salud. 2016; 21(2): 99-113.
- EPSA. Edulcorantes. In: EPSA, editor. 2005. p. 6.
- Cheng KC LY, Cheng JT. The Areas Under Curves (AUC) used in Diabetes research. Update view. Integr ObesityDiabetes. 2018; 4(3): 1-2.
- Rodriguez L PT. Edulcorantes no nutritivos (No calóricos). Rev Chil Pediatr. 2018; 89(6): 683-684.
- Abdelsamad M AA, Sitohy M, et.al. The impact of stevioside supplementation on glycemic control and lipid profile in patients with type 2 diabetes: a controlled clinical trial. Egiptian journal of internal medicine. 2019; 31(1): 22-30.
- Ensor M, Banfield AB, Smith RR, Williams J, Lodder RA. Safety and Efficacy of D-Tagatose in Glycemic Control in Subjects with Type 2 Diabetes. J Endocrinol Diabetes Obes. 2015; 3(1): 1065.
- Tan SY, Tucker RM. Sweet Taste as a Predictor of Dietary Intake: A Systematic Review. Nutrients. 2019; 11(1): 94. 1
- Jayasinghe SN, Kruger R, Walsh DCI, Cao G, Rivers S, Richter M, et al. Is Sweet Taste Perception Associated with Sweet Food Liking and Intake? Nutrients. 2017; 9(7): 750.
- Shin Y, Lee S, Kim Y. Sweet Preference Associated with the Risk of Hypercholesterolemia Among Middle-Aged Women in Korea. J Atheroscler Thromb. 2018; 25(12): 1215-1221.
- Yu JH SM, Kim DJ, et.al. Enhanced carbohydrate craving in patients with poorly controlled type 2 diabetes mellitus. Diabet Med. 2013; 30(9): 1080- 1086.
- Basciano H, Federico L, Adeli K. Fructose, insulin resistance, and metabolic dyslipidemia. Nutr Metab (Lond). 2005; 2(1): 5.
- Tanaka M, Itoh H. Hypertension as a Metabolic Disorder and the Novel Role of the Gut. Curr Hypertens Rep. 2019; 21(8): 63.
- Kessler K, Hornemann S, Petzke KJ, Kemper M, Kramer A, Pfeiffer AF, et al. The effect of diurnal distribution of carbohydrates and fat on glycaemic control in humans: a randomized controlled trial. Sci Rep. 2017; 7: 44170.
- Tucker LA, LeCheminant JD, Bailey BW. Meat Intake and Insulin Resistance in Women without Type 2 Diabetes. J Diabetes Res. 2015; 2015: 174742.
- Kitada M, Ogura Y, Monno I, Koya D. The impact of dietary protein intake on longevity and metabolic health. EBioMedicine. 2019; 43: 632-640.
- Bruggink SM, Shomaker LB, Kelly NR, Drinkard BE, Chen KY, Brychta RJ, et al. Insulin Sensitivity, Depression/Anxiety, and Physical Fitness in At-Risk Adolescents. Sports Med Int Open. 2019; 3(2): E40-E47.