Efecto de la dieta CAF sobre la capacidad de EX4 de modular la expresión de marcadores proteicos de oxidación de ácidos grasos y termogénesis en músculo de ratones
Cristian Jaque1, Yanireth Jiménez1, Francisca Muñoz1, Claudio Pérez-Leighton1*.
Effect of the CAF diet on the ability of EX4 to modulate the expression of protein markers of fatty acid oxidation and thermogenesis in mouse muscle
- Departamento de Fisiología, Facultad de Ciencias Biológicas, Pontificia Universidad Católica de Chile, Santiago, Chile.
*Correspondencia: Claudio Perez-Leighton /
cperezl@bio.puc.cl
Av. Libertador Bernardo O’Higgins 340,
Santiago, Chile.
Financiamiento: SOCHED 2019/2, ANID Anillo de Ciencia y Tecnología ACT210039.
No existe conflicto de interes.
Recibido: 15-12-2022.
Aceptado: 31-01-2023.
Resumen: El ambiente obesogénico promueve la obesidad al facilitar el acceso y consumo de una amplia variedad de alimentos palatables altos en calorías. La activación del receptor de GLP1 (GLP1R) reduce la ingesta de alimentos, enlentece el vaciamiento gástrico y promueve un balance energético negativo a través de su acción en distintos órganos como el músculo esquelético, disminuyendo así el peso corporal. La obesidad inducida por dieta alta en grasa disminuye el efecto anorexigénico de la administración sistémica vía intra-peritoneal de EX4 (agonista de GLP1R). Sin embargo, se desconoce si la exposición a un ambiente obesogénico previo a la manifestación de obesidad disminuye los efectos anorexigénicos de EX4 o un posible efecto de EX4 sobre marcadores de oxidación de ácidos grasos y termogénesis en músculo esquelético. El objetivo de esta investigación fue determinar el efecto a corto plazo de la dieta CAF, un modelo del ambiente obesogénico humano, sobre la capacidad de EX4 de reducir la ingesta y modular la expresión de marcadores proteicos de oxidación de ácidos grasos y termogénesis (CPT1 y UCP2) en músculo de ratones. Nuestros datos muestran que una inyección intraperitoneal de EX4 a ratones C57BL/6J alimentados con dieta CAF o dieta control durante 10 días no altera la ingesta calórica total, peso corporal, o la expresión de proteínas marcadoras de los procesos de beta-oxidación y de termogénesis (CPT1 y UCP2). Estos datos sugieren que protocolos alternativos de administración de EX4 son necesarios para observar los efectos fisiológicos de la activación de GLP1R.
Palabras clave: CPT1; Dieta CAF; EX4; GLP1; UCP2.
Abstract: The obesogenic environment promotes obesity by facilitating access to and consumption of a wide variety of palatable, high-calorie foods. Activation of the GLP1 receptor (GLP1R) reduces food intake, slows gastric emptying, and promotes a negative energy balance by acting on organs such as skeletal muscle, thus decreasing body weight. Obesity induced by a high-fat diet decreased the anorexigenic effect of intraperitoneal systemic administration of EX4 (GLP1R agonist). However, it is unknown whether exposure to an obesogenic environment before the manifestation of obesity diminishes the anorexigenic effects of EX4 or a possible effect of EX4 on markers of fatty acid oxidation and thermogenesis in skeletal muscle. This investigation aimed to determine the short-term effect of the CAF diet, a model of the human obesogenic environment, on the ability of EX4 to reduce intake and modulate the expression of protein markers of fatty acid oxidation and thermogenesis (CPT1 and UCP2) in mouse muscle. Our data show that intraperitoneal injection of EX4 to C57BL/6J mice fed CAF diet or control diet for ten days does not alter total caloric intake, body weight, or expression of proteins markers of beta-oxidation and thermogenesis processes (CPT1 and UCP2). These data suggest that alternative EX4 administration protocols are necessary to observe the physiological effects of GLP1R activation.
Keywords: CPT1; Diet CAF; EX4; GLP1; UCP2.
Introducción
La obesidad es una condición definida por una acumulación excesiva de tejido adiposo (TA) blanco que puede causar alteraciones metabólicas como la reducción en la sensibilidad a la insulina y en la capacidad de oxidación de ácidos grasos en músculo esquelético1,2,3, lo que aumenta el riesgo de enfermedades crónicas no transmisibles como la diabetes mellitus tipo 2, cáncer y enfermedad cardiovascular4. La obesidad tiene un origen multifactorial, donde se entrelazan factores biológicos, conductuales y ambientales5,6. El conjunto de factores ambientales que promueven el desarrollo de obesidad se conoce como ambiente obesogénico7. El ambiente obesogénico facilita el acceso a una amplia variedad de alimentos palatables que son ricos en grasa, azúcar y/o sal; favoreciendo un consumo excesivo de comida y promoviendo un balance energético positivo8,9. Comprender los mecanismos por los cuales el ambiente obesogénico altera los mecanismos biológicos que regulan el balance energético es necesario para mejorar las opciones terapéuticas contra obesidad.
El péptido similar al glucagón 1 (GLP1) es un péptido neuroendocrino anorexigénico que se expresa en respuesta a la ingesta de alimentos. En el cerebro, GLP1 se expresa en las neuronas preproglucagón (PPG) del núcleo del tracto solitario; y a nivel periférico, en las células L enteroendocrinas del intestino delgado10,11. GLP1 actúa a través del receptor de GLP1 (GLP1R), el cual es un receptor acoplado a proteína G que se expresa a nivel central y periférico. La activación del receptor de GLP1 (GLP1R) reduce la ingesta de alimentos, enlentece el vaciamiento gástrico, promueve un balance energético negativo y disminuye el peso corporal12. Exendina-4 (EX4) es un agonista de GLP1R, que cruza la barrera hematoencefálica13 y tiene una vida media mayor que GLP1 endógena por su mayor resistencia a la degradación por la enzima dipeptil-peptidasa-4 (DPP-4)14. En roedores, la administración de EX4 reduce el consumo de alimentos en ratones15,16. Además, EX4 in-vitro incrementa la expresión de genes relacionados a la oxidación de ácidos grasos y termogénesis en células musculares, sugiriendo un aumento del gasto energético17.
En roedores, la obesidad inducida por dieta alta en grasa disminuye el efecto anorexigénico causado por la administración sistémica vía intra-peritoneal de EX418. Sin embargo, la dieta alta en grasa no modela la complejidad del ambiente alimentario humano. En nuestro laboratorio, modelamos el ambiente obesogénico humano usando la dieta CAF, la cual ofrece una variedad rotativa de alimentos palatables de consumo humano (por ejemplo, papas fritas) además del acceso constante a comida estándar (chow)19. Si bien la obesidad inducida por exposición crónica a dieta CAF (i.e. más de 8 semanas) reduce los efectos anorexigénicos de EX420, no está claro si exposición a dieta CAF antes del desarrollo de obesidad tiene efectos anorexigénico o si modula un posible efecto de EX4 sobre marcadores de oxidación de ácidos grasos y termogénesis en músculo esquelético. El objetivo de esta investigación fue determinar el efecto de la dieta CAF por un corto periodo sobre la capacidad de EX4 de modular la expresión de marcadores proteicos de oxidación de ácidos grasos y termogénesis en músculo de ratones.
Material y métodos
Animales. Ratones macho C57BL/6J (n= 32, Bioterio Pontificia Universidad Católica de Chile, 8-11 semanas de edad, 21-26 g de peso) fueron alojados individualmente en jaulas con viruta de papel, material de enriquecimiento, acceso a comida chow Prolab RMH-3000 (LabDiet, USA) y agua ad libitum, en una habitación con ciclo de luz-oscuridad de 12/12 horas y temperatura controlada (20 – 26 ºC). Los ratones fueron aclimatados entre 5-9 días previo al inicio del experimento. Todos los procedimientos fueron aprobados por el Comité Institucional de Uso y Cuidado de Animales de la Pontificia Universidad Católica de Chile.
Diseño experimental. Los ratones fueron asignados aleatoriamente a uno de dos grupos de dieta por una duración de 15 días: dieta control (CTRL, n= 16) o dieta de cafetería (CAF, n= 16). Luego, estos dos grupos fueron divididos en ratones que recibirían una inyección IP diaria de solución salina o EX4 por 10 días mientras continuaban con su dieta, formando los siguientes 4 grupos experimentales (n= 8 por grupo): 1) dieta control más inyección IP de salino (CTRL-Veh), 2) dieta control más inyección IP de EX4 (CTRL-EX4), 3) dieta CAF más inyección IP de salino (CAF-Veh) o 4) dieta CAF más inyección IP de EX4 (CAF-EX4). En el último día, y dos horas posteriores a la última inyección IP, los ratones fueron eutanasiados por exceso de isoflurano más decapitación. Los músculos gastrocnemio y sóleo fueron recolectados bilateralmente, y guardados a -80 °C hasta su uso.
Dietas. La dieta CTRL consistió en comida chow ad libitum. La dieta CAF consistió en chow ad libitum más acceso a alimentos palatables al mismo tiempo. Los alimentos palatables fueron cortados en trozos pequeños (1-2 cm) y puestos en un pocillo de cerámica ubicados en las esquinas dentro de la jaula (mismo lugar para todos los ratones). Dentro del pocillo se colocaban 4 alimentos palatables distintos (2 dulces y 2 salados), los que eran cambiados cada 2 ó 3 días para mantener la variedad y novedad del alimento. La información nutricional de los alimentos utilizados se muestra en la tabla 1. El protocolo de dieta CAF usado fue modificado en los tipos de alimentos del usado por 20.
Tabla 1. Información nutricional de los alimentados administrados.
| Clase | Alimento (Nombre comercial) |
Descripción de los alimentos |
Energía (kcal/g) | Proteínas/g | Lípidos/g | Carbohidratos/g | Azucares/g | Sodio/mg |
| Chow | Prolab
RMH- 3000 |
Comida regular para ratones | 3,46 | 0,15 | 0,05 | 0,53 | 0,07 | 2 |
| Dulce | Criollitas | Galletas sabor a vainilla con cristales de azúcar | 4,08 | 0,084 | 0,058 | 0,806 | 0,529 | 1,1 |
| Galletas Toddy | Galletas con chispas de chocolate |
4,74 | 0,056 | 0,206 | 0,676 | 0,342 | 2,91 | |
| Trencito | Barra de chocolate con leche | 5,48 | 0,083 | 0,305 | 0,6 | 0,523 | 1,08 | |
| Ga lleta Bonobon | Galletas rellenas con
pasta de maní y cubierta de chocolate |
5,23 | 0,078 | 0,29 | 0,57 | 0,41 | 1,03 | |
| Galleta de chocolate Costa | Galletas sabor chocolate | 4,96 | 0,049 | 0,22 | 0,697 | 0,265 | 3,39 | |
| Galleta de mantequilla Costa | Galletas con mantequilla | 4,68 | 0,052 | 0,183 | 0,707 | 0,274 | 3,22 | |
| Cereal Quaker | Cuadritos de avena | 4,03 | 0,11 | 0,049 | 0,78 | 0,16 | 3,42 | |
| Mantecol | Pasta de maní con cacao | 5,03 | 0,14 | 0,31 | 0,42 | 0,4 | 0,11 | |
| Chocolate blanco | Chocolate blanco | 5,3 | 0,043 | 0,28 | 0,64 | 0,64 | 1,5 | |
| Bonobon | Bonobon con chocolate de leche y oblea relleno con crema de maní | 5,56 | 0,091 | 0,36 | 0,48 | 0,43 | 0,95 | |
| Colacao cereal | Cereal de trigo y arroz
rellenos de crema sabor a chocolate |
4,14 | 0,09 | 0,139 | 0,631 | 0,422 | 2,48 | |
| Salado | Cheetos | Palitos de maíz con sabor a queso | 4,69 | 0,066 | 0,179 | 0,679 | 0,027 | 6 |
| Papas fritas Lays | Papas fritas | 5,52 | 0,044 | 0,34 | 0,57 | 0,02 | 3,76 | |
| Twistos | Tostadas de harina de trigo | 4,78 | 0,12 | 0,18 | 0,66 | 0,04 | 4,97 | |
| Doritos | Tortillas de maíz | 5,08 | 0,054 | 0,27 | 0,6 | 0,032 | 6,57 | |
| Ramitas | Palitos de harina de trigo con sabor a queso | 5,33 | 0,084 | 0,26 | 0,6 | 0,012 | 4,52 | |
| Suflé de maní | Cereales horneados de maíz con pasta de maní |
4,6 | 0,109 | 0,202 | 0,586 | 0,033 | 4,79 | |
| Galletas cracker | Galletas de harina de trigo | 4,33 | 0,11 | 0,15 | 0,66 | 0,008 | 6,89 | |
| Almendras | Almendras tostadas | 5,7 | 0,211 | 0,499 | 0,091 | 0,07 | 0,1 | |
| Suflé de papa | Cereales horneados de maíz y harina de papa |
5,07 | 7,08 | 0,019 | 0,571 | 0,287 | 0,051 | |
| Maní | Maní seco | 5,88 | 0,256 | 0,492 | 0,107 | 0,046 | 0,39 |
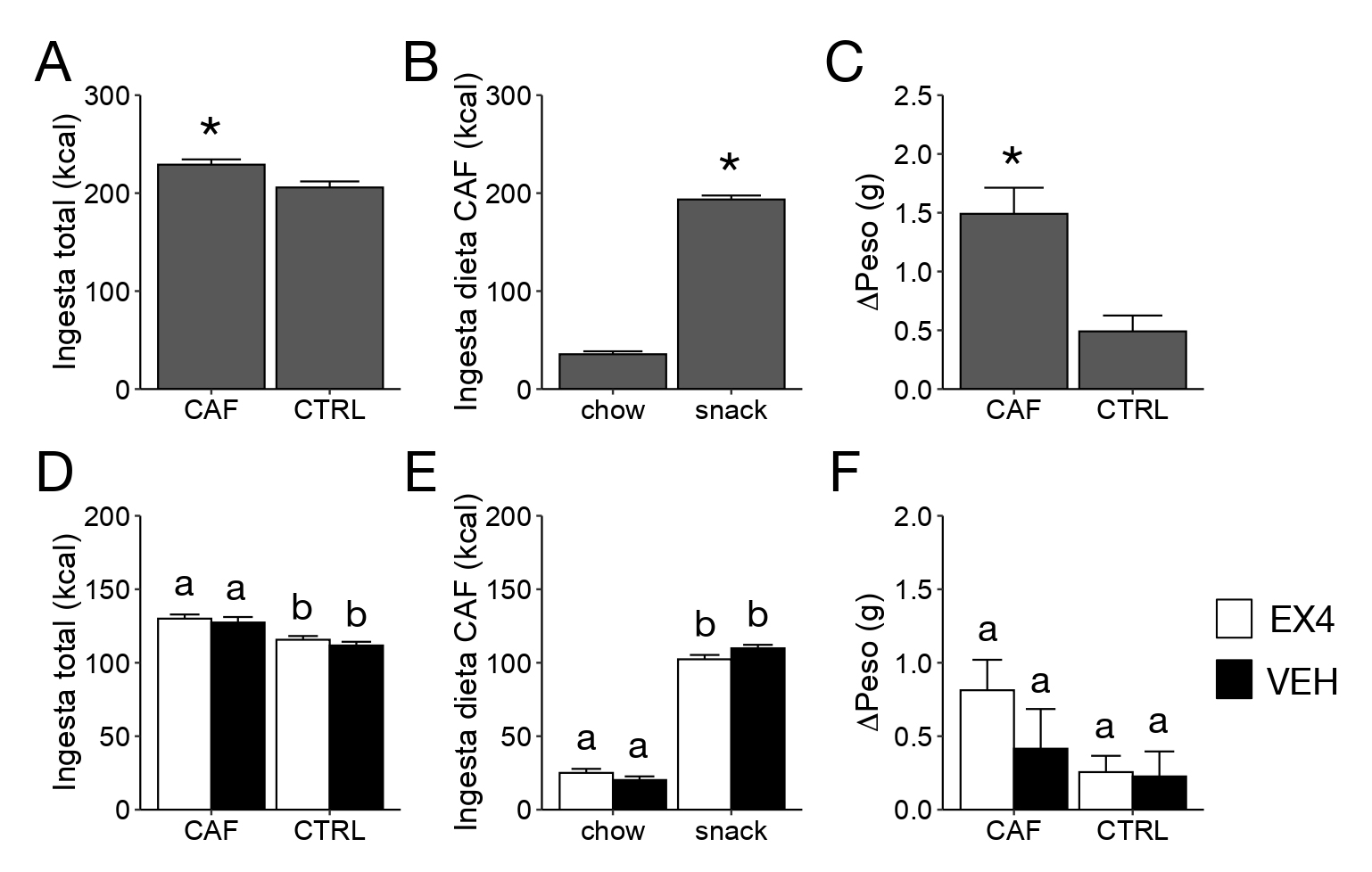 Figura 1: EX4 IP no afecta la ingesta o el peso corporal en ratones alimentados con dieta CAF o control. A. Ingesta calórica total durante la etapa de dieta sin
inyecciones (n = 15-16 por grupo). B. Ingesta calórica total de chow y snacks para animales alimentados con dieta CAF durante la etapa de dieta sin inyecciones
(n = 15-16 por grupo). C. Cambio en peso durante la etapa de dieta sin inyecciones (n = 15-16 por grupo). D. Ingesta calórica total durante la etapa de dieta con
inyecciones de EX45 o VEH (n = 7-8 por grupo). E. Ingesta calórica total de chow y snacks para animales alimentados con dieta CAF durante la etapa de dieta
con inyecciones de EX45 o VEH (n = 7-8 por grupo). F. Cambio en peso durante la etapa de dieta con inyecciones de EX45 o VEH (n = 7-8 por grupo). CTRL: dieta
control; CAF: dieta de cafetería; Veh: inyección IP de salino; EX4: inyección IP de Exendina-4 (10 ug/kg). Los datos se presentan con media ± SEM. El * denota un
<0,05 entre CAF y CTRL. En paneles C-D, letras distintas representan diferencias significativas después de comparaciones múltiples entre los cuatro grupos.
Figura 1: EX4 IP no afecta la ingesta o el peso corporal en ratones alimentados con dieta CAF o control. A. Ingesta calórica total durante la etapa de dieta sin
inyecciones (n = 15-16 por grupo). B. Ingesta calórica total de chow y snacks para animales alimentados con dieta CAF durante la etapa de dieta sin inyecciones
(n = 15-16 por grupo). C. Cambio en peso durante la etapa de dieta sin inyecciones (n = 15-16 por grupo). D. Ingesta calórica total durante la etapa de dieta con
inyecciones de EX45 o VEH (n = 7-8 por grupo). E. Ingesta calórica total de chow y snacks para animales alimentados con dieta CAF durante la etapa de dieta
con inyecciones de EX45 o VEH (n = 7-8 por grupo). F. Cambio en peso durante la etapa de dieta con inyecciones de EX45 o VEH (n = 7-8 por grupo). CTRL: dieta
control; CAF: dieta de cafetería; Veh: inyección IP de salino; EX4: inyección IP de Exendina-4 (10 ug/kg). Los datos se presentan con media ± SEM. El * denota un
<0,05 entre CAF y CTRL. En paneles C-D, letras distintas representan diferencias significativas después de comparaciones múltiples entre los cuatro grupos.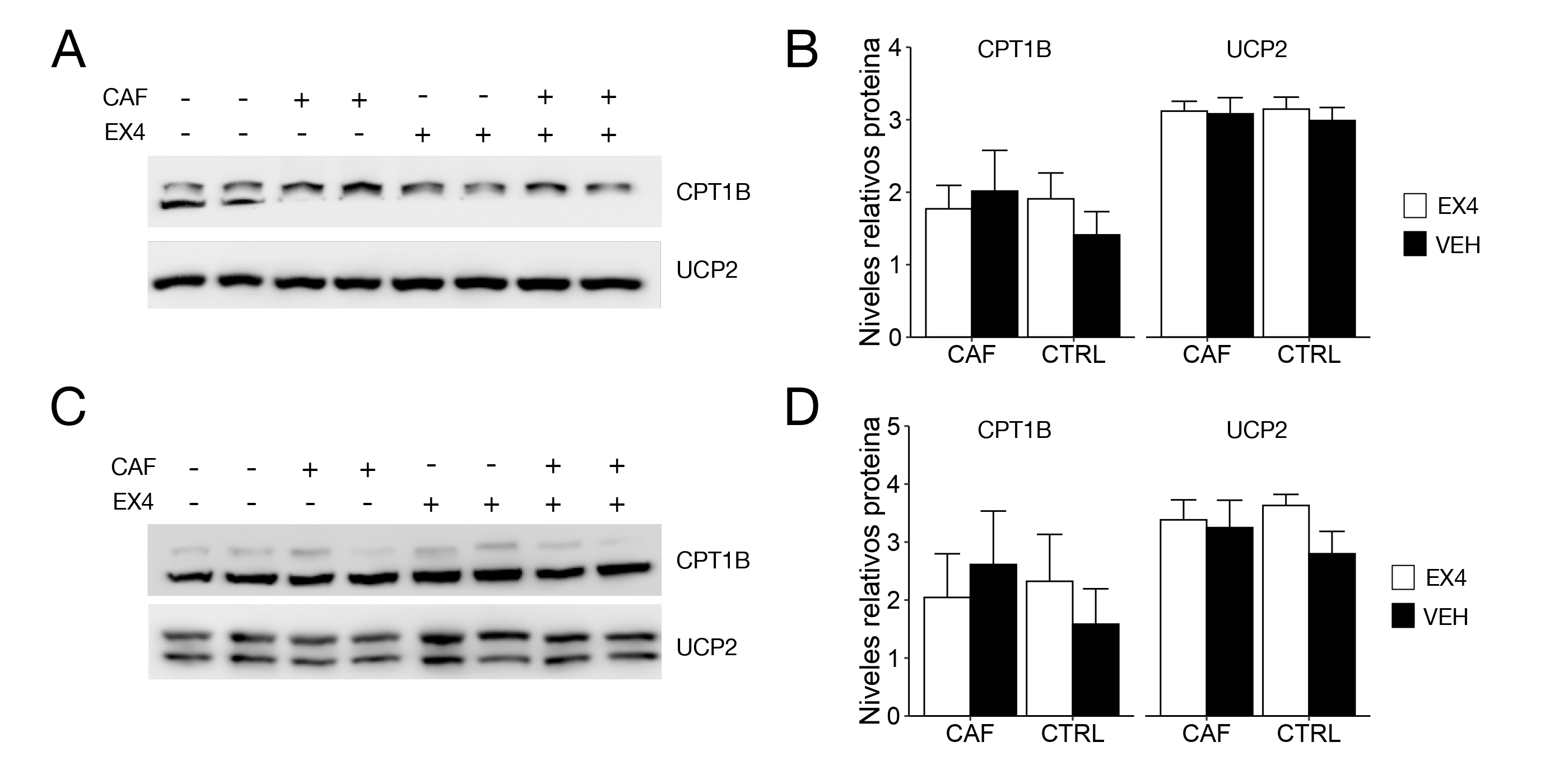 Figura 2: Detección de CPT1y UCP2 en músculo sóleo y gastrocnemio utilizando la técnica de Western Blot. N = Veh: inyección IP de salino; EX4: inyección IP
de Exendina-4 (10 ug/kg). Los datos se presentan con media ± SEM. A. Resultados de Western Blot para las proteínas CPT1B y UCP2 en tejido soleo. B. Niveles
relativos de proteínas UCP2 y CPT1 en tejido soleo, datos agrupados según dietas y tratamientos. C. Resultados de Western Blot para la proteína CPT1B y UCP2
Figura 2: Detección de CPT1y UCP2 en músculo sóleo y gastrocnemio utilizando la técnica de Western Blot. N = Veh: inyección IP de salino; EX4: inyección IP
de Exendina-4 (10 ug/kg). Los datos se presentan con media ± SEM. A. Resultados de Western Blot para las proteínas CPT1B y UCP2 en tejido soleo. B. Niveles
relativos de proteínas UCP2 y CPT1 en tejido soleo, datos agrupados según dietas y tratamientos. C. Resultados de Western Blot para la proteína CPT1B y UCP2
Droga e inyecciones intraperitoneales. EX4 (Tocris Bioscence,
USA) fue disuelta en suero fisiológico y guardada en alícuotas
de uso único a -20°C. Las inyecciones intraperitoneales (IP)
fueron administradas dentro de los últimos 90 minutos del ciclo
de luz, y alternando cada día el lado de la inyección. EX4 fue
administrada a una dosis de 10 ug/kg. El volumen de solución
inyectada fue 10 ul/g.
Western blot. El músculo fue lisado en buffer RIPA (Thermo Scientific, USA) suplementado con un cóctel de inhibidores de fosfatasas y proteasas (Thermo Scientific, USA) y con un homogeneizador de tejidos (Omni International, USA). Posteriormente, el homogeneizado fue centrifugado dos veces a 13.000 rpm a 4°C durante 10 minutos y se obtuvo el sobrenadante que fue guardado a -20°C. La cuantificación de proteínas fue realizada con un kit de BCA (Thermo Scientific, USA). Las proteínas se separaron en un gel de poliacrilamida al 10% en condiciones desnaturantes (SDS-PAGE) a 90 V por 30 minutos y luego cambiado a 70 V hasta el final. Luego, el gel fue transferido a una membrana de nitrocelulosa a 350 mA por 90 minutos. Luego, las membranas fueron teñidas con Rojo Ponceau por 5 minutos. Posteriormente las membranas se bloquearon en 3% leche descremada durante una hora. Las membranas se incubaron con el anticuerpo primario anti-CPT1b (Invitrogen, USA) en dilución de 1: 1.000 y con el anticuerpo primario anti-UCP2 en dilución 1:1000 (Sigma-Aldrich, USA) durante toda la noche a 4°C. Luego de los lavados, las membranas se incubaron con el anticuerpo secundario antirabbit IgG (Bio-rad, USA) en dilución de 1: 3.000 durante una hora a temperatura ambiente. El revelado de las membranas se realizó mediante un kit de quimioluminiscencia (Biological Industries, Israel). La normalización de las bandas se realizó mediante tinción de proteína total de la membrana con Rojo Ponceau.
Análisis estadístico
El análisis estadístico fue realizado con el programa R versión 4.03. Los datos se presentan con media ± error estándar de la media (SEM). Se utilizó el análisis Welch t-test de muestras independientes para comparar a los grupos CTRL y CAF (etapa dieta). Se utilizó un análisis de la varianza (ANOVA) de 2 vías (dieta x inyección) para analizar el efecto de la dieta CAF y el tratamiento con EX4 IP, seguido del análisis de comparación múltiple de Tukey cuando correspondiera (etapa dieta más IP). Un valor de p < 0,05 fue considerado estadísticamente significativo.
Resultados
La muestra final estuvo compuesta por 30 ratones (grupo CTRL n = 15; grupo CAF n = 15). No hubo diferencias entre el peso corporal de ambos grupos al inicio del experimento (CTRL = 24,44 ± 0,34 g; CAF = 23,65 ± 0,37 g; P = 0,13).
Durante la etapa de alimentación sin inyecciones, los ratones alimentados con dieta CAF acumularon una ingesta de calorías totales significativamente mayor que los ratones del grupo CTRL (p < 0,05; Figura 1A), lo que estuvo asociado a un mayor consumo de snacks comparado con chow en ratones alimentados con dieta CAF (Figura 1B). Los efectos observados en ingesta reflejan los cambios en peso corporal. Durante la etapa de alimentación sin inyecciones, los ratones alimentados con dieta CAF aumentaron significativamente su peso corporal en comparación a los ratones alimentados con dieta CTRL (p < 0,05; Figura 1C). Comparado con la administración de vehículo, la administración de EX4 no tuvo un efecto significativo sobre la ingesta total de calorías (Figura 1D), no afecto el consumo de snacks o chow (Figura 1E) o el peso corporal (Figura 1F) independiente si los ratones fueron alimentados con dieta CAF o control.
No hubo efectos de dieta o tratamiento con EX4 en la expresión de las proteínas CPT1 y UCP2 (Figuras 2A y 2B) del músculo soleo. Tampoco se observaron efectos de la alimentación con dieta CAF o la administración de EX4 en estas proteínas en el músculo gastronemio (Figuras 2C y 2D).
Discusión
Se utilizó la dieta CAF para modelar el acceso a comidas palatables presentes en un ambiente obesogénico humano. En los ratones alimentados con dieta CAF por 15 días se acumuló una mayor ingesta calórica comparado al grupo de dieta CTRL. Esto concuerda con diversos estudios previos que han reportado un aumento de la ingesta en roedores, machos y hembras, cuando son alimentados con dieta CAF20,21,22,23,24.
En nuestro estudio, quince días de exposición a dieta CAF causaron un aumento de peso corporal de aproximadamente un gramo. Si bien la gran mayoría de los estudios reportan un aumento de peso corporal con dieta CAF, un gramo de diferencia es bajo en comparación a otros estudios de dieta CAF por periodos más largos de tiempo 19, lo que sugiere que este aumento de peso corresponde a estadios tempranos del desarrollo de obesidad. A pesar de que EX4 administrado vía IP a una dosis similar a la usada acá puede reducir el peso corporal y la ingesta, en nuestro experimento no se observó un efecto en la ingesta calórica total ni en el cambio de peso corporal, lo que fue independientemente de la dieta administrada. Por otro lado, no observamos un efecto de la exposición a dieta CAF o de la administración repetida de EX4 en la expresión de las proteínas CPT1 y UCP2 en músculo soleo o gastronemio. Si bien es posible que aumentar la duración de la alimentación con dieta CAF, la dosis de EX4, o la duración del tratamiento con EX4 pudiera haber mostrado efectos de los tratamientos en peso corporal o expresión de CPT1 y UCP2, nuestros datos indican que la exposición temprana a dieta CAF y la administración de EX4 no alteran la expresión de proteínas relevantes para beta-oxidación y termogenésis.
Conclusión
La presencia de un ambiente obesogénico, como la dieta CAF, por un corto periodo induce un aumento en la ingesta calórica mediado por la preferencia por alimentos altos en calorías. La inyección IP de EX4, el cual es un agonista de GLP1R, a una dosis de 10 ug/kg durante 10 días no induce cambios en la ingesta calórica total ni en el cambio de peso corporal en ratones C57BL/6J, ni en la expresión de proteínas marcadoras de los procesos de beta-oxidación y de termogénesis (CPT1 y UCP2) independiente de la presencia de dieta CAF.
Agradecimientos: A la SOCHED y a ANID Anillo de Ciencia y Tecnología ACT210039.
Referencias
- Bluher M. Obesity: global epidemiology and pathogenesis. Nat Rev Endocrinol 2019; 15: 288-298.
- Haslam DW, James WP. Obesity. Lancet 2005; 366:1197-209.
- De Pergola G, Silvestris F. Obesity as a major risk factor for cancer. J Obes 2013; 2013: 291546.
- Wang YC, McPherson K, Marsh T, Gortmaker SL, Brown M. Health and economic burden of the projected obesity trends in the USA and the UK. Lancet 2011; 378: 815-825.
- Hruby A, Hu FB. The Epidemiology of Obesity: A Big Picture. Pharmacoeconomics 2015; 33: 673-689.
- Hill JO. Understanding and addressing the epidemic of obesity: an energy balance perspective. Endocr Rev 2006; 27: 750-761.
- Kirk SF, Penney TL, McHugh TL. Characterizing the obesogenic environment: the state of the evidence with directions for future research. Obes Rev 2010; 11: 109-117.
- Uribe-Cerda S, Morselli E, Perez-Leighton C. Updates on the neurobiology of food reward and their relation to the obesogenic environment. Curr Opin Endocrinol Diabetes Obes 2018; 25: 292-297.
- Johnson F, Wardle J. Variety, palatability, and obesity. Adv Nutr 2014; 5: 851-859.
- Trapp S, Brierley DI. Brain GLP-1 and the regulation of food intake: GLP-1 action in the brain and its implications for GLP-1 receptor agonists in obesity treatment. Br J Pharmacol 2022; 179: 557-570.
- McLean BA, Wong CK, Campbell JE, Hodson DJ, Trapp S, Drucker DJ. Revisiting the Complexity of GLP-1 Action from Sites of Synthesis to Receptor Activation. Endocr Rev 2021; 42: 101-132.
- Muller TD, et al. Glucagon-like peptide 1 (GLP-1). Mol Metab 2019; 30: 72-130.
- Kastin AJ, Akerstrom V. Entry of exendin-4 into brain is rapid but may be limited at high doses. Int J Obes Relat Metab Disord 2003; 27: 313-318.
- Yap MKK, Misuan N. Exendin-4 from Heloderma suspectum venom: From discovery to its latest application as type II diabetes combatant. Basic Clin Pharmacol Toxicol 2019; 124: 513-527.
- Talsania T, Anini Y, Siu S, Drucker DJ, Brubaker PL. Peripheral exendin-4 and peptide YY (3-36) synergistically reduce food intake through different mechanisms in mice. Endocrinology 2005; 146: 3748-3756.
- Mack CM, et al. Antiobesity action of peripheral exenatide (exendin-4) in rodents: effects on food intake, body weight, metabolic status and side-effect measures. Int J Obes (Lond) 2006; 30: 1332-1340.
- Choung JS, Lee YS, Jun HS. Exendin-4 increases oxygen consumption and thermogenic gene expression in muscle cells. J Mol Endocrinol 2017; 58: 79-90.
- Williams DL, et al. Maintenance on a high-fat diet impairs the anorexic response to glucagon-like-peptide-1 receptor activation. Physiol Behav 2011; 103: 557-564.
- Lalanza JF, Snoeren EMS. The cafeteria diet: A standardized protocol and its effects on behavior. Neurosci Biobehav Rev 2021; 122: 92-119.
- Mella R, Schmidt CB, Romagnoli PP, Teske JA, Perez-Leighton C. The Food Environment, Preference, and Experience Modulate the Effects of Exendin-4 on Food Intake and Reward. Obesity (Silver Spring) 2017; 25: 1844-1851.
- Lazzarino GP, Acutain MF, Canesini G, Andreoli MF, Ramos JG. Cafeteria diet induces progressive changes in hypothalamic mechanisms involved in food intake control at different feeding periods in female rats. Mol Cell Endocrinol 2019; 498: 110542.
- Lazzarino GP, et al. Cafeteria diet differentially alters the expression of feeding-related genes through DNA methylation mechanisms in individual hypothalamic nuclei. Mol Cell Endocrinol 2017; 450: 113-125.
- Sampey BP, et al. Cafeteria diet is a robust model of human metabolic syndrome with liver and adipose inflammation: comparison to high-fat diet. Obesity (Silver Spring) 2011; 19: 1109-1117.
- Giudetti AM, et al. Brief daily access to cafeteria-style diet impairs hepatic metabolism even in the absence of excessive body weight gain in rats. FASEB J 2020; 34: 9358-9371.