Cáncer Papilar de Tiroides a la luz de las evidencias actuales
Lorena Mosso G.
Papillary thyroid cancer. An update
Profesor Adjunto, Departamento de Endocrinología Facultad de Medicina Pontificia Universidad Católica de Chile.
Correspondencia a: Dra. Lorena Mosso. Departamento de Endocrinología, P. Universidad Católica de Chile, Lira 85, 5° piso, Santiago, Chile. e-mail: mosso@med.puc.cl
The new screening and diagnostic tools for thyroid cancer lead to a higher prevalence of the disease. This requires a new approach to the therapy of thyroid cancer, that usually has an indolent and slow evolution. The incidence of microcarcinoma is increasing since the vast majority of thyroid cancers are diagnosed during a screening ultrasonography. In papillary thyroid cancer there is a familial aggregation and close relatives of an index patient have three to six times more risk of having the disease. Exposure to radiation, older age and association with other thyroid diseases are external risk factors for the disease. Thyroid cancer is staged using TNM classification, that allows to establish prognosis. There is still discussion about the best treatment in early stages of the disease. Our working group always recommends total thyroidectomy and radioiodine ablation to obtain a better control and survival and reduce the risk of relapse.
Introducción
En los últimos años, la prevalencia del cáncer de tiroides ha aumentado en paralelo a la aparición de nuevas técnicas de tamizaje y al uso masivo de la ecografía como técnica de detección de nódulos tiroideos. Los nódulos tiroideos pueden encontrarse hasta en el 60% de la población dependiendo de la técnica utilizada. De estos, del 0,6 al 12% pueden ser malignos.
Numerosos estudios han alertado acerca de una “epidemia” de cáncer tiroideo. En los EEUU existieron 25.690 casos nuevos el año 2005 y 1.460 personas fallecieron por esta neoplasia1,2. En Francia, se ha comunicado un dramático aumento de la incidencia de cáncer tiroideo de 8,1% y 6,2% por año en mujeres y hombres, respectivamente3,4. Recientemente, un estudio poblacional en el estado de Minnesota de la Mayo Clinic, comunicó el aumento de la incidencia de cáncer tiroideo en mujeres desde 2,7 por 100.000 personas/año en el periodo 1935-1949 a 9,2 por 100.000 personas año en el periodo 1990-1999 y en hombres de 0,8 a 5 por 100.000 personas año en los mismos lapsos5. La American Cáncer Society señaló en 2003 un aumento de la incidencia de 5% por año en la última década. El incremento de prevalencia también ha sido comunicado por otros países como Canadá, Italia, Alemania, España y Australia entre otros (6-9). El aumento de la prevalencia de este cáncer obliga a analizar sus posibles causas; en este sentido, se han invocado factores como la exposición a las radiaciones ionizantes, la predisposición genética, la residencia en áreas de bocio endémico y la historia de patologías tiroideas previas, entre otros1,10. Pese a lo anterior, ninguno de estos factores por sí solo, salvo el caso puntual de Chernobyl11 puede explicar el aumento observado. Es necesario entonces, reconocer que la prevalencia de cáncer tiroideo puede estar siendo influenciada por las nuevas técnicas de pesquisa y diagnóstico12.
Recientemente, en la experiencia del Hospital Clínico de la Pontificia Universidad Católica comunicamos un dramático aumento del número de tiroidectomías por cáncer de tiroides, llegando a quintuplicarse en los últimos 10 años (Fig. 1)14. Por otra parte, se observó un aumento significativo del porcentaje de casos de “microcáncer” en relación a los cánceres de tamaño mayor a 1 cm, desde 17,6% en 1992 a 40% del total de los cánceres tiroideos en el año 2003.
El aumento de casos de cáncer operados, no necesariamente refleja aumento de la prevalencia de la enfermedad, ya que ello podría estar dado por situaciones como la precocidad del diagnóstico clínico, la mayor y mejor utilización de tecnologías diagnósticas (ecografía, punción tiroidea), estudio afinado de piezas quirúrgicas, o cambios en el comportamiento biológico del tumor.
En paralelo al aumento de pacientes, los clínicos hemos observado un mayor número de casos de comportamiento agresivo y de “microcáncer” tiroideo15.
El diagnóstico de cáncer tiroideo parte del hallazgo de un “nódulo”, cuya incidencia es variable, dependiendo de la población analizada y del método empleado. Un estudio más reciente, realizado en 100 voluntarios asintomáticos encontró que 67% tenía tiroides uni o multinodular. La prevalencia de nódulos fue mayor en las mujeres (72% vs 41%, p <0,02)16.
En autopsias de 821 sujetos con examen clínico normal, se encontró que 49,5% de las glándulas contenía uno o más nódulos y que 35,5% de éstos medían más de 2 cm. Otro estudio, también en pacientes supuestamente normales, mostró nódulos tiroideos en 32,5% de ellos17. No existen estudios observacionales prospectivos que permitan establecer el pronóstico de los nódulos tiroideos incidentales. Los estudios transversales de necropsias, anteriormente citados, muestran que la frecuencia de malignidad en nódulos tiroideos incidentales varía entre 0,4% y 12,5%18. La variabilidad de estas cifras se explica por las características de las muestras de las poblaciones seleccionadas. En un estudio de autopsias no seleccionadas, se encontró un nódulo maligno en 4,2% de los bocios nodulares16. La prevalencia de cáncer oculto de tiroides varía entre 3,9% y 4,1% en población de EE.UU., correspondiendo casi la totalidad de ellos al tipo de carcinoma papilar19,20. Es muy relevante hacer notar que pese al aumento de la incidencia del cáncer de tiroides, esto no se ha acompañado de aumento de la mortalidad por su causa21.
Dada la gran prevalencia de nódulos tiroideos en nuestra población, la simple extrapolación de cifras buscando la eventual prevalencia de cáncer de tiroides resulta muy elevada creando un gran desafío clínico respecto del manejo diagnóstico y terapéutico. Esta revisión está orientada al clínico y circunscrita al cáncer papilar de tiroides (CPT), dado que es el subtipo que representa más del 90% de los casos.
Etiología
El proceso de oncogénesis es concebido actualmente como una serie de hechos genéticos y ambientales que alteran el control de la proliferación y diferenciación celular. La mayor parte de los carcinomas tiroideos son monoclonales; estos tumores son, por lo tanto, la progenie de una célula que ha escapado a los mecanismos de división celular normal. En este contexto, podemos distinguir en el cáncer de tiroides mecanismos genéticos y otros factores:
Mecanismos genéticos
En los últimos años se ha acumulado una nutrida información referente a la expresión de la oncogénesis en el tejido tiroideo humano. Los “oncogenes”, que habitualmente permanecen “dormidos”, al activarse por traslocaciones cromosómicas, deleciones o mutaciones, inducen en células normales crecimiento descontrolado. Para producir una transformación maligna es necesaria la activación de más de un oncogen o la concomitancia de ella con la inactivación inactivación de un gen supresor del crecimiento.
El proto-oncogen c-myc es expresado en adenomas y carcinomas tiroideos y es estimulado por TSH; mutaciones y sobre-expresión del h-ras se han descrito en CPT, pero también en bocios multinodulares. La expresión tiroidea del oncogen ret/PTC1 puede inducir CPT. Mutaciones del BRAF también son frecuentes en CPT llegando a presentarse hasta en el 44% de los casos22; en especial, la mutación BRAF V600E se ha asociado con CPT de comportamiento agresivo y las mutaciones del Ras a subtipos de alta recurrencia y menor sobrevida23. Muchos otros genes, como el gen supresor de tumores TSG101, galectina 3, timosin beta 10, hTERT, CD97, VEGF, se han descrito en CPT, sin embargo, no está claro si son causa o consecuencia. Las mutaciones del receptor de TSH no se han relacionado con el proceso tumoral; más bien la pérdida de expresión de ese receptor se asocia a mal pronóstico. La deleción de genes supresores tumorales como p53y RB ha sido descrita en CPT24. Algunos de estos oncogenes y sus mutaciones se han utilizado como marcadores tumorales de diseminación y gravedad; por ejemplo, el PX8-PPAR gamma se asocia a multifocalidad e invasión vascular, las mutaciones del RAS se asocian a tamaño tumoral, invasión extratiroidea, diseminación y recurrencia tumoral, y la osteopontina a comportamiento agresivo. El problema está en que la sola expresión de estos marcadores no implica siempre malignidad y se han descrito en lesiones benignas.
Si bien el CPT no se considera un cáncer familiar, existe un riesgo 3 veces mayor de contraer la enfermedad en hijos de pacientes con CPT y 6 veces si el afectado es un hermano. Recientemente, nuestro grupo ha descrito las características de esta asociación familiar de CPT25. La inclusión de CPT dentro de síndromes de neoplasias familiares tales como el síndrome de Cowden (asociación con hamartomas y carcinomas de varios tejidos, principalmente mama), Gardner (pólipos intestinales, osteomas, fibromas, lipomas), Carney (nódulos adrenales, adenomas pituitarios, mixomas) u otros como el Turcot (tumores cerebrales y pólipos intestinales) es rara26.
Otros factores
Radiación externa
Winship describió en el 80% de 562 niños con cáncer de tiroides, el antecedente de radiación (500 a 2000 rads) en el área del tiroides, como tratamiento de la hiperplasia del timo o de adenoides. El periodo de latencia entre la exposición y el tumor podía ser de hasta 20 años27. Actualmente, sabemos que la incidencia es proporcional a la dosis. En pacientes sometidos a radiación por linfoma de Hodgkin se describió un 1,7% de CPT cuando la exposición era mayor a 500 rads, lo que equivale a 5,5 casos por millón de personas expuestas por rad al año28,30. Dosis menores de radiación externa no se han asociado a una mayor incidencia de cáncer. Luego del accidente de Chernobyl la incidencia de cáncer de tiroides en los niños expuestos subió de 1/106 a 100/106. La tiroides de los adultos mayores de 35 años es menos sensible a las radiaciones externas; las mujeres son más sensibles que los hombres, lo que se ha relacionado al rol que la autoinmunidad pudiera ejercer como factor predisponente para la formación de tumores31.
Desde el punto de vista clínico la recomendación vigente es que pacientes que han recibido más de 20 rads deben ser sometidos a estudio para descartar enfermedad tiroidea32.
La relación entre el uso de yodo radioactivo para tratar enfermedades benignas de la tiroides y la subsiguiente aparición de cáncer tiroideo ha motivado numerosos estudios y es un tema aún controversial. El yodo radioactivo induce cambios nucleares con aumento de la actividad mitótica y otras alteraciones histológicas33; por otra parte, se ha descrito aumento de la incidencia de nódulos tiroideos en pacientes tratados por enfermedad de Graves en su infancia, pero, no se ha demostrado mayor riesgo de cáncer en este grupo34,35.
Yodo
En áreas de bocio endémico por falta de yodo se ha encontrado aumento de cánceres tiroideos de tipo folicular, probablemente asociado a la estimulación crónica por TSH; sin embargo, con el aumento del aporte de yodo y también en áreas de exceso de consumo del halógeno se ha descrito aumento del CPT.
Asociación con otras patologías tiroideas:
Se ha descrito la co-existencia del CPT con enfermedad de Hashimoto en cerca de 2% a 4%, y que en el caso de cáncer papilar familiar pareciera ser más frecuente25. También, en enfermedad de Graves algunas series han descrito hasta 10% de cáncer36; sin embargo, muchos de estos datos provienen de series quirúrgicas o de pacientes seleccionados por presentar grandes bocios. Se ha descrito que el riesgo de cáncer en pacientes con enfermedad de Graves está aumentado en 2 a 3 veces, planteando la posibilidad de que los anticuerpos anti receptor de TSH posean un rol patogénico, lo que no ha sido probado37,38.
Edad, factores raciales y género
La incidencia mayor del CPT se da entre la tercera y cuarta década de la vida y su incidencia aumenta con la edad39. El CPT en los niños es particularmente agresivo con gran tendencia a generar metástasis, pero sin condicionar mayor mortalidad. Los datos epidemiológicos son escasos; en EE.UU., se observa mayor incidencia en mujeres de raza blanca versus las de raza negra (11,2 vs 5.8). Por otra parte, se ha comunicado mayor incidencia en mujeres filipinas y vietnamitas, sin poder establecerse si ello está asociado a la alimentación. En mujeres la incidencia global es mayor que la de los hombres con una relación 3 a 4 por 1; sin embargo, en la etapa pre-puberal y en la postmenopausia la incidencia es igual para ambos sexos, no habiéndose identificado algún factor que estuviese asociado a los estrógenos40.
Presentación clínica
Hasta hace algunos años podíamos decir que el CPT se presentaba con mayor frecuencia como un nódulo tiroideo palpable, que podía ser único o en el contexto de un bocio multinodular; en los últimos años hemos observado gran aumento de cáncer descubierto accidentalmente, debido al mayor uso y mejor calidad de la ecografía cervical como método complementario de examen14,41. En los dos últimos años, en nuestro centro se han intervenido más casos de “microcarcinoma” que de cánceres posibles de ser detectados al examen clínico, lo que, aunque no refleja la situación nacional, pone de relieve el problema del enfrentamiento clínico del “microcarcinoma”.
Los “microcarcinomas” papilares (< 1 cm.) no son palpables en su gran mayoría y su diagnóstico corresponde a un hallazgo ecográfico y certificado por la punción biopsia con apoyo de esta última. Otra forma de diagnóstico de estos cánceres pequeños, es como hallazgo post operatorio después de una tiroidectomía total por enfermedad benigna (5%-10%). Probablemente estos “microcanceres” corresponden a lo que antiguamente llamábamos “tumores ocultos”, descritos como hallazgos en trabajos de autopsias con cortes del total de la glándula tiroides a intervalos de 1 a 2 mm; se describió este tipo de tumor en hasta el 6% de la población adulta fallecida en EE.UU. por causas no tiroideas42,41. El problema del “microcarcinoma” es la controversia en torno a la imposibilidad de predecir con seguridad su comportamiento biológico; probablemente la gran mayoría pudiera permanecer con un curso indolente o estable, sin embargo, un subgrupo de ellos puede comportarse agresivamente; de este modo, mientras no contemos con elementos predictores de mayor seguridad es adecuado no considerarlos “ocultos” y actuar consecuentemente frente a un cáncer diagnosticado in vivo y no en autopsia44. En este sentido, es muy clarificador el estudio observacional de “microcarcinomas” de Ito que señaló que ya a los 6 meses del diagnóstico un porcentaje significativo de casos tenía diseminación ganglionar linfática y un diez por ciento aumentaba de tamaño lo que obligó a suspender el estudio44.
Otra forma de presentación del CPT es el hallazgo de una adenopatía cervical palpable (10%-15% de los casos). La presentación clínica por metástasis a distancia es rara, ocurriendo en no más del 1%-2% de los casos y compromete con mayor frecuencia el pulmón. En niños el nódulo cervical sigue siendo la forma más típica de presentación, no obstante la presencia de adenopatías es mucho más frecuente (50%-80%), pudiendo aparecer también en forma agresiva con enfermedad localmente avanzada y metástasis a distancia45.
Diagnóstico
De acuerdo a los consensos actuales frente a un nódulo tiroideo de más de 1 cm está indicada la punción con aguja fina (PAF); en nódulos menores de 1 cm, la presencia de criterios ecográficos de malignidad, como microcalcificaciones, margen nodular irregular, flujo vascular intralesional o hipoecogenicidad, también podría inclinar al clínico a solicitar la PAF. Sin embargo, por limitación técnica y falta de evidencia de largo plazo, es cuestionable puncionar nódulos menores de 5 mm siendo recomendable observar ecográficamente su evolución46,47.
La PAF es una excelente herramienta diagnóstica del CPT. Su rendimiento es altísimo con un 1% de falsos positivos y 2% de falsos negativos; debe tenerse presente que estos resultados son los obtenidos en centros de gran experiencia y número de pacientes47. Este procedimiento diagnóstico tiene muy baja morbilidad y puede repetirse durante el seguimiento de un nódulo con punción previa negativa, que haya cambiado, adquiriendo características sospechosas. Otro criterio para solicitar una PAF es el crecimiento significativo de un nódulo (>20% en un año).
Etapificación
El riesgo de recurrencia y mortalidad para el CPT se correlaciona con el tamaño del tumor primario, la invasión extratiroidea, las metástasis linfáticas y a distancia. Existen sistemas que han intentado establecer el riesgo de recurrencia y de mortalidad. Aunque existen muchas clasificaciones para el CPT, la mayor parte de los consensos actuales recomiendan utilizar el sistema TNM de la American Joint Committee on Cáncer48,49. El TNM, al igual que otras clasificaciones, considera factores propios de la diseminación del tumor y además el factor pronóstico más importante que es la edad del paciente al momento del diagnóstico. Con el sistema TNM se puede establecer un riesgo de mortalidad a 10 años de 1,7% para el estadio I, 15,8% para el estadio II, 30% para el estadio III y 60,9% para el estadio IV50,51.
En la mayoría de los casos, el examen físico y la ecografía son suficientes para determinar la extensión del tumor primario (T). Es recomendable que el examen físico incluya una laringoscopia indirecta para documentar la movilidad de las cuerdas vocales antes de la operación. En algunos casos, cuando la clínica sugiere infiltración hacia la tráquea o esófago, o hay parálisis de cuerda vocal la nasofibroscopía y resonancia nuclear magnética son necesarias. No se recomienda la tomografía axial computada (TAC), ya que para que sea útil se necesita medio de contraste yodado el cual interferirá con un eventual tratamiento posterior con yodo radioactivo.
Respecto de la evaluación de los linfonodos cervicales (N), hasta un 20% de los pacientes tienen adenopatías no palpables, que son detectadas por una ecografía cervical dirigida realizada por un radiólogo familiarizado con las vías de diseminación linfáticas del CPT52,53.
La evaluación de las metástasis a distancia (M) por CPT en general depende del compromiso local o regional. Así, en un paciente con un tumor localizado y sin metástasis linfáticas, como sucede en la gran mayoría, no se realiza preoperatoriamente en forma rutinaria la evaluación de metástasis a distancia. En cambio, en un paciente con enfermedad local y regional avanzada se puede considerar efectuar una TAC de tórax sin medio de contraste.
La evaluación final del compromiso a distancia, se realizará posterior al tratamiento con yodo radioactivo por el rastreo sistémico lo que hace posible visualizar la diseminación tumoral.
Tratamiento
Cirugía
El tipo de cirugía a realizar en CPT es aún motivo de controversia, especialmente en el estadio clínico I dado su buen pronóstico general con sobrevida a 15 años de 95% a 98% y a 30 años 95% las alternativas usadas en este grupo han sido: lobectomia, lobectomía más lobectomía contralateral intracapsular, tiroidectomía total o “casi” total y excisión radical54,57. Algunos grupos han tratado de definir pacientes de bajo y de alto riesgo para decidir el abordaje quirúrgico; sin embargo, la gran limitante de esta aproximación es que la categorización real del paciente no es posible hacerla al momento de la cirugía dado que el estadio TNM sólo puede ser asignado con seguridad al final del tratamiento contando con la información del rastreo corporal. Si quisiéramos estratificar a los pacientes antes de la cirugía, sería necesario incluir estudios avanzados de imágenes y en todos los pacientes, dado que en muchos casos la apreciación de “bajo riesgo” falla por multicentricidad, metástasis ganglionares ocultas y/o mayor agresividad de tumores pequeños49,55.
Mazzaferri en su revisión de 576 casos de CPT encontró que la tiroidectomía total reducía el riesgo de recurrencia, y esto posiblemente debiera estar relacionado con mortalidad a mayor plazo56. Los datos de largo plazo de la Clínica Mayo mostraron que esta aproximación no disminuía la mortalidad, pero sí la recurrencia local57. En la Universidad de Chicago un estudio con 269 pacientes tuvo conclusiones semejantes demostrando a 12 años que la aproximación con tiroidectomía casi total o total se asociaba a menor mortalidad y menor recurrencia en los estadios I y II58.
En nuestro centro preferimos la tiroidectomía total como aproximación general inicial al CPT. Las ventajas de esta conducta incluyen: 1) Disminución de la recurrencia local; 2) Posibilita el tratamiento con yodo radioactivo para el manejo de la enfermedad microscópica y 3) Permite el seguimiento con tiroglobulina. La desventaja es que la lobectomía mas istmectomía, tendría menor morbilidad. Sin embargo, en centros con gran numero de cirugías tiroideas como el nuestro (> 300 tiroidectomías por año) la morbilidad es muy baja, permitiendo realizar la tiroidectomía total en forma segura. Dado que la gran mayoría de los CPT son de tamaño menor a 4 cm y no invaden las estructuran vecinas, la tiroidectomía total es suficiente en aproximadamente el 80%-85% de los casos.
En estadios más avanzados puede requerirse la resección de músculos pretiroideos o resecciones parciales de traquea o esófago, incluyendo el nervio laríngeo recurrente.
Las complicaciones específicas de la tiroidectomía total son la lesión del nervio laríngeo recurrente (disfonía) y la hipocalcemia. La gran mayoría de estas complicaciones son leves y se recuperan dentro de los primeros 3 meses de la operación; sin embargo, en cerca del 1% de los casos puede haber una complicación potencialmente grave con hipoparatiroidismo definitivo de difícil manejo o lesión irreversible del nervio laríngeo recurrente. Otras complicaciones poco frecuentes son el hematoma cervical precoz (12 hrs.) que ocurre en el 1-2% de los casos y la infección de la herida operatoria (< 1%). A nivel regional, el CPT puede dar metástasis linfáticas con una frecuencia que varía entre un 50%-80% de los casos. La disección cervical se realiza en presencia de metástasis que, como se planteó previamente, debieran estar diagnosticadas con una ecografía cervical de alta resolución en manos expertas.
Con este criterio, el porcentaje de pacientes que requiere disección cervical al diagnóstico de un CPT es cercano al 20%-25%. En el resto la metástasis linfática microscópica es tratada con el yodo radioactivo. La recidiva linfática del CPT luego de una tiroidectomía total completada con yodo radioactivo es de aproximadamente 10% a 15%. En los pacientes con metástasis linfáticas clínicamente evidentes, ya sea al diagnóstico inicial o como recidiva, debe realizarse una disección cervical formal que incluye la resección, tanto de la enfermedad macroscópica, como del tejido linfático en riesgo de presentar metástasis (> 20%). Esto significa que la disección debe incluir los niveles II, III y IV (cadena yugular profunda), el nivel Vb (región supraclavicular) y nivel VI (región paratraqueal)59. A pesar de que el control regional de los linfonodos metastáticos no influye mayormente en la sobrevida de pacientes con CPT, realizar disecciones más limitadas tiene riesgo importante de recurrencia cervical. La re-exploración cervical por recurrencia ganglionar produce más morbilidad, particularmente en la región paratraqueal (nivel VI), por mayor riesgo de lesión de los nervios laríngeos recurrentes y de daño isquémico de las glándulas paratiroides61. Además, la cirugía por recurrencia implica un alto costo económico, psicológico y físico para los pacientes.
En estadios más avanzados, III y IV, se han agregado en los últimos años técnicas adyuvantes intraoperatorias como radiación, hipertermia endotraqueal y otras61.
Yodo Radioactivo
El uso del yodo radioactivo post quirúrgico en el manejo del CPT cumple diversas funciones:
Ablación: permite la erradicación del remanente de tejido tiroideo normal, asegurando la posibilidad de contar con la tiroglobulina (proteína específica) como marcador plasmático para el seguimiento tumoral.
Tratamiento: Irradiación localizada de enfermedad tumoral persistente conocida o desconocida al momento del tratamiento. La avidez por el yodo de las células tiroideas y de la mayor parte de las células tumorales permite su captación por ellas. Dada la gran prevalencia de enfermedad linfática microscópica, el yodo radioactivo con el rastreo sistémico posterior, permite descubrir la enfermedad oculta y tratarla a la vez. La dosis de yodo-131 se administra aproximadamente a las 4 semanas de la tiroidectomía, cuando los niveles de TSH sean > 30 u/dL para así maximizar la captación. A los siete días de la dosis se realiza el rastreo sistémico corporal total para localizar el remanente y visualizar posibles metástasis.
Seguimiento: Es posible usar el yodo radioactivo en dosis bajas (5 mCi) para estudios de seguimiento en pacientes de riesgo moderado o alto.
Supresión con Levotiroxina
Dado que potencialmente la TSH puede estimular el crecimiento de células tiroideas malignas que no fueron eliminadas por el yodo-131, el tratamiento con levotiroxina no solo debe reemplazar la función tiroidea, sino también suprimir la secreción de TSH hipofisiaria. Se busca una dosis que logre reducir la TSH a valores <0,1, sin que la T4 sobrepase el límite alto de la normalidad, lo que deja al paciente en un estado de hipertiroidismo subclínico.
Seguimiento
La acuciosidad, métodos a emplear y tiempo de seguimiento deberá establecerse de acuerdo al estadío clínico al diagnóstico (TNM) y el consiguiente riesgo de recurrencia de la enfermedad. Para el seguimiento se utiliza la medición de la tiroglobulina plasmática, proteína producida exclusivamente por células tiroideas benignas o malignas. En pacientes tratados con tiroidectomía total y yodo radioactivo su concentración debe ser indetectable. Por esto, el aumento de la tiroglobulina permitirá la detección bioquímica precoz de enfermedad, incluso en etapa subclínica. La sensibilidad de este marcador aumenta cuando se efectúa su medición estimulada por TSH endógena o exógena (TSH recombinante). El rastreo sistémico con dosis bajas (5 mCi) de yodo radioactivo se utiliza también para seguimiento ya que puede localizar el sitio de la recurrencia. Se debe tener presente que la captación de yodo por el tejido tumoral depende de la masa tumoral, de la dosis administrada y de la avidez por el yodo. Tumores pobremente diferenciados pueden perder la capacidad de captar el yodo. Dado que con mayor frecuencia las recurrencias del CPT ocurren en el cuello, la ecografía cervical constituye un complemento valioso para el seguimiento, permitiendo una localización mucho más exacta de linfonodos metastáticos que se pueden puncionar para certificar el diagnóstico.
A futuro
Necesitamos una mejor estratificación de riesgo que incluya criterios clínicos, histológicos y de biología molecular. Esto permitirá un enfrentamiento adecuado inicial y un seguimiento racional, sin caer en daño al paciente, sin excesos pero sin perder de vista los casos más graves. Necesitamos una cirugía mínimamente invasiva para los casos leves que deje el menor número de secuelas físicas y sicológicas y un adecuado registro de las complicaciones de corto y largo plazo, sólo estos datos permitirán una decisión caso a caso mejor informada. Necesitamos un criterio común para el manejo de pequeñas recurrencias o recidivas que cada día detectamos más precozmente con ecografía sin caer en exageraciones. Posiblemente se abrirán caminos para la radioablación o tratamientos locales focalizados. Necesitamos alternativas terapéuticas para los casos más agresivos. Algunos estudios se están realizando con los inhibidores de tirosina kinasa, inhibidores de EGFR y VEGF e inhibidores de BRAF.
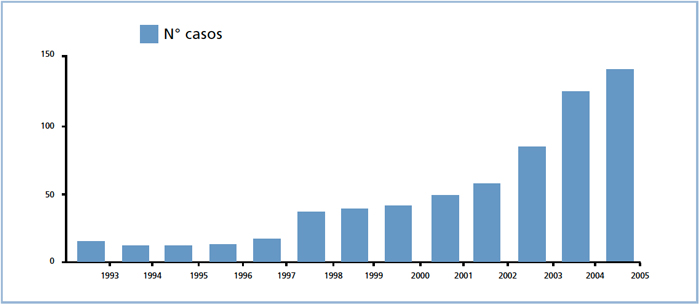
Figura 1. Número de casos de cáncer de tiroides operados, por año, en Hospital Clínico Universidad Católica de Chile.
Referencias
- Sherman, S.I., Thyroid carcinoma. Lancet, 2003. 361(9356): 501-511.
- Jemal, A., Tiwari RC, Murray T, Ghafoor A, et al. 2004 Cancer statistics, CA Cancer J Clin, 54(1): 8-29.
- Leenhardt, L.,Bernier MO, Boin-Pineau MH, Conte Devolx B, Maréchaud R, et al., 2004. Advances in diagnostic practices affect thyroid cancer incidence in France. Eur J Endocrinol. 150(2): 133-139.
- Leenhardt, L., P. Grosclaude, and L. Cherie-Challine, 2004. Increased incidence of thyroid carcinoma in france: a true epidemic or thyroid nodule management effects? Report from the French Thyroid Cancer Committee. Thyroid, 14(12): 1056-1060.
- Burke JP, Hay ID, Dignan F, Goellner JR, Achenbach SJ, Oberg AL, Melton LJ. 2005 3rdLong-term trends in thyroid carcinoma: a population- based study in Olmsted County, Minnesota, 1935-1999. Mayo Clin Proc. Jun; 80(6):753-758.
- Liu S, Semenciw R, Ugnat AM and Y Mao. 2001 Increasing thyroid cancer incidence in Canada, 1970-1996: time trends and age-period-cohort effects. Br J Cancer. Nov 2; 85(9):1335-1339.
- Farahati J, Geling M, Mader U, Mortl M, Luster M, Muller JG, Flentje M, Reiners C. 2004. Changing trends of incidence and prognosis of thyroid carcinoma in lower Franconia, Germany, from 1981-1995. Thyroid. Feb; 14(2):141-147.
- Colonna M, Grosclaude P, Remontet L, Schvartz C, Mace-Lesech J, Velten M, Guizard A, Tretarre B, Buemi AV, Arveux P, Esteve J. 2002. Incidence of thyroid cancer in adults recorded by French cancer registries (1978-1997). Eur J Cancer. Sep; 38(13):1762-1768.
- Zheng T, Holford TR, Chen Y, Ma JZ, Flannery J, Liu W, Russi M, Boyle P. 1996. Time trend and age-period-cohort effect on incidence of thyroid cancer in Connecticut, 1935-1992. Int J Cancer. Aug 7; 67(4):504-509.
- Hirabyshini Rn, Lindsay S. 1965. The relation the thyroid carcinoma and chronic thyroiditis. Surg Gynecol Obstet; 121: 243-252.
- Cardis E, Kesminiene A, Ivanov V, Malakhova I, Shibata Y, Khrouch V, Drozdovitch V, Maceika E, Zvonova I, Vlassov O, Bouville A, Goulko G, Hoshi M, Abrosimov A, Anoshko J, Astakhova L, Chekin S,Demidchik E, Galanti R, Ito M, Korobova E, Lushnikov E, Maksioutov M, Masyakin V, Nerovnia A, Parshin V, Parshkov E, Piliptsevich N, Pinchera A, Polyakov S, Shabeka N, Suonio E, Tenet V, Tsyb A, Yamashita S, Williams D. Risk of thyroid cancer after exposure to 131I in childhood. J Natl Cancer Inst. 2005 May 18;97(10):724-732.
- Leenhardt L, Bernier MO, Boin-Pineau MH, Conte Devolx B, Marechaud R,Niccoli-Sire P, Nocaudie M, Orgiazzi J, Schlumberger M, Wemeau JL,Cherie-Challine L, De Vathaire F. 2004. Advances in diagnostic practices affect thyroid cancer incidence in France Eur J Endocrinol. Feb; 150(2):133-139.
- Muzzo S, Ramirez I, Carvajal F, Biolley E, Leiva L. 2003. Iodine nutrition in school children of four areas of Chile during the year 2001. Rev Med Chil. Dec; 131(12):1391-1398.
- Fardella C, Jiménez M, González H, León A, Goñi I, Cruz F, Solar A, Torres J, Mosso L, González G, Rodríguez JA, Campusano C, López JM, Arteaga E. Características de presentación del microcarcinoma papilar del tiroides. Experiencia de 12 años de la Universidad Católica de ChileRev Med Chil. 2005 Nov;133(11):1305-1310.
- Mosso L, Jimenez M, Gonzalez H Solar A, Torres J, Fardella C. Thyroid microcarcinoma with an aggressive evolution. Rev. méd. Chile, Mar. 2005, vol.133(3), 323-326.
- Ezzat S, Sarti DA, Cain DR, Braunstein GD. 1994. Thyroid incidentalomas. Prevalence by palpation and ultrasonography. Arch Int Med; 154: 1838-1840.
- Mortensen JD, Woolner LB, Bennett WA. 1955. Gross and microscopic findings in clinically normal thyroid glands. J Clin Endocrinol; 15: 1270-1280.
- Carroll BA. 1982. Asymptomatic thyroid nodules: incidental sonografic detection. AJR; 138: 499-501.
- Sampson RJ, Woolner LB, Bahn RC, Kurland LT. 1974. Occult thyroid carcinoma in Olmsted County, Minnesota: prevalence at autopsy compared with that in Hiroshima and Nagasaki, Japan. Cancer; 34: 2072-2076.
- Nishiyama RH, Ludwig GK, Thompson NW. 1977. The prevalence of small papillary thyroid carcinoma in 100 consecutive necropsies in an American population. En: DeGroot LJ, ed. Radiation-Associated Thyroid Carcinoma. New York: Grune & Stratton; pp 123-135.
- DaviesL, Welch HG. 2006. Increasing incidence of thyroid cancer in the United States, 1973-2002. JAMA. 295(18):2164-2167.
- Lupi C, Giannini R, Ugolini C, Proietti A, Berti P, Minuto M, Materazzi G, Elisei R, Santoro M, Miccoli P, Basolo F. 2007. Association of BRAF V600E mutation with poor clinicopathological outcomes in 500 consecutive cases of papillary thyroid carcinoma. J Clin Endocrinol Metab.; 92(11):4085-4090.
- Costa AM, Herrero A, Fresno MF, Heymann J, Alvarez JA, Cameselle- Teijeiro J, García-Rostán G. 2008. BRAF mutation associated with other genetic events identifies a subset of aggressive papillary thyroid carcinoma. Clin Endocrinol (Oxf). 68(4):618-634.
- Fagin, J, Matsuo, K, Karmakar, A, Chen, D, Tang, S-H, Koeffler, H 1993. High prevalence of mutations of the p53 gene in poorly differentiated human thyroid carcinomas. J Clin Invest 91:179-184.
- Mosso L, Velasco S, Salazar I, Solar A, González H, Cardona B, Fardella C, González G, López JM, Rodríguez JA, Cruz F, Arteaga E. [Clinical features of 17 patients with familial non medullary thyroid carcinoma] Rev Med Chil. 2007 Jun;135(6):718-724.
- Malchoff, C D, Malchoff, D M 2002 The genetics of hereditary nonmedullary thyroid carcinoma. J Clin Endocrinol Metab 87:2455-2459.
- Winship, T, Rosvoll, R 1961. Thyroid carcinoma in childhood. Cancer 14:734-743.
- Maxon, H, Thomas, S, Saenger, E, Buncher, C, Kereiakes, J 1977. Ionizing irradiation and the induction of clinically significant disease in the human thyroid gland. Am J Med 63:967-978.
- Sadetzki S, Chetrit A, Lubina A, Stovall M, Novikov I. 2006. Risk of thyroid cancer after childhood exposure to ionizing radiation for tinea capitis. J Clin Endocrinol Metab. 91(12):4798-4804.
- Hancock, S, Cox, R, McDougall, I 1991. Thyroid diseases after treatment of Hodgkin’s disease. N Engl J Med 325:599-605.
- Pacini, F, Vorontsova, T, Demidchik, E, et al. 1997. Post-Chernobyl thyroid carcinoma in Belarus children and adolescents. Comparison with naturally occurring thyroid carcinoma in Italy and France. J Clin Endocrinol Metab 82:3563-3569.
- Spitalnik, P, Straus, F 1978. Patterns of human thyroid parenchymal reaction following low-dose childhood irradiation. Cancer 41:1098- 10105.
- Cantolino, S, Schmickel, R, Ball, M, Cisar, C 1966. Persistent chromosomal aberrations following radioiodine therapy for thyrotoxicosis. N Engl J Med 275:739-745.
- Holm, L-E, Dahlqvist, I, Israelsson, A, Lundell, G 1980. Malignant thyroid tumors after iodine 131-therapy. N Engl J Med 303:188-191.
- Holm, L-E, Eklund, G, Lundell, G 1980. Incidence of malignant thyroid tumors in humans after exposure to diagnostic doses of iodine-131. II. Estimation of thyroid gland size; thyroid radiation; and predicted versus observed number of malignant thyroid tumors. J Natl Cancer Inst 65:1221.
- Kim WB, Han SM, Kim TY, Nam-Goong IS, Gong G, Lee HK, Hong SJ, Shong YK. 2004. Ultrasonographic screening for detection of thyroid cancer in patients with Graves’ disease. Clin Endocrinol (Oxf). Jun;60(6):719-725.
- Filetti, S, Belfiore, A, Amir, S, et al. 1988. The role of thyroid-stimulating antibodies of Graves’ disease in differentiated thyroid cancer. N Engl J Med 318:753-759.
- Belfiore, A, Garofalo, M, Giuffrida, D, et al. 1990. Increased aggressiveness of thyroid cancer in patients with Graves’ disease. J Clin Endocrinol Metab 70(4):830-835.
- Woolner, L, Lemmon, M, Beahrs, O, Black, B, Keating, F J 1960. Occult papillary carcinoma of the thyroid. Study of 140 cases observed in a 30-year period. J Clin Endocrinol Metab 20:89-113.
- Halnan, K 1966. Influence of age and sex on incidence and prognosis of thyroid cancer. Cancer 19(11):1534-1536.
- Sampson, R, Woolner , L, Bahn, R, Kurland, L 1974. Occult thyroid carcinoma in Olmsted County; Minnesota. Prevalence at autopsy compared with that in Hiroshima and Nagasaki; Japan. Cancer 34(6):2072- 2076.
- Fukunaga, F, Yatani, R 1975. Geographic pathology of occult thyroid carcinomas. Cancer 36(3):1095-1099.
- Mosso L, Jimenez M, González H, Solar A, Torres J, Fardella C. 2005. Microcarcinoma tiroideo de evolución agresiva. Rev. Méd. Chile. 133: 232- 326.
- Ito Y, Uruno T, Nakano K, Takamura Y, Miya A, Kobayashi K, Yokozawa T, Matsuzuka F, Kuma S, Kuma K, Miyauchi A. An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid. Thyroid. 2003 Apr;13(4):381-7.
- González H., Godoy C., Martínez A., Mosso L. 2005. Tiroidectomía de emergencia en cáncer papilar de tiroides obstructivo en niña de 9 años. Libro resúmenes Reunión Anual Sociedad Chilena de Endocrinología.
- Gharib H., J.R. Goellner, and D.A. Johnson. 1993. Fine-needle aspiration cytology of the thyroid. A 12-year experience with 11,000 biopsies. Clin Lab Méd,. 13(3): p. 699-709.
- Campusano CM, Bello FM, González RE, Lam JE, Liberman CG, et al., 2004 [Consensus report on the diagnosis and management of non palpable thyroid nodules]. Rev Méd Chile, 132(10): p. 1249-55.
- Sobin LH, Wittekind Ch (eds) 2002 TNM Classification of Malignant Tumors, 6th Edition. Wiley-Liss, New York, pp 52-56.
- 49. Hay ID, Bergstralh EJ, Goellner JR, et al. 1993. Predicting outcome in papillary thyroid carcinoma. Surgery 114(6):1050-1057.
- Woolner, L, Lemmon, M, Beahrs, O, Black, B, Keating, F J 1960. Occult papillary carcinoma of the thyroid. Study of 140 cases observed in a 30-year period. J Clin Endocrinol Metab 20:89-113.
- . Passler, C; Prager, G; Scheuba, C; Niederle, BE; Kaserer, K; Zettinig, G; Niederle, B. Follicular 2003. Variant of papillary thyroid carcinoma: a long-term follow-up. Arch Surg 138; 1362-1366.
- Gonzalez H., Mosso L, Cruz F, O’Brien A, Goñi I. et al. 2006. Papillary thyroid carcinoma: impact of pre-operative staging of the neck. Annual Meeting of the Endocrine Society.
- Ito, Y.,Tomoda C, Uruno T, Takamura Y, Miya A,. et al. 2004, Preoperative ultrasonographic examination for lymph node metastasis: usefulness when designing lymph node dissection for papillary microcarcinoma of the thyroid. World J Surg, 28(5): p. 498-501.
- Samaan, N, Schultz, P, Hickey, R, et al. 1992. The results of various modalities of treatment of well differentiated thyroid carcinoma. A retrospective review of 1599 patients. J Clin Endocrinol Metab 75:714- 720
- Tollefson, H, DeCosse, J 1964. Papillary carcinoma of the thyroid. The case for radical neck dissection. Am J Surg 108:547-551.
- Mazzaferri, E, Young, R, Oertel, J, Kemmerer, W, Page, C 1977. Papillary thyroid carcinoma. The impact of therapy in 576 patients. Medicine 56:171
- Hay, I, Grant, C, Bergstralh, E, Thompson, G, van Heerden, J, Goellner, J 1998. Unilateral total lobectomy. Is it sufficient surgical treatment for patients with AMES low-risk papillary thyroid carcinoma? Surgery 124:958-966
- DeGroot LJ, Kaplan EL, Straus FH, Shukla MS. Does the method of management of papillary thyroid carcinoma make a difference in outcome? World J Surg. 1994 Jan-Feb;18(1):123-30.
- González H., Goñi I, León A, Camus M, Claure R et al. 2004. Papillary thyroid carcinoma: pattern of neck metastasis according to the AHNS neck dissection classification update. Annual meeting of the American Head and Neck Society.
- González H., Goñi I, León A, Camus M, Claure R, et al. 2004. Paratracheal recurrence of papillary thyroid carcinoma: increased morbidity is associated to extracapsular spread. Annual meeting of the American Head and Neck Society of thyroid cancer in children? Ann Surg 165:745.
- Wolf, G, Kohek, P, Geyer, E, et al. 1996. Intraoperative radiation therapy; endotracheal hyperthermia and IR-192-brachytherapy in patients with advanced thyroid cancer. Acta Medica Austriaca 23:76-79.