Frecuencia de anticuerpos anti-ZnT8 en diabéticos tipo 1
Francisca Salas P.1, Ethel Codner D.2, Alejandra Ávila A.2, Elena Carrasco P.1 y Francisco Pérez B.1
Frequency of antibodies against zinc transporter gene (ZnT8) among patients with type 1 diabetes mellitus
1Laboratorio de Genómica Nutricional. Departamento de Nutrición. Facultad de Medicina. Universidad de Chile. Santiago, Chile.
2Instituto de Investigaciones Materno
Infantil (IDIMI). Hospital San Borja Arriarán. Facultad de Medicina. Universidad de
Chile.
Correspondencia:
Dr. Francisco Pérez-Bravo
Laboratorio de Genómica Nutricional,
Departamento de Nutrición.
Facultad de Medicina.
Universidad de Chile.
Av. Independencia 1027, 3º Piso,
Santiago, Chile.
Teléfono: 56 2 978 62 42
E-mail: fperez@med.uchile.cl
Recibido: 01 de marzo de 2012
Aceptado: 18 de marzo de 2012
Background: Zinc transporter gene (ZnT8) in pancreatic β cells plays an essential role in insulin secretion. Auto-antibodies against this transporter are present in in 60 to 80% of recently diagnosed type 1 diabetic patients. Aim: To determine the frequency of antibodies against ZnT8, glutamic acid decarboxylase (GAD) and islet cell autoantibodies (IA-2) in patients with type 1 diabetes mellitus. Material and Methods: Sera from 68 individuals with type 1 diabetes mellitus and 122 control subjects, were analyzed. Antibodies against GAD65, IA-2 and ZnT8 were measured using a semi quantitative ELISA technique. Results: Positive antibodies against GAD65, IA-2 and ZnT8 were found in 42 (62%), 32 (47%) and 46 (68%) diabetic patients. Nineteen diabetic patients had all antibodies present. No differences in the distribution of antibodies according to age, were observed. The frequency of antibodies against ZnT8 was higher among subjects in whom diabetes was diagnosed at an older age. Anti-GAD are the antibodies that last longer during the course of the disease. Conclusions: Anti-ZnT8 antibodies are common among patients with type 1 diabetes mellitus and their determination improves the sensitivity of autoimmunity detection in type 1 diabetes mellitus.
Key words: Type 1 diabetes, autoantibodies, GAD, IA-2, ZnT8.
En la patogénesis de la Diabetes tipo 1 (DM1) se puede diferenciar tres fases importantes: la fase I, caracterizada por la presencia de infiltrados mononucleares en los islotes pancreáticos; la Fase II denominada comunmente pre-diabetes, en donde se observa la presencia de diversos anticuerpos dirigidos contra las células del islote pancreático y que son detectables en alrededor del 70 al 90% de los pacientes en el momento del diagnóstico y que corresponde a las primeras señales del comienzo del proceso autoinmune y la Fase III, en donde se activan una serie de células y moléculas que son las encargadas del proceso autoinmune final y que controlan el mecanismo que produce la injuria de la célula beta pancreática1. El inicio del proceso autoinmune está marcado por la presentación de un péptido diabetogénico al sistema inmune el cual puede tener diversos orígenes y de los cuales se pueden mencionar algunos antígenos virales, antígenos dietarios o la propia presentación de autoantígenos. Este fenómeno produce una respuesta inmunológica que se en su fase activa genera una pérdida general en la tolerancia hacia el péptido diabetogénico. Los mecanismos involucrados en la tolerancia inmunológica corresponden a los eventos de anergia clonal, deleción clonal y supresión clonal, la pérdida de la tolerancia puede involucrar fenómenos de mimetismos moleculares antigénicos como es el caso de algunos virus (citomegalovirus, coxsackie B4), ciertos antígenos dietarios (gluten, caseína y albúmina bovina) o a la producción de antígenos modificados o por la liberación de antígenos que se encontraban enmascarados y que tendrían la capacidad de generar una respuesta autoinmune2.
Los principales autoantígenos identificados en la DM1 corresponden a ICA (islet cell antibodies), GAD (ácido glutámico descarboxilasa), IA-2 (proteína tirosina fosfatasa), e insulina (IAA). Los estudios realizados en familiares de primer grado de pacientes con DM1 indican que la determinación aislada de los anticuerpos ICA no resulta útil para el pronóstico de la enfermedad, a pesar de ser el autoanticuerpo utilizado como "gold" estándar3.
En la actualidad se sabe que alrededor del 90% de los pacientes con diagnóstico reciente de DM1 poseen autoanticuerpos positivos para al menos uno de los cuatro antígenos antes mencionados. A pesar de que existe variabilidad en el patrón de la inmunidad, los anti-IAA son más frecuentes en niños pequeños, en cambio los autoanticuerpos para IA-2 a menudo disminuyen después del diagnóstico y los anti-GAD tienden a persistir mayormente en el tiempo4.
Recientemente ha sido descrito el transportador de zinc (ZnT8) en las células pancreáticas5,6. Su sobreexpresión en cultivos de islotes de células conduce a la secreción de insulina. También se ha descrito la presencia de autoanticuerpos anti-ZnT8 en el 60-80% de los DM1 de reciente diagnóstico y los estudios preliminares, parecen indicar que son buenos predictores de la enfermedad7,8. En contraste con otros anticuerpos, los anti-ZnT8 no parecen estar asociados con el antígeno leucocitario humano (HLA) de clase II y por lo tanto, podrían ser de especial valor en las personas con bajo riesgo genético en aquellos donde el perfil de otros autoanticuerpos es negativo9.
Hasta la fecha, la prevalencia de ZnT8 en pacientes chile-nos con DM1 no se ha informado y por lo tanto, nos pareció interesante evaluar la frecuencia este anticuerpo en pacientes con DM1 y compararlo con los clásicos marcadores de autoinmunidad como IA-2 y GAD65.
Sujetos y Método
El estudio incluyó un total de 68 pacientes con DM1 de edad promedio 12,3 ± 5,14 años, con una edad de debut de 7,91 ± 4,53 años y una antigüedad de la enfermedad de 4,37 ± 0,62 años. El grupo control estuvo compuesto por 122 sujetos sanos cuya edad promedio fue de 20,4 ± 6,2 años, todos sin antecedentes familiares de diabetes tipo 1 y otras enfermedades autoinmunes. Se tabularon mediciones antropométricas de peso, talla e índice de masa corporal. El protocolo de esta investigación fue aprobado por el Comité de Ética del Hospital San Borja Arriarán y todos los pacientes y controles entregaron su consentimiento por escrito.
Análisis serológico de anticuerpos
Los anticuerpos anti-GAD65, anti-IA2 y anti-ZnT8 fueron determinados mediante inmunoensayo enzimático (ELISA) con el uso de kits comerciales (Medizym® Diagnostic, Berlin, Alemania). La detección de anticuerpos se llevó a cabo de manera semi-cuantitativa tomando como referencia de positividad el valor de 5 UI/mL para GAD65 y 10 UI/mL para IA2 y ZnT8. Aquellas muestras con un título mayor o igual a dicho valor fueron consideradas muestras positivas. Se obtuvo una sensibilidad y especificidad del 92,3%, 98,6% para anti-GAD65,85% y 98% para anti-IA-2 y 94% y 98,2% para anti-ZnT8. Todas las muestras fueron tratadas en duplicado y los valores detectados se encontraron dentro de los rangos esperados para un ELISA de acuerdo al programa DASP, Diabetes Antibody Standardization Program10.
Análisis estadístico
Los datos se analizaron como porcentajes. Se utilizaron test de comparaciones para analizar las diferentes frecuencias de anticuerpos en el grupo con DM1. Se consideró un p < 0,05 para signifi cancia estadística.
Resultados
La Figura 1 muestra una gráfica de Venn para ejemplificar la distribución del conjunto de anticuerpos analizados en los 68 pacientes con DM1. Se puede apreciar que un 27,9% de todos los casos presentaron los tres anticuerpos positivos (n = 19). La presencia de un único anticuerpo positivo entre los pacientes fue más frecuente de encontrar para en anticuerpo anti-ZnT8 el cual fue detectado en forma aislada en 17 casos (25%). Sólo un paciente con DM1 resultó negativo para el panel de tres anticuerpos. Los 122 individuos controles fueron negativos para GAD, IA-2 y ZnT8.
No se observan diferencias importantes de acuerdo a los rangos de edad de los pacientes con DM1. La positividad de los anticuerpos es muy similar para los tres auto-anticuerpos entre los 0 y 15 años. Existe un leve aumento de anticuerpos anti-ZnT8 para los pacientes con DM1 mayores de 16 años (Tabla 1).
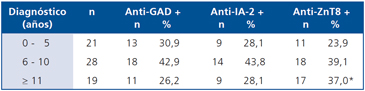
Al comparar la distribución de los auto-anticuerpos según la edad de diagnóstico se observa una cierta homogeneidad entre los anticuerpos anti-GAD y anti-IA-2 para los tres rangos de edad al diagnóstico utilizados. Sin embargo, el anticuerpo anti-ZnT8 presenta una mayor frecuencia entre los pacientes con DM1 que han sido diagnosticados por sobre los 11 años de edad (p < 0,05) (Tabla 2).
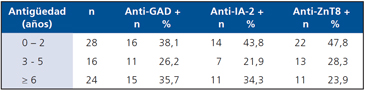
Finalmente, la más alta frecuencia de anticuerpos positivos se observó para anti-ZnT8 en pacientes con antigüedad de la enfermedad inferior a los dos años. El auto-anticuerpo anti-GAD es el que perdura por más tiempo en el suero de los pacientes con DM1, aún después de más de seis años de antigüedad de la enfermedad (Tabla 3).
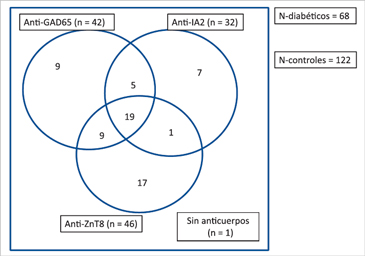
Tabla 1. Distribución de auto-anticuerpos en pacientes con DM1 de acuerdo a grupos de edad
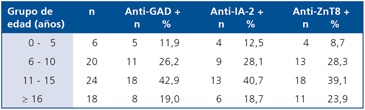
Tabla 2. Distribución de auto-anticuerpos en pacientes con DM1 de acuerdo a la edad de diagnóstico de la enfermedad
 *p < 0,05 anti-ZnT8 en grupo ≥ 1 años.
*p < 0,05 anti-ZnT8 en grupo ≥ 1 años.
Tabla 3. Distribución de auto-anticuerpos en pacientes con DM1 de acuerdo a la antigüedad de la diabetes
Discusión
Desde hace más de 15 años, tradicionalmente se han utilizado cuatro autoanticuerpos para describir el fenómeno autoinmune asociado a la DM1, entre los que se encuentran ICA, IAA, GAD e IA-2. Todos estos autoanticuerpos se encuentran con frecuencias variables en distintas poblaciones y es usual detectarlos en la presentación clásica de la DM1 en niños y adolescentes11,12. Hace cinco años se describió un nuevo autoanticuerpo dirigido contra el transportador del catión zinc dentro las células de los islotes, denominado ZnT8 y el cual fue detectado con mucha frecuencia en DM1 de diagnóstico reciente6,13.
Nuestros datos en esta pequeña serie de casos con DM1, demuestran que el anticuerpo anti-ZnT8 es más frecuente que los clásicos IA-2 y GAD. Además, anti-ZnT8 a en forma similar a lo que han informado otros estudios parece declinar más rápidamente con los años14 y parece presentar una mayor frecuencia a edades más avanzadas del diagnóstico15,16. En forma aislada, como lo muestra la distribución de Venn (Figura 1) el anti-ZnT8 fue mucho más frecuente de encontrar que GAD e IA-2 respectivamente.
La utilidad de estos cinco anticuerpos combinados ha permitido identificar a un alto número de niños con DM1 al momento del diagnóstico17. Sin embargo, es frecuente encontrar niños y adolescentes negativos para esta presentación de anticuerpos (diabetes fulminante) o personas adultas donde la presentación clínica de la enfermedad puede ser más leve o puede confundirse con una diabetes tipo 2 (DM2). En este tipo de casos, disponer de un mayor número de marcadores serológicos podría ser de gran utilidad. Al respecto, se sabe con certeza que los autoanticuerpos IA-2 e IAA son de muy baja frecuencia en la diabetes gestacional y en la de tipo LADA18-20.
La determinación de un nuevo autoanticuerpo como el anti-ZnT8 permite aumentar la estrategia de combinaciones para identificar subtipos de diabetes. Lampasona y cols21, encontraron un 18,6% de anti-ZnT8 en pacientes de tipo LADA y un 1,7% en pacientes con DM2. Es por esta razón que los autores sugieren que los anticuerpos contra ZnT8 son bastante específicos para DM1, donde la frecuencia es muy alta y que al parecer podrían ser marcadores útiles de autoinmunidad para distinguir subgrupos de pacientes con DM2 y diabetes LADA que anteriormente eran negativos para otros marcadores.
En los últimos dos años ha surgido importante evidencia respecto a la utilidad de los anticuerpos anti-ZnT8 en la DM122. Recientemente, se ha demostrado que este nuevo marcador se distribuye en forma distinta entre los niños con DM1 y los adultos diagnosticados con la enfermedad, esto al menos en población japonesa15. Esto al parecer es coincidente con el estudio de Vaziri-Sani y cols14, quienes encuentran que el autoanticuerpo anti-ZnT8 declina a los cuatro años siguientes después del diagnóstico de DM1 y que por lo tan-to, sería de especial utilidad en diabéticos jóvenes. También, muy recientemente se ha analizado el papel de este nuevo autoanticuerpo para la pesquisa de nuevos casos de DM1 mostrando utilidad en los análisis de progresión y desarrollo futuro de DM110.
El fenómeno de autoinmunidad que caracteriza a la mayoría de los casos nuevos con DM1 ha encontrado una fuerte evidencia en una reciente publicación de Dang y cols23, donde, además de la alta frecuencia descrita del anticuerpo anti-ZnT8 en DM16, se describe la asociación de este transportador con el proceso autoinmune mediado por células T.
Estudios realizados en población China con DM1 demuestran que este nuevo autoanticuerpo mejora la predicción de la enfermedad, proporcionando evidencia de autoinmunidad y estableciendo una medida más sensible de este fenómeno cuando se combinan con GAD e IA-224,25.
En estudios muy recientes con diseño familiar, han demostrado que el anticuerpo anti-ZnT8 presta gran utilidad sobre todo en individuos con bajo riesgo genético de DM1 y en sujetos mayores siendo útil en ampliar el número de combinaciones disponibles para establecer riesgo de DM19.
Finalmente, la determinación del anticuerpo contra ZnT8 realizada en este estudio ha demostrado que su frecuencia es alta en pacientes con DM1 y que este puede ser considerado como un marcador adicional para utilizarse en la pesquisa y progresión de la enfermedad. La determinación de anticuerpos anti- ZnT8 junto con otros marcadores clásicos como GAD e IA-2 debiera aumentar la sensibilidad de detección de autoinmunidad en la DM1.
Agradecimientos
Este trabajo ha sido financiado parcialmente por el proyecto FONDECYT 1100075 (Dr. Francisco Pérez-Bravo). Agradecemos a todas las familias participantes en esta investigación y al apoyo del Hospital San Borja Arriarán.
Referencias bibliográficas
- Van Belle TL, Coppieters KT, von Herrath MG. 2011. Type 1 diabetes: etiology, immunology, and therapeutic strategies. Physiol Rev 91: 79-118.
- Pearce SH, Merriman TR. 2006. Genetic progress towards the molecular basis of autoimmunity. Trends Mol Med. 12: 90-98.
- Taplin CE, Barker JM. 2008. Autoantibodies in type 1 diabetes. Autoimmunity 41: 11-18.
- Zhang L, Eisenbarth GS. 2011. Prediction and prevention of type 1 diabetes mellitus. J Diabetes 3: 48-57.
- Wenzlau JM, Hutton JC, Davidson HW. 2008. New antigenic targets in type 1 diabetes. Curr Opin Endocrinol Diabetes Obes 15: 315-320.
- Wenzlau JM, Juhl K, Yu L, Mova O, Sarkar SA, Gottlieb P, et al. 2007. The cation efflux transporter ZnT8 (Slc30A8) is a major autoantigen in human type 1 diabetes. Proc Natl Acad Sci U S A. 104: 17040-17045.
- Lampasona V, Buzzetti R, Bazzigaluppi E, Petrone A, Capizzi M, Tiberti C, et al. 2008. Zinc transporter 8 antibodies complement GAD and IA-2 antibodies in the identification of adult-onset autoimmune diabetes. Diabetologia 51 (Suppl 1): S237.
- Kawasaki E, Uga M, Nakamura K, Satoh T, Fujishima K, Ozaki M, et al. 2008. Association between anti-ZnT8 autoantibody specificities and SLC30A8 Arg325Trp variant in Japanese patients with type 1 diabetes. Diabetologia 51: 2299-2302.
- Long AE, Gooneratne T, Rokni S, Williams AJ, Bingley PJ. 2012. The Role of autoantibodies to Zinc Transporter 8 in Prediction of Type 1 Diabetes in Relatives: Lessons from the European Nicotinamide Diabetes Intervention Trial (ENDIT) Cohort. J Clin Endocrinol Metab 97: 632-637.
- De Grijse J, Asanghanwa M, Nouthe B, Albrecher N, Goubert P, Vermeulen I, et al. 2010. Predictive power of screening for antibodies against insulinoma-associated protein 2 beta (IA-2beta) and zinc transporter-8 to select first-degree relatives of type 1 diabetic patients with risk of rapid progression to clinical onset of the disease: implications for prevention trials. Diabetologia 29: 517-524.
- Winter WE, Harris N, Schatz D. 2002. Immunological markers in the diagnosis and prediction of autoimmune type 1a diabetes. Clin Diabetes 20: 183-191.
- Palmer JP, Hampe CS, Chiu H, Goel A, Brooks-Worrell BM. 2005. Is latent autoimmune diabetes in adults distinct from type 1diabetes or just type 1 diabetes at an older age? Diabetes 54: S62-S67.
- Wenzlau JM, Frisch LM, Gardner TJ, Sarkar S, Hutton JC, Davidson HW. 2009. Novel antigens in type 1 diabetes: the importance of ZnT8. Curr Diab Rep 9: 105-112.
- Vaziri-Sani F, Oak S, Radtke J, Lermmark A, Lynch K, Agardh CD, et al. 2010. ZnT8 autoantibody titers in type 1 diabetes patients decline rapidly after clinical onset. Autoimmunity 43: 598-606.
- Kawasaki E, Nakamura K, Kuriya G, Satho T, Kuhuara H, Kobayashi M, et al. 2010. Autoantibodies to insulin, insulinoma•associated antigen-2, and zinc transporter 8 improve the prediction of early insulin requirement in adult-onset autoimmune diabetes. J Clin Endocrin Metab 95: 707-713.
- Kawasaki E, Nakamura K, Kuriya G, Satoh T, Kobayashi M, Kuwahara H, et al. 2011. Zinc transporter 8 autoantibodies in fulminant, acute-onset, and slow-onset patients with type 1 diabetes. Diabetes Metab Res Rev 27: 895-898.
- Krischer J, Cuthbertson DD, Yu L, Orban T, Maclare N, Jackson R, et al. 2003. Screening strategies for the identification of multiple antibody-positive relatives of individuals with type 1 diabetes. J Clin Endocrinol Metab 88: 103-108.
- Fuchtenbush M, Ferber K, Standl E, Ziegler AG. 1997. Prediction of type 1 diabetes postpartum in patients with gestational diabetes mellitus by combined islet cell autoantibody screening: a prospective multicenter study. Diabetes 46: 1459-1467.
- Falorni A. 2003. Immunologic and genetic aspects of latent autoimmune diabetes in the adult. Minerva Endocrinol 28: 297-312.
- Falorni A, Buozzetti A. 2005. Diabetes-related antibodies in adult diabetic patients. Best Pract Res Clin Endocrinol Metab 19: 119-133.
- Lampasona V, Petrone A, Tiberti C, Capizzi M, Spoletini M, di Pietro S, et al. 2010. Zinc transporter 8 antibodies complement GAD and IA-2 antibodies in the identification and characterization of adult-onset autoimmune diabetes: Non Insulin Requiring Autoimmune Diabetes (NIRAD) 4. Non Insulin Requiring Autoimmune Diabetes (NIRAD) Study Group. Diabetes Care 33: 104-108.
- Lampasona V, Schlosser M, Mueller PW, Williams AJ, Wenzlau JM, Hutton JC, Achenbach P. 2011. Diabetes antibody standardization program: first proficiency evaluation of assays for autoantibodies to zinc transporter 8. Clin Chem 57: 1693-1702.
- Dang M, Rockell J, Wagner R, Wenzlau JM, Yu L, Hutton JC, et al. 2011. Human type 1 diabetes is associated with T cell autoimmunity to zinc transporter 8. J Immunol 186: 6056-6063.
- Yang L, Luo S, Huang G, Peng J, Li X, Yan X, et al. 2010. The diagnostic value of zinc transporter 8 autoantibody (ZnT8A) for type 1 diabetes in Chinese. Diabetes Metab Res Rev. 26: 579-584.
- Kawasaki E, Nakamura K, Kuriya G, Satoh T, Kobayashi M, Kuwahara H, et al. 2011. Differences in the humoral autoreactivity to zinc transporter 8 between childhood and adult-onset type 1 diabetes in Japanese patients. Clin Immunol 138: 146-153.