Struma ovarii con un foco de micro-carcinoma papilar variante folicular de tiroides:
reporte de caso y revisión de la literatura
Johnayro Gutiérrez R.1, Carlos Esteban Builes M.2 y Alejandro Vélez H.3
Struma ovarii with follicular variant of papillary
thyroid carcinoma. Report of one case
1Médico Internista y Endocrinólogo, Hospital Pablo Tobón Uribe, Docente de Endocrinología y Metabolismo Universidad de Antioquia.
2Médico Internista, Residente de segundo año de Endocrinología, Universidad de Antioquia, Hospital Pablo Tobón Uribe.
3Médico Patólogo, Hospital Pablo Tobón Uribe.
Correspondencia:
Johnayro Gutiérrez R.
Médico Internista y Endocrinólogo, Universidad de Antioquia. Endocrinólogo Hospital Pablo Tobón Uribe. Universidad de Antioquia. Medellín, Colombia.
Teléfono: 4459888. Fax: 2635397.
E-mail: johnayro@hotmail.com
Recibido: 13 de mayo de 2013
Aceptado: 24 de mayo de 2013
Struma ovarii is an ovarian teratoma composed mainly of thyroid tissue, which can occasionally develop a malignant thyroid tumor. We report a 61 years old female consulting for a metrorrhagia in whom an ovarian cyst was discovered. The patient was subjected to a hysterectomy and bilateral oophorectomy. The pathological study of the surgical piece revealed a focus of papillary thyroid carcinoma, follicular variety in a right struma ovarii. Three months after surgery, an abdominal CAT scan did not show any abnormality.
Key words: Struma ovarii, papillary carcinoma, follicular carcinoma.
Una paciente de 61 años consultó al servicio de ginecología por un cuadro de hemorragia uterina anormal, para este momento la paciente no refería ningún otro síntoma. Dentro de los estudios solicitados la ecografía transvaginal reportó una imagen quística de 3 cm con múltiples septos y papilas en su interior en el ovario derecho que posteriormente fue caracterizado mediante una tomografía de abdomen y pelvis (Figura 1). Cuatro meses después de haber consultado, y con la sospecha de un carcinoma de ovario fue llevada a cirugía donde se realizó resección de ambos ovarios y útero y no se encontró compromiso macroscópico más allá del ovario; no presentó complicaciones asociadas al procedimiento. En la evaluación de patología describen en el ovario derecho un foco de 0,5 x 0,6 cm de un carcinoma papilar variedad folicular de tiroides en un struma ovarii (Figura 2).
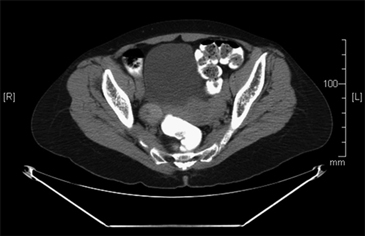 Figura 1. Tomografía de abdomen y pelvis. Ovario derecho de 29 x 30 cm ligeramente aumentado de tamaño de aspecto heterogéneo.
Figura 1. Tomografía de abdomen y pelvis. Ovario derecho de 29 x 30 cm ligeramente aumentado de tamaño de aspecto heterogéneo. 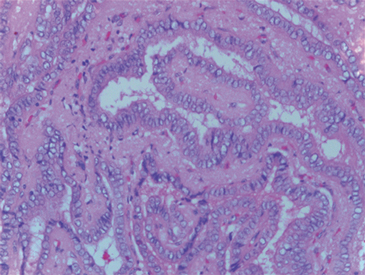 Figura 2. Histología del foco de carcinoma papilar de tiroides en ovario derecho. Folículos de aspecto dilatado y quístico con coloide en su interior, con otras áreas de estructuras foliculares revestidas de células cilíndricas con núcleos densos y otros de cromatina clara, algunos en grano de café con variación en el tamaño, algunos superpuestos. Las estructuras foliculares están adosadas entre sí y algunas están sumergidas en tejido fibroso; hallazgos correspondientes a un foco de carcinoma papilar patrón folicular en un struma ovarii.
Figura 2. Histología del foco de carcinoma papilar de tiroides en ovario derecho. Folículos de aspecto dilatado y quístico con coloide en su interior, con otras áreas de estructuras foliculares revestidas de células cilíndricas con núcleos densos y otros de cromatina clara, algunos en grano de café con variación en el tamaño, algunos superpuestos. Las estructuras foliculares están adosadas entre sí y algunas están sumergidas en tejido fibroso; hallazgos correspondientes a un foco de carcinoma papilar patrón folicular en un struma ovarii.
La paciente fue remitida al servicio de endocrinología del Hospital Pablo Tobón Uribe tres meses después de la cirugía; para este momento se encontraba sin síntomas que sugirieran una tirotoxicosis y su valor de hormona estimulante del tiroides (TSH) era de 5,59 uUI/ml (valor de referencia 0,4-4,0); la evaluación de la glándula tiroides era completamente normal, por lo que se decidió no realizar tiroidectomía sino hacer seguimiento ecográfico. Se realizó una ecografía de tiroides en la cual no se encontraron nódulos o ganglios que sugieran malignidad, y una tomografía de tórax y abdomen en la cual no se encontró ninguna alteración.
Revisión de la literatura
El struma ovarii maligno es un tumor de ovario con más de un 50% de tejido tiroideo en cuyo interior se encuentra una neoplasia tiroidea. Dentro de los teratomas maduros de ovario, el struma ovarii es una entidad rara, equivalente al 2 a 3% de los casos y al 0,3 a 1,2% de todos los tumores de ovario. La presencia de malignidad en este tejido es mucho más rara, aproximadamente del 5% de todos los casos1-3.
Para hacer el diagnóstico del struma ovarii maligno se pueden usar los mismos criterios de malignidad utilizados en el diagnóstico del cáncer de tiroides2,5, e inclusive se han reportado mutaciones del BRAF en los struma, hallazgo característico de los carcinomas papilares de tiroides6.
Debido a la baja incidencia de estos tumores, (menos del 0,5% de todos los tumores de ovario)2, no existen guías para el manejo y seguimiento de estos pacientes, aunque recientemente Jean y cols., propusieron una estrategia de abordaje multimodal basados en una revisión de los casos reportados en la literatura3.
En la revisión más grande de la literatura realizada en pacientes con struma ovarii maligno, se reportó que el dolor, las masas abdominales y pélvicas y las irregularidades menstruales son los síntomas más frecuentemente encontrados al momento de la presentación, aunque algunos pacientes se pueden presentar también síntomas de tirotoxicosis3,7.
En cuanto al manejo del struma ovarii maligno, se deben seguir los mismos lineamientos utilizados para el manejo del carcinoma de ovario: Histerectomía total, salpingo-ooforectomía bilateral, lavado peritoneal, muestreo de ganglios linfáticos para aórticos y pélvicos y omentectomía4.
Las formas histológicas más frecuentemente encontradas son la variante papilar clásica (44%), folicular (30%) y la variante folicular del carcinoma papilar (20%)3. También se ha reportado casos con un componente neuroendocrino8, de variante de células claras del carcinoma folicular, de tumor tiroideo pobremente diferenciado (Insular), de tumor anaplásico7 y de nidos celulares sólidos9. Recientemente, se ha reconocido una nueva variedad, el carcinoma folicular altamente diferenciado, en cual, a pesar de tener una histología de aspecto benigno similar a la de un bocio coloide o nodular, se asocia con la presencia de metástasis a distancia y a extenso compromiso peritoneal (“Estrumosis peritoneal”)9,10.
Aunque en la mayoría de los casos se utilizan los mismos criterios de malignidad con los que se definen los tumores de tiroides y se pueden encontrar cuerpos de Psamoma, no existen unos criterios establecidos para hacer el diagnóstico histológico de malignidad en el struma ovarii. En casos de carcinoma folicular el diagnóstico puede ser particularmente difícil, debido a la ausencia de cápsula en muchas de estas lesiones. En situaciones difíciles, el uso de la inmunohistoquímica puede ser de gran ayuda en la identificación de estas neoplasias (Factor de transcripción tiroideo (TTF-1), tiroglobulina, citoqueratina, tiroxina, etc.)7.
Las metástasis son infrecuentes, pero se han reportado 16 casos, de los cuales el 25% se presentaron en pacientes con variantes foliculares de carcinomas papilares5,11-21. Tanto las metástasis como las recurrencias son más comunes en los pacientes con la variedad folicular. La mayoría de metástasis se dan en hígado, pulmón y hueso, siguiendo un patrón de diseminación similar a las del cáncer de ovario. También se han descrito reportes de compromiso de otros sitios como el colon y la bóveda craneana19.
Existe mucha controversia con respecto al uso de terapia adyuvante con tiroidectomía total y terapia ablativa con yodo radioactivo (I131); la recomendación de utilizar esta terapia viene de reportes1, en los cuales los pacientes sometidos a este tipo de tratamiento son menos propensos a presentar recaídas. Usualmente las metástasis se presentan al momento de la recurrencia más que al momento del diagnóstico y su frecuencia se ha reportado en un 5 a 27% de los pacientes2,3,5,13. La tiroidectomía permite definir que el origen de la malignidad es en realidad el ovario y no la tiroides. La sobrevida a 10 y 25 años se ha estimado en un 92% y 75% respectivamente7, lo cual confiere a este tipo de tumores un buen pronóstico, similar a los de origen tiroideo.
Existe gran controversia con respecto al seguimiento de estos pacientes, Makani y cols., reportaron que en promedio los pacientes presentaban la recaída a los 4 años de seguimiento y sugieren un tiempo de seguimiento de 10 años basados en estos hallazgos2, recomendación que también ha sido sugerida por otros autores3. Se recomienda también que el seguimiento de los pacientes que han sido sometidos a tiroidectomía y terapia ablativa con I131 con niveles de tiroglobulina sérica, y en caso de estar elevados correlacionarlos con un estudio gammagráfico con yodo radioactivo, de la misma forma que se realiza en los pacientes con un carcinoma bien diferenciado de tiroides22.
Similar a lo que sucede con los pacientes con carcinomas bien diferenciados de tiroides, el manejo del micro-carcinoma (aquel menor a 10 mm) plantea aún más preguntas. En los pacientes con tumores de origen tiroideo la sobrevida a 15 años es del 99,3%23, y la recomendación es el tratamiento quirúrgico sin terapia ablativa con yodo radiactivo22, ya que este probablemente no cambia la mortalidad o morbilidad asociada a este tipo de tumores. Se han reportado muy pocos casos de micro carcinoma papilar de tiroides en un struma ovarii24-26, y el manejo en este tipo de pacientes es incierto y se basa más en las preferencias y experiencia de cada centro.
Discusión
Reportamos el caso de un struma ovarii con un foco de micro carcinoma papilar de tiroides de la variedad folicular; por tratarse de una mujer pos menopaúsica se realizó extracción de ambos ovarios y el útero, documentándose sólo el compromiso por el micro carcinoma en el ovario. En pacientes más jóvenes se han descrito intervenciones mucho menos agresivas, con las que se busca preservar la fertilidad20. Debido a que en la ecografía no se evidenciaron lesiones en la glándula tiroides, y por tratarse de un micro carcinoma, se decidió no realizar terapia adyuvante con tiroidectomía y ablación con I131. El seguimiento de esta paciente supone un reto, pues la tiroglobulina producida por la glándula tiroides dificulta el seguimiento con los niveles de esta; así mismo, la presencia de la glándula tiroides también hace que la gammagrafía no sea una buena opción para el seguimiento sino se hace un bloqueo adecuado de la captación tiroidea con lugol27. Sin embargo, la buena sobrevida y el bajo riesgo de que la paciente presente una recidiva o metástasis hacen del seguimiento clínico de imágenes sea una buena opción. En nuestra paciente, seis meses después de la primera evaluación por endocrinología se encuentra completamente asintomática; se evaluó sin evidencia de bocio al examen físico y sin hallazgos patológicos en el cuello. Su perfil tiroideo estaba normal, y se le realizó una tomografía contrastada de tórax y abdomen sin evidencia de lesiones que sugieran recaída tumoral ni metástasis.
Referencias bibliográficas
- DeSimone CP, Lele SM, Modesitt SC. 2003. Malignant struma ovarii: a case report and analysis of cases reported in the literature with focus on survival and I131 therapy. Gynecol Oncol 89 (3): 543-548.
- Makani S, Kim W, Gaba AR. 2004. Struma ovarii with a focus of papillary thyroid cancer: a case report and review of the literature. Gynecol Oncol 94 (3): 835-839.
- Jean S, Tanyi JL, Montone K, McGrath C, Lage-Álvarez MM, Chu CS. 2012. Papillary thyroid cancer arising in struma ovarii. J Obstet Gynaecol 32 (3): 222-226.
- Yang C-W, Liang W-Y, Lin J-K, Chiou T-J, Lee C-H, Jiang J-K. 2010. Colonic metastasis from a papillary thyroid carcinoma arising in struma ovarii. Int J Colorectal Dis 25 (7): 913-914.
- Dardik RB, Dardik M, Westra W, Montz FJ. 1999. Malignant struma ovarii: two case reports and a review of the literature. Gynecol Oncol 73 (3): 447-451.
- Schmidt J, Derr V, Heinrich MC, Crum CP, Fletcher JA, Corless CL, et al. 2007. BRAF in papillary thyroid carcinoma of ovary (struma ovarii). Am J Surg Pathol 31 (9): 1337-1343.
- Roth LM, Miller AW 3rd, Talerman A. 2008. Typical thyroid-type carcinoma arising in struma ovarii: a report of 4 cases and review of the literature. Int J Gynecol Pathol 27 (4): 496-506.
- Selvaggi F, Risio D, Waku M, Simo D, Angelucci D, D’Aulerio A, et al. 2012. Struma ovarii with follicular thyroid-type carcinoma and neuroendocrine component: case report. World journal of surgical oncology 10 (1): 93.
- Cameselle-Teijeiro J, Caramés N, Romero-Rojas A, Reyes-Santías R, Piso-Neira M, Bernabeu I, et al. 2011. Thyroid-type solid cell nests in struma ovarii. Int J Surg Pathol 19 (5): 627-631.
- Roth LM, Karseladze AI. 2008. Highly differentiated follicular carcinoma arising from struma ovarii: a report of 3 cases, a review of the literature, and a reassessment of so-called peritoneal strumosis. Int J Gynecol Pathol 27 (2): 213-222.
- Kempers RD, Dockerty MB, Hoffman DL, Bartholomew LG. 1970. Struma ovarii-ascitic, hyperthyroid, and asymptomatic syndromes. Ann Intern Med 72 (6): 883-893.
- Pardo-Mindan FJ, Vázquez JJ. 1983. Malignant struma ovarii. Light and electron microscopic study. Cancer 51 (2): 337-343.
- Rosenblum NG, LiVolsi VA, Edmonds PR, Mikuta JJ. 1989. Malignant struma ovarii. Gynecol Oncol 32 (2): 224-227.
- O’Connell ME, Fisher C, Harmer CL. 1990. Malignant struma ovarii: presentation and management. Br J Radiol 63 (749): 360-363.
- Ayhan A, Yanik F, Tuncer R, Tuncer ZS, Ruacan S. 1993. Struma ovarii. Int J Gynaecol Obstet 42 (2): 143-146.
- Tokuda Y, Hatayama T, Sakoda K. 1993. Metastasis of malignant struma ovarii to the cranial vault during pregnancy. Neurosurgery 33 (3): 515-518.
- Vadmal MS, Smilari TF, Lovecchio JL, Klein IL, Hajdu SI. 1997. Diagnosis and treatment of disseminated struma ovarii with malignant transformation. Gynecol Oncol 64 (3): 541-546.
- Chan SW, Farrell KE. 2001. Metastatic thyroid carcinoma in the presence of struma ovarii. Med J Aust 175 (7): 373-374.
- Zekri JM, Manifold IH, Wadsley JC. 2006. Metastatic struma ovarii: late presentation, unusual features and multiple radioactive iodine treatments. Clin Oncol (R Coll Radiol) 18 (10): 768-772.
- Salvatori M, Dambra DP, D’Angelo G, Conte LL, Locantore P, Zannoni G, et al. 2008. A case of metastatic struma ovarii treated with 131I therapy: focus on preservation of fertility and selected review of the literature. Gynecol Endocrinol 24 (6): 312-319.
- Yamashita M, Ishii T, Ohtori S, Oikawa Y, Watanabe T, Ito T, et al. 2010. Metastasis of malignant struma ovarii to the lumbar spine. J Clin Neurosci 17 (2): 269-272.
- Cooper DS, Doherty GM, Haugen BR, Hauger BR, Kloos RT, Lee SL, et al. 2009. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19 (11): 1167-1214.
- Hay ID, Hutchinson ME, González-Losada T, McIver B, Reinalda ME, Grant CS, et al. 2008. Papillary thyroid microcarcinoma: a study of 900 cases observed in a 60-year period. Surgery 144 (6): 980-987; discussion 987-988.
- Pelosi G, Sonzogni A, Rosai J. 2008. Thyroid-type papillary microcarcinoma in ovarian strumal carcinoid. Int J Surg Pathol 16 (4): 435-437.
- Garg K, Soslow RA, Rivera M, Tuttle MR, Ghossein RA. 2009. Histologically bland “extremely well differentiated” thyroid carcinomas arising in struma ovarii can recur and metastasize. Int J Gynecol Pathol 28 (3): 222-230.
- Meringolo D, Bianchi D, Capula C, Costante G. 2012. Papillary thyroid microcarcinoma in struma ovarii. Endocrine 41 (1): 164-165.
- Balci TA, Kabasakal L. 2005. Is the I131 whole-body scanning proper for follow-up management of the patients with malignant struma ovarii without performing the thyroidectomy? Gynecol Oncol 99 (2): 520.