Efecto de los antagonistas de aldosterona en nefropatía diabética. Revisión sistemática de la literatura
Jorge Sapunar Z.1, Tatiana Vásquez A.2, Víctor Neira R.3 y Nicolás Aguilar F.4
Systematic review of the effect of aldosterone antagonists on urinary albumin excretion in diabetic nephropathy
1Unidad de Endocrinología y
2Unidad de Kinesiología,
3Departamento Medicina Interna. 4Centro de Excelencia CIGES, Facultad de Medicina, Universidad de La Frontera.
Soporte económico: Ninguno.
Conflictos de Interés: Los autores no tienen ninguno que declarar.
Correspondencia:
Jorge Sapunar Zenteno
Manuel Montt 112, Dpto. Medicina Interna, Facultad de Medicina, Universidad de la Frontera, Temuco.
Teléfono: 9-6470293
E-mail jorge.sapunar@ufrontera.cl
Recibido: 10 de mayo de 2013
Aceptado: 02 de julio de 2013
The beneficial effect angiotensin converting enzyme inhibitors (ACEI) and angiotensin II receptor antagonists (ARA) for diabetic nephropathy can be hampered by the phenomenon of aldosterone escape. Aldosterone antagonists such as espironolactone or epleronone could potentiate the effects of ACEI and ARA and avoid the later problem. We performed a systematic search of the literature on the effects of aldosterone antagonists on diabetic nephropathy. We searched for clinical trials and follow up studies measuring the effects of aldosterone antagonists on urinary albumin excretion among patients with diabetic nephropathy. We retrieved 1345 papers on the subject and 10 were selected for analysis. Among these, spironolactone was more effective than comparing drugs to achieve a reduction in urinary albumin excretion of approximately 30 to 40%. On the other hand epleronone was not superior to comparing drugs. All studies reported a modest reduction in glomerular filtration rate and an increase in serum potassium levels. In conclusion, spironolactone in doses of 25 to 100 mg/day reduces urinary albumin excretion but reduces also glomerular filtration rate and increases serum potassium levels.
Key words: Aldosterone, Aldosterone Antagonists, Spironolactone, Proteinuria, Diabetic Nephropaty
La nefropatía diabética es una de las principales causas de ingreso a hemodiálisis en el mundo; en Chile el 34% de los pacientes en diálisis tiene diabetes mellitus (DM)1. Se estima que un 25-30% de los pacientes con DM 1 y 20 a 40% de pacientes con DM 2 desarrollarán insuficiencia renal2,3.
Los principales factores de riesgo modificables para la aparición de nefropatía diabética son el mal control de la glicemia y de la presión arterial, la presencia de microalbuminuria y la activación del sistema renina-angiotensina-aldosterona4.
Entre las intervenciones farmacológicas más efectivas para evitar la progresión de la nefropatía diabética se encuentra el bloqueo del eje renina-angiotensina-aldosterona (RAA). La aldosterona puede producir de daño renal a través de efectos hemodinámicos como vasoconstricción y no hemodinámicos como disfunción endotelial y aumento de factores pro-ateroescleróticos5.
El bloqueo del eje RAA en pacientes nefropatía diabética tiene como metas la disminución de la presión arterial y protección renal (Cuantificada como reducción de la relación albuminuria/proteinuria), objetivos que a su vez podrían evitar el desarrollo de insuficiencia renal crónica y eventos cardiovasculares5. Los fármacos más usados para este fin son los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas del receptor de angiotensina II (ARA II).
Los IECA retardan la progresión de micro a macroalbuminuria y la disminución de la velocidad de filtración glomerular en diabéticos tipo 1 con macroalbuminuria3. Los ARA II retardan la aparición de microalbuminuria, la progresión de micro a macroalbuminuria y el desarrollo insuficiencia renal crónica en pacientes con DM2 e hipertensión arterial3. La combinación de estas drogas otorga un beneficio adicional en la disminución de la albuminuria, pero su efecto a largo plazo en la función renal no ha sido estudiado3.
El uso Aliskireno, un inhibidor directo de la renina efectivo en reducir la macroalbuminuria en pacientes con DM2 e hipertensión arterial6, se asoció con aumento en la incidencia de ictus no fatal, complicaciones renales, hiperkalemia e hipotensión en pacientes usuarios de IECA o ARA II, con riesgo cardiovascular y renal elevado7.
Un factor que limita el efecto beneficioso de IECA y ARA II es el llamado “escape de aldosterona” que es un aumento de este mineralocorticoide luego de 2 a 3 meses de bloqueo del eje RAA5. Para contrarestar este mecanismo se dispone de los antagonistas de aldosterona como Espironolactona y Epleronona5. Estos fármacos compiten con la aldosterona por el receptor mineralocorticoide en el túbulo contorneado distal renal. La Espironolactona es un medicamento usado desde la década del 60 para el tratamiento del edema en hiperaldosteronismo secundario y de la hipertensión arterial en hiperaldosteronismo primario. Su bajo costo y el tener efectos adversos conocidos le permitiría tener un rol en el manejo de la nefropatía diabética.
El propósito de esta revisión sistemática es obtener la mejor evidencia disponible que permita conocer el efecto de los antagonistas de aldosterona en desenlaces relacionados con nefropatía diabética en relación al comparador, en pacientes usuarios de IECA y/o ARA II.
Método
Realizamos una revisión sistemática de la literatura buscando estudios que evaluaran el efecto de los antagonistas de aldosterona (Espironolactona, Epleronona) en desenlaces relacionados con nefropatía diabética en pacientes con DM1 y/o DM2, con o sin hipertensión arterial, con albuminuria.
Se realizó una búsqueda computarizada por EMBASE desde 1996 hasta julio de 2012 y por MEDLINE desde 1950 hasta julio de 2012 utilizando en esta última base la estrategia: (spironolactone) OR (aldosterone AND antagonism) AND (diabetes mellitus) AND (kidney diseases) OR nephropathy OR albuminuria. Adicionalmente realizamos una búsqueda manual de las referencias bibliográficas de los estudios originales. No hubo restricción de idioma.
Se consideraron elegibles ensayos clínicos controlados y estudios de cohortes. Se seleccionaron para la extracción de datos y análisis aquellos estudios elegibles en que los antagonistas de aldosterona fueron evaluados en relación a un comparador y en que el desenlace relacionado con nefropatía diabética fue la relación albuminuria/creatininuria o albuminuria.
La calidad de los estudios fue expresada de acuerdo a la escala de Jadad8, considerando además la forma de comparación del desenlace (ej. Diferencia del cambio promedio del parámetro basal-final) y el reporte de efectos adversos.
Los autores revisaron en forma independiente los estudios elegibles obtenidos en MEDLINE y EMBASE excluyendo aquellos que no cumplían con los criterios de selección y evaluando su calidad. Las diferencias en la selección y evaluación de estudios fueron resueltas por consenso.
Los desenlaces analizados fueron:
- Albuminuria: Diferencia en el cambio promedio basal/final de la albuminuria o la relación albuminuria/creatininuria entre intervención y comparador. También se aceptó la diferencia en el valor final de albuminuria o relación albuminuria/creatininuria cuando el valor basal era el mismo en ambos grupos de comparación.
- Velocidad de Filtración Glomerular: Diferencia en el cambio promedio basal/final en la depuración de creatinina, depuración de creatinina o creatinina sérica entre intervención y comparador. También se aceptó la diferencia en la proporción de sujetos con insuficiencia renal.
- Kalemia: Diferencia en el cambio promedio basal/final en la kalemia entre intervención y comparador. También se aceptó la diferencia en la proporción de sujetos con hiperkalemia (K > 5,5 mEq/l).
- Cambios en el eje Renina-Angiotensina-Aldosterona (RAA): Diferencias en el cambio promedio basal/final en Actividad de Renina Plasmática (ARP) y aldosterona plasmática. También se aceptó la diferencia en el valor final cuando el valor basal era el mismo en ambos grupos de comparación.
- Otros desenlaces: Se obtuvieron otros desenlaces reportados en los estudios originales como cambio en la presión arterial y eventos adversos.
Si los datos lo permitieren se realizará meta-análisis mediante el programa Rev-Man 5 (Cochrane Iniciative). En el caso de variables continuas el efecto conjunto se expresará como diferencia del cambio promedio y en el caso de frecuencias el riesgo se expresará como odds ratio (OR). La homogeneidad de los estudios originales será expresada mediante valor p en un modelo de efectos aleatorios y la consistencia del análisis por I2 de Higgins.
Resultados
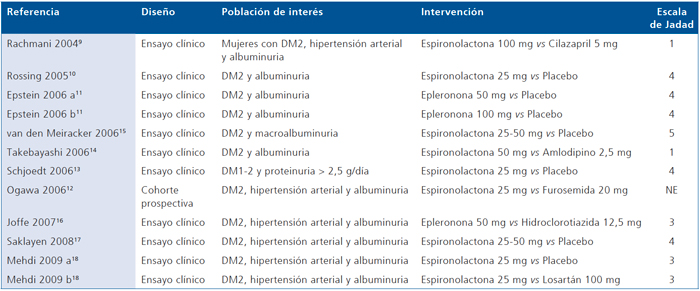
Mediante las estrategias de búsqueda utilizadas encontramos 1.345 artículos que se referían al efecto de los antagonistas de aldosterona en nefropatía diabética, de los cuales seleccionamos para análisis 109-18. En la Tabla 1 se describen los artículos seleccionados considerando su diseño, población de interés, intervenciones y puntaje de acuerdo a la escala de Jadad. Nueve de éstos eran ensayos clínicos9-11,13-18 y 1 estudio observacional de cohortes prospectivo12. Los artículos de Epstein11 y de Mehdi18 fueron considerados compuestos de 2 estudios cada uno, debido a que evaluaron diferentes dosis del antagonista de aldosterona y utilizaron 2 comparadores simultáneos respectivamente; 7/10 ensayos clínicos presentaron un puntaje ≥ 3 de la escala de Jadad. El estudio de Ogawa12 no fue evaluado por ser un estudio observacional, los estudios de Takebayashi14 y Rachmani9 tuvieron puntaje 1 por no describir el método de aleatorización, no reportar ni describir enmascaramiento y diferencias post-aleatorización.
Tabla 1. Descripción de los estudios originales seleccionados para análisis
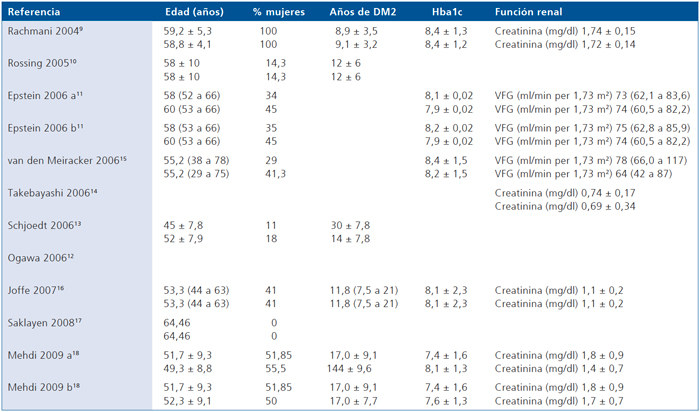
En la Tabla 2 se describen variables demográficas y analíticas basales de los diferentes estudios. La mayor parte de los autores seleccionaron muestras de población predominantemente masculina, excepto Rachmani y Mehdi9,18. La edad promedio observada en los estudios fue alrededor de 50 años, excepto en la rama de DM1 de Schjoedt13. El control metabólico de la diabetes mellitus era sólo regular como lo señalan valores promedio de hemoglobina glicosilada elevados. Aunque en todos los casos fueron evaluados individuos con distintos niveles de albuminuria, sólo en los estudios de Rachmani y Mehdi9,18 la función renal estaba comprometida.
Tabla 2. Características basales de los sujetos incluidos en los estudios originales
Albuminuria
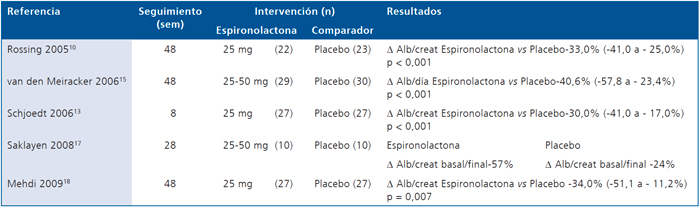
En la Tabla 3 se describe el efecto de espironolactona vs placebo en la albuminuria. En 3/5 estudios10,13,18 los resultados se expresaron como diferencia porcentual en el cambio promedio de la relación albuminuria/creatininuria con intervalo de confianza. En todos los casos la espironolactona produjo una reducción adicional significativa de la relación albuminuria/creatininuria. Los estudios de Rossing y
Medhi10,18 se extendieron por 48 sem y fueron realizados en DM2. El estudio de Schjoedt13 sólo se extendió por 8 sem y se realizó en pacientes con DM1 y DM2 con proteinuria en rango nefrótico. El estudio de van den Meiracker15 el efecto favorable de la espironolactona se evaluó mediante albuminuria de 24 h y fue significativo. Finalmente, el estudio de Saklayen17 sólo reportó la diferencia porcentual en la relación albuminuria/creatininuria basal vs final, pero no sometió a prueba de hipótesis la diferencia observada entre la intervención y comparador.
Tabla 3. Efecto de la Espironolactona vs placebo en la albuminuria de pacientes con diabetes mellitus
En la Tabla 4 se describe el efecto de espironolactona vs otros comparadores activos. Rachmani9, encontró que espironolactona 100 mg fue más efectiva que cilazapril 5 mg en reducir la relación albuminuria/creatininuria en 36 meses de seguimiento. De la misma forma el estudio observacional de Ogawa12, reportó que espironolactona 25 mg tenía un efecto significativamente mayor que el de furosemida 20 mg. Aunque no fueron comparados entre sí, Takebayashi14, encontró que espironolactona y no amlodipino reducía la relación albuminuria/creatininuria. Mehdi18, encontró que espironolactona tenía un efecto relativamente mayor que losartán 100 mg en la relación albuminuria/creatininuria, aunque no hubo prueba de hipótesis.
Tabla 4. Efecto de la Espironolactona vs comparadores activos en la albuminuria de pacientes con diabetes mellitus
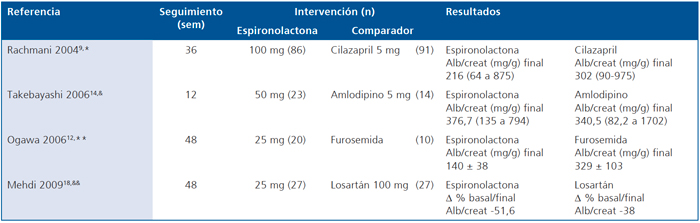
*Valor p = 0,02 para la diferencia entre Espironolactona y Cilazapril. En ambos casos la relación Alb/creat basal fue 452 (124-1571) mg/g. &Valor p = 0,0037 para diferencia basal/final con Espironolactona. Valor p = 0,3815 para diferencia basal/final con amlodipino.
**Valor p < 0,001 para la diferencia entre Espironolactona y Furosemida. &&No se compararon estas intervenciones entre sí.
En la Tabla 5 se describe el efecto de epleronona vs comparador en la albuminuria. El estudio de Epstein11, comparó 2 dosis de epleronona con placebo durante 12 sem y sólo reportó la diferencia porcentual en la relación albuminuria/creatininuria basal vs final, pero no sometió a prueba de hipótesis la diferencia observada entre la intervención y comparador. El estudio de Joffe16, no encontró diferencias significativas en la albuminuria de 24 h final, en estudio de sólo 6 sem, entre epleronona e hidroclorotiazida.
Tabla 5. Efecto de la Epleronona vs comparador en la albuminuria en pacientes con diabetes mellitus
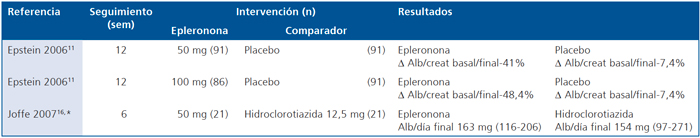
Filtración glomerular
En la Tabla 6 se describe el efecto de la espironolactona en la velocidad de filtración glomerular en relación al placebo, en pacientes diabéticos con albuminuria. Todos los estudios originales mostraron una reducción modesta en la VFG con espironolactona en relación al placebo. En la Tabla 7 se describe el efecto en la función renal, expresada principalmente como creatinina plasmática, de la espironolactona en relación a comparadores activos. Solamente el estudio de Takebayashi14, reportó prueba de hipótesis para comparar el efecto de espironolactona y amlodipino, aumentando la primera la creatinina sérica significativamente más que el segundo. En la Tabla 8 se describe el efecto de epleronona vs comparador en la velocidad de filtración glomerular. El estudio de Epstein11, no reportó prueba de hipótesis para comparar efecto en VFG de epleronona vs comparador. Joffe16, no encontró diferencias significativas en la VFG final entre epleronona e hidroclorotiazida, partiendo ambos grupos con la misma VFG basal.
Tabla 6. Efecto de la Espironolactona vs placebo en la velocidad de filtración glomerular (VFG) de pacientes con diabetes mellitus

Tabla 7. Efecto de la Espironolactona vs comparador activo en la velocidad de filtración glomerular (VFG) de pacientes con diabetes mellitus

Tabla 8. Efecto de la Epleronona vs comparador en la velocidad de filtración glomerular de pacientes con diabetes mellitus

Kalemia
En la Tabla 9 se describe el efecto de la espironolactona en relación al placebo en la kalemia de pacientes con diabetes mellitus. Considerando la variabilidad en la función renal y kalemia basales promedio entre los estudios, la intervención se asoció con un aumento significativo en la kalemia en relación al placebo. En la Tabla 10 se puede apreciar el efecto en la kalemia de la espironolactona en relación a cilazapril, amlodipino y losartán. En comparación a los 2 primeros, el uso de espironolactona se asoció con mayor frecuencia de hiperkalemia. Finalmente, en la Tabla 11 se describe el efecto de epleronona en la kalemia en relación a comparador. La frecuencia de hiperkalemia sólo fue significativamente mayor con 100 mg de epleronona.
Tabla 9. Efecto de la Espironolactona vs placebo en la kalemia de pacientes con diabetes mellitus
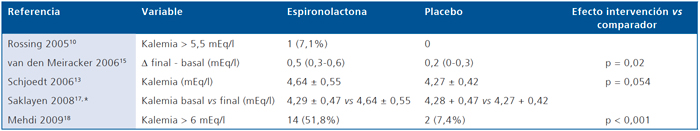
*∆ basal-final para espironolactona p = 0,002. ∆ basal-final para placebo p = 0,77.
Tabla 10. Efecto de la Espironolactona vs comparador activo en la kalemia de pacientes con diabetes mellitus
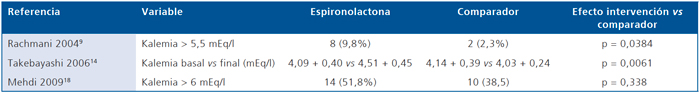
Tabla 11. Efecto de la Epleronona vs comparador en la kalemia de pacientes con diabetes mellitus
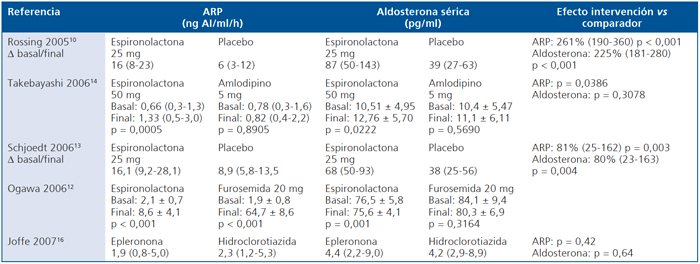
Eje Renina-Angiotensina-Aldosterona (Tabla 12)
Sólo 5 estudios reportaron el efecto de la intervención en los niveles de aldosterona sérica y en la actividad de renina plasmática10,12-14,16. De éstos el estudio de Ogawa no comparó los resultados entre espironolactona y furosemida. En todos los otros estudios el uso de espironolactona se asoció con incremento significativo en ARP y aldosterona sérica en relación a lo observado en el comparador12. El estudio de Joffe con epleronona vs hidroclorotiazida no mostró diferencias16.
Eventos adversos
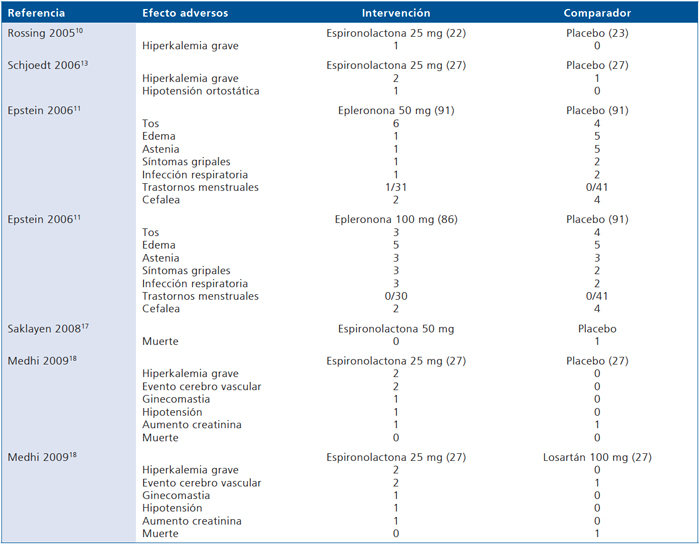
En la Tabla 13 se resumen los eventos adversos reportados en los estudios. Solamente 5 estudios comunicaron efectos adversos. No se encontraron diferencias estadísticamente significativas en la frecuencia de efectos adversos entre los antagonistas de aldosterona y sus comparadores.
Tabla 12. Efecto del antagonista de aldosterona vs comparador en la ARP y aldosterona sérica de pacientes con diabetes mellitus

Tabla 13. Eventos adversos reportados por los estudios
Discusión
La albuminuria es el marcador más importante de nefropatía diabética y un factor de riesgo cardiovascular emergente en DM2, lo que explica que sea un desenlace relevante en la evaluación de distintas terapias4.
Nuestra revisión sistemática mostró que la espironolactona es eficaz en reducir la albuminuria en pacientes con DM en tratamiento con IECA y ARA II, al compararla con placebo y otros fármacos (incluidos otros IECA y ARA II). Sin embargo, en los estudios originales incluídos en el análisis los valores de albuminuria basal eran muy dispares, el seguimiento fue breve (8 a 48 sem) y las dosis de espironolactona usadas variaron entre 25 y 100 mg/día. El efecto conjunto de los estudios con epleronona fue menos consistente.
El deterioro de la función renal es uno de los efectos no deseados de los antagonistas de aldosterona, sin embargo, nuestro estudio encontró que el uso de espironolactona se asociaba con una pequeña reducción de la velocidad de filtración glomerular en relación al comparador, que no fue significativa. No fue posible comparar el efecto en la velocidad de filtración glomerular de espironolactona con el de IECA o ARA II, debido a las limitaciones metodológicas de los estudios que utilizaron cilazapril y losartán como comparadores activos9,18.
El otro efecto no deseado de estos fármacos y que posiblemente constituye la mayor limitante para su uso es la hiperkalemia. En nuestra revisión sistemática el uso de espironolactona se asoció con aumento en la kalemia al compararla con placebo, cilazapril y amlodipino9,14. Sin embargo, en la mayoría de los casos la complicación se resolvió disminuyendo la dosis del fármaco, con dieta pobre en potasio o mediante kayexalate. Sólo un paciente debió suspender el tratamiento con espironolactona10.
El aumento en los niveles de aldosterona y ARP fue documentada en 4 de 5 estudios10,12-14,16, pero en ninguno de éstos el comparador fue IECA o ARA II. Esta comparación resultaría interesante para evaluar el llamado “escape de aldosterona”, fenómeno que limita la efectividad de estos fármacos en el manejo de la nefropatía diabética5.
Otros efectos adversos fueron comunicados sólo en 5 estudios10,11,13,17,18. Aunque el uso de espironolactona se asoció con hipotensión y ginecomastia, la mayor frecuencia de estas complicaciones no fue estadísticamente significativa al compararlas con placebo u otros fármacos.
La principal limitación de esta revisión sistemática es la diferencia en la forma de expresión del desenlace primario albuminuria en los estudios originales, lo que impide resumir los resultados en un meta-análisis. El pequeño tamaño muestral de los estudios y la falta del control de variables afectan la albuminuria como la ingesta de sal o el control metabólico de la diabetes mellitus les resta validez interna. Finalmente, nuestros resultados no son extrapolables a DM 1 ya que sólo un estudio incluyo a este tipo de pacientes13.
Considerando estas limitaciones podemos concluir que el uso de espironolactona podría ser beneficioso en pacientes con nefropatía diabética en tratamiento con IECA o ARA II, ya que es efectivo en disminuir la albuminuria, tiene bajo costo y un nivel de seguridad aceptable, vigilando la kalemia. Creemos que el uso espironolactona cobra mayor importancia luego de los resultados del estudio ALTITUDE con aliskireno7.
Es necesario realizar estudios con mejor calidad metodología y mayor seguimiento para establecer el lugar de la espironolactona en nefropatía diabética. También sería interesante evaluar si el uso de antagonistas de aldosterona en pacientes con diabetes mellitus podría tener otros beneficios a nivel cardiovascular.
Agradecimientos
Agradecemos a la Sra. Cristina Miranda, asesor Centro Saval Temuco, por su valiosa cooperación en la búsqueda bibliográfica para esta revisión sistemática.
Referencias bibliográficas
- Guía Clínica Diabetes Mellitus tipo 2. Santiago, Minsal. 2010.
http://www.redsalud.gov.cl/portal/url/item/72213ed52c3e23d1e04001011f011398.pdf - Steinke JM, Mauer M. 2008. International Diabetic Nephropathy Study Group. Lessons learned from studies of the natural history of diabetic nephropathy in young type 1 diabetic patients. Pediatr Endocrinol Rev 5 Suppl 4: 958-963.
- Standards of Medical Care in Diabetes 2012. Diabetes Care. 2012; 35 (Suppl 1): s11-s43. DOI: 10.2337/dc12-s011.
- Gross J, De Azevedo M, Silveiro S, Canani L, Caramori M, Zelmanovitz T. 2005. Diabetic Nephropathy: Diagnosis, Prevention, and Treatment. Diabetes Care 28: 176-188.
- Schjoedt KT. 2011. The rennin-angiotensin-aldosterone system and its blockade in diabetic nephropathy. Dan Med Bull 58: (4); B 4265.
- Zelmanovitz T, Gerchman F, Balthazar A, Thomazelli F, Matos J, Canani L. 2009. Diabetic nephropathy. Diabetol Metab Syndr 1 (1): 10. doi: 10.1186/1758-5996-1-10.
- Novartis announces termination of ALTITUDE study with Rasilez/Tekturna in high-risk patients with diabetes and renal impairment. http://hugin.info/134323/R/1572562/489351.pdf
- Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan Dj, et al. 1996. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials 17: 1-12.
- Rachmani R, Slavachevsky I, Amit M, Levi Z, Kedar Y, Berla M, Ravid M. 2004. The effect of spironolactone, cilazapril and their combination on albuminuria in patients with hypertension and diabetic nephropathy is independent of blood pressure reduction: a randomized controlled study. Diabet Med 21: 471-475.
- Rossing K, Schjoedt KJ, Smidt UM, Boomsma F, Parving HH. 2005. Beneficial effects of adding spironolactone to recommended antihypertensive treatment in diabetic nephropathy: a randomized, double-masked, cross-over study. Diabetes Care 28: 2106-2112.
- Epstein M, Williams GH, Weinberger M, Lewin A, Krause S, Mukherjee R, Patni R, Beckerman B. 2006. Selective aldosterone blockade with eplerenone reduces albuminuria in patients with type 2 diabetes. Clin J Am Soc Nephrol 1: 940-951.
- Ogawa S, Takeuchi K, Mori T, Nako K, Ito S. 2006. Spironolactone further reduces urinary albumin excretion and plasma B-type natriuretic peptide levels in hypertensive type II diabetes treated with angiotensin-converting enzyme inhibitor. Clin Exp Pharmacol Physiol 33: 477-479.
- Schjoedt KJ, Rossing K, Juhl TR, Boomsma F, Tarnow L, Rossing P, Parving HH. 2006. Beneficial impact of spironolactone on nephrotic range albuminuria in diabetic nephropathy. Kidney Int 70: 536-542.
- Takebayashi K, Matsumoto S, Aso Y, Inukai T. 2006. Aldosterone blockade attenuates urinary monocyte chemoattractant protein-1 and oxidative stress in patients with type 2 diabetes complicated by diabetic nephropathy. J Clin Endocrinol Metab 91: 2214-2217.
- van den Meiracker AH, Baggen RG, Pauli S, Lindemans A, Vulto AG, Poldermans D, Boomsma F. 2006. Spironolactone in type 2 diabetic nephropathy: Effects on proteinuria, blood pressure and renal function. J Hypertens 24: 2285-2292.
- Joffe HV, Kwong RY, Gerhard-Herman MD, Rice C, Feldman K, Adler GK. 2007. Beneficial effects of eplerenone vs hydrochlorothiazide on coronary circulatory function in patients with diabetes mellitus. J Clin Endocrinol Metab 92: 2552-2558.
- Saklayen MG, Gyebi LK, Tasosa J, Yap J. 2008. Effects of additive therapy with spironolactone on proteinuria in diabetic patients already on ACE inhibitor or ARB therapy: results of a randomized, placebo-controlled, double-blind, crossover trial. J Investig Med 56: 714-719.
- Mehdi UFAdams-Huet B, Raskin P, Vega GL, Toto RD. 2009. Addition of Angiotensin Receptor Blockade or Mineralocorticoid Antagonism to Maximal Angiotensin-Converting Enzyme Inhibition in Diabetic Nephropathy. J Am Soc Nephrol 20: 2641-2650.