Tabaquismo y diabetes mellitus: evidencia científica e implicancias en salud pública
Marcia Erazo B.1 y Juan Guillermo Gormaz A.2
Smoking and diabetes mellitus: scientific evidence and public health implications
1Departamento de Nutrición, Facultad de Medicina, Universidad de Chile.
2Programa de Farmacología Molecular y Clínica, Instituto de Ciencias Biomédicas, Facultad de Medicina, Universidad de Chile.
Correspondencia:
Dra. Marcia Erazo B.
Independencia 1027, Santiago, Chile.
Fax: +56-2-7355581.
E-mail: merazo@med.uchile.cl
Recibido: 1 de julio de 2013
Aceptado: 12 de julio de 2013
Noncommunicable Diseases (NCDs) are the leading cause of death and disability worldwide. Among them, diabetes has been identified as the condition causing more disabilities, being blindness, kidney failure and limb amputation the major causes. The literature indicates that these diseases are explained by four factors: unhealthy diet, sedentary lifestyle, tobacco smoking and hazardous alcohol consumption. Of these risk factors, tobacco consumption is being studied lately as a risk condition for diabetes, finding in the international literature several studies that confirm a causal association between both and a dose-response as well. Several mechanisms have been proposed by which the association would be possible, pointing out to a connection with a release of insulin hormone antagonist, a decrease of the insulin sensitivity and high blood levels of FFA, hypotheses that need to be tested in detail. Various international organizations have called for action to prevent NCDs and their risk factors. Among this, the prevention and cessation of tobacco smoking gain great relevance in the country, since the new law protects from exposure to second hand tobacco smoke. At clinical level, one of the challenges that need to be faced is the implementation of smoking cessation programs.
Key words: Tobacco smoking, diabetes, association, prevention and control.
En septiembre de 2011, por segunda vez desde su creación, en una Asamblea General de Naciones Unidas se trató un tema de salud. Los mandatarios de diversos países hicieron una Declaración Política de Alto Nivel en que reconocían a las Enfermedades no transmisibles (ENT) como una epidemia y hacían un llamado a actuar para prevenir la gran carga de enfermedad y de costos asociados1.
Se reconocen cuatro factores de riesgo de las ENT, entre ellas el tabaquismo, el que ha sido identificado en el último tiempo como un factor de riesgo independiente para diabetes2. Chile, ha incorporado en su Estrategia Nacional de Salud 2011-2020 una serie de acciones tendientes a disminuir la prevalencia de los factores de riesgo y las ENT3, siendo la disminución y control de la diabetes y del tabaquismo, parte de los objetivos estratégicos planteados.
El objetivo de este artículo es brindar los antecedentes científicos que apoyan la hipótesis que el tabaquismo causa diabetes, así como revisar los potenciales mecanismos propuestos hasta ahora que apoyan dicha hipótesis y los desafíos para su control a nivel poblacional.
Epidemiología de la diabetes y del tabaquismo
Según la Organización Mundial de la Salud, las ENT son en la actualidad la primera causa de muerte y enfermedad a nivel mundial4. En el año 2008, de los 57 millones de muertes a nivel mundial, 36 millones fueron por este tipo de enfermedades. En los países de ingresos bajos y medios se concentran mayoritariamente los casos, causando una carga social y económica difícil de abordar, ya que alrededor del 25% de las muertes por ENT ocurren antes de los 60 años de edad4.
La diabetes mellitus provocó 1,3 millones de muertes durante el año 2008, siendo además la responsable del 4% de muertes prematuras, entre personas menores de 70 años4. A nivel mundial, la prevalencia de diabetes tipo 2 se ha estimado en un 10%, siendo las regiones de las Américas y del Mediterráneo del Este, las que presentan las mayores tasas, con un 11% estimado para ambos sexos4. A su vez, se ha estimado que existen 84.000.000 de casos de diabetes tipo 1, observándose un incremento promedio de 2,8% en las tasas de incidencia a nivel mundial, siendo el grupo etáreo de niños menores de 10 años quienes presentaron las mayores alzas (4,3%)5. La diabetes produce gran discapacidad entre la población, siendo la falla renal, amputación de extremidades, y ceguera, los problemas de salud primordiales que ocasiona. Las personas con diabetes, gastan en promedio, tres veces más recursos en salud comparados con personas que no tienen diabetes, llegando a implicar un aumento en el presupuesto de salud de un 15%4.
La prevalencia nacional estimada de diabetes mellitus tipo 2 es de 9,4% en la población mayor de 15 años, valor que va aumentando con la edad, llegando a presentarse en el 25,8% de la población mayor de 65 años. En la población menor de 15 años de edad, la tasa de incidencia de diabetes tipo 1 es de entre un 6,5 y 8,6 x 100.000 habitantes6. Según un estudio realizado por el Ministerio de Salud, en el país, el 84% de la carga de enfermedad se debe a las ENT, siendo los años perdidos por discapacidad, los que explican el 66,7% de la carga7. La diabetes es responsable de más de 72.000 años de vida perdidos por muerte prematura y discapacidad y su tasa de mortalidad incrementó en un 17% entre los años 1999 y 20073.
Estas enfermedades se explican básicamente por cuatro factores de riesgo: Consumo de tabaco, dieta malsana, insuficiente actividad física y consumo riesgoso de alcohol. En el caso de diabetes, el consumo de tabaco se ha venido reportando desde hace algún tiempo como un factor de riesgo independiente.
El consumo de tabaco es una práctica ampliamente difundida. Según el Atlas del tabaco8, el 20% de la población mundial fuma, existiendo una diferencia marcada entre las distintas regiones, siendo los países del pacífico occidental los que presentan las mayores prevalencias, con un 48% y África la con menor tasa, sólo un 3%. La región de las Américas presenta en su conjunto un 11%8.
En Chile, según el Atlas de tabaco, el 40,6% de la población mayor de 15 años fuma, con 860 cigarrillos por persona al año. Al desagregar por sexo la información, un 37,1% de la población fumadora corresponde a mujeres, y un 44,2% son hombres, observándose además que entre los niños y niñas de 13 a 15 años, las mujeres fuman casi 12% más que los hombres (28% vs 39,9%), habiendo además un 51,7% de jóvenes expuestos en su hogar a humo de tabaco8.
Si bien, las prevalencias de tabaquismo en el país son altas, los efectos sobre la salud aún no expresan la carga poblacional de ésta, ya que el porcentaje de muertes atribuibles a tabaquismo son de un 11% en hombres y un 8% entre las mujeres8, situación que debiera ir en aumento.
Estudios epidemiológicos que demuestran potencial asociación causal entre tabaquismo y diabetes mellitus tipo 2
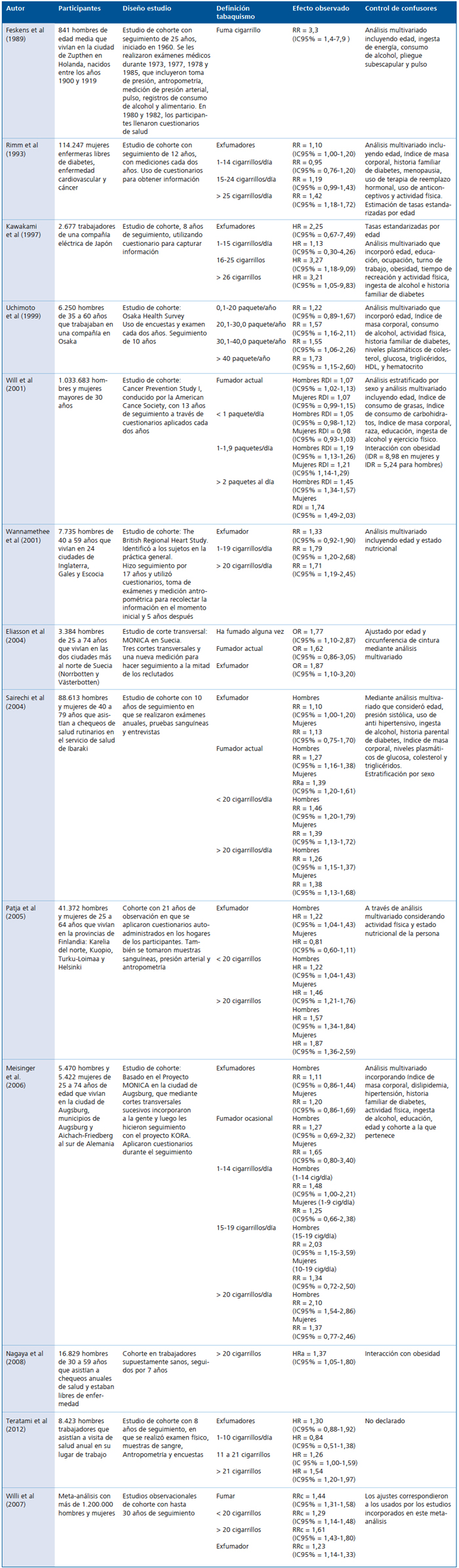
En los últimos años se han escrito diversos artículos científicos basados en estudios longitudinales prospectivos con grandes tamaños poblacionales, que señalan que el consumo de tabaco incrementa el riesgo de tener diabetes mellitus en hombres y mujeres (Tabla 1). El primer estudio en reportar esta asociación fue el realizado por Feskens9, en 1989, a una cohorte de 841 hombres, en que después de 25 años de seguimiento, encontró que el riesgo de tener diabetes aumenta en 3,9 veces para los fumadores.
Posteriormente, un estudio10 que incorporó 114.247 mujeres y las siguió durante 12 años, mostró que si bien había una dosis respuesta en el riesgo de presentar diabetes mellitus, los valores sólo eran significativos para aquellas mujeres que fumaban más de 25 cigarrillos (Riesgo relativo (RR) = 1,42; IC95% = 1,18-1,72).
En 1997, Kawakami11, reportó tras seguir durante 8 años a 2.312 hombres trabajadores, que aquellos que fumaban entre 16 y 25 cigarrillos al día, tenían 3,27 veces más riesgo de desarrollar diabetes mellitus que aquellos trabajadores que no fumaban (Hazard Ratio (HR) = 3,27; IC95% = 1,18-9,09), valor de riesgo que era similar en los trabajadores que fumaban más de 26 cigarrillos por día (HR = 3,21; IC95% = 1,05-9,83).
Un estudio realizado en Japón12, que siguió 6.250 hombres de entre 35 y 60 años de edad, demostró que después de ajustar por diversas potenciales variables de confusión, el riesgo de presentar diabetes entre los fumadores era un 47% mayor que los no fumadores (RR = 1,47; IC95% = 1,14-1,92), riesgo que aumentaba si los fumadores consumían más de 30 cigarrillos al día (RR = 1,72; IC95% = 1,20-2,48).
En el año 2001, Will13 (Will, 2001), reportó a partir de datos recolectados por la Asociación Americana de Cáncer durante 13 años de seguimiento a más de 700.000 hombres y mujeres mayores de 30 años, que aquellos hombres que fumaban más de dos paquetes de cigarrillos al día incrementaban su riesgo de tener diabetes mellitus en un 45% (Razón de densidad de incidencia (RDI) = 1,45; IC95% = 1,34-1,57), y para las mujeres, este riesgo aumentaba a un 75% (RDI = 1,75; IC95% = 1,49-2,03), observándose en ambos casos, que los riesgos aumentaban a más de 4 veces cuando además de ser fumadores, eran obesos (IDR = 8,98 en mujeres y IDR = 5,24 para hombres).
En Inglaterra, se realizó un seguimiento de casi 17 años a 7.735 hombres de edades entre los 40 y 59 años14, demostrando que los fumadores tienen un 71% más de riesgo de sufrir diabetes mellitus (al ajustar por potenciales variables de confusión) comparado con aquellos no fumadores (Riesgo Relativo ajustado (RRa) = 1,71; IC95% = 1,19-2,45).
El estudio MONICA realizado en Suecia15, que incorporó 3.384 hombres de 25 a 74 años de edad, demostró que los fumadores tenían un 88% más probabilidades que los no fumadores de desarrollar diabetes mellitus (Odds Ratio ajustado (ORa) = 1,88; IC95% = 1,17-3,0).
Sairechi y cols.16, encontraron después de seguir por 10 años a 88.613 hombres y mujeres de entre 40 y 79 años, que después de ajustar diversas variables de confusión, los hombres que fumaban presentaban un 27% más de riesgo de tener diabetes que los no fumadores (RRa = 1,27; IC95% = 1,16-1,38), cifra que aumentó a 39% en las mujeres (RRa = 1,39;IC95% = 1,20-1,61), observándose además que a medida que aumenta la edad, los riesgos tienden a disminuir en ambos sexos.
En Finlandia, se realizó un gran estudio de seguimiento en que durante 21 años se observó a 41.372 hombres y mujeres de edades que estaban entre los 25 y 64 años17. En él se halló una relación dosis-respuesta de la asociación entre el consumo de cigarrillos y la probabilidad de desarrollar diabetes mellitus, relación que es independiente de la actividad física y el estado nutricional de la persona. Así es como para aquellos hombres que fumaban menos de 20 cigarrillos al día, los valores de riesgo fueron de 1,22 (IC95% = 1,04-1,43), valor que aumentó a 1,57 entre los que fumaban más de 20 cigarrillos al día (IC95% = 1,34-1,84). En las mujeres, se encontraron valores más altos de riesgo, conservando de igual manera la relación dosis-respuesta (RR menos de 20 cigarrillos = 1,46; IC95% = 1,21-1,76 y RR más de 20 cigarrillos = 1,87; IC95% = 1,36-2,59).
En Alemania, otro grupo de investigadores18 describió que en los hombres y en mujeres existía una relación dosis-respuesta en los riesgos, siendo los valores más bajos en mujeres (Hombres: RR = 1,48; 2,03; 2,10 vs Mujeres: RR = 1,25; 1,34; 137).
Otro estudio realizado en Japón19, siguió durante más de 7 años a 16.829 hombres supuestamente sanos de 30 a 59 años de edad, reportándose que los hombres obesos y con alto consumo de cigarrillos (> 20 cigarrillos al día) tenían un 37% más de riesgo de presentar diabetes mellitus (Hazard Ratio ajustado (HRa) = 1,37; IC95% = 1,05-1,80) que los hombres no fumadores. Estos hallazgos que fueron similares a los encontrados en otro estudio realizado también en Japón20, en que siguieron durante 8 años a 8.423 hombres trabajadores, demostró que existe una relación positiva dosis-respuesta entre el consumo de tabaco y el posterior desarrollo de diabetes mellitus tipo 2, ya que los riesgos más altos (HR = 1,54; IC95% = 1,20-1,97) se observaron cuando los trabajadores consumían más de 21 cigarrillos por día, disminuyendo el HR a 1,26 (IC 95% = 1,00-1,59) cuando los trabajadores fumaban entre 11 y 20 cigarrillos diarios.
Si bien se había demostrado en los estudios anteriores que existía una asociación entre el consumo de tabaco y diabetes mellitus, no estaba completamente resuelto si esa asociación era dosis-respuesta. Para avanzar en esa hipótesis, se realizó un meta-análisis21 que incluyó diversos estudios de cohorte, aportando en su conjunto con la observación a 1,2 millones de participantes, con períodos de tiempo que variaron entre los 5 y 30 años. En él se refuerza que el fumar es un factor de riesgo independiente de diabetes mellitus tipo 2, ya que el Riesgo relativo combinado (RRc) es de 1,44 (IC95% = 1,31-1,58). También demostró que existe una relación dosis-respuesta, en que las personas que fuman menos cigarrillos diarios presentan menores valores de riesgo que las que fuman más. Así es como para los que fuman más de 20 cigarrillos diarios, los valores de RRc son de 1,61 (IC95% = 1,43-1,80), en los que fuman menos de 20 cigarrillos, los valores disminuyeron a 1,29 (IC95% = 1,14-1,48). En los exfumadores también se observa una disminución en los riesgo (RRc = 1,23; IC95% = 1,14-1,33) comparado con los fumadores actuales.
Finalmente, en el año 2010, un Reporte del Surgen General2 declaró, después de haber analizado la evidencia científica, que el desarrollo de diabetes mellitus tipo 2 es otro de los efectos dañinos del consumo de cigarrillos, y hace un llamado a la cesación del hábitos como parte de los cuidados a personas con diabetes, con el fin de facilitar el control glicémico y limitar las complicaciones de esta patología.
Tabla 1. Estudios de cohorte que muestran asociación entre tabaquismo y riesgo de diabetes mellitus
Potenciales mecanismos implicados
Desde hace bastante tiempo existe evidencia básico-clínica que ha demostrado que el tabaquismo reduciría la sensibilidad del organismo a la insulina mediante distintos mecanismos22,23, siendo éste uno de los principales mecanismos asociados al desarrollo y progresión de diabetes mellitus tipo 224. En 1992 Facchini y cols.25, estudiaron los efectos del tabaquismo sobre la homeostasis de la glicemia, comparando la respuesta de 20 individuos sanos de en promedio 39 años con un grupo de similares características que fumaba. Si bien no hubo diferencias en la curva de tolerancia a la glucosa en ayunas, el grupo con tabaquismo presentó una insulinemia significativamente más elevada en todos los puntos de la curva. Posteriormente Attval y cols.26, compararían mediante clamp euglicémico la sensibilidad periférica a la insulina, encontrando que el fumar disminuía la captación periférica de la glucosa. Este incremento en la insulinemia estaría mediado principalmente por la capacidad de la nicotina para inducir un aumento sostenido en los niveles plasmáticos de hormonas que antagonizan con las funciones hipoglicemiante e hipolipemiante de la insulina por distintos mecanismos, incluyendo catecolaminas, cortisol y hormona de crecimiento (GH)27-32.
El efecto de la nicotina sobre las catecolaminas estaría dado mayoritariamente a nivel simpático en las uniones neuroefectoras, mediante la activación de los receptores colinérgicos que estimulan a la médula suprarrenal33-36. Un aumento sostenido en los niveles plasmáticos de catecolaminas reduciría tanto la sensibilidad periférica a la insulina22,37,38 como la secreción β-pancreática de esta hormona39. La inducción de la secreción de coritsol por nicotina sería indirecta, originándose de la capacidad de este compuesto para actuar como agonista colinérgico en el hipotálamo, estimulando la liberación de hormona liberadora de corticotrofina (CRH)36, la que a su vez induce la secreción pituitaria de hormona estimulante de la corteza suprarrenal (ACTH). El incremento crónico en los niveles de cortisol plasmático ha sido asociado a la ocurrencia de resistencia a la insulina y su progresión de diabetes con independencia de obesidad40, mediante mecanismos que alterarían tanto la función β-pancreática como la sensibilidad de los tejidos periféricos a la insulina41. La secreción de hormona del crecimiento inducida por nicotina ocurriría directamente en la hipófisis42. Niveles anormalmente elevados de hormona de crecimiento inducirían resistencia a la insulina, mayoritariamente mediante la insensibilización del músculo esquelético a esta última hormona43 pero también existe evidencia de que podría tener un efecto similar en tejido adiposo44,45.
Se han postulado variados mecanismos celulares específicos mediante los cuales las catecolaminas39, el cortisol41 y la hormona de crecimiento45 favorecerían de forma independiente el desarrollo de resistencia a la insulina. Estos mecanismos incluirían efectos a nivel periférico sobre el número de receptores de insulina y la cantidad de proteínas transportadoras de glucosa22,23, así como en la traducción de señales38, habiéndose planteado también efectos directos e indirectos sobre la propia célula β-pancreática39. Sin embargo, la ruta más estudiada a nivel sistémico sería el efecto común de estos tres mediadores sobre el metabolismo lipídico, orientado hacia la movilización de lípidos al plasma, especialmente ácidos grasos libres (AGL), al favorecer la lipólisis en diversos tejidos46. La acumulación intracelular de AGL genera daños por distintos mecanismos, fenómeno conocido genéricamente como lipotoxicidad47. En la década de los 60 se observó que el tabaquismo aumenta de manera aguda los AGL circulantes29. También se afectaría el perfil lipídico, habiéndose reportado en el trabajo de Facini y cols.25, que el grupo con hábito tabáquico presentó niveles significativamente más elevados de triacilgliceroles (TAG) totales, de TAG en lipoproteínas de muy baja densidad (VLDL) y de colesterol VLDL, así como una disminución importante del colesterol en lipoproteínas de alta densidad (HDL). Por tanto, desde principios de la década pasada comenzó a sugerirse que el tabaquismo induciría diabetes por su capacidad de incrementar los AGL circulantes por inducción de lipólisis a nivel sistémico48.
Un aumento de los AGL circulantes estimulan un aumento de su captación muscular, hepática y adiposa donde son rápidamente metabolizados a través de dos vías: oxidación y almacenamiento49. Cuando el flujo de estos mediadores excede la capacidad de estas vías en cualquiera de los tejidos mencionados, los AGL y/o sus intermediarios metabólicos comienzan a acumularse, afectando la traducción de la señal de la insulina por mecanismos bioquímicos (fosoforilación-desfosforilación de proteínas entre otros)50 y oxidativos (aumento de especies reactivas del oxígeno y nitrógeno)51. Por otra parte, existe evidencia de que las células β-pancreáticas serían especialmente sensibles al daño por acumulación de AGL, el cual podría derivar en disfunción y posterior muerte celular por apoptosis y/o necrosis mediante distintos mecanismos52,53.
Finalmente, no se puede descartar la existencia de mecanismos adicionales que pudiesen contribuir a la capacidad del tabaquismo para inducir resistencia a la insulina y posterior diabetes de manera independiente a la nicotina. En ese sentido el estrés oxidativo asociado a la adicción al tabaco, muy estudiado en modelos cardiovasculares54, podría tener algún rol en el desarrollo y progresión de resistencia a la insulina y posterior diabetes, más aun cuando se ha demostrado que la presencia de estrés oxidativo sería un factor clave en la pérdida periférica de sensibilidad a esta hormona55.
Desafíos para la salud pública
En septiembre de 2011, en la Reunión de Alto Nivel de Naciones Unidas, se resuelve las modalidades, formato y organización que deberán tener en cuenta los países y diferentes organismos para controlar la epidemia de ENT1. Teniendo en consideración lo anterior, la Organización Panamericana de la Salud elaboró una Estrategia para la prevención y el control de las enfermedades no transmisibles56, en la cual se pone énfasis al control y prevención de los factores de riesgo de estas enfermedades, entre los que se encuentra el tabaquismo, estrategias que el Estado chileno deberá implementar.
En el año 2003, la Organización Mundial de la Salud generó el Convenio Marco para el Control del Tabaco57. Chile, adhirió a este marco jurídico y con la nueva legislación anti-tabaco entrada en vigencia en marzo de 2013, se está dando respuesta jurídica al Convenio al haber prohibido fumar en el 100% de los lugares cerrados de uso público. No obstante lo anterior, es necesario avanzar en otros temas que tienen relación con la prevención del consumo de tabaco, especialmente en adolescentes, así como instaurar programas de cesación de hábito tabáquico para las personas que ya lo consumen.
Por otro lado, la Asociación de Diabetes de Estados Unidos58, ha señalado que es fundamental comunicar eficientemente a los profesionales y a las personas que tienen diabetes, los riesgos de fumar, y hace un llamado a las autoridades a implementar programas de cesación del hábito tabáquico, incorporando tres áreas prioritarias a trabajar en la consulta individual: 1) Evaluación del estatus de fumador, con foco en analizar el grado de dependencia del paciente a la nicotina, historias de intentos de dejar el hábito y fracaso; 2) Consejería en prevención y cesación del hábito, que puede ser realizada en la clínica ya que puede tomar entre 3 a 10 min y es crucial par prevenir el consumo o apoyar la cesación; 3) Implementación de un sistema efectivo de apoyo a la cesación, la que requiere de la implementación de guías para ser aplicadas en la rutina clínica e incluye actividades como evaluación del estatus de fumador, consejería, apoyo terapéutico y seguimiento.
Conclusiones
El consumo de tabaco es un factor de riesgo independiente de diabetes mellitus. Se están develando los mecanismos por los cuales se explicaría esta asociación. Es necesario contar con políticas de salud pública para prevenir el consumo de tabaco, especialmente en adolescentes, y a nivel clínico, es urgente implementar programas de cesación del hábito.
Referencias bibliográficas
- Naciones Unidas. Prevención y control de las Enfermedades no Transmisibles. Disponible en:
http://www.un.org/es/ga/ncdmeeting2011/. [Consultado el 12 de junio de 2013]. - U.S. Department of Health and Human Services. How Tobacco Smoke Causes Diseases: The Biology and Behavioral Basis for Smoking-Attributable Disease: A Report of the Surgeon General. Atlanta, GA: U.S. department of Health and Human Services, Centers for Disease Control and Prevention, National Center for Chronic Disease Prevention and Health Promotion, Office on Smoking and Health, 2010.
- Ministerio de Salud, 2011. Objetivos sanitarios de la década 2011-2020. Disponible en:
http://www.minsal.cl/portal/url/item/c4034eddbc96ca6de0400101640159b8.pdf. [Consultado el 28 de junio de 2013]. - Organización Mundial de la Salud. Global status report on noncommunicable diseases 2010. Disponible en:
http://www.who.int/nmh/publications/ncd_report2010/en/. [Consultado el 15 de junio de 2013]. - The DIAMOND Project Group. 2006. Incidence and trends of childhood Type 1 diabetes worldwide 1990-1999. Diabetic Medicine 23: 857-866.
- Carrasco E, Pérez-Bravo F, Dorman J, Mondragon A, Santos JL. 2006. Increasing incidence of type 1 diabetes in population from Santiago of Chile: trends in a period of 18 years (1986-2003). Diabetes Metab Res Rev 2291: 34-37.
- Ministerio de Salud de Chile, 2008. Estudio de carga enfermedad y carga atribuible. Disponible en:
http://epi.minsal.cl/epi/html/invest/cargaenf2008/Informe%20final%20carga_Enf_2007.pdf. [Consultado el 29 de junio de 2013]. - Eriksen M, Mackay J, Ross H. Atlas del Tabaco. Cuarta edición ed. Atlanta, GA: Sociedad Americana contra el Cáncer; Nueva York, NY:
Fundación Mundial del Pulmón; 2012. - Feskens EJ, Kromhout D. 1989. Cardiovascular risk factors and the 25-year incidence of diabetes mellitus in middle-aged men: the Zutphen study. Am J Epidemiol 130: 1101-1108.
- Rimm E, Manson J, Stampfer M, Colditz G, Willett W, Rosner B, et al. 1993. Cigarette smoking and the risk of diabetes in women. Am J Public Health 83: 211-214.
- Kawakami N, Takatsuka N, Shimizu H, Ishibashi H. 1997. Effets of smoking on the incidence of non-insulin-dependent diabetes mellitus. Am J Epidemiol 145: 103-109.
- Uchimoto S, Tsumura K, Hayashi T, Suematsu C, Endot G, Fujii S, et al. 1999. Impact of cigarette smoking on the incidence of type 2 diabetes mellitus in middle-aged Japanese men: the Osaka Health Survey. Diabet Med 16: 951-955.
- Will J, Galuska D, Ford E, Mokdad A, Calle E. 2001. Cigarette smoking and diabetes mellitus: evidence of a positive Association from a large prospective cohort study. Int J Epidemiol 30: 540-546.
- Wanamethee S, Shaper A, Perry I. 2001. Smoking as a modifiable risk factor for type 2 diabetes in middle-aged men. Diabetes care 24: 1590-1595.
- Eliasson M, Asplund K, Nasic S, Rodu, B. 2004. Influence of smoking and snus on the prevalence and incidence of type 2 diabetes amongst men: the northern Sweden MONICA study. J Internal Medicine 256: 101-110.
- Sairechi T, Iso H, Nishimura A, Hosoda T, Irie F, Saito Y, et al. 2004. Cigarette smoking and risk of type 2 diabetes mellitus among middle-aged and elderly Japanese men and women. Am J Epidemiol 160: 158-162.
- Patja K, Jousilahti P, Valle T, Qiao Q, Tuomilehto J. 2005. Effects of smoking, obesity and physical activity on the risk of type 2 dabetes in middle-aged Finnish men and women. J Internal Med 258: 356-362.
- Meisinger C, Döring A, Thorand B, Löwel, H. 2006. Association of cigarette smoking and tar andnicotine intake with development of type 2 diabetes mellitus in men and women from the general population: the MONICA/KOAR Augsburg cohort study. Diabetología 49: 1770-1776.
- Nagaya T, Yoshida H, Takahashi H, Kawai M. 2008. Heavy smoking raises risk for type 2 diabetes mellitus in obese men, but light smoking reduces the risk in lean men: A follow-up study in Japan. Ann Epidemiol 18: 113-118.
- Teratani T, Morimoto H, Sakata K, Oishi M, Tanaka K, Nakada S, et al. 2012. Dose-response relationship between tobacco or alcohol consumption and the development of diabetes mellitus in Japanese male workers. Drug and Alcohol dependence 125: 276-282.
- Willi C, Bodenmann P, Ghali W, Faris P, Cornuz J. 2007. Active smoking and the risk of type 2 diabetes: A Systematic review and meta-analysis. JAMA 298: 2654-2664.
- Eliasson B, Attvall S, Taskinen MR, Smith U. 1997. Smoking cessation improves insulin sensitivity in healthy middle- aged men. Eur J Clinical Investigation 27: 450-456.
- Eliasson B, Mero N, Taskinen MR, Smith U. 1997. The insulin resistance syndrome and postprandial lipid intolerance in smokers. Atherosclerosis 129: 79-88.
- Soumaya K. 2012. Molecular mechanisms of insulin resistance in diabetes. Adv Exp Med Biol 771: 240-251.
- Facchini FS, Hollenbeck CB, Jeppesen J, Chen YD, Reaven GM. 1992. Insulin resistance and cigarette smoking. Lancet 339: 1128-1130.
- Attvall S, Fowelin J, Lager I, Von Schenck H, Smith U. 1993. Smoking induces insulin resistance-a potential link with the insulin resistance syndrome. J Intern Med 233: 327-332.
- Cryer PE, Haymond MW, Santiago JV, Shah SD. 1976. Nor-epinephrine and epinephrine release and adrenergic mediation of smoking-associated hemodynamic and metabolic events. New Eng J Med 295: 573-577.
- Wilkins JN, Carlson HE, Van Vunakis H, Hill MA, Gritz E, Jarvik ME. 1982. Nicotine from cigarette smoking increases circulating levels of cortisol, growth hormone, and prolactin in male chronic smokers. Psychopharmacology 78: 305-308.
- Kershbaum A, Bellet S. 1966. Smoking as a factor in atherosclerosis: a review of epidemiological, pathological, and experimental studies. Geriatrics 21: 155-170.
- Kirschbaum C, Wust S, Strasburger CJ. 1992. ‘Normal’ cigarette smoking increases free cortisol in habitual smokers. Life Sciences 50: 435-442.
- Morgan TM, Crawford L, Stoller A, Toth D, Yeo KT, Baron JA. 2004. Acute effects of nicotine on serum glucose insulin growth hormone and cortisol in healthy smokers. Metabolism 53: 578-582.
- Møller N, Jørgensen JO. 2009. Effects of growth hormone on glucose, lipid, and protein metabolism in human subjects. Endocr Rev 30: 152-177.
- Grassi G, Seravalle G, Calhoun DA, Bolla GB, Giannattasio C, Marabini M, et al. 1994. Mechanisms responsible for sympathetic activation by cigarette smoking in humans. Circulation 90: 248-253.
- Haass M, Kübler W. 1997. Nicotine and sympathetic neurotransmission. Cardiovasc Drugs Ther 10: 657-665.
- Park J, Middlekauff HR. 2009. Altered pattern of sympathetic activity with the ovarian cycle in female smokers. Am J Physiol Heart Circ Physiol 297: H564-8.
- Richards JM, Stipelman BA, Bornovalova MA, Daughters SB, Sinha R, Lejuez CW. 2011. Biological mechanisms underlying the relationship between stress and smoking: state of the science and directions for future work. Biol Psychol 88: 1-12.
- Barth E, Albuszies G, Baumgart K, Matejovic M, Wachter U, Vogt J, et al. 2007. Glucose metabolism and catecholamines. Crit Care Med 35 (9 Suppl): S508-18.
- Günther T. 2010. The biochemical function of Mg•+ in insulin secretion, insulin signal transduction and insulin resistance. Magnes Res 23: 5-18.
- Straub SG, Sharp GW. 2012. Evolving insights regarding mechanisms for the inhibition of insulin release by norepinephrine and heterotrimeric G proteins. Am J Physiol Cell Physiol 302: C1687-98.
- Mancini T, Kola B, Mantero F, Boscaro M, Arnaldi G. 2004. High cardiovascular risk in patients with Cushing’s syndrome according to 1999 WHO/ISH guidelines. Clinical Endocrinology 61 (6): 768-777.
- Di Dalmazi G, Pagotto U, Pasquali R, Vicennati V. 2012. Glucocorticoids and type 2 diabetes: from physiology to pathology. J Nutr Metab 525093.
- Seyler LE Jr, Pomerleau OF, Fertig JB, Hunt D, Parker K. 1986. Pituitary hormone response to cigarette smoking. Pharmacol Biochem Behav 24: 159-162.
- Krag MB, Gormsen LC, Guo Z, Christiansen JS, Jensen MD, Nielsen S, et al. 2007. Growth hormone-induced insulin resistance is associated with increased intramyocellular triglyceride content but unaltered VLDL-triglyceride kinetics. Am J Physiol Endocrinol Metab 292: E920-E927.
- Sasaki-Suzuki N, Arai K, Ogata T, Kasahara K, Sakoda H, hida K, et al. 2009. Growth hormone inhibition of glucose uptake in adipocytes occurs without affecting GLUT4 translocation through an insulin receptor substrate-2-phosphatidylinositol 3-kinase-dependent pathway. J Biol Chem 284: 6061-6070.
- Takano A, Haruta T, Iwata M, Usui I, Uno T, Kawahara J, et al. 2001. Growth hormone induces cellular insulin resistance by uncoupling phosphatidylinositol 3-kinase and its downstream signals in 3T3-L1 adipocytes. Diabetes 50: 1891-1900.
- Vijayakumar A, Novosyadlyy R, Wu Y, Yakar S, LeRoith D. 2010. Biological effects of growth hormone on carbohydrate and lipid metabolism. Growth Horm IGF Res 20: 1-7.
- Gormaz JG, Rodrigo R. Nonalcoholic steatohepatitis. In: Rodrigo R, editor. 2009. Oxidative stress and antioxidants: their role in human disease. New York: Nova Science Publishers Inc 223-256.
- Bergman RN, Ader M. 2000. Free fatty acids and pathogenesis of type 2 diabetes mellitus. Trends in Endocrinology and Metabolism 11: 351-356.
- Capurso C, Capurso A. 2012. From excess adiposity to insulin resistance: the role of free fatty acids. Vascul Pharmacol 57: 91-97.
- Gao Z, Zhang X, Zuberi A, Hwang D, Quon MJ, Lefevre M, et al. 2004. Inhibition of insulin sensitivity by free fatty acids requires activation of multiple serine kinases in 3T3-L1 adipocytes. Mol Endocrinol 18: 2024-2034.
- Martins AR, Nachbar RT, Gorjao R, Vinolo MA, Festuccia WT, Lambertucci RH, et al. 2012. Mechanisms underlying skeletal muscle insulin resistance induced by fatty acids: importance of the mitochondrial function. Lipids Health Dis 11: 30.
- Cascio G, Schiera G, Di Liegro I. 2012. Dietary fatty acids in metabolic syndrome, diabetes and cardiovascular diseases. Curr Diabetes Rev 8: 2-17.
- Shao S, Yang Y, Yuan G, Zhang M, Yu X. 2013. Signaling molecules involved in lipid-induced pancreatic beta-cell dysfunction. DNA Cell Biol 32: 41-49.
- Grassi D, Desideri G, Ferri L, Aggio A, Tiberti S, Ferri C. 2010. Oxidative stress and endothelial dysfunction: say NO to cigarette smoking! Curr Pharm Des 16: 2539-2550.
- Houstis N, Rosen ED, Lander ES. 2006. Reactive oxygen species have a causal role in multiple forms of insulin resistance. Nature 440: 944-948.
- Organización Panamericana de la Salud. Estrategia para la prevención y control de las Enfermedades no Transmisible, 2012-2025. 2012. Disponible en http://new.paho.org/hq/index.php?option=com_content&view=article&id=7022&Itemid=39541&lang=es. [Consultado el 23 de junio de 2013].
- Organización Mundial de la Salud. Convenio Marco de la OMS para el control de Tabaco. 2003. Disponible en: http://www.who.int/tobacco/framework/WHO_fctc_spanish.pdf. [Consultado el 15 de junio de 2013].
- Haire-Joshu D, Glasgow RE, Tibbs TL. 2003. American Diabetes Association. Smoking and diabetes. Diabetes Care 26 Suppl 1: S89-90.