Relación entre el polimorfismo -34 Bp de la región promotora del Gen CYP17 con el perfil hormonal y metabólico en mujeres con diabetes mellitus tipo 1
Francisco Pérez B.1, Jacqueline Mohr2, Francisca Eyzaguirre C.2, Patricia López C.2, Germán Iñiguez V.2, Fernando Cassorla G.2 y Ethel Codner.2
Relationship of -34 Bp polymorphism in the promoter of Cyp17 Gene with hormonal and metabolic profile in women with type 1 diabetes mellitus
1Laboratorio de Genómica Nutricional Departamento de Nutrición. Facultad de Medicina. Universidad de Chile.
2Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile.
(Proyecto Fondecyt 1050452).
Correspondencia: Dr. Francisco Pérez Bravo Laboratorio de Genómica Nutricional Departamento de Nutrición. Facultad de Medicina. Universidad de Chile. Avda. Independencia 1027. Santiago. E-mail: fperez@med.uchile.cl
Recibido: 07 Abril de 2009
Aceptado: 04 Mayo de 2009
The P450c17a enzyme has a central role in ovarian hyperandrogenism, which is a characteristic of polycystic ovary syndrome (PCOS). Several studies have suggested a possible role for the CYP17 gene, which codes for the enzyme P450c17a and the -34bp T-C polymorphism in the development of hyperandrogenism. The presence of the Cytosine, known as A2 allele, has been associated with hyperandrogenism in patients with PCOS. Objective: To evaluate the frequency and association of the -34bp polymorphism in the CYP17 gene and determine its association with hormonal and metabolic characteristics in women with DM1. Patients and Methods: The CYP17 polymorphism was studied in 72 DM1 and 71 control women by PCR and RFLP analysis. The CYP17 genetic dosage was compared with the antropometrical characteristics and the serum concentrations of testosterone, androstenedione, DHEAS and 17OH progesterone in women with DM1. Results: Genotype A2/A2 was present in 20.8% and 7.1% of DM1 and controls, respectively (p = 0,034). Allele A2 was present in 40.3% and 27.5% of DM1 and healthy women, respectively (p = 0,031). No association between CYP17 genotypes and hormonal or metabolic characteristics was observed. Conclusion: This study shows that the frequency of the A2/A2 genotype was higher in women with DM1 than in the control group. However, no association between the presence of the polymorphism and circulating steroid levels or BMI was observed.
Key words: Type 1 diabetes, CYP17 polymorphism, Genetic Markers, Association Study, Hyperandrogenism.
La diabetes mellitus tipo 1 (DM1) es una de las enfermedades crónicas de mayor importancia en la niñez. En los últimos años la mayoría de los países en el mundo han informado de un sostenido y creciente aumento en sus tasas de incidencia. Esta patología presenta una compleja etiología en la cual se ha descrito la participación de factores genéticos y ambientales1,2.
El tratamiento actual con insulina, dieta y estricto control glicémico ha elevado la sobrevida de los pacientes con DM1; sin embargo, también han aparecido una serie de complicaciones crónicas derivadas del tratamiento3-5, entre ellas la obesidad y el síndrome de ovario poliquístico (SOP)6-12.
Dentro de los múltiples genes que se han estudiado en el campo de las hormonas sexuales, el gen CYP17, el cual codifica para el complejo citocromo P450c17a, que involucra las actividades enzimáticas 17a-hidroxilasa y 17,20-liasa, ha sido intensamente estudiado en diversas patologías y modelos metabólicos como el cáncer de mamas, el SOP, el hiperandrogenismo y otros13-15. Esta enzima tiene un rol fundamental en la regulación de la síntesis de los andrógenos ováricos y suprarrenales. El gen que codifica para dicha enzima se localiza en el brazo largo del cromosoma 10 y se ha descrito un polimorfismo de nucleótido simple (SNP) en su región promotora que se encuentra a -34 bases del sitio de iniciación, correspondiente a una sustitución de T/C que genera un nuevo sitio de unión al factor Sp1, fenomeno que se postula como una de las causas del aumento de la expresion de dicho gen (A1 presenta T y A2 presenta C). La presencia de la variante alelica A2 ha sido asociada con un exceso de androgenos circulantes. Al respecto, existen publicaciones con resultados divergentes en relacion al papel de este polimorfismo en el desarrollo del hiperandrogenismo16,17.
Varios estudios han observado un incremento en la prevalencia de hiperandrogenismo en mujeres con DM1, pero no existen estudios que analicen el posible papel de este polimorfismo (-34 bp) en la DM1. El tratamiento con insulina efectuado en mujeres con DM1 podria gatillar una sobre-expresion de CYP17, lo que podria conducir a una mayor produccion de androgenos por el ovario18-21.
El objetivo de este estudio fue evaluar la frecuencia del polimorfismo del gen -34 bp CYP17 y determinar su posible asociacion con las caracteristicas metabolicas y hormonales en mujeres con DM1.
Sujetos y Metodo
El estudio incluyo un total de 143 mujeres: 72 con DM1 y 71 controles. Se tabularon mediciones antropometricas de peso, talla e indice de masa corporal. En el grupo de pacientes diabeticas se registro la hemoglobina glicosilada (HbA1C) promedio del ultimo ano, duracion de la enfermedad y dosis diaria de insulina utilizada. El protocolo de esta investigacion fue aprobado por el Comite de Etica del Hospital San Borja Arriaran y todos los pacientes y controles entregaron su consentimiento por escrito. Se obtuvo una muestra de sangre en ayuna para estudio hormonal y obtencion de DNA. En las mujeres post-menarquicas la muestra fue obtenida en fase folicular (dias 1-7 del ciclo menstrual). Se determino la concentracion serica de esteroides sexuales: DHEAS, androstenediona, 17 OH progesterona y testosterona me. diante RIA convencional 22.
El DNA genomico fue aislado de una muestra de 5 mL de sangre periferica a traves del metodo de Schomzynki. Mediante PCR se amplifico un fragmento de DNA de 459 bp que contenia el sitio -34bp donde se encuentra la transicion T --> C utilizando los siguientes partidores: (sense) 5' -CAT TGGCACTCTGGAGTC-3 y (antisense) 5' -AGG CTCTTGGGGTACTTG-3. La reaccion de PCR se realizo en condiciones estandarizadas: volumen final de 25 μL, 80 ng de DNA genomico; 10 pmol cada partidor, 100 μM de cada dNTP, 50 μM de MgCl2, 1 U de Taq DNA polimerasa. La reaccion de PCR se realizo en 35 ciclos constituidos por: 1 minuto de denaturacion a 94o C, 1 minuto de alineamiento a 57o C y 1 minuto de extension a 72o C. Los productos de amplificacion se visualizaron en geles de agarosa al 2% con bromuro de etidio. La sustitucion C por T en la posicion -34 bp del gen CYP17 se realizo a traves de corte con la enzima de restriccion MspA1 bajo las siguientes condiciones: 10 μL de producto de amplificacion, incubacion a 37o C durante 1 hora con 4U de MspA1. El reconocimiento del sitio de restriccion da lugar a la generacion de dos fragmentos de 335 bp y 124 bp los cuales se visualizaron mediante geles de agarosa al 2% con bromuro de etidio18,19.
Analisis Estadistico
El analisis estadistico se realizo con el programa STATA 11.0. La comparacion de los perfiles hormonales (testosterona, androstenediona, DEAS y 17 OH-progesterona), edad, antiguedad de la DM1 e IMC, se llevo a cabo mediante ANOVA. Las comparaciones de frecuencia alelicas y genotipicas entre casos y controles fueron analizadas mediante las pruebas de χ2 y Prueba exacta de Fisher utilizando el programa SHESIS (URL: http://202.120.7.14/ analysis/myAnalysis.php). Se evaluo la concordancia de las frecuencias genotipicas con respecto al equilibrio de Hardy-Weinberg mediante la prueba exacta de χ2. Un valor de p menor de 0,05 fue considerado como estadisticamente significativo.
Resultados
El analisis de polimorfismo para el gen CYP17 se muestra en la Tabla 1. La distribucion alelica y genotipica se encontro en equilibrio de Hardy-Weinberg. El Genotipo A2/ A2 fue mas prevalente en el grupo DM1 (20,8%) comparado con la población de mujeres controles (7,1%; p = 0,034). El genotipo A1/A1 fue más frecuente en la población control, pero esta diferencia no fue estadísticamente significativa. La frecuencia del alelo A2 fue mayor en DM1 comparado con los controles (40,3% vs 27,5%, respectivamente, p = 0,031).
La Tabla 2 muestra los parámetros clínicos y hormonales en el grupo de mujeres con DM1 según su genotipo. Las características clínicas y hormonales no fueron diferentes según el genotipo CYP17 y tampoco se observaron diferencias en los parámetros clínicos ni hormonales según el genotipo CYP17 en las mujeres controles (Tabla 3).
Tabla 1. Distribución de genotipos y frecuencia alélica para el polimorfismo -34 bp del gen CYP17 en mujeres con DM1 y controles
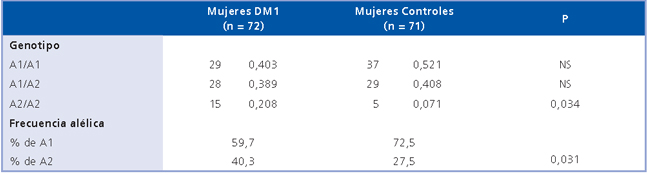
Tabla 2. Características clínicas, antropométricas y hormonales de mujeres con DM1 estratificadas de acuerdo al genotipo
CYP17
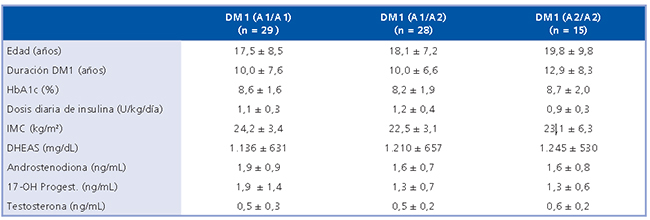
Tabla 3. Características antropométricas y hormonales de mujeres controles de acuerdo a la estratificación por genotipo CYP17
Discusion
Este estudio analizo la frecuencia de la sustitucion T --> C (polimorfismo -34 bp del gen CYP17) en un grupo de mujeres chilenas con DM1. Nuestros resultados mostraron una mayor frecuencia del genotipo A2/A2 en el grupo de mujeres con DM1 en comparacion con el grupo control y por consiguiente una mayor frecuencia alelica A2 entre las diabeticas.
Debido a la asociacion de DM1 con hiperandrogenismo y SOP, la propuesta de este estudio fue analizar la posible relacion entre la variante genetica -34 bp del gen CYP17 y DM1, dado que en la literatura existe informacion contradictoria respecto a la asociacion de este polimorfismo con el hiperandrogenismo y el SOP18,19. Hace algunos anos, Diamati-Kandarakis y cols19, describieron la distribucion de este polimorfismo entre mujeres controles y mujeres con SOP y asociaron la presencia del alelo A2 del gen CYP17 con niveles aumentados de testosterona. Este estudio, mostro una significativa mayor frecuencia del alelo A2 en el grupo de mujeres con DM1 respecto al grupo control (40,3% versus 27,5%; p = 0,031). No obstante, corresponde a una distribucion que se encuentra dentro del porcentaje de alrededor de 37-44% descrito en otras poblaciones23,24.
A pesar de la asociacion inicialmente descrita por el estudio Griego19, otras investigaciones han sido incapaces de confirmar esta asociacion16,18. Estudios recientes han relacionado al polimorfismo del gen CYP17 con alteraciones metabolicas25. Recientemente, Echiburu y col26, analizaron la frecuencia de este polimorfismo en poblacion chilena con SOP, no encontrando diferencias en la distribucion alelica y genotipica comparado con controles, aunque se postulo una posible asociacion del alelo A2 con aumento del peso corporal, adiposidad abdominal y alteraciones metabolicas. Un reciente estudio realizado en Argentina demostro una leve asociacion de este polimorfismo en pacientes con SOP, sugiriendo un papel menor en el fenotipo hiperandrogenico asociado al SOP27, aunque este efecto no ha sido observado en la poblacion coreana28. Por ultimo, este polimorfismo ha mostrado tambien resultados contradictorios cuando se ha intentado asociarlo con la edad de la menarquia29,30.
Diversas observaciones clinicas y experimentales apoyan la hipotesis de que la insulina tiene una importante actividad gonadotrofica. Esta actividad podria explicar, en parte, una serie de alteraciones clinico-metabolicas que se pueden observar en la DM1 tales como hipofuncion ovarica, amenorrea primaria, anovulacion, menarquia tardia y baja tasa de embarazos. La mayor frecuencia del alelo deletereo A2 en este grupo podria estar condicionando un comportamiento distinto de la celula frente al estimulo insulinico, aunque no observamos un perfil hormonal diferente al comparar pacientes portadoras y no portadoras.
En resumen, este estudio describe una mayor frecuencia del alelo A2 del gen CYP17 en un grupo de mujeres chilenas con DM1. Sin embargo, no se observaron asociaciones significativas entre los portadores de este alelo A2 y niveles aumentados de androgenos o alteraciones del control metabolico en pacientes con DM1.
Agradecimientos
Este trabajo fue financiado a traves del Proyecto FONDECYT 1050452 (Dra. Ethel Codner). Los autores agradecen a la Sra. Alejandra Avila el excelente apoyo de enfermeria, y a todas las pacientes y controles que participaron de este estudio y el apoyo logistico aportado por el Hospital San Borja Arriaran. Este trabajo constituyo la estadia de investigacion en Chile de la alumna Jacqueline Mohr proveniente de la Universidad de Leiden, Holanda.
Referencias
- Skyler JS. 2008. Type 1 Diabetes TrialNet Study Group. Update on worldwide efforts to prevent type 1 diabetes. Ann N Y Acad Sci 1150: 190-196.
- Hawa MI, Beyan H, Buckley LR, Graham RD. 2002. Impact of genetic and non-genetic factors in type 1 diabetes. Am J Med Genet 115: 8-17.
- Jacob AN, Salinas K, Adams-Huet B, Raskin P. 2006 Potential causes of weight gain in type 1 diabetes mellitus. Diabetes Obes Metab 8: 404-411.
- Libman IM, Pietropaolo M, Arslanian SA, LaPorte RE, Becker DJ. 2003. Changing prevalence of overweight children and adolescents at onset of insulin-treated diabetes. Diabetes Care 26: 2871-2875.
- De Block CE, De Leeuw IH, Van Gaal LF. 2005. Impact of overweight on chronic microvascular complications in type 1 diabetic patients. Diabetes Care 28: 1649-1655.
- Thorn LM, Forsblom C, Fagerudd J, Thomas MC, Pettersson- Fernholm K, Saraheimo M, et al. 2005. Metabolic syndrome in type 1 diabetes: association with diabetic nephropathy and glycemic control:the FinnDiane study). Diabetes Care 28: 2019- 2024.
- McGill M, Molyneaux L, Twigg SM, Yue DK. 2008. The metabolic syndrome in type 1 diabetes: does it exist and does it matter? J Diabetes Complications 22: 18-23.
- Sandhu N, Witmans MB, Lemay JF, Crawford S, Jadavji N, Pacaud D. 2008. Prevalence of overweight and obesity in children and adolescents with type 1 diabetes mellitus. J Pediatr Endocrinol Metab 21: 631-640.
- Ljungkrantz M, Ludvigsson J, Samuelsson U. 2008. Type 1 diabetes: increased height and weight gains in early childhood. Pediatr Diabetes 9: 50-56.
- Escobar- Morreale HF, Roldan B, Barrio R, Alonso M, Sancho J, de la Calle H, et al. 2000. High prevalence of the polycystic ovary syndrome and hirsutism in women with type 1 diabetes mellitus. J Clin Endocrinol Metab 85: 4182-4187.
- Codner E, Soto N, Lopez P, Trejo L, Avila A, Eyzaguirre F, et al. 2006. Diagnostic Criteria for Polycystic Ovary Syndrome and Ovarian Morphology in Women with Type 1 Diabetes Mellitus. J Clin Endocrinol Metab 91: 2250-2256.
- Codner E, Escobar-Morreale H. 2007. Hyperandrogenism and Polycystic Ovary Syndrome in Women with Type 1 Diabetes Mellitus. J Clin Endocrinol Metab 92: 1209-1216.
- Gambineri A, Pelusi C, Vicennati V, Pagotto U, Pasquali R. 2002. Obesity and the polycystic ovary syndrome. Int J Obes Relat Metab Disord 26: 883-896.
- Corbould A. 2008. Effects of androgens on insulin action in women: is androgen excess a component of female metabolic syndrome?. Diabetes Metab Res Rev 24: 520-532.
- Bugano DD, Conforti-Froes N, Yamagushi MN. 2008. Baracat EC. Genetic polymorphisms, the metabolism of estrogens and breast cancer: a review. Eur J Gynaecol Oncol 29: 313-320.
- Franks S. 1997. The 17 alpha-hydroxylase/17,20 lyase gene (CYP17) and polycystic ovary syndrome. Clin Endocrinol (Oxf) 46: 135-136.
- Berstein LM, Imyanitov EN, Gamajunova VB, Kovalevskij AJ, Kuligina ESh, Belogubova EV, et al. 2002. CYP17 genetic polymorphism in endometrial cancer: are only steroids involved?. Cancer Lett 180:47-53.
- Techatraisak K, Conway GS, Rumsby G. 1997. Frequency of a polymorphism in the regulatory region of the 17 alphahydroxylase- 17,20-lyase (CYP17) gene in hyperandrogenic states. Clin Endocrinol (Oxf) 46: 131-134.
- Diamanti-Kandarakis E, Bartzis MI, Zapanti ED, Spina GG, Filandra FA, Tsianateli TC, et al. 1999. Polymorphism T--> C (-34 bp) of gene CYP17 promoter in Greek patients with polycystic ovary syndrome; Fertility and Sterility 71: 431-435.
- Tee MK, Dong Q, Miller WL. 2008. Pathways Leading to Phosphorylation of P450c17 and to the Posttranslational Regulation of Androgen Biosynthesis. Endocrinology 149: 2667-2677.
- Bremer AA, Miller WL. 2008. The serine phosphorylation hypothesis of polycystic ovary syndrome: a unifying mechanism for hyperandrogenemia and insulin resistance. Fertil Steril 89: 1039-1048.
- Codner E, Mook-Kanamori D, Bazaes RA, Unanue N, Sovino H, Ugarte F, et al. 2005. Ovarian Function during Puberty in Girls with Type 1 Diabetes Mellitus: Response to Leuprolide. J Clin Endocrinol Metab 90: 3939-3945.
- Gharani N, Waterworth DM, Williamson R, Franks S. 1996. 5' polymorphism of the CYP17 gene is not associated with serum testosterone levels in women with polycystic ovaries. J Clin Endocrinol Metab 81: 4174. doi:10.1210/jc.81.11.4174.
- Marszalek B, Lacinski M, Babych N, Capla E, Biernacka-Lukanty J, Warenik-Szymankiewicz A, et al. 2001. Investigations on the genetic polymorphism in the region of CYP17 gene encoding 5'-UTR in patients with polycystic ovarian syndrome. Gynecol Endocrinol 15: 123-128.
- Ohnishi T, Ogawa Y, Saibara T, Nishioka A, Kariya S, Focumoto M, et al. 2005. CYP17 polymorphism as a risk factor of tamoxifeninduced hepatic steatosis in breast cancer patients. Oncol Rep 13: 485-489
- Echiburu B, Perez-Bravo F, Maliqueo M, Sanchez F, Crisosto N, Sir-Petermann T. 2008. Polymorphism T > C (-34 base pairs) of gen CYP17 promoter in women with polycystic ovary syndrome is associated with increased body weight and insulin resistance: a preliminary study. Metabolism 57: 1765-1771.
- Perez MS, Cerrone GE, Benecia H, Marquez N, De Piano E, Frechtel G. 2008. Polimorfismos en los genes CYP11ƒ¿ y CYP17 y etiologia del hiperandrogenismo en pacientes con poliquistosis ovarica. Medicina (Buenos Aires) 68: 129-134.
- Park JM, Lee EJ, Ramakrishna S, Cha DH, Baek KH. 2008. Association study for single nucleotide polymorphisms in the CYP17A1 gene and polycystic ovary syndrome. Int J Mol Med 22: 249-254.
- Pei YF, Zhang L, Deng HW, Dvornyk V. 2008. CYP17 MspA1 polymorphism and age at menarche: a meta-analysis. Dis Markers 25: 87-95.
- Mitchell ES, Farin FM, Stapleton PL, Tsai JM, Tao EY, Smith-DiJulio K, et al. 2008. Association of estrogeno-related polymorphisms with age at menarche, age at final menstrual period and stages of the menopausal transition. Menopause 15: 105-111.