Alta frecuencia de patología tiroidea funcional y autoinmune en mujeres embarazadas chilenas catalogadas como sanas
Carmen Castillo S.1, Marisol García M.1, Carolina Martínez C.1, Jorge Carvajal C.2, Carmen Campino J.1, Eugenio Arteaga U.1, Lorena Mosso G.1
High frequency of functional and autoimmune thyroid disease in women classified as healthy Chilean pregnant
Departamentos de Endocrinología1 y Obstetricia y Ginecología2. Pontificia Universidad Católica de Chile.
Proyecto de Investigación concurso SOCHED 2007-05.
Correspondencia: Lorena Mosso Departamento de Endocrinología Facultad de Medicina, Pontificia Universidad Católica de Chile Lira 85, piso 5 Santiago, Chile Fono: (56-2) 354-3095 Fax: (56-2) 638-5675 E-mail: mosso@med.puc.cl
Recibido: 30 Marzo de 2009
Aceptado: 08 Junio de 2009
Background: Untreated functional thyroid diseases are a risk factor for maternal and fetal complications during pregnancy. Aim: To determine the frequency of functional or autoimmune thyroid disease in healthy women during the first trimester of pregnancy. Subjets and Methods: Healthy pregnant women attending a routine consult during their first trimester of pregnancy were studied. Thyroid stimulating hormone (TSH), total and free thyroxin (T4) anti-thyroid peroxidase (TPO) antibodies and spot urine iodine levels were measured. The reference ranges provided by the Atlanta Georgia Consensus in 2004 were used as normal values. A urine iodine concentration < 150 ug/L was considered low. Results: One hundred women age 30 ± 5 years with a mean gestational age of 8,8 ± 1,9 weeks, were studied. The frequencies of subclinical hypothyroidism, clinical hypothyroidism, isolated low thyroxin levels, high antiTPO antibodies and low urine iodine levels were 19, 2, 3, 13 and 15%, respectively. Women with high TSH levels had lower total and free T4 levels. Conclusions: Twenty one percent of this sample of apparently healthy pregnant women had a clinical or subclinical hypothyroidism.
Key words: Embarazo, tiroides, hipotiroidismo, anticuerpos TPO, yoduria.
La función tiroidea materna es fundamental durante el embarazo. Las hormonas tiroideas (HT) son importantes para el crecimiento y la diferenciación de muchos órganos y resultan esenciales para el desarrollo normal del feto, especialmente en el aspecto neurológico. En el primer trimestre del embarazo prácticamente no hay función tiroidea fetal propia y las HT presentes en las cavidades embrionarias humanas son de origen materno. La producción fetal de HT comienza recién en el tercer trimestre. Durante todo el embarazo hay una demanda fetal permanente de HT materna y es la placenta la que permite que T4 y T3 pasen de la madre al feto1.
Recientemente se han publicado acuerdos de expertos en este tema, resumidos en el Consenso de Atlanta-Georgia de 2004 sobre enfermedades tiroideas maternas y desarrollo fetal2 y las Guías de la Endocrine Society, USA, para el estudio y tratamiento de la enfermedad tiroidea durante el embarazo3. En estos consensos, se ha establecido que la enfermedad tiroidea materna durante la gestación condiciona un aumento del riesgo de morbilidad y mortalidad fetal y materna4.
El daño intelectual para los hijos de madres hipotiroideas no tratadas es un hecho conocido. Haddow y col5, realizaron un estudio cuidadoso observando la asociación entre los niveles maternos elevados de TSH sérica en el segundo trimestre de embarazo y el desempeño neuropsicológico de los niños a la edad de 7-9 años. En este estudio, los hijos de mujeres hipotiroideas no tratadas tenían coeficientes intelectuales inferiores a los controles, mientras que los niños de madres tratadas tenían un desempeño similar a los controles. Las madres tratadas tenían TSH y T4 libre similares a las madres no tratadas en el segundo trimestre.
Un analisis posterior de los datos demostro que la baja puntuacion del coeficiente intelectual en los ninos de madres no tratadas tenia una estrecha correlacion con la TSH materna en el momento del tamizaje6.
Otros efectos deletereos del hipotiroidismo materno clinico o subclinico durante el embarazo son una mayor frecuencia de hipertension arterial, diabetes, aborto y parto prematuro7,8. El estudio poblacional mas completo que analiza la asociacion entre hipotiroidismo y complicaciones del embarazo fue realizado por Casey y col9, quienes estudiaron 17.298 embarazadas, con una edad gestacional de 20 semanas o menos. Se identifico la presencia de hipotiroidismo subclinico en 2,3% de esa poblacion. Las mujeres con hipotiroidismo subclinico tenian 3 veces mas incidencia de desprendimiento de placenta y 2 veces mas de parto prematuro (nacimiento ≤ 34 semanas de gestacion).
Existen datos que la sola presencia de anticuerpos antitiroideos, sin alteraciones funcionales, tambien puede afectar el curso de una gestacion10-12. Diferentes autores han demostrado un incremento del riesgo de aborto y parto prematuro, y la aparicion de hipotiroidismo durante el curso del embarazo por la mayor demanda tiroidea en ese periodo. De hecho, Negro et al11, comprobo que al tratar con levotiroxina a las embarazadas eutiroideas con TPO positivos, tenian menos frecuencia de abortos y partos prematuros que las pacientes similares no tratadas e igual que las embarazadas controles (TPO negativo).
Otro aspecto importante de considerar es la condicion materna respecto del yodo en la funcion tiroidea de este periodo. Se ha demostrado que mujeres embarazadas con deficit de yodo tienen TSH mas alta y T4 total mas baja13. El requerimiento de yodo aumenta durante el embarazo, y asi, aun en paises con suplemento de yodo como Chile, muchas madres pueden tener deficit del elemento. En EEUU, el estudio NHANES, mostro una excrecion urinaria de yodo baja en 14,9% de las mujeres en edad de procrear y 6,7% durante el embarazo14. En Chile, actualmente tenemos legislacion para yodacion de la sal, con mediciones de yodurias normales altas en diferentes partes del pais15, pero no existen datos especificos en embarazadas o mujeres en edad fertil.
En estudios poblacionales, la enfermedad tiroidea durante la gestacion, ha demostrado ser mas frecuente de lo pensado16,17. Muchas mujeres no dan el antecedente de patologia tiroidea cuando comienzan su embarazo, pese a que la enfermedad puede estar presente, siendo asintomatica o subclinica. El embarazo es un estado de alta demanda para la tiroides; la TBG aumenta, con lo que se requiere mayor sintesis de hormona tiroidea para mantener los niveles de hormona libre. Ademas, la placenta metaboliza hormonas tiroideas, mientras la gonadotropina corionica estimula la produccion tiroidea de HT y la depuracion renal de yodo aumenta; todo lo anterior hace mas probable que aparezca o se acentue la enfermedad tiroidea oculta previamente1,18.
En Chile, no existe informacion que de cuenta de la incidencia de patologia tiroidea en mujeres embarazadas, solo hay pocos datos de parametros tiroideos en mujeres sin antecedentes familiares de enfermedad tiroidea, sin bocio y sin patologia tiroidea autoinmune durante la gravidez. El estudio mas relevante fue publicado por Wohllk19 en 1993, que determino la funcionalidad tiroidea en los diferentes trimestres del embarazo en un total de 53 pacientes, estableciendo el comportamiento de las hormonas tiroideas durante la gestacion.
Pese al conocido riesgo materno y fetal que implica la patologia tiroidea no tratada, y a la probablemente alta incidencia de enfermedad subclinica o asintomatica, no existe una politica de tamizaje de hormonas tiroideas y anticuerpos anti-TPO para toda mujer embarazada en su control prenatal, probablemente porque se requieren mas datos que indiquen la prevalencia de la enfermedad, ademas de comprobar que los efectos deletereos sobre la madre y el feto disminuyen con la intervencion.
El objetivo de nuestro trabajo fue determinar la frecuencia de patologia tiroidea tanto funcional como autoinmune y el estado de yodo en mujeres catalogadas como sanas durante el primer trimestre de su embarazo, en el control obstetrico ambulatorio habitual.
Metodos
Se reclutaron pacientes embarazadas cursando el primer trimestre del embarazo, en control regular en el Policlinico ambulatorio de Obstetricia de la Pontificia Universidad Catolica de Chile. Los criterios de ingreso fueron: ser mayor de 18 anos, cursar un embarazo unico, tener una edad gestacional calculada por ecografia precoz ≤ 12 semanas (primer trimestre). Los criterios de exclusion fueron: tener antecedentes personales de patologia tiroidea diagnosticada antes del embarazo, uso de farmacos que alteren la determinacion de hormonas tiroideas tales como anticonvulsivantes, antidepresivos o antipsicoticos de nueva generacion, antecedentes personales de otras enfermedades autoinmunes, patologias cronicas intercurrentes como dia. betes mellitus o hipertension arterial. Todas las pacientes firmaron un consentimiento informado y el desarrollo del trabajo conto con aprobacion del Comite de Etica de la Facultad de Medicina de la Pontificia Universidad Catolica de Chile.
A las pacientes incluidas se les tomo una muestra de sangre para medicion de TSH, T4 total, T4 libre, anticuerpos antiTPO y una de orina para yoduria. Todas estas muestras se procesaron en el laboratorio de Bioquimica de la Pontificia Universidad Catolica. La medicion de TSH ultrasensible se hizo con Inmunoensayo competitivo de electroquimioluminiscencia (Modular Analitics E 170, ROCHE). La deteccion minima fue < 0,01 μUI/mL y el coeficiente de variacion fue 7,2% para concentracion de 0,035 μUI/mL y 3,3% para concentracion de 3,66 μUI/mL. La medicion de T4 total se realizo con Inmunoensayo competitivo de electroquimioluminiscencia (Modular Analitics E 170, ROCHE). Los valores normales estaban comprendidos entre 4,6 y 12 μg/dL, con coeficiente de variacion de 3,7% para niveles de 5,1 μg/dL y 4,2% para niveles de 18 μg/dL. La medicion de T4 libre se llevo a cabo con un Inmunoensayo competitivo de electroquimioluminiscencia (Modular Analitics E 170, ROCHE). El valor normal es de 0,93-1,7 ng/dL, y el coeficiente de variacion 2,7% para concentracion de 1,16 ng/dL y de 3,6% para concentracion de 2,0 ng/ dL. La medicion de anticuerpos antiTPO se efectuo con determinacion cuantitativa de anticuerpos antiperoxidasa tiroidea (antiTPO), a traves de un enzimoinmunoensayo de microparticulas (AXSYM-ABBOT), anticuerpos dirigidos contra la enzima peroxidasa de ubicacion microsomal y que cataliza la yodacion de las moleculas de tiroglobulina. La medicion de yoduria en la muestra de orina matinal aislada se verifico por metodo de oxido reduccion por HPLC.
Se definieron como alterados aquellos valores de TSH > 2,55 μUI/mL o < 0,03 μUI/mL. La T4 total se considero normal entre 6,9 y 18 ug/dL (correspondiente a 1,5 veces la dispersion de nuestro laboratorio), segun lo establecido en el Consenso de Atlanta-Georgia de 2004 sobre enfermedades tiroideas maternas y desarrollo fetal. Se definio como baja aquella yoduria < 150 μg/L, lo que indica un consumo diario < 250 μg al dia, valor considerado como representativo de una ingesta adecuada durante el embarazo.
Todas las pacientes llenaron un cuestionario sobre antecedentes personales y familiares relacionados con pato. logia tiroidea, incluyendo: edad, formula obstetrica (numero de abortos o perdidas fetales); tambien antecedentes de infertilidad e irregularidad menstrual, partos prematuros, desprendimiento placentario, preeclampsia, retardo del crecimiento intrauterino, hijos con retardo en el desarrollo intelectual y cognitivo; ademas, antecedentes personales de bocio, radiacion cervical, cirugia de cuello, yodo radioactivo, depresion pre o postparto y antecedentes familiares, de primer y segundo grado, de patologia tiroidea o enfermedades autoinmunes. A todas se les realizo un examen fisico general y tiroideo. El resultado de los examenes se comunico en forma oportuna a la paciente y a su medico tratante, y en aquellas con examenes alterados, se decidio con este el tratamiento o conducta de seguimiento. A las pacientes que presentaron alteraciones en los examenes iniciales se les repitieron durante el 2° y 3er trimestre, independiente de si habian requerido o no tratamiento. El seguimiento de cada una de las pacientes duro hasta el parto.
Para determinar el tamano muestral de nuestro estudio se considero que se trataba de un estudio de cohorte, pros. pectivo, donde se intenta demostrar que no hay diferencia con respecto a la incidencia de esta enfermedad en otras poblaciones. La poblacion de referencia tiene una incidencia de 15% de patologia tiroidea. Para el calculo del tamano muestral consideramos que si la poblacion chilena tuviera una diferencia de 5% respecto de esa poblacion (es decir menos de 10% de incidencia), asumiendo un error alfa de 5% y un poder de 80%, se requeria de 95 pacientes reclutadas. Se decidio incluir a 100 pacientes, considerando la eventualidad de una perdida de seguimiento de 5%.
Para el analisis estadistico todos los resultados se compararon mediante test de χ2. Se considero una diferencia como estadisticamente significativa cuando el valor p era < 0,05. Las variables nominales se establecieron por frecuencia numerica con promedios y desviacion estandar (DS). Las variables continuas se calcularon en promedio, con DS y percentiles. Las variables continuas se analizaron por correlacion de Pearson. Cuando la correlacion fue significativa, se estimo regresion lineal simple. La fuerza de la asociacion se midio a traves del riesgo relativo.
Resultados
Pacientes
Se invitaron a participar a un total de 102 gestantes entre septiembre de 2007 y enero de 2009, pero solo 100 de ellas completaron el reclutamiento. La edad promedio fue 29,7 ± 5,0 anos, con una dispersion entre 19 y 46 anos. La edad gestacional de reclutamiento fue en promedio a las 8,8 ± 1,9 semanas. El IMC promedio de las embarazadas fue 24,2 ± 3,4 kg/m2. La presion arterial (PA) fue normal en todas las embarazadas. Al examen fisico la tiroides se palpaba de mayor tamano y/o consistencia en 48% de las embarazadas. En relacion a los antecedentes personales y familiares de las madres, 23% habia tenido algun aborto espontaneo, 31% fumaba al momento de quedar embarazada, 26% habia sido tratada alguna vez por alteraciones del animo, 26% daba el antecedente de alteraciones menstruales, 41% tenia historial de enfermedad tiroidea en algun familiar de primer o segundo grado y 15% daba el antecedente de infertilidad primaria o secundaria.
Funcion tiroidea
En relacion a los examenes para evaluar disfuncion tiroidea, se resumen en la Tabla 1. Los anticuerpos anti TPO fueron positivos en el 13%. Las pacientes con TSH > 2,55 μUI/mL representaban el 21% y con TSH ≤ 0,4 μUI/mL un 10%, todas ellas clinicamente eutiroideas y con TSH que se normalizo en todas en el control a las 6-8 semanas despues del primero. Con TSH . 0,03 uUI/mL (bajo percentil 2,5 en estudio de pacientes chinas sanas embarazadas. Panesar NS, 2001) solo hubo una paciente (1%). Por lo tanto, las pacientes que presentaron hipotiroidismo subclinico (TSH alta y T4 normal) representaron el 19%, con hipotiroidismo clinico (TSH alta con T4 baja) el 2%, con hipertiroidismo subclinico (TSH baja con T4 normal) el 1% (bajo el percentil 2,5 para el primer trimestre del embarazo) y con hipotiroxinemia aislada (T4 baja con TSH normal) el 3%, lo que no es diferente al tomar en cuenta los valores de T4 libre.
Tabla 1. Características generales de la población de embarazadas (n = 100) y su función tiroidea
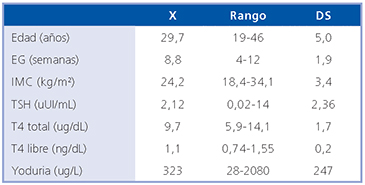
EG: Edad Gestacional. IMC: Índice Masa Corporal
Se correlaciono la funcion tiroidea con otras variables. No se encontro correlacion entre edad y TSH (p = 0,11), pero al separarlas por tramos del valor de TSH, hay una tendencia a establecer que las pacientes con TSH mas alta tienen mas edad, pero ello sin significancia estadistica.
En pacientes con TSH normal, los anticuerpos anti TPO positivos determinaron TSH más alta, T4 total y T4 libre más bajas con significancia estadística (Figura 1). En el caso de TSH la diferencia se hace más marcada al incluirse todas las pacientes (p = 0,001), encontrándose la TSH promedio, con TPO positivos de 3,7 μUI/mL y sin TPO de 1,8 μUI/mL.
Las pacientes con TSH alta tenían T4 total y T4 libre más bajas que con TSH normal (p = 0,0005 y 0,0001, respectivamente) (Figura 2). También existe correlación proporcional significativa entre los valores de T4 y T4 libre (p = 0,00001).
No se encontro relacion entre la alteracion de TSH y el antecedente de alteraciones del animo, infertilidad, irregularidad menstrual, antecedentes de familiares con patologia tiroidea, o de abortos.
Se demostro una tendencia en que los pacientes con TSH alta presentan menores valores de yoduria (ug/g crea) (p = 0,09) (Figura 2).
Existe relacion entre encontrar glandula tiroides alterada a la palpacion y la funcion tiroidea (p = 0,05), pero ello es solo una tendencia cuando hay AcTPO positivos (p = 0,09).
Los valores de yoduria promedio 322,4 ± 311,1 ug/g creatinina o 32,3 ± 24,7 μg/dL. En el 15% de los casos (evaluado en 93 pacientes) se detectó yoduria baja, sin encontrar relación entre yoduria, T4 total o T4 libre.
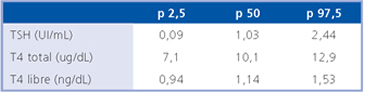
En base a los valores establecidos como normales para TSH en este grupo de pacientes, se establecieron los percentiles 2,5 y 97,5 para las variables TSH, T4 y T4 libre con negatividad de anticuerpos anti TPO (Tabla 2).
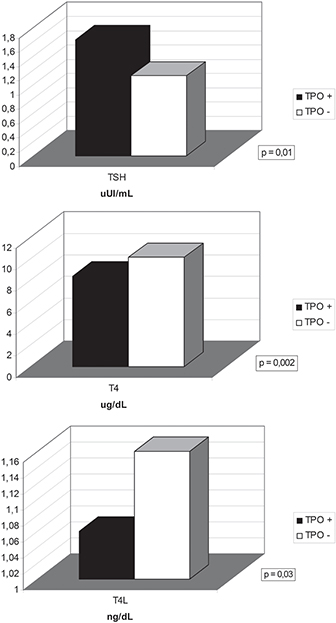
Figura 1. Concentraciones de TSH, T4 y T4L según la presencia o no de anticuerpos anti TPO en embarazadas con TSH normal.
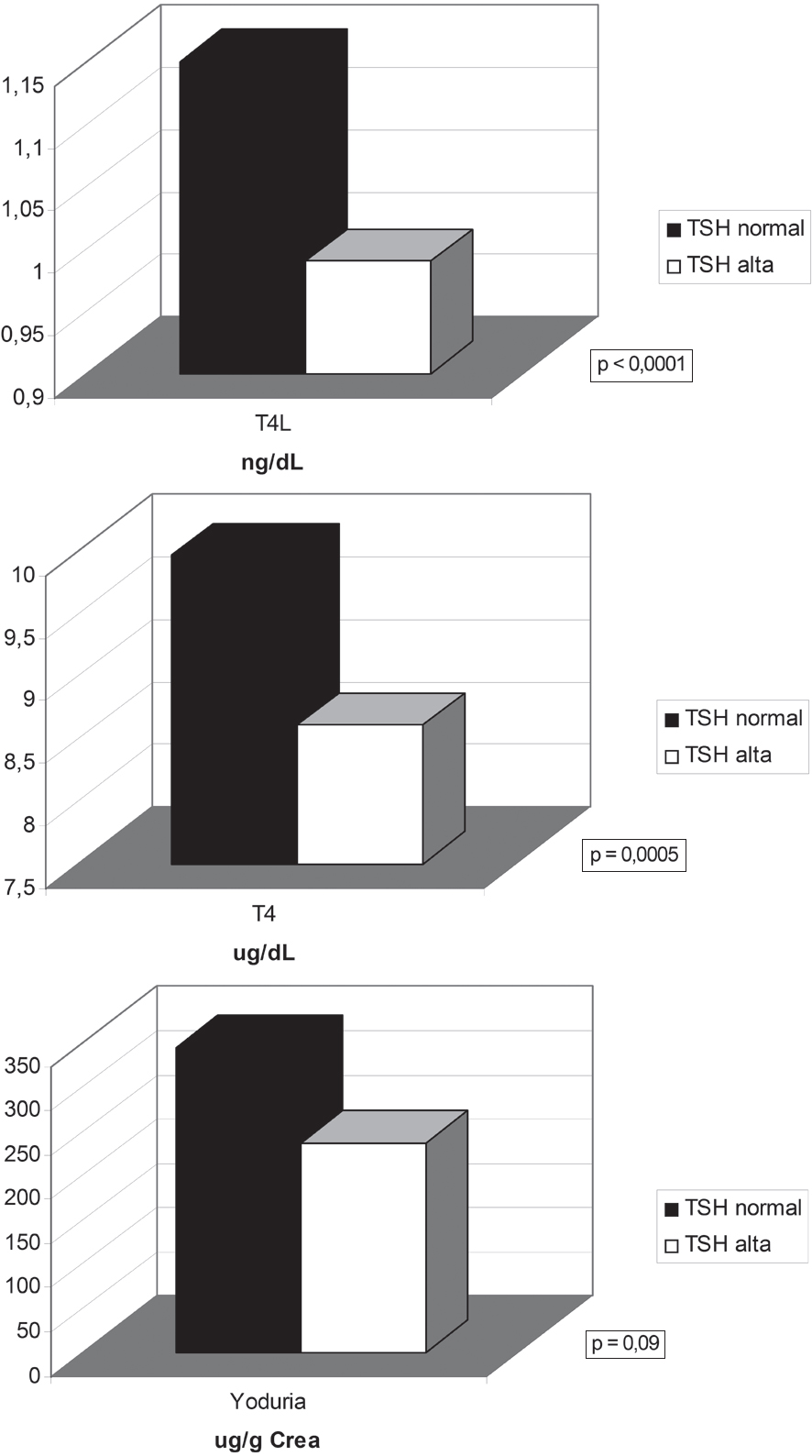
Figura 2. Concentraciones de T4L, T4 y yoduria según los niveles de TSH.
Tabla 2. Percentiles en mujeres embarazadas en el primer trimestre con TSH normal y anticuerpos anti TPO negativos
Seguimiento
Todas las pacientes con TSH elevada iniciaron trata. miento con Levotiroxina (Eutirox®) para llevar la TSH a nivel normal, segun el trimestre del embarazo, lo mas rapido posible. De las 21 pacientes tratadas, solo dos lo suspendieron al poco tiempo por decision propia. A todas se les controlo TSH, T4 y T4 libre, al menos una vez por cada trimestre, a lo largo de todo el embarazo. Las pacientes con anticuerpos anti TPO positivos, pero sin alteracion de la funcion tiroidea, solo tuvieron seguimiento funcional en cada trimestre.
Durante el seguimiento, se registraron 5 abortos o pérdidas fetales, cifra que representa un 5,8% de las madres que hasta la fecha han completado el seguimiento, sin demostrarse diferencia entre aquellas con alteración de la función tiroidea y las normales. Sin embargo, se debe destacar que en 3 de los 5 casos la madre presentaba hipotiroidismo, en 1 caso había TPO positivo y el otro no exhibía patología tiroídea materna.
Discusión
Siguiendo las pautas actuales para el diagnóstico y tratamiento de las enfermedades tiroideas en el embarazo, encontramos una alta frecuencia de trastornos tiroideos en embarazadas consideradas sanas de acuerdo a los estándares habituales y a la evaluación de sus médicos tratantes.
La frecuencia de trastornos funcionales detectados, utilizando los datos de referencia de normalidad según consensos internacionales en uso, es muy superior en nuestra casuística a la descrita para otras poblaciones. La prevalencia de hipotiroidismo clínico estimado fluctúa entre 0,3 a 0,5% y de hipotiroidismo subclínico8,9,20 entre 2 y 3%; en nuestra población encontramos un 19% de hipotiroidismo subclínico y 2% con hipotiroidismo clínico.
Las normas actuales recomiendan que en caso de hipo–tiroidismo materno manifiesto, debe titularse la dosificación de
tiroxina para llegar rápidamente a concentraciones se TSH < 2,5 μUI/mL en el 1er trimestre o < 3 μU/ml en el 2do y 3er
trimestre, o valores de TSH normales propios del trimestre
y manteniendo esos niveles (información de nivel A, buena
evidencia). Si la madre tiene hipotiroidismo subclínico se
recomienda dar T4, dado que los beneficios compensan los
riesgos potenciales. Para el resultado obstétrico el nivel es
tipo B con evidencia regular, y para el resultado neurológico
nivel I con evidencia pobre. Si a la madre se le diagnostica
hipotiroidismo antes del embarazo, se recomienda ajustar la
dosis de TSH antes de la concepción a un nivel no superior
a 2,5 μU/L (nivel I, evidencia pobre). En general, se plantea
que el nivel óptimo de la concentración de TSH debería estar
entre 0,5 y 1 μU/mL, pues en tal caso, es menos probable
que se deba aumentar la dosis durante el embarazo3. En otros
trabajos que aseveran que no habría mayor riesgo materno
fetal en las embarazadas con disfunción tiroidea, hay varias
observaciones que comentar. Lambert-Messerlian21 en un
grupo de 9.562 mujeres (FaSTER trial of Down síndrome
screening) mostraron valores de TSH de 0,12 y 2,68 μUI/
mL para embarazadas con anticuerpos negativos y de 0,32
y 5,17 μUI/mL para gestantes con anticuerpos positivos
durante el primer trimestre, y referido a los percentiles 5 y
95, respectivamente. En conjunto, los valores de TSH fueron
de 0,13 y 4,15 μUI/mL, para el primer trimestre y 0,36 y
3,77 μUI/mL en el segundo trimestre para los percentiles
5 y 98, respectivamente. Por lo tanto, estas cifras pueden
ser levemente mayores a las indicadas en las guías de la
Endocrine Society, pero cabe destacar que para determinar
las dispersiones se usaron pacientes con más de 11 semanas
de gestación, es decir, al final del primer trimestre.
Nuestros valores promedios de TSH fueron semejantes a los descritos internacionalmente; sin embargo, la TSH en nuestra muestra fue relativamente mayor respecto de los estudios más grandes de Casey9 y Panesar22, por ello, es necesario un estudio poblacional más extenso para evaluar este aspecto. En el estudio de Casey9, con 17.298 mujeres, se determinaron valores de TSH entre 0,08 y 3 μUI/mL (percentiles 2,5 y 97,5), pero de madres en la primera mitad del embarazo, y por lo tanto, con edad gestacional menor de 20 semanas, y no específicamente para el primer trimestre.
Para nuestros resultados hay que considerar que se hayan incorporado a este tamizaje un mayor número (43%) de mujeres con antecedentes familiares de enfermedad tiroidea respecto de la población general; sin embargo, no se encontró relación entre este antecedente y el valor de TSH, aunque no se indagó la presencia de patología tiroidea ecográfica en pacientes con antecedentes familiares. Un consumo bajo de yodo en nuestra población no parece sustentable dado que el porcentaje de pacientes con yoduria baja es similar al descrito para otras poblaciones14.
Respecto a la hipotiroxinemia existe menos consenso respecto a tratar o no a dichas personas. Hay trabajos que señalan detrimento en el desarrollo neuropsicológico de los hijos de mujeres con hipotiroxinemia (bajo el percentil 10 a las 12 semanas) versus los de madres con T4 normal23, circunstancia que puede afectar independientemente de los valores de TSH o la presencia de anticuerpos antitiroideos24.
En cuanto a resultados maternos fetales, no habría mayor riesgo de HTA, diabetes, parto prematuro o desprendimiento de placenta al comparar con mujeres eutiroideas25. En relación a la enfermedad tiroidea autoinmune encontramos 13% de pacientes con anticuerpos anti TPO positivos, dado que es similar al comunicado en otras poblaciones26 y levemente mayor a datos de población general en Chile27. La autoinmunidad es de alto riesgo en embarazo y su rol está claramente establecido en el riesgo de aborto, parto prematuro y asociación con déficit neurológico, así como el riesgo de hacer tiroiditis postparto10-12. Un 50% de las mujeres con anticuerpos anti TPO positivo en el embarazo, desarrollará algún grado de tiroiditis post parto.
A nivel mundial, la deficiencia de yodo es la causa más importante de insuficiencia tiroidea. Según los datos de la Organización Mundial de la Salud del 2004, alrededor de 40% de la población mundial no está recibiendo la dosis propuesta de 150 μg de yodo por día, o 250 μg para las mujeres embarazadas y nodrizas. Incluso, en los países con suplemento de yodo o programas de yodación de sal, muchas mujeres jóvenes tienen deficiencia de yodo, como lo comunicó el estudio de Zimmermann28 en el 28% de las embarazadas, o el estudio US-NHANES, que mostró excreción urinaria de yodo < de 50 μg/L en el 11,7% de la población general y en el 14,9% en mujeres en edad fértil14. En consecuencia, la política de yodación de sal es suficiente para los niños, pero no así para mujeres embarazadas o en período de lactancia. El indicador de la ingesta de yodo más usado es la medición de la excreción urinaria del halógeno, ya que el cálculo en base a medición de ingesta por encuestas es impreciso29. La deficiencia de yodo es reconocida desde 1986 como la causa más frecuente, después de la desnutrición, de alteraciones mentales prevenibles en el recién nacido. En casos de yoduria con insuficiencia leve (50-100 μg/L) a moderada (20-49 μg/L), la tiroides privilegia la producción de T3 versus T4, sin aumento compensatorio de TSH, aunque existe hipotiroxinemia, que no es fácil de diagnosticar; así, en consecuencia, existe una cantidad insuficiente de T4 para el desarrollo neurológico normal del feto. Sólo 37% de las embarazadas tendría una ingesta adecuada de yodo28,30. En Chile, el estudio de Téllez et al31, mostró una alta prevalencia de bocio en mujeres embarazadas eutiroideas, con excreción de yodo urinario normal en 87,2% (μg/g creatinina). No sucede lo mismo en otro estudio chileno que demostró, que las mujeres con bocio tenían valores más altos de TSH y más bajos de T4 libre17. En este estudio encontramos 15% de embarazadas con yoduria < 150 μg/L, lo que estaría manifestando una ingesta insuficiente de yodo; de ellas un 2,2% era < 50 μg/L, lo que constituye déficit moderado de yodo. No encontramos pacientes con deficiencia grave de yodo (< 20 μg/L). El análisis no mostró correlación de la yoduria con variables como T4 o T4L, como también lo han expresado otros trabajos32.
No sabemos si el tamizaje universal es costo-efectivo y tampoco en qué momento hacerlo. No disponemos de datos suficientes que indiquen si los resultados maternos y fetales mejorarían efectivamente tras la intervención. La mejor atención médica la constituyen las medidas preventivas, tales como conocimiento de los niveles de referencia vinculados al trimestre, y el estado del yodo del paciente, información sobre el estado local de yodo y yodación de la sal, y el aumento a > 250 μg/d del suplemento de yodo a mujeres embarazadas y nodrizas, y el tamizaje de mujeres de alto riesgo antes de la concepción. Sin embargo, a nivel individual es razonable, con el nivel de evidencia disponible y a la luz de nuestros datos, considerar que en nuestra población chilena tengamos un alto porcentaje de patología tiroidea encubierta o limítrofe que se manifestará frente a la mayor demanda del embarazo. Es importante enfatizar y, en base a las recomendaciones de la Endocrine Society, la realización del tamizaje sólo a pacientes con mayor riesgo de tener enfermedad tiroidea. Al respecto existe una publicación33, que indica que con esta medida hay falla en la identificación del 30% de las embarazadas con hipotiroidismo subclínico.
Finalmente, recomendamos asegurar una buena suplementación de yodo durante el embarazo y la lactancia, sin esperar la confirmación del déficit con la medición de excreción urinaria. Lo que también debe ser independiente de la implementación de programas de tamizaje para medición de TSH y T4, en semejanza a lo que existe de manera amplia, respecto de la suplementación con ácido fólico.
Referencias
- linoer D. 1997. The regulation of thyroid function in pregnancy: Pathways of endocrine adaptation from physiology to pathology. Endocrine Reviews 18 (3): 404-433.
- LaFranchi S, Smallridge R, Spong C, Haddow JC, Boyle C. 2005. Where do we go from here? Summary of working group discussions on thyroid function and gestational outcomes. Thyroid 15 (1): 72-76.
- Abalovich M, Amino N, Barbour L, Cobin R, De Groot L, Glinoer D, Mandel S, Stagnaro-Green A. 2007. Management of thyroid dysfunction during pregnancy and postpartum: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 92: S1-S47.
- LaFranchi S, Haddow J, Hollowell J. 2005. Is thyroid inadequacy during gestation a risk factor for adverse pregnancy and developmental outcomes? Thyroid 15 (1): 60-71.
- Haddow JE, Palomaki GE, Allan WC. 1999. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 341: 549-555.
- Klein RZ, Sargent JD, Larsen PR, Waisbren SE, Haddow JE, Mitchell ML. 2001. Relation of severity of maternal hypothyroidism to cognitive development of offspring. J Med Screen 8: 18-20.
- Leung AS, Millar LK, Koonings PP, Montoro M, Mestman JH. 1993. Perinatal outcome in hypothyroid pregnancies. Obstet Gynecol 81: 349-353.
- Abalovich M, Gutiérrez S, Alcaraz G, Maccallini G, García A, Levalle O. 2002. Overt and subclinical hypothyroidism complicating pregnancy. Thyroid 12 (1): 63-68.
- Casey BM, Dashe JS, Wells CE, McIntire DD, Byrd W, Leveno KJ. 2005. Subclinical hypothyroidism and pregnancy outcomes. Obstet Gynecol 105: 239-245.
- Dendrino S, Papasteriades C, Tarassi K, Christodoulakos G, Prasinos G, Creatsas G. 2000. Thyroid autoinmunity in patients with recurrent spontaneous miscarriages. Gynecol Endocrinol 14: 270-274.
- Negro R, Formoso G, Mangieri T, Pezzarossa A, Dazzi D, Asan H. 2006. Levothyroxine treatment in euthyroid pregnant woman with autoinmune thyroid disease: effects on obstetrical complications. J Clinical Endocrinology and Metabolism 91 (7): 2587-2591.
- Glinoer D, Riahi M, Grun JP, Kinthaert J. 1994. Risk of subclinical hypothyroidism in woman with asymptomatic autoimmune thyroid disorders. J Clin Endocrinol Metab 79: 197-204.
- Zimmermann MB, Burgi H, Hurrell RF. 2007. Iron deficiency predicts poor maternal thyroid status during pregnancy. J Clin Endocrinol Metab 92: 3436-3440.
- Hollowell JG, Staehling NW, Hannon WH, Flanders DW, Gunter EW, Maberly GF, et al. 1998. Iodine nutrition in the United States. Trends and public health implications: iodine excretion data from National Health and Nutrition Examination Surveys I and III (1971-1974 and 1988-1994). J Clin Endocrinol Metab 83: 3401- 3408.
- Muzzo S, Leiva L, Ramírez I, Carvajal F, Biolley E. 2005. Nutrición de yodo en escolares de una zona con alta ingesta de yodo (Calama) comparada con zona de ingesta normal (Punta Arenas). Rev Chil Nutr 32: 28-35.
- Hollowell J, Staehling N, Flanders D, Hannon H, Gunter E, Spencer C, et al. 2002. Serum TSH, T4; and thyroid antibodies in the united states population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clinical Endocrinology and Metabolism 87 (2): 489-499.
- Fardella C, López JM, Valdés ME, Núñez M, Miranda M. 1990. Autoimmune thyroid disease in the puerperium. Predictive value of thyroid enlargement and related hormonal changes occurring during pregnancy. J Endocrinol Invest 13: 283-286.
- Smallridge R, Glinoer D, Hollowell J, Brent G. 2005. Thyroid function inside and outside of pregnancy: What do we know and don’t we know? Thyroid 15 (1): 54-59.
- Wohllk N, Osorio M, Aguayo J, Pineda G, Miranda B, Norambuena H. 1993. Perfil tiroideo de la embarazada normal. Rev Méd Chile 121: 652-659.
- Allan WC, Haddow JE, Palomaki GE, Williams JR, Mitchell ML, Hermos RJ, et al. 2000. Maternal thyroid deficiency and pregnancy complications: implications for population screening. J Med Screen 7: 127-130.
- Lambert-Messerlian G, McClain M, Haddow J, Palomaki BS, Canick J, Cleary-Goldman J, et al. 2008. First and Second trimester thyroid hormone reference data in pregnant women: A FaSTER (First and second trimester evaluation of risk for aneuploidy) Research Consortium Study. Am J Obstet Gynecol 199: 62.e1-62.e6.
- Panesar NS, Li CY, Rogers MS. 2001. Reference intervals for thyroid hormones in pregnant chinese woman. Ann Clin Biochem 38: 329-332.
- Pop V, Kuijpens J, Baar A, Verkerk G, Son M, Vijlder J, et al. 1999. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin Endocrinol 50: 149-155.
- Morreale De Escobar G, Obregon MJ, Escobar del Rey F. 2000. Is neuropsychological development related to maternal hypothyroidism or to maternal hypothyroxinemia. J Clin Endocrinol Metab 85: 3975-3987.
- Casey BM, Dashe JS, Spong C, McIntire DD, Leveno KJ, Cunningham G. 2007. Perinatal significance of isolated maternal hypothyroxinemia identified in the first half of pregnancy. Obstet Gynecol 109: 1129-1135.
- Cleary-Goldman J, Malone F, Lambert-Messerlian G, Sullivan L, Canick J, Porter F, et al. 2008. Maternal thyroid hypofunction and pregnancy outcome. Obstet Gynecol 112: 85-92.
- Fardella C, Poggi H, Gloger S, Rojas A, Velásquez CG, Barroileth S, et al. 2001. Alta prevalencia de enfermedad tiroidea subclínica en sujetos que concurren a control de salud. Rev Méd Chile 129: 155-160.
- Zimmermann MB, Delange F. 2004. Iodine suplementation of pregnant women in Europe: A review and recommendations. Eur J Clin Nutr 58: 979-984.
- Leung A, Braverman L, Pearce E. 2007. A dietary iodine questionnaire: Correlation with urinary iodine and food diaries. Thyroid 17: 755-762.
- Berbel P, Obregón MJ, Bernal J, Escobar del Rey F, Morreale de Escobar G. 2008. Iodine supplementation during pregnancy: A public health challenge. Trends Endocrinol Metab 18: 338-343.
- Téllez R, Michaud P, Téllez A, Guzmán MP, Estrada A. 1993. Patología tiroidea autoinmune del embarazo y puerperio: estudios de su prevalencia en una zona de bocio endémico y su repercusión en el recién nacido. Rev Méd Chile 121: 908-915.
- Delange F, Lecomte P. 2000. Iodine suplementation: benefits outweigh risks. Drug Saf 22: 89-95.
- Vaidya B, Anthony S, Bilous M, Shields B, Drury J, Hutchison S, et al. 2007. Detection of thyroid dysfunction in early pregnancy: Universal screening or targeted high-risk case finding? J Clin Endocrinol Metab 92: 203-207.