Radioterapia como indicación post operatoria en macroadenomas hipofisiarios no funcionantes. A propósito de un caso
Marisol García M.1, Pablo Villanueva G.2, José M. López M.3 y Carmen Carrasco M.3
Surgical treatment of a non functioning pituitary macroadenoma without postoperative radiotherapy. Report of one case
1Residente Becario de Endocrinología. Escuela de Medicina,
Pontificia Universidad Católica de Chile
2Departamento de Neurocirugía. Facultad de Medicina,
Pontificia Universidad Católica de Chile.
3Departamento de Endocrinología. Facultad de Medicina,
Pontificia Universidad Católica de Chile
Correspondencia a: Marisol García M.
Departamento de Endocrinología. Facultad de Medicina,
Pontificia Universidad Católica de Chile.
Lira 85, 5º piso. Santiago, Chile. Teléfono 3543095. Fax: 6385675.
E-mail: sol.garcia77@gmail.com
Recibido: 05 Mayo de 2009
Aceptado: 24 Mayo de 2009
We report a 45 years old female that consulted for amenorrhea and galactorrhea after discontinuing oral contraceptives, that she used for several years. The patient had hyperprolactinemia, a hypogonadotrophic hypogonadism and a primary hypothyroidism. Sella turcica magnetic resonance showed a pituitary macroadenoma with a diameter of 23 mm and supraselar extension. The patient was subjected to a transsphenoidal excision of the tumor with good clinical and surgical results. Therefore radiotherapy was not used for the treatment of the tumor.
Key words: Macroadenoma hipofisiario no funcionante, radioterapia selar
El universo de los macroadenomas hipofisiarios está más frecuentemente representado por aquellos que no son funcionantes, de modo que la sintomatología que alerta de su presencia ocurre cuando hay grave compromiso funcional por destrucción de la hipófisis o manifestaciones neurológicas compresivas. Es frecuente que dado este tamaño mayor, la cirugía sea seguida por tratamiento radioterápico de la lesión residual. Sin embargo, esta conducta está hoy siendo revisada en términos de definir criterios premonitores de crecimiento del remanente o, al contrario, de estabilidad del mismo. En el primer caso, la radioterapia sigue siendo un elemento importante, pero en el segundo una opción que al menos merece ser juiciosamente aquilatada o postergada.
A raíz de un caso con un macroadenoma hipofisiario no funcionante, con buena resolución quirúrgica, aunque no total, se plantea la argumentación respecto de los elementos en juego para indicar radioterapia o no hacerlo.
Caso clínico
Paciente de 45 años, madre de 3 hijos, que consulta por presentar amenorrea de 6 meses de evolución, la que se hace evidente luego de suspender anticonceptivos orales que tomaba desde varios años antes. No relataba cefalea, alteraciones visuales ni otros síntomas asociados. El examen físico no develó signos de hipoestrogenismo, pero sí galactorrea bilateral moderada. La glándula tiroides era de tamaño normal, superficie lisa, sin nódulos. Presión arterial 120/70 mmHg.
La exploración de laboratorio demostró hiperprolactinemia (104 ng/mL) hipogonadotropismo hipogonadotropo (FSH: 6,3 mUI/mL; E2: 33 pg/mL), hipotiroidismo primario (TSH: 10,4 μUI/mL; T4 total: 6,4 μg/dL), y normalidad de los ejes somatotropo (IGF-1: 137 ng/mL) y adrenocorticotropo (cortisol plasmático 9.00 am: 13,7 μg/ dL; ACTH 9:00 am: 9,0 pg/mL).
Un estudio de RM de silla turca evidenció un macroadenoma hipofisiario de 23 mm de diámetro mayor, con extensión supraselar, de modo que contactaba el quiasma óptico, e invadía el seno cavernoso izquierdo (Figura 1-A y B); sin embargo, la campimetría computarizada no mostró alteraciones.
Se inició tratamiento con cabergolina en dosis de 1,25 mg/semana y L-tiroxina 50 mcg/d. A las 2 semanas de iniciado el tratamiento desapareció la galactorrea, tanto espontánea como inducida por expresión mamaria; a la tercera semana presentó una regla espontánea. La RM selar al mes de tratamiento no demostró disminución del tamaño tumoral a pesar de que la prolactina se redujo a 2 ng/mL. Basado en la información precedente se hizo el diagnóstico de macroadenoma hipofisiario no funcionante, hiperprolactinemia por compresión de tallo hipofisiario e hipotiroidismo primario subclínico y se derivó para resolución neuroquirúrgica.
Se realizó, por vía transesfenoidal, una resección tumoral amplia, evolucionando en el post operatorio con diabetes insípida transitoria. Fue dada de alta con L-Tiroxina 50 μg/d y cortisol 20 mg am y 10 mg pm. El estudio histológico de la pieza operatoria fue informado como adenoma gonadotropo de la hipófisis. El índice de proliferación celular fue 0,8%.
La evolución post operatoria fue satisfactoria. A los 3 meses de operada se realizó RM que mostró pequeño remanente de tejido hipofisiario a izquierda, en relación con el seno cavernoso izquierdo (Figura 1-C y D).
A los 3 meses de operada la funcionalidad hipofisiaria estaba restablecida (FSH: 4,4 μIU/mL; E2: 183 pg/mL; Prl: 1,8 ng/d/L; TSH: 1,54 mUI/mL; T4L: 1,47 μg/dL, cortisol post estimulación con 250 μg ACTH: 21 μg/dL) teniendo como única medicación L-Tiroxina, manteniendo reglas regulares y desarrollando una vida normal.
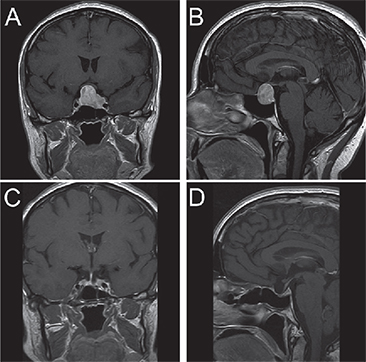
Figura 1. Imágenes coronal (A) y sagital (B) en T1 con gadolinio de la RM selar al momento del diagnóstico; se evidencia el macroadenoma hipofisiario que contacta el quiasma e invade el seno cavernoso izquierdo, circundando la mitad de la carótida sin estenosarla. A los tres meses post cirugía, se observa sólo un remanente tumoral en seno cavernoso izquierdo (C) y escaso remanente selar (D).
Discusión
Los macroadenomas hipofisiarios más frecuentes son los no funcionantes. Se presentan en aproximadamente el 0,2% de la población1. La presentación clínica es generalmente debida a síntomas y signos compresivos como alteraciones del campo visual, cefalea y/o hipopituitarismo. El tratamiento de los macroadenomas no funcionantes (MHNF) es quirúrgico, especialmente en el caso de aquellos de gran tamaño o que comprimen estructuras adyacentes como el quiasma óptico. La vía de elección del abordaje quirúrgico es la transesfenoidal, ya que ella ofrece mejores resultados y menor morbilidad que cuando se usa la craneotomía clásica2. En el pasado, durante la década de los sesenta, la tasa de éxito del tratamiento quirúrgico era baja, alcanzando 76% de recurrencia a los 10 años de seguimiento3; por ello, la radioterapia (RT) complementaria a la cirugía, al mejorar la tasa de éxito pasó a constituir la segunda parte del tratamiento. La literatura comunica tasas de recurrencia del 11 al 46% para los MHNF tratados sólo con cirugía, cifra que se reduce a un margen entre 0 y 36% cuando la cirugía se complementó con RT4. Sin embargo, los estudios publicados tienen la limitación de ser retrospectivos, no aleatorios y de incluir pacientes abordados quirúrgicamente por craneotomía clásica, vía de acceso que reconocidamente se asocia a mayor tasa de recurrencia.
Un estudio holandés de tipo retrospectivo, publicado en el 2006, aportó mayores elementos para la toma de decisión respecto a la indicación o no de radioterapia complementaria4. Este estudio analizó la evolución de 97 pacientes consecutivos sometidos a resección transesfenoidal, a los cuales no se les administró radioterapia y que fueron seguidos por un promedio de 6 años. El 73% de estos pacientes tenían una RM efectuada 6 meses post cirugía que mostraba tumor residual. En esta población, la sobrevida libre de recurrencia a 5 y 10 años de la operación fue de 92% y 74%, respectivamente. Si se consideraban los que quedaron sin tumor residual post operatorio la sobrevida libre de enfermedad fue del 100% a los 10 años4. El diagnóstico de recurrencia se hizo por RM en todos los pacientes (n = 9) y en 5/9 no se acompañó de compromiso de la campimetría. El único factor independiente asociado a recurrencia o crecimiento del residuo tumoral fue el tiempo de seguimiento. La importancia de este trabajo radica en que es el primero en el cual en forma homogénea se indicó conducta expectante a todos los tumores, y plantea la validez de adoptar la conducta de “wait and see” que podría evitar la exposición a la RT y sus secuelas en el 90% de los pacientes seguidos a 6 años. La limitante, sin embargo, es la falta de descripción con respecto al volumen residual que presentaban los pacientes, aunque es esperable que este haya sido intraselar y pequeño.
La indicación de complementar el tratamiento quirúrgico con RT debe estar basada en el riesgo de recurrencia del tumor, lo que es variable para cada paciente. Algunos elementos predictivos que indican mayor posibilidad de recurrencia tumoral serían: a) extensión supraselar en la RM post quirúrgica importando la magnitud de ella; b) invasión del seno cavernoso antes de la cirugía, y la cuantía de ello; c) certificación después de la cirugía de tumor residual con extensión importante supra o infraselar; d) invasión de la duramadre; e) elevación del índice de proliferación tumoral (Ki-67 > 1,5%); f) diagnóstico inmunohistoquímico de adenoma secretor de ACTH, pero silente5,6.
Los defensores de la RT complementaria no selectiva han planteado que la efectividad de la RT podría ser menor cuando ella se administra tardíamente respecto de la primera cirugía, con un control de enfermedad que disminuye de 95% a 5 años para la radioterapia indicada inmediatamente post cirugía a 49% a los 5 años al ser aplicada al momento de la recurrencia de la enfermedad7. Sin embargo, otro estudio de 18 pacientes a quienes se indicó RT en el momento que presentaron recurrencia tumoral, muestra que ninguno de ellos presentó recurrencia o crecimiento tumoral en el seguimiento posterior, indicando que la efectividad de la RT se mantenía8. Este último trabajo proviene de uno de los centros con mayor experiencia neuroquirúrgica del mundo, por lo que es posible plantear que diferencias en el volumen del residuo tumoral puedan explicar las diferencias entre ambos trabajos.
Es importante tener en consideración los efectos adversos de la radioterapia, como lo es el hipopituitarismo que se ve a lo largo del seguimiento en el 50% de los pacientes y está relacionado con la dosis utilizada. También existe mayor riesgo de accidente vascular cerebral (AVC) secundario a daño microvascular y también por estenosis oclusiva de las arterias carótidas9. La mortalidad asociada a ACV también es mayor (RR: 4,1)5. Otro elemento negativo es que los pacientes sometidos a RT presentan mayor riesgo de desarrollar tumores cerebrales como meningiomas, astrocitomas y gliomas, riesgo que es de 2% a 20 años de recibida la RT y que tiene relación con la dosis usada. Los tumores cerebrales se pueden presentar tan precozmente como a los 6 años de recibida la RT, como es el caso de los astrocitomas, o más distante en el de los meningiomas, que incluso puede ser 50 años después de recibida la RT10. La neuropatía óptica es un hecho poco frecuente que se presenta en 1,5% de los pacientes sometidos a RT y aparece con una latencia entre 2 meses y 4 años. La mayor mortalidad que se describe en algunos pacientes tratados con RT, puede estar dada por la presencia o la conjunción de hipopituitarismo, AVC y la enfermedad cardiovascular asociada al déficit de GH11. Los defensores de la radioterapia profiláctica plantean a su vez que la tasa de hipopituitarismo en el tiempo es igual en los pacientes irradiados u observados, planteando que el mismo tumor induce daño local que es independiente de la administración de radioterapia, por lo que esta complicación no debiera ser argumento para no indicarla.
El caso clínico que comunicamos se caracterizó por un remanente tumoral post quirúrgico pequeño, conservación de la función hipofisiaria y un bajo (0,8%) índice de proliferación tumoral (Ki-67). En ese contexto y con la información discutida precedentemente se tomó la decisión de no administrar RT y sólo observar la evolución.
En resumen, la RT constituye una herramienta muy efectiva en el control de la recurrencia en MHNF sometidos a tratamiento quirúrgico, pero su indicación no debe ser ciega sino fundamentada en el riesgo individual de recurrencia según los criterios predictores y considerando además los efectos adversos de la RT. La destreza de un neurocirujano especializado en hipófisis y la sensibilidad de la RM para pesquisar crecimiento del remanente permiten en la actualidad adoptar la conducta de “wait and see” en forma segura y seleccionar a los pacientes que serán expuestos a la RT complementaria.
Referencias
- Nammour GM, Ybarra J, Naheedy MH, Romeo JH, Aron DC. 1997. Incidental pituitary macroadenoma: a population-based study. Am J Med Sci 314: 287-291.
- Molitch ME. 2008. Nonfunctioning pituitary tumors and pituitary
incidentalomas. Endocrinol Metab Clin North Am 37: 151-171.
- Sheline GE. 1974. Proceedings: Treatment of nonfunctioning chromophobe adenomas of the pituitary. Am J Roentgenol Radium Ther Nucl Med 120: 553-561.
- Dekkers OM, Pereira AM, Roelfsema F, Voormolen JH, Neelis KJ, Schroijen MA, et al. 2006. Observation alone after transsphenoidal surgery for nonfunctioning pituitary macroadenoma. J Clin Endocrinol Metab 91: 1796-1801.
- Minniti G, Jaffrain-Rea ML, Osti M, Cantore G, Enrici RM. 2007. Radiotherapy for nonfunctioning pituitary adenomas: from conventional to modern stereotactic radiation techniques. Neurosurg Rev 30: 167-175; discussion 175-176.
- Honegger J, Prettin C, Feuerhake F, Petrick M, Schulte-Monting J, Reincke M. 2003. Expression of Ki-67 antigen in nonfunctioning pituitary adenomas: correlation with growth velocity and invasiveness. J Neurosurg 99: 674-679.
- van den Bergh AC, van den Berg G, Schoorl MA, Sluiter WJ, van der Vliet AM, Hoving EW, et al. 2007. Immediate postoperative radiotherapy in residual nonfunctioning pituitary adenoma: beneficial effect on local control without additional negative impact on pituitary function and life expectancy. Int J Radiat Oncol Biol Phys 67: 863-869.
- Park P, Chandler WF, Barkan AL, Orrego JJ, Cowan JA, Griffith KA, et al. 2004. The role of radiation therapy after surgical resection of nonfunctional pituitary macroadenomas. Neurosurgery 55: 100-106; discussion 106-107.
- O'Connor MM, Mayberg MR. 2000. Effects of radiation on cerebral vasculature: a review. Neurosurgery 46: 138-149; discussion 150-151.
- Minniti G, Traish D, Ashley S, Gonsalves A, Brada M. 2005. Risk of second brain tumor after conservative surgery and radiotherapy for pituitary adenoma: update after an additional 10 years. J Clin Endocrinol Metab 90: 800-804.
- Tsang RW, Brierley JD, Panzarella T, Gospodarowicz MK, Sutcliffe SB, Simpson WJ. 1994. Radiation therapy for pituitary adenoma: treatment outcome and prognostic factors. Int J Radiat Oncol Biol Phys 30: 557-565.