Características clínicas y metabólicas de síndrome de ovario poliquístico en la ciudad de Temuco
Marcela Jiménez M.1,3, Virginia Iturrieta G.1, Guillermo Aguilera S.a, Guillermo Cárcamo R.a, Luis Galvez N.2 y Patricio Valdés G.2,4
Clinical and metabolic characteristics of polycystic ovary syndrome in the city of Temuco
1 Departamento de Medicina Interna, Unidad de Endocrinología, Universidad de La Frontera, Temuco.
2 Centro de Capacitación Investigación y Gestión para la Salud Basada en Evidencia (CIGES), Universidad de la Frontera, Temuco.
3 Unidad Endocrinología y Diabetes, Clínica Alemana Temuco. 4Departamento de Ginecología y Obstetricia, Universidad de la Frontera, Temuco.
a Alumno Medicina Universidad de la Frontera, Temuco.
Correspondencia a:
Marcela Jiménez Moyano.
Departamento de Medicina Interna,
Facultad de Medicina, Universidad de la Frontera.
M. Montt 112, Temuco.
Teléfono: 65957265.
E mail: marcejimm@gmail.com
Recibido : 21-04-2014
Aceptado: 12-05-2014
Background: Polycystic Ovarian Syndrome (PCOS) is the most common endocrine disorder, its etiology is multifactorial. It is associated with multiple metabolic abnormalities. Objective: To evaluate statistical association between the clinical characteristics of patients diagnosed with PCOS. Patients and Methods: Descriptive study, 121 patients between 13 and 44 years with PCOS were included, and their clinical characteristics, blood glucose, insulin, lipid profile and calculated HOMA were evaluated. Data was analyzed with Chi2, considering p < 0.05 as statistically significant. Results: Mean age 25,5 years, 12,5 years menarche. 22% with a history of abortion. Mean BMI 31,4. Acanthosis nigricans was presented in 58,6%. Average Glucose 96,5 mg/dl. Insulin resistance (IR) was found in 79.3%. Average HOMA 4,5. 64% of patients with IR presented acanthosis nigricans (p = 0.002). It showed direct relationship between BMI and RI (p 0.000). 38,8% had dysglycemia. RI was found in 78,7% of patients with dysglycemia (p 0.8). Lipid profile was measured in 78 patients, of whom 40% had total cholesterol above 200 mg/dl, 49% hypertriglyceridemia and high LDL in 13% of cases. Conclusion: The data reported are similar to those reported in the international literature. Our population has obesity and dyslipidemia figures higher than those reported in national studies. The menarche occurs at a younger age while the prevalence of dyslipidemia and RI is greater than the general population, forming a higher risk group.
Key words: Polycystic Ovary Syndrome, Hyperandrogenism, ovarian diseases, reproductive health.
Síndrome de Ovario Poliquístico (SOP) es el desorden endocrinológico más común, afectando al 5-8% de las mujeres en edad reproductiva y es una de las principales causas de infertilidad 1. Es definido como una condición heterogénea cuyos criterios diagnósticos han sido bien establecidos en el consenso de Rotterdam en mayo de 20032. Su etiología es multifactorial con probable base genética3,5. Se ha asociado a obesidad6, síndrome metabólico7, resistencia a la insulina y disglicemia8 que usualmente se manifiesta después de la adolescencia8,9, sin embargo, algunos estudios han mostrado diferencias de acuerdo al tipo de población estudiada, observándose baja prevalencia de trastornos de la tolerancia a los hidratos de carbono en pacientes adolescentes orientales con SOP10,11. Por otra parte, la evidencia muestra que la población general de pacientes con SOP tiene un riesgo 10 veces mayor de desarrollar diabetes tipo 2, lo que representa un problema de salud pública y una oportunidad para la intervención temprana12,14.
El propósito de este estudio es realizar una asociación estadística entre las características clínicas y anormalidades metabólicas de pacientes con diagnóstico de síndrome de ovario poliquístico, controladas en policlínico de ginecología en la ciudad de Temuco.
Material y Método
Se diseñó un estudio de corte transversal en base a un protocolo con muestreo no probabilístico de casos consecutivos, que incluyó pacientes entre 13 y 44 años con diagnóstico de SOP, quienes acudieron a evaluación ginecológica en la ciudad de Temuco. El diagnóstico se estableció a través de los criterios de Rotterdam de 2003 que considera al menos dos de los siguientes: 1) hiperandrogenismo clínico (definido como presencia de hirsutismo, acné o alopecía androgénica) o bioquímico (utilizando niveles de testosterona total, SHBG e índice androgénico libre); 2) Oligomenorrea (sangrado irregular con períodos variables entre 35 y 90 días) o anovulación; 3) alteraciones ecográficas sugerentes de ovario poliquístico (12 o más folículos de 2 a 9 mm, aumento de volumen de ovario mayor a 10 ml).
Cumplieron con los criterios de inclusión 121 pacientes en quienes se evaluó edad, antorpometría, antecedentes gineco -obstétricos y presencia clínica de hirsutismo (según escala de Ferriman y Gallwey. Se efectuaron mediciones séricas de glicemia y perfil lipídico los cuales fueron procesados mediante métodos enzimáticos utilizando como reactivos hexoquinasa y colesterol esterasa respectivamente e insulinemia basal por método de quimioluminiscencia. Se calculó de HOMA utilizando la siguiente fórmula: Insulina basal uU/ ml X glicemia ayunas mg/ml/405, considerándose resistencia a la insulina valor > 2,5. Se evaluó presencia de disglicemia de ayuno en las pacientes, considerando los valores planteados por ADA el 2003 (glicemia alterada de ayuno > 100 mg/ dl). Se realizó mediciones de perfil lipídico a 78 pacientes, teniendo en cuenta que una parte de esta muestra está compuesta por adolescentes, se realizaron ajustes de los parámetros según grupo etario, considerando valores publicados en "the National Cholesterol Education Program (NCEP)" para las pacientes menores de 20 años: colesterol total > 200; LDL > 130; TG > 130. En pacientes adultas se consideró anormal colesterol total >200, LDL > 160 y TG > 150.
El análisis de los datos fue hecho con software stata 11.1, debido al tamaño muestral (121) se utilizó estadísticos de c2 en el caso de variables dicotómicas y ordinales. Los resultados fueron considerados estadísticamente significativos con p menor a 0,05 y fueron expresados como media, mediana y DS. No fue posible medir OR debido a que los pacientes estudiados son casos, no existiendo controles.
La extracción de los datos para este trabajo fue aprobada por el Comité Ético Científico del Servicio de Salud Araucanía Sur.
Resultados
Se evaluó 121 pacientes diagnosticadas con SOP. Las características clínicas se describen en Tabla 1.
El promedio de menarquia fue de 12,5 ± 1,65 años con un rango entre 9 y 18 años; El rango intercuartílico corresponde a 11 a 13 años.
De las 121 pacientes 50 de ellas habían tenido embarazo, con antecedente de aborto en 11 de ellas.
Índice de masa corporal
Se evaluó el estado nutricional clasificándolas de acuerdo al índice de masa corporal (Tabla 2). El 15% y el 27% presentaban un IMC normal y sobrepeso respectivamente mientras que el 58% eran obesas (Figura 1). Evaluamos esta característica según el rango etario dividiéndolas en 3 grupos (Tabla 3). Al evaluar las pacientes obesas el 24% del total correspondió a obesidad tipo 1, 20 y 9% a obesas tipo 2 y mórbidas respectivamente.
La presencia de hirsutismo según escala de Ferriman y Gallwey, resultó mayor de 8 puntos en el 56,1% (68/121).
Resistencia a la insulina
El promedio de insulinemia basal fue de 18,5 uU/ml con rango entre 3,1 y 59 uU/ml, mientras que la glicemia promedio en estas pacientes fue 96,5 mg/dl (rango 60-172) (Tabla 1).
HOMA promedio de las pacientes fue 4,4 ± 2,3, rango 0,7-14. De ellas 95 (81%) presentó RI (HOMA > 2,5) (Figura 2). Se encontró Acantosis nigricans en el 64,9% con valor p: 0,002 utilizando c2 (Tabla 3). Por otra parte, RI se encontró en el 88,7% de las pacientes que presentan Acantosis nigricans.
Se analizó este grupo de acuerdo al rango etario observando que el 26,8% de ellas eran menores a 20 años, 45,4% entre 20 y 30 años y 27,8% mayores de 30 años.
Al dividir el grupo con RI según rangos de IMC (Figura 3) se pudo ver que sólo 5% de las pacientes presentaban peso normal mientras que el 41% se encontraban con sobrepeso y el 54% eran obesas, al analizar con estadístico c2 la relación entre rango IMC y resistencia a la insulina es posible observar asociación estadísticamente significativa con un valor p < 0,001 (Tabla 3).
Disglicemia
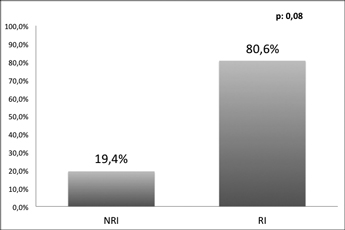
Se observó un valor promedio de glicemia 96,5 mg/dl. 47 pacientes (38,8%) presentaron glicemia de ayuno mayor a 100 mg/dl. Comparamos presencia de IR en pacientes con disglicemia observando HOMA > 2,5 en el 78,7% de las pacientes (p 0,8) (Figura 4).
Dislipemedia
Se realizó mediciones de perfil lipídico en 78 pacientes.
El promedio para colesterol total, LDL, HDL y triglicéridos (Tabla 1). Treinta y un pacientes (40%) presentaron colesterol total > 200 mg/dl (Tabla 1), de las cuales el 26% tenían sobrepeso y el 61% eran obesas, con valor p para este último grupo de 0,8 (Tabla 3).
Al evaluar presencia de RI se observó que el 87% de las pacientes con colesterol total elevado presentaban HOMA > 2,5, con valor p: 0,46. Se presentó hipertrigliceridemia en
38 pacientes (49%) (Tabla 3). De la misma forma se clasificó las alteraciones de LDL observando niveles alterados en 10 pacientes (13%) (Tabla 1).
Tabla 1. Características clínicas y de laboratorio de pacientes con SOP
| Media | (DS) | n | % | ||
| Edad | 25,5 | (7,5) | Aborto | 11/50 | 20 |
| Menarquia | 12,5 | (1,65) | Hirsutismo | 68 | 56,2 |
| Peso (Kg) | 79,4 | (17) | Acantosis | 71 | 58,6 |
| IMC | 31,4 | (6,3) | |||
| Insulina basal (uU/ml) | 18,5 | (9,6) | Eutrófica | 18 | 14,8 |
| HOMA | 4,4 | (2,3) | Sobrepeso | 32 | 26,4 |
| Glicemia ayuno (mg/dl) | 96,5 | (12,9) | Obesidad | 71 | 58,5 |
| Colest. total (mg/dl) | 198 | (36,9) | Disglicemia ayuno | 47 | 38,8 |
| LDL (mg/dl) | 115 | (30,3) | Colesterol total elevado | 31/78 | 39,7 |
| HDL (mg/dl) | 45 | (12,7) | LDL elevado | 11/78 | 18,9 |
| TG (mg/dl) | 159 | (84) | HDL bajo | 44/78 | 65,6 |
| TG elevado | 38/78 | 48,1 | |||
| RI | 95 | 81 |
DS: desviación estándar, IMC: índice de masa corporal, RI: resistencia a la insulina.
Tabla 2. IMC según rango etario
| Edad (años) | n | Normal | Sobrepeso | Obesidad |
| < 20 | 31 | 19 | 36 | 45 |
| 20 - 29 | 55 | 14 | 22 | 64 |
| > 30 | 35 | 11 | 26 | 63 |
Tabla 3. Asociación entre variables
| RI | Valor p | Obesidad | Valor p | |
| Acantosis | 63 | 0,002 | 52 | 0,000 |
| 56% | 41,7% | |||
| Disglicemia | 37 | 0,89 | 31 | 0,19 |
| 37,3% | 27,6 | |||
| Colesterol elevado | 27 | 0,4 | 19 | 0,8 |
| 25,8% | 18,7% | |||
| LDL elevado | 9 | 0,78 | 7 | 0,8 |
| 9,3% | 6,6% | |||
| HDL bajo | 34 | 0,15 | 29 | 0,2 |
| 36,1% | 26,9% | |||
| RI | 63 | 0,002 | ||
| 56,3% |
RI: resistencia a la insulina.
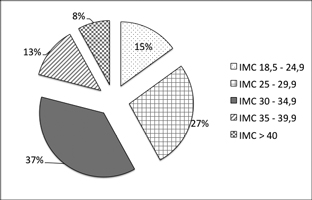
Figura 1. Distribución de pacientes con SOP según IMC.
IMC: índice de masa corporal, >: mayor.
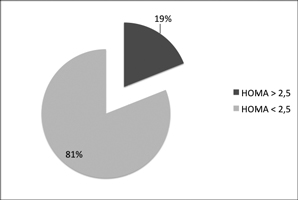
Figura 2. Distribución de pacientes con SOP según HOMA.
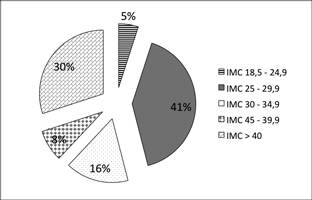
Figura 3. Distribución IMC en pacientes con SOP y RI. >: mayor.
Discusión
El síndrome de ovario poliquístico fue descrito por primera vez como síndrome X en 1988 por Gerald M. Reaven15 y los primeros criterios diagnósticos fueron establecidos por el NIH 199016. Es una patología con una alta incidencia y ha cobrado mayor importancia por la estrecha relación que se ha encontrado en el desarrollo de trastornos metabólicos. Ahora por ser un síndrome muy variable en el fenotipo de presentación, no es fácil realizar su evaluación clínica, debido a esto se realizó un Consenso en Rotherdam (2003) que estableció criterios clínicos, de laboratorio y agregó criterios ecográficos respecto a características ováricas que pueden presentar este grupo de pacientes2. En la actualidad se utilizan y han cumplido un importante rol en mejorar la precisión diagnóstica.
Nuestra población SOP, reporta datos similares a los comunicados en la literatura internacional respecto a los trastornos metabólicos. Carvajal y cols. 201017 evaluaron población chilena con SOP y publicaron un 56,9% de obesidad, 25,4% sobrepeso, 14,7% HGA, que estarían por debajo de lo encontrado en nuestro grupo en el que el porcentaje de obesidad alcanzó el 58,5%, con 26,4% de sobrepeso y 38,8% de HGA. Lo mismo ocurre con los valores promedio de HDL bajo (53,9%) y TG elevados (30,4%) comparados con 65,6% y 48,1% respectivamente en nuestro grupo; esto podría explicarse por diferencias en estrato socioeconómico y estilo de vida (dieta-ejercicio) entre mujeres de la Región Metropolitana y de nuestra región, sin embargo, no es posible establecer asociación o causalidad con lo anterior ya que estas variables no fueron consideradas por ninguno de los grupos.
Al comparar la edad de menarquia de este grupo con la reportada en la Encuesta Nacional de Salud de 201018 es posible observar que nuestra población SOP presenta menarquia más precoz (13,1 vs 12,5 años). De igual forma al evaluar presencia de obesidad y sobrepeso podemos observar que existe mayor porcentaje de sobrepeso en población general (32,61% vs 26,4% respectivamente) mientras que la población obesa es considerablemente mayor en el grupo de pacientes con SOP (23,75% vs 58,7% respectivamente). Los valores promedio de colesterol total, LDL y TG, resultan mayores en pacientes con SOP mientras que HDL es menor que el encontrado en población general.
Nuestro grupo comunica las características metabólicas de población SOP de la ciudad de Temuco, que al igual que en otras publicaciones muestran ser un grupo de mayor riesgo cardiovascular. Si evaluamos estos datos desde el punto de vista de salud pública podría ser interesante desarrollar intervenciones dietéticas y actividad física, medidas que han mostrado tener impacto positivo en disminuir incidencia de enfermedades cardiometabólicas.
Referencias bibliográficas
- Azziz R, Woods KS, Reyna R. 2004. [The prevalence and features of the polycystic ovary syndrome in an unselected population]. J Clin Endocrinol Metab 89: 2745.
- The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group. 2004. Revised 2003 consensus on diagnostic criteria and longterm health risks related to polycystic ovary syndrome. Fertil Steril 81: 19-25.
- Govind A, Obhrai MS, Clayton RN. 1999. [Polycystic ovaries are inherited as an autosomal dominant trait: analysis of 29 polycystic ovary syndrome and 10 control families]. Journal of Clinical Endocrinology and Metabolism 84 (1): 38-43.
- Vink JM, Sadrzadeh S, Lambalk CB, Boomsma DI. 2006. [Heritability of polycystic ovary syndrome in a Dutch twin-family study]. Journal of Clinical Endocrinology and Metabolism 91 (6): 2100-2104.
- Wood JR, Nelson VL. 2003. [The molecular phenotype of polycystic ovary syndrome (PCOS) theca cells and new candidate PCOS genes defined by microarray analysis]. Journal of Biological Chemistry 278 (29): 26380-26390.
- Kirchengast S, Huber J. 2001. [Body composition characteristics and body fat distribution in lean women with polycystic ovary syndrome]. Hum Reprod 16: 1255.
- Leibel NI, Baumann EE, Kocherginsky M, Rosenfield RL. 2006. [Relationship of adolescent polycystic ovary syndrome to parental metabolic syndrome]. J Clin Endocrinol Metab 91:1275.
- Apter D, Bützow T, Laughlin GA, Yen SS. 1995. [Metabolic features of polycystic ovary syndrome are found in adolescent girls with hyperandrogenism]. J Clin Endocrinol Metab 80: 2966.
- Buggs C, Rosenfield RL. [Polycystic ovary syndrome in adolescence]. Endocrinol Metab Clin North Am 34: 677-705.
- Chen X, Yang D, Li L, Feng S, Wang L. 2006. [Abnormal glucose tolerance in Chinese women with polycystic ovary syndrome]. Hum Reprod 21: 2027-2032.
- Ni RM, Mo Y, Chen X, Zhong J, Liu W, Yang D. 2009. [Low prevalence of the metabolic syndrome but high occurrence of various metabolic disorders in Chinese women with polycystic ovary syndrome]. Eur J Endocrinol 161: 411-418.
- Ehrmann DA, Barnes RB, Rosenfield RL, Cavaghan MK, Imperial J. 1999. [Prevalence of impaired glucose tolerance and diabetes in women with polycystic ovary syndrome]. Diabetes Care 22: 141-6.
- Legro RS, Kunselman AR, Dodson WC, Dunaif A. 1999. [Prevalence and predictors of risk for type 2 diabetes mellitus and impaired glucose tolerance in polycystic ovary syndrome: a prospective, controlled study in 254 affected women]. J Clin Endocrinol Metab 84: 165-169.
- Nestler JE. 2008. [Metformin for the treatment of the polycystic ovary syndrome]. N Engl J Med 358: 47-54.
- Reaven GM. 1988. [Role of insulin resistance in human disease]. Diabetes 37: 1595-1607.
- Dunaif A, Givens JR, Haseltine FP, Merriam GR. 1992. [Polycystic ovary syndrome]. Boston: Blackwell Scientific: 377-384.
- Carvajal R, Herrera GC, Porcile JA. 2010. Espectro fenotípico del síndrome de ovario poliquístico. Rev Chil Obstet Ginecol 75 (2): 124-132.
- Encuesta Nacional de Salud Chile 2009-2010. Disponible en http://www.minsal.cl/portal/url/item/ bcb03d7bc28b64dfe040010165012d23.pdf [Consultado el 20 de junio 2013].