Diabéticos tipo 1 portadores de síndrome metabólico: cuantificación de la resistencia a la insulina
Lilian Sanhueza M.1, Luciana Concha L.1, Pilar Durruty A.1,a, Claudia Rubio C.1,b, Carlos Wolff F.2,a y Manuel García de los Ríos A.1
Type 1 Diabetics patients carriers of metabolic syndrome: quantification of insulin resistance
1Unidad de Diabetes, Hospital San Juan de Dios, Servicio y Departamento de Medicina Occidente. Facultad de Medicina Universidad de Chile. 2Laboratorio Hepatología, Servicio y Departamento de Medicina Occidente, Facultad de Medicina, Universidad de Chile. aBioquímico. bNutricionista.
Correspondencia a:
Lilian Sanhueza M.
Fray Camilo Henríquez 175, Depto. 404. Santiago, Chile.
Teléfonos: 26353533 Fax: 26817414
E-mail: lilianllay@yahoo.es
Recibido: 05-04-2014
Aceptado: 25-04-2014
Introduction: The presence of insulin resistance (IR) has been indirectly assessed in Type 1 Diabetics (T1DM) through the detection of Metabolic Syndrome (MS), by applying criteria for Type 2 Diabetics (T2DM). In the EDC study (the Pittsburg Epidemiology of Diabetes Complications) a formula applicable to T1DM was validated, quantifying IR through the glucose uptake (GU) employing the usual clinical and laboratory parameters, in patients with HbA1c < 11.4%. Objectives: To determine in T1DM whether there exists a relationship between the presence of MS according to the Modified NCEP/ATPIII criteria and IR quantification through assessment of the glucose uptake or GU. Patients and Method: The modified NCEP/ATPIII criteria were applied to 150 T1DM patients, and those with more than 3 altered parameters were classified as MS carriers. IR was quantified through the glucose uptake (GU), applying the formula for Estimated Glucose Disposal Rate (GDR- EDC). Results: 26.6% of the T1DM (40 patients) complied with the modified NCEP/ATPIII criteria. When the formula for GU was applied (31 patient), 90.3% of the T1DM showed insulin resistance (GU value < 8.77). And when applied to 124 patients (T1DM with and without MS and HbA1c < 11,4%) 75% showed IR.
Key words: Type 1 Diabetes, Metabolic syndrome, insulin resistance.
Síndrome Metabólico (SM) es una agrupación de factores de riesgo metabólico, más interrelacionados que sólo por el azar, promueven directamente el de sarrollo de diabetes mellitus tipo 2 (DM2) y de enfermedad cardiovascular (ECV).
El SM se caracteriza por la aparición en forma simultánea o secuencial de diversas alteraciones metabólicas e inflamatorias a nivel molecular, celular o hemodinámicas, asociadas a la presencia de resistencia a la insulina (RI) y de adiposidad de predominio visceral.
La diabetes mellitus tipo 1 (DM1) es una enfermedad autoinmune, pero en el último tiempo también se le ha dado importancia a factores ambientales como la obesidad y a los tratamientos insulínicos intensificados que favorecen la RI1.
Existen varios criterios diagnósticos de SM. El más conocido es el The National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (NCEP/ATPIII) modificado, que considera los siguientes parámetros: circunferencia cintura (cc); presión arterial (PA); triglicéridos (TG); colesterol HDL (col HDL) y glicemia de ayunas (GA) siendo este el más usado en clínica2. El propuesto por el World Health Organization (WHO) considera la presencia de diabetes (DM), anormalidad de la GA, intolerancia a la glucosa, RI, relación cintura cadera (c/c), TG, col HDL, PA, microalbuminuria3, el que tiene la dificultad de la medición de la RI y es el único que incluye la microalbuminuria. La International Diabetes Federation (IDF) también propone otro criterio, el que considera la cc y/o el Índice de Masa Corporal (IMC), TG, col HDL, PA y GA, este es el único que incluye el IMC además de la cc4. Todos se han propuesto para individuos no diabéticos y se han aplicado en DM2.
En los últimos años se ha descrito la presencia de SM y sus componentes en pacientes con DM1. Las tasas publicadas son variables, encontrándose cifras entre 15 y 42%5,6, su determinación ha sido utilizada para estimar indirectamente la RI. La presencia de SM y RI en diabéticos tipo 1 se asociaría a mal control metabólico y a un aumento del riesgo cardiovascular7.
La cuantificación del grado de RI en los DM1 no puede realizarse mediante métodos simples como el the homeostasis assessment model for insulin resistance (HOMA-IR), que relaciona las glicemias y las insulinemias de ayunas: por cuanto en estos pacientes, por el hecho de recibir tratamiento con insulina se mediría la insulina endógena y exógena. Por otra parte, técnicas como el clamp euglicémico hiperinsulinémico, establecido como el "gold standard" para la cuantificación de la RI, resultan demasiado invasivas y costosas para su uso en clínica y quedan limitadas a la investigación.
Ante estas dificultades, se reconoce con frecuencia a los pacientes con DM1 y resistencia a la insulina por sus mayores requerimientos diarios de esta; en dicho sentido, se considera la existencia de RI cuando dichos requerimientos superan 1 U/kg peso/día. En los últimos años se han validado varias fórmulas para cuantificar la RI en los DM1; una de ellas es la propuesta por el estudio The Pittsburg Epidemiology of Diabetes Complications (EDC), que calcula la RI indirectamente al cuantificar la captación de glucosa (CG), utilizando parámetros clínicos y de laboratorio habituales, tales como relación c/c, HbA1c y el antecedente de hipertensión arterial8. Las fórmulas matemáticas tienen correlación estadísticamente significativa con las mediciones de RI determinadas mediante el clamp euglicémico hiperinsulinémico8,9.
El objetivo de nuestro estudio fue determinar si en pacientes DM1 existe relación entre la presencia de SM según criterio NCEP/ATPIII modificado y la cuantificación de RI a través de la captación de glucosa evaluada con la fórmula de CG del estudio EDC.
Pacientes y Métodos
Este trabajo de corte transversal, se realizó en 150 DM1 escogidos al azar de un universo de 400 pacientes, controlados en la Unidad de Diabetes del Hospital San Juan de Dios, Santiago. Se incluyeron individuos mayores de 18 años de edad de ambos sexos y su consentimiento informado.
Se definió a un paciente como portador de DM1, cuando su inicio fue en un Síndrome Diabético Agudo, su cuadro llevaba más de dos años de evolución y ha requerido insulina desde su diagnóstico.
A los 150 DM1 (88 mujeres y 62 hombres) se les determinó la presencia de SM aplicando el criterio del NCEP/ ATPIII modificado2, que considera de riesgo los siguientes parámetros: cc > 102 cm en el hombre y > 88 cm en la mujer, TG ≥ 150 mg/dl, PA ≥ 130/85 mmHg, col HDL < 40 mg/dl en el hombre y < 50 mg/dl en la mujer y glicemia de ayunas ≥ 100 mg/dl. Se clasifica al individuo portador de SM si cumple con tres o más de estos criterios alterados; en este estudio como todos los pacientes son diabéticos (hiperglicemia) se exigió dos de los 4 restantes criterios.
El peso y la talla se midieron en una balanza marca Seca con cartabon. Se calculó el IMC (kg/m2) considerando sobrepeso el rango entre 25 y 29,9 y obesidad ≥ 30 para los pacientes entre 18 y 64 años. En los sujetos mayores de 65 años se consideró 28 a 31,9 para sobrepeso y ≥ 32 para obesidad.
Las glicemias, el col-HDL y los TG se midieron con métodos enzimáticos colorimétricos en un equipo automatizadoArchitec 8.000, con coeficientes de variación (CV) < 5%. Para las glicemias se usó hexoquinasa/6, para el col-HDL un detergente acelerador selectivo y para los TG las enzimas glicerol fosfato deshidrogenasa (GPO) y peroxidasa (POD).
Las HbA1c se determinaron en columnas de cromatografía líquida de alta resolución (HPLC) con un CV < 5%, utilizando un equipo HPLC Variant 2000.
La PA se midió en dos oportunidades con un esfingo-manómetro de Hg, estando los pacientes sentados en dos repeticiones, sin haber fumado ni recibido alimentos recientemente.
La circunferencia de cintura se midió con una cinta métrica flexible, en forma horizontal a nivel de la zona hendida entre el último arco costal y la cresta ilíaca, con el sujeto de pie y con la pared abdominal relajada (al final de una respiración normal). La circunferencia de cadera se determinó con la misma cinta métrica, en forma horizontal a nivel de la zona más prominente de los glúteos con el sujeto en igual posición que el examen anterior.
A todos los individuos se les calculó la RI, aplicando la fórmula de captación de glucosa (CG), que incluye las siguientes variables clínicas:
CG = 24,3 –12,22 x cintura/cadera (c/c) –3,29 x hipertensión arterial (HTA) –0,57 x HbA1c. En la fórmula se considera: HTA = 0 si el paciente no es hipertenso. HTA = 1 si tiene historia personal de hipertensión arterial. Esta fórmula se utiliza sólo en sujetos cuyas HbA1c son < 11,4%.
Un valor de CG < 8,77 (mg/kg x min) es indicador de RI; las cifras más bajas de CG indican grados mayores de RI.
Los resultados de los exámenes se obtuvieron de las fichas clínicas de los pacientes.
Análisis estadístico
Los parámetros clínicos y bioquímicos se expresaron como media aritmética ± desviación standard (MA ± DS) o porcentaje (%). Para el cálculo de la significancia estadística se usaron los tests exacto de Fisher y de Mann Whitney y se estableció como significativos un p < 0,05.
Resultados
La presencia de SM se pesquisó en 40 pacientes (26,6%); la distribución de los DM1 según presencia de SM y género aparece en la Figura 1, se puede apreciar que una mayor proporción de mujeres presenta SM.
Las características clínicas: edad, años de diabetes, estado nutricional y cc de los DM1 con y sin SM se presentan en la Tabla 1. Sólo se encontró diferencia significativa (p < 0,05) en la cc de las mujeres con SM quienes tenían una circunferencia de cintura mayor que las sin SM. Se clasificó a las personas con Índice de Masa Corporal (IMC) en rangos de 25-30 kg/m2 y obesos > 30. El 60% de los DM1 con SM tenían sobrepeso u obesidad versus el 39% de los sin SM (NS).
En la Tabla 2 podemos observar que los DM1 con SM presentaban glicemia de ayunas y PA sistólica superiores significativamente y colesterol HDL inferior (p < 0,05). En cambio los niveles de HbA1c, PA diastólica y triglicéridos fueron similares en ambos grupos.
Para la determinación de la RI en los DM1, del total de 40 pacientes con SM, se debieron excluir 9 por tener HbA1c> 11,4%. Al aplicar la fórmula a los 31 sujetos restantes, 90,3% tenían RI, con diferencias de género: 23 mujeres (74,2%) y 5 hombres (16,1%) (p < 0,05). Estos resultados se presentan en la Figura 2.
En el grupo de 110 individuos sin SM se calculó la RI en 93 de ellos (17 DM1 fueron excluidos por tener HbA1c> 11,4%); se encontró que el 67% de los pacientes presentaba RI.
En el total de los DM1 que se pudo aplicar la fórmula de CG, el 75% de los sujetos tenían valores < 8,77 mg/kg x min, lo que se considera RI.
antropométricas de los pacientes DM1 con y sin SM
| con SM | sin SM | p | |
| (n = 40) | (n = 110) |
|
|
| Edad (años) | 42 ± 14 | 38 ± 14 | NS |
| Años de diabetes | 12 ± 7 | 10 ± 8 | NS |
| IMC < 25 kg/m² (%) | 40 | 61 | NS |
| IMC 25-30 kg/m² (%) | 42 | 33 | NS |
| IMC > 30 kg/m² (%) | 18 | 6 | NS |
| cc hombres (cm) | 84 ± 13 | 80 ± 8 | NS |
| cc mujeres (cm) | 96 ± 7 | 77 ± 6 | < 0,05 |
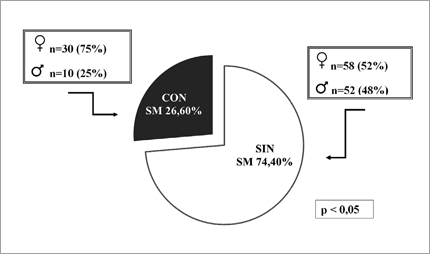 Figura 1. Frecuencia de los DM1 con SM según criterios NCEP/ATPIII modificado.
Figura 1. Frecuencia de los DM1 con SM según criterios NCEP/ATPIII modificado.
con y sin SM
|
con SM | sin SM | p |
|
(n = 40) | (n = 110) | |
| Glicemia de ayunas mg/dl | 210 ± 100 | 134 ± 70 | < 0,05 |
| HbA1c % | 8,8 ± 1,7 | 8,9 ± 0,2 | NS |
| P A sistólica mmHg | 130 ± 16 | 116 ± 12 | < 0,05 |
| P A diastólica mmHg | 76 ± 9 | 72 ± 8 | NS |
| col HDL mg/dl | 46 ± 10 | 61 ± 18 | < 0,05 |
| Triglicéridos mg/dl | 110 ± 49 | NS |
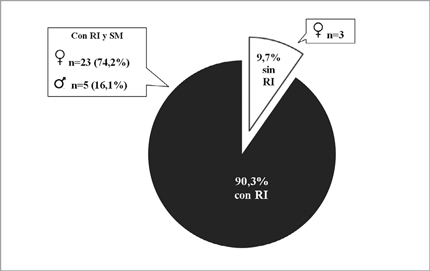
Figura 2. Frecuencia de los DM1 con RI y con SM.
Discusión
El síndrome metabólico se asocia en general a la diabetes tipo 2, existiendo al respecto numerosas publicaciones, a la inversa, en DM1 son escasos los datos disponibles. En este estudio el grupo de DM1 analizado presentó una frecuencia de SM de un 26,6%; cifra muy similar a la publicada por Baéz y cols.10 , quienes encontraron una prevalencia de 25% en el año 2009; estos autores incluyeron –al igual que nosotros– DM1 mayores de 18 años de ambos sexos y aplicaron también el NCEP/ATPIII, de manera que confirmamos lo encontrado previamente por estos autores en Chile. En Europa, estudios como el FinnDiane11 muestran en DM1 una prevalencia de síndrome metabólico algo mayor, 39% con el criterio del NCEP/ATPIII. En EE.UU. se han publicado cifras muy variables, que van de 8% a 42% según el método diagnóstico utilizado. La publicación del Pittsburg Epidemiology of Diabetes Complications Study informa de tasas bajas, 12% de SM en DM1 empleando el NCEP/ATPIII12.
La prevalencia de SM es muy superior en los DM2, aplicando la misma clasificación del NCEP/ATPIII, es así como el estudio National Health and Nutrition Examination Survey III (NHANES III) de los EE.UU, informa de un 86% de SM en población DM2 mayor de 50 años13.
La Encuesta Nacional de Salud de Chile del año 2009- 2010 publicó un 35% de SM en la población general14; evidenciando un aumento respecto al año 2003 que era de 22,6%15; lo que se explica por el incremento de la obesidad y sedentarismo entre esos años, situación que afecta igualmente a los pacientes diabéticos tipo 2 y tipo 1 de nuestro país. En este trabajo encontramos que un mayor número de pacientes con SM tenían sobrepeso u obesidad (60% vs 39% en los sin SM), esta diferencia no fue significativa, probablemente por el bajo número de DM1 con SM (n: 40). Además, la circunferencia de cintura era superior en las mujeres con SM respecto a aquellas sin SM (p < 0,05). Es un hecho conocido que el aumento del tejido adiposo visceral es el principal causante de la resistencia a la insulina, asociación que validamos en los DM1 estudiados.
En relación a la presión arterial, encontramos que los pacientes DM1 con SM tenían niveles promedio de PA sistólica más elevados (p < 0,05) que aquellos sin SM. En cambio la diastólica aunque también era superior no alcanzó significancia estadística, posiblemente por el bajo número de casos. En la actualidad se estima que son de riesgo CV cifras de PA> 130/80 mmHg, tanto la sistólica como la diastólica son relevantes como factores de riesgo. Es importante señalar que los DM1 con SM tenían glicemias de ayunas muy superiores 210 ± 100 mg/dl versus 134 ± 70 mg/dl en los sin SM (p < 0,05), podríamos deducir que la RI de estos pacientes favorece la neoglucogénesis elevando las glicemias mencionadas.
Es conocido y aceptado que la relación patogénica entre el síndrome metabólico, la DM2 y las complicaciones cardiovasculares (CV) es la existencia de resistencia a la insulina con hiperinsulinemia compensatoria16. El mejor tratamiento de los factores de riesgo CV se ha acompañado de descensos de las tasas de mortalidad y de complicaciones microvasculares; sin embargo, no se ha observado la misma tendencia en la patología cardiovascular17. Desde hace años hay investigaciones que establecen que la enfermedad CV es la razón del aumento del riesgo de mortalidad en los DM1 y la primera causa de muerte a partir de los 30 años18. En edades comprendidas entre los 60 y los 84 años, el 56% de las muertes en los varones y el 65% en las mujeres con DM1 se deben a episodios cardiovasculares19. Los antecedentes señalados apuntan a que la existencia de RI sería responsable de esta relación, por lo que es importante tener presente su presencia en estos pacientes.
Desde hace varias décadas se ha puesto de manifiesto que la causa de la diabetes en la mayoría de los DM1 es la destrucción autoinmune de las células beta pancreáticas, la que suele presentarse desde edades tempranas de la vida; sin embargo, los DM1 no estarían exentos de tener RI durante la evolución de la enfermedad.
En el estudio EDC7 al analizar la relación entre RI y SM en 514 DM1, encontraron valores significativamente menores de CG en los pacientes con SM, según criterio del NCEP/ ATPIII.
En el trabajo realizado por nosotros, observamos un mayor número de individuos con RI en el grupo con SM (90,3% vs 67% en los sin SM). Es necesario señalar el alto porcentaje de pacientes con RI entre los individuos sin SM, hecho que podríamos atribuir a los altos niveles de HbA1c (a pesar de excluir aquellos con HbA1c mayores a 11,4%), lo que influye negativamente en la fórmula, disminuyendo el valor de la CG.
Nuestros resultados muestran en DM1 un 75% de RI y sólo un 26,3% de SM; por lo anteriormente mencionado, consideramos que al aplicar la fórmula de captación de glucosa que incluye la HbA1c, en estos DM1 estaríamos sobrestimando la presencia de RI.
Autores como Kilpatrick20 han puesto de manifiesto la
relación entre la CG determinada al inicio del estudio DCCT
y el desarrollo de complicaciones micro y macrovasculares
en el seguimiento de los pacientes. Los sujetos con mayor RI
tenían más riesgo de desarrollar complicaciones vasculares;
por lo que debe tenerse presente que la existencia de RI en
los DM1, al igual que en los DM2, los predispondría a tener
en el curso de la enfermedad mayor morbimortalidad cardiovascular.
La identificación de RI en los DM1 puede tener implicancias terapéuticas, ya que el uso de fármacos sensibilizadores a la insulina, como la metformina, podría ser eficaz en el control glicémico y del peso de estos pacientes. La presencia de SM en los DM1 justificaría el uso de este insulinosensibilizador.
En conclusión, aunque no encontramos concordancia entre la frecuencia de SM según criterio del NCEP-ATPIII modificado y la presencia de RI cuantificada por la fórmula del estudio EDC, consideramos que en los DM1 se debe tener presente la existencia de RI por el riesgo cardiovascular que esto significa.
Referencias bibliográficas
- Cleland SJ, Fisher BM, Colhoun HM, Sattar N, Petrie JR. 2013. Insulin resistance in type 1 diabetes: what is "double diabetes " and what are the risks? Diabetología 56: 1462-1470.
- National Cholesterol Education Program (NCEP). 2002. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adults Treatment Panel III), Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 106: 3143-3421.
- World Health Organization. 1999. Definition, Diagnosis, and Classification of Diabetes Mellitus and its Complication. Genev a, World Health Org.
- Alberti KGMM, Zimmet P, Shaw J. 2006. Metabolic syndrome: a new world wide definition a consensus statement from the International Diabetes Federation. Diabet Med 23: 469-480.
- Mc Gill M, Molineaetes L, Turgg S. 2008. The metabolic syndrome in type 1 diabetes: does it exist and does it matter? J Diabetes Complications 22: 18-23.
- Soedamah-Muthu SS, Fuler JH, Mulnier HE, Raleigh VS, Lawrenson RA, Colhoun HM. 2006. High risk of cardiovascular disease in patients with type 1 diabetes in the UK: a cohort study using the general practice research diabetes. Diabetes Care 29: 798- 804.
- Orchard TJ, Olson JC, Erbery JR, Williams K, Forrest KYZ, Smithline Kinder L, et al. 2003. Insulin resistance related fac tors, but not glycemia, predict coronary artery disease in type 1 diabetes: 10 years follow-up data from Pittsbur gh Epidemiology of Diabetes Complications Study. Diabetes Care 26: 1374-1379.
- Williams K, Erbey J, Becker D, Orchard TJ. 2000. Can clinical factors estimate insulin resistance in type 1 diabetes?. Diabet es 49: 626-632.
- Gibes J. 2008. Métodos para la determinación de la sensibilidad a la insulina basadas en la sobrecar ga oral de glucosa. Av Diabetol 24: 296-304.
- Báez MS, Novik V, Alegría F, Cardemil F, Riveros R, Bofill L. 2009. Síndrome metabólico en un grupo de pacientes diabéticos tipo 1. ¿Una nueva variedad de diabetes? Rev Med Chile 137: 888-893.
- Thorn LM, Forsblom C, Fagerudd J, Thomas MC, Pettersson-Fernholm K, Saraheimo M, et al. 2005. Metabolic syndrome in type 1 diabetes: association with diabetic nephropa thy and glycemic control (the FinnDiane Study). Diabetes Care 28: 2019-2024.
- Pambianco G, Costacou T, Orchard TJ. 2007. The prediction of major outcomes of type 1 diabetes: a 12 year prospective evaluation of three separate definitions of the metabolic syndr ome, and their components and estimated glucose disposal rate: the Pittsburg Epidemiology of Diabetes Complications Study experience. Diabetes Care 30: 1248-1254.
- Alexander CM, Lansdman PB, Teutsch SM, Haffner SM. 2003. NCEP-defined metabolic syndrome, diabetes mellitus and prevalence of coronary heart disease among NHANES III participants age 50 years and older. Diabetes 52: 1210-1214.
- Encuesta de salud 2009-2010 web.minsal.cl/portal/url/item/ bcb03d7bc28b64dfe040010165012d23
- Encuesta de salud 2003. epi.minsal.cl/epi/html/elvigia/VIGIA20.pdf
- Muntoni S. 2011. Insulin resistance: pathophysiology and rationale for treatment. Ann Nutr Metab 58: 25-36.
- Pambianco G, Costacou T, Ellis D, Becker DJ, Klein R, Orchard TJ. 2006. The 30-year natural history of type 1 diabetes complications: the Pittsburgh Epidemiology of Diabetes Complications Study experience. Diabetes 55: 1463-1469.
- Laing SP, Swerdlow AJ, Slater SD, Botha JL, Burden AC, Waugh NR, et al. 1999. The British Diabetic Association Cohort Study II: cause-specific mortality in patients with insulin-tre ated diabetes mellitus. Diabet Med 16: 466-471.
- The Metascreen Writing Committee. 2006. The metabolic syndrome is a risk indicator of microvascular and macrovascular complications in diabetes: results from Metascreen, a multicenter diabetes clinic-based survey. Diabetes Care 29: 2701-2707.
- Kilpatrick ES, Rigby AS, Atkin SL. 2007. Insulin resistance, the metabolic syndrome, and complications risk in type 1 diabetes: "double diabetes" in the Diabetes Complications Trial. Diabetes Care 30: 707-712.