Efecto del factor de crecimiento de fibroblastos-21 en la expresión de la fosfatasa SHP-2 en células Malme-3
Fernando Rodríguez C.1,a, Alejandro Tapia P.1,b y Germán Iñiguez V.1,c
Fibroblast growht factor 21 effects over phosphatase SHP-2 expression in Malme-3 cells
1Instituto de Investigaciones Materno Infantil (IDIMI), Facultad de Medicina, Universidad de Chile.
aLicenciado en Biología Molecular. bBioquímico. cQuímico Farmacéutico.
Apoyo Financiero: Proyecto SOCHED 2012-01 (FR). Proyecto Fondecyt Regular N°1110240 (GI).
Conflictos de Interés: Los autores declaran no tener conflictos de interés.
Correspondencia a:
Fernando Rodríguez
Instituto de Investigaciones Materno Infantil. Facultad de Medicina - Universidad de Chile. Santa Rosa 1234 (Santiago Centro - CP 8360160) Tel.: +56-2-29770855
Fax: +56-2-24248240
E-mail: frodriguezr@med.uchile.cl
Recibido: 13-06-2014
Aceptado: 27-06-2014
Background: Almost 50% of Noonan Syndrome patients, characterized by short stature, present activating mutations of the citoplasmatic phosphatase SHP-2, which induce hyperactivation of the Ras/MAPK pathway. On the other hand, the fibroblast growth factor 21 (FGF-21), recently suggested as a FGF with "endocrine" function, would affect longitudinal growth inhibiting growth hormone signaling at chondrocytes level. Union and activation of FGF-21 to its receptor is regulated by the co-factor βKlotho (KLB). Aims: To determine if FGF-21 and/or FGF -21+KLB are able to modify the genetic expression of SHP-2 in a human skin fibroblast cell line (Malme-3). Methods: Cells were incubated with or without
FGF-21, FGF -21 + KLB. At 12 and 24 hours after induction total RNA was extracted and SHP-2 mRNA levels were determine by quantitative PCR. Expression of GADPH gene was employed for normalization. Results: Incubation with FGF-21 produce a 36% (p = < 0,05) increment in SHP-2 expression, which was not modified with KLB co-incubation. Discussion: It is shown by the first time that FGF -21 is able to produce an increase in SHP-2 gene expression in human fibroblast, which was independent of KLB presence.
Key words: Growth, FGF21, SHP-2
El eje somatotrófico es el principal blanco de estudio cuando la talla baja no puede ser asociada a causas tales como deficiencias nutricionales; infecciones recurrentes; o patologías crónicas no endocrinológicas. Este eje presenta como componente central la hormona de crecimiento (GH). Esta hormona es liberada en forma pulsátil por las células somatotrópas de la hipófisis anterior a la circulación porta hipofisiaria. Su liberación está regulada por dos neuropéptidos hipotalámicos, uno estimulante (GHRH) y otro inhibidor denominado somatostatina (SRIF). Los efectos biológicos atribuidos a GH son mediados en mayor medida, por el factor de crecimiento similar a la insulina del tipo I (Insulin- Like Growth Factor 1, IGF- I), liberado fundamentalmente desde el hígado, uno de los blancos principales de GH1.
La unión de GH a su receptor (GHR) provoca la dimerización de éste lo cual induce la unión y activación de la quinasa JAK2. La activación de JAK2 lleva a la fosforilación de tirosinas presentes en el dominio citoplasmático del GHR. Estas tirosinas fosforiladas son un punto de bifurcación a diversas vías de señalización. La principal vía, conocida como canónica, es mediada por un grupo de factores de transcripción citoplasmáticos denominados STAT, los cuales una vez fosforilados por JAK2 dimerizan y se translocan al núcleo donde promueven la transcripción de genes entre los cuales destaca IGF-I2,3. Otra de las vías que transmite la señal de GH al interior celular es la vía Ras-MAPK. Esta involucra una serie de proteínas adaptadoras, GTPasas, fosfatasas y quinasas que regulan la expresión de genes vinculados a diferenciación y proliferación, entre los cuales se encuentra IGF-I4-5. Se ha postulado que la hiperactivación de la vía Ras-MAPK a partir de GH llevaría a una disminución en la secreción de IGF-I2.
En la vía Ras-MAPK participa una fosfatasa denominada SHP -2, codificada por el gen PTPN11, cuyo papel ha adquirido gran relevancia a partir de su vinculación con el Síndrome de Noonan6, condición en la cual la talla baja es un signo característico. Mutaciones en PTPN11 dan cuenta del 50% de los casos de Síndrome de Noonan. Diversos estudios bioquímicos apuntan a que las mutaciones de PTPN11 halladas en pacientes con este síndrome, llevan a una hiperactivación de la vía Ras-MAPK7-9.
Recientemente, se ha relacionado con el crecimiento longitudinal al factor de crecimiento de fibroblastos 21 (FGF-21), que a diferencia de la mayoría de los FGFs, se caracteriza por actuar como un factor endocrino10,11. La acción de FGF-21 parece ser mediada principalmente por un complejo formado por el receptor FGFR1 y el co-receptor β-klotho (KLB); este último facilitaría la activación de FGFR1 por FGF-2112. Inagaki y cols.13 demostraron que ratones que sobre-expresan FGF-21 resultaron más pequeños cuando se compararon con ratones silvestres. Por otro lado, se ha observado que ante una restricción crónica de alimento se produce un aumento en los niveles de FGF-21, asociado a una reducción del crecimiento longitudinal de los huesos e insensibilidad a GH14. Wu y cols.15 mostraron que FGF -21, a través del receptor FGFR1, antagoniza el efecto de GH sobre la proliferación de condrocitos de la placa epificiaria de rata. Finalmente, se ha reportado que en células endoteliales el bloqueo del receptor FGFR1 produce una disminución en la vida media de SHP-2 llevando a una disminución de los niveles citoplasmáticos de la fosfatasa, lo cual se traduciría en una facilitación de la señalización inducida por GH16.
En base a los antecedentes presentados, nos propusimos estudiar si FGF- 21 es capaz de modificar la expresión génica de SHP-2 en un modelo celular humano.
Cultivo celular e inducción con FGF-21
Se empleó una línea de fibroblastos de piel humana, proveniente de un adulto normal (Malme-3), obtenidas del (American Tissue Cell Culture, ATCC). Las células fueron cultivadas en medio McCoy`s 5a modificado (Gibco -Life Technologies, USA), suplementado con 15% de suero fetal bovino inactivado (Gibco-Life Technologies, USA) y una mezcla de antibióticos/antimicótico (Gibco-Life Technologies, USA); en incubadora a 37ºC y 5% de CO 2. Para la estimulación con FGF-21 las células fueron colocadas en placas de seis pocillos (Nest Biotech, China) y cultivadas hasta una confluencia de alrededor del 80%, momento en el cual el medio fue cambiado por uno fresco pero sin suero fetal bovino (privación). Luego de 24 h de privación, las células fueron incubadas en medio de privación durante 12 ó 24 h en presencia o ausencia de FGF-21 (10nM) o FGF-21 (10nM) + KLB (1nM) (R&D Systems, USA).
Obtención de cDNA
Las células obtenidas después de 12 ó 24 h post-estímulo fueron lavadas tres veces con DPBS 1X (Gibco-Life Technologies, USA) y posteriormente tratadas con TRIzol (Ambion- Life Technologies, USA) para la obtención de RNA total, de acuerdo a las indicaciones del fabricante. Después de la cuantificación del RNA total, utilizando el equipo Nanodrop 2000c (Thermo Scientific, USA), se realizó una retro-transcripción para la obtención del cDNA correspondiente. Brevemente, 2 ug de RNA total se incubaron durante 5 min a 65ºC en presencia de 300 ng de Random primers (Invitrogen-Life Technologies, USA); 0,5 mM de dNTPs (Omega Bio-Tek, USA) y agua libre de nucleasas hasta un volumen de 12 ul. Inmediatamente después de la incubación la mezcla fue colocada en hielo y a continuación se agregó First Strand Buffer 5X (Invitrogen-Life Technologies, USA) hasta una concentración 1X; 10 mM de DTT y 40 unidades de RNase OUT (Invitrogen -Life Technologies, USA). Esta nueva mezcla se incubó por 2 min a 37ºC. Finalmente, se agregaron 200 unidades de la retro-transcriptasa M-MLV RT (Invitrogen-Life Technologies, USA) y se realizaron las siguientes incubaciones: 10 min a 25ºC; 50 min a 37ºC y 15 min a 70ºC.
PCR cuantitativa
Con el fin de cuantificar la expresión de PTPN11 en respuesta a FGF- 21 se realizó PCR cuantitativa (qPCR), empleando como gen normalizador GADPH (sentido: 5` agccgcatcttcttttgc 3`; antisentido: 5` aatgaaggggtcattgatgg 3`). Previamente se realizó la búsqueda de condiciones para la amplificación con los oligonucleótidos para PTPN11 (sentido: 5` ccaatgagcctgtttcagattac 3`; antisentido: 5` gccttgtgtggcaatgtaac 3`) los cuales fueron diseñados en nuestro laboratorio con el programa Primerquest® www.idtdna.com/ Primerquest/(IDT, USA). Tanto para la cuantificación del RNAm de PTPN11 como para la estandarización ya mencionada, 1 ul del cDNA obtenido como se describió anteriormente o una dilución seriada de dicha cantidad, respectivamente; fue mezclado con 5 ul del reactivo SensiMix HRM (Bioline, UK); 0,4 ul del fluoróforo intercalante Eva-green® (Bioline, UK); 0,5 uM de cada oligonucleótido (sentido y antisentido) y agua libre de nucleasas hasta un volumen final de 10 ul. Esta mezcla fue incubada en el equipo Eco Illumina ® (Illumina, USA) a 95ºC durante 5 min seguido de 40 ciclos a 95ºC/30 seg, 57ºC/30 seg y 72ºC/15 seg. Cada muestra fue analizada en triplicado. En el caso de la puesta a punto, los amplificados resultantes fueron resueltos en gel de agarosa al 2% (Winkler, España) y visualizados mediante la aplicación al gel del fluoróforo SYBR safe® (Invitrogen-Life Technologies, USA).
Resultados
En el presente trabajo se investiga por primera vez el efecto de FGF- 21 sobre la expresión génica de SHP-2 en células humanas.
Para realizar la cuantificación del RNAm de SHP-2 se realizó la estandarización de las condiciones para la amplificación con los oligonucleótidos diseñados en nuestro laboratorio. En la Figura 1A se observa que con una temperatura de annealing (Ta) de 58°C se obtiene un amplificado único del tamaño esperado (~ 107 pb); esta Ta difiere en 4°C con respecto a la Ta teórica predicha por el fabricante (54°C). Una vez definida la Ta se determinó la eficiencia de los oligonucleótidos mediante la generación de una curva estándar con diluciones seriadas de cDNA, el cual fue obtenido como se describió en la sección Materiales y Métodos. En la Figura 1B se muestran los plots de amplificación correspondiente a las distintas diluciones empleadas, mientras que en la Figura 1C se puede observar la curva estándar generada a partir del Ct (primer ciclo de la qPCR en el que se detecta fluorescencia sobre el umbral) de cada dilución. El análisis de dicha curva indica una eficiencia del 102% (R2 = 0,993) para los oligonucleótidos probados. Por otra parte, el análisis de la curva de denaturación (Figura 1D), muestra que las curvas de melting para las distintas diluciones presentan una temperatura de denaturación (Tm) de 76ºC, sólo un grado de diferencia con respecto a las Tm teórica (75ºC) determinada con el programa Umelt® https://www.dna.utah.edu/(Universidad de Utah, USA). Los resultados obtenidos nos permiten asegurar que los oligonucleótidos diseñados amplifican eficiente y específicamente el cDNA correspondiente a SHP-2.
Posteriormente, se estudió la temporalidad del efecto de FGF-21 y FGF21 + KLB sobre la expresión de SHP-2. En la Figura 2 se muestra que después de 12 h post-estimulación con FGF-21, tanto en presencia como en ausencia de KLB se produjo un aumento en la expresión del RNA mensajero de SHP-2 (p < 0,05). Sin embargo, a las 24 h post-estimulación este efecto no fue observado. La Figura 3 muestra el efecto, a las 12 h, de FGF21 en presencia o ausencia de KLB sobre la expresión de SHP-2; encontrándose un incremento del 36% en la expresión de SHP-2 al incubar con FGF-21, el cual no fue modificado al realizar las incubaciones en presencia de KLB.
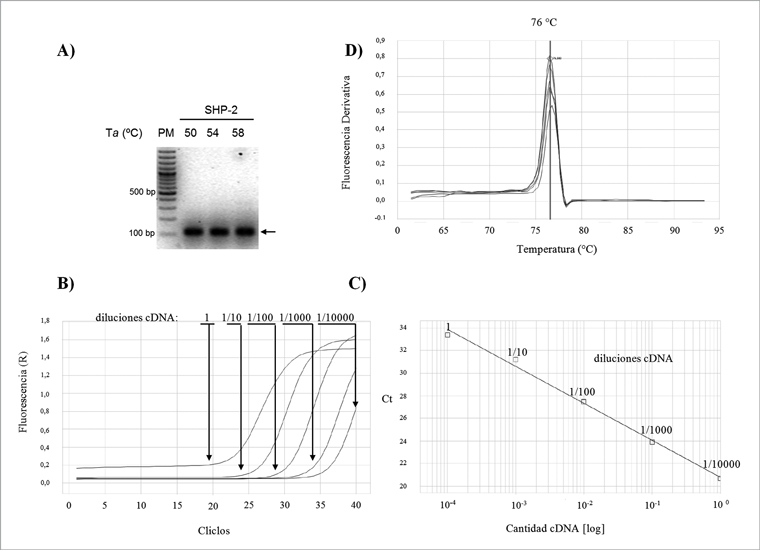
Figura 1. Puesta a punto oligonucleótidos para qPCR de SHP-2. A) Gel de agarosa mostrando amplificados (flecha) obtenidos con oligonucleótidos generados para SHP-2, con Ta de 50, 54 y 58°C; en el extremo izquierdo se muestra el marcador de peso molecular (100 pb ladder-Fermentas, USA). B) Plots de amplificación para oligonucleótidos de SHP-2 en presencia de diluciones seriadas de cDNA. C) Curva estándar resultante de los Ct de cada dilución. D) Curvas de melting para productos obtenidos con oligonucleótidos de SHP2 y diluciones seriadas de cDNA.
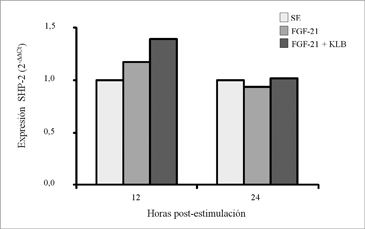
Figura 2. Temporalidad en inducción de la expresión de SHP-2 por FGF21. Células Malme-3 fueron privadas de suero durante 24 h y posteriormente incubadas durante 12 ó 24 h en presencia de FGF-21(10 nM) con o sin KLB (1 nM). A partir de los respectivos RNA totales obtenidos se sintetizó cDNA el cual fue utilizado como templado para qPCR de SHP-2 y GADPH (gen normalizador). Los datos se representan como cambio relativo, determinado mediante el algoritmo 2- Ct, respecto a la condición sin estímulo (SE).
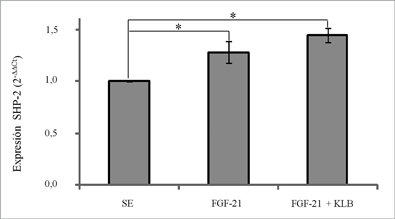
Figura 3. Participación de FGF-21 y KLB en la expresión de SHP-2. Células Malme-3 fueron tratadas de manera similar al experimento anterior, pero considerando sólo 12 h de estimulación. Los datos representan 5 experimentos independientes y se muestran como promedio ±EEM del cambio relativo, determinado mediante el algoritmo 2- Ct, con respecto a la condición sin estímulo (SE). *p < 0,05 FGF21 y FGF21+KLB vs SE (Wilcoxon).
Discusión
En el presente trabajo mostramos por primera vez, que FGF-21 produce un aumento en la expresión génica de SHP-2 en fibroblastos de piel humana. Hasta el momento, sólo se ha relacionado indirectamente un posible efecto de FGFs sobre la expresión de SHP -2; es así que Hatanaka y cols. 16 observaron que el bloqueo del receptor FGFR1, mediante la sobreexpresión de un mutante dominante negativo de dicho receptor en células endoteliales de aorta de bovino (BAEC), lleva a un aumento del RNA mensajero de SHP-2. Esto nos lleva a suponer que un estímulo de la vía induciría una disminución de la expresión de SHP-2 en dichas células. Estos resultados opuestos podrían explicarse por un efecto diferente de FGF-21 sobre la expresión de SHP-2 dependiente del tipo celular. A su vez, en el trabajo de Hatanaka sólo se considera el bloqueo del receptor FGFR1 sin tener en cuenta los demás receptores para FGFs (FGFR2-4), los cuales también pueden ser activados por FGF-2117.
Por otra parte, observamos que el efecto de FGF-21 sobre la expresión de SHP-2 es independiente de la presencia de KLB. No obstante, no podemos descartar la posibilidad de que los fibroblastos de piel humana empleados en este estudio sean capaces de secretar KLB de tal modo de poder formar complejos con los receptores FGF que unen a FGF-21, con lo cual el KLB agregado no produciría un mayor efecto. Se ha reportado que el RNAm para KLB es expresado en líneas celulares provenientes de piel de ratón; no obstante la cantidad detectada en dicho tejido es muy inferior a la detectada en hígado y páncreas18. Por otra parte, a nivel proteico SHP-2 ha sido detectada en keratinocitos epidérmicos humanos19.
En resumen, reportamos por primera vez que en células humanas FGF- 21 es capaz de producir un aumento en la expresión génica de SHP-2, este resultado nos permite sugerir que el efecto de FGF21 sobre la expresión de SHP2 sería independiente de la presencia de KLB. Estos resultados nos alientan a estudiar el efecto de los niveles proteicos de SHP-2 en presencia de FGF- 21 y posteriormente el efecto que dichos cambios podrían tener sobre la activación de la vía Ras-MAPK por parte de GH; todo lo cual nos permitirá abrir un nuevo campo de exploración en la búsqueda de posibles causas de talla baja en niños que además presenten alteraciones en las concentraciones sistémicas de FGF-21.
Agradecimientos
Los autores agradecen la lectura crítica y los aportes constructivos del Dr. Fernando Cassorla en la generación del proyecto SOCHED en el marco del cual se generó este artículo. Esta investigación fue financiada con el Proyecto SOCHED 2012-01 asignado a FR.
Referencias bibliográficas
- Castro JR, Castro-Feijó L, Pombo M. 2002. Crecimiento prenatal y posnatal. En: Beas F, ed. Endrocrinología del niño y el adolescente. Segunda edición. Santiago, Editoral Mediterráneo, 56-70.
- Benekli M, Baumann H, Wetzler M. 2009. Targeting signal transducer and activator of transcription signaling pathway in leukemias. J Clin Oncol. 27: 4422-4432.
- Davey HW1, Xie T, McLachlan MJ, Wilkins RJ, Waxman DJ, Grattan DR. 2001. Stat5b is required for GH-induced liver Igf-I gene expression. Endocrinology 142: 3836-3841.
- Carter-Su C, Pj King A, Argetsinger L, Smit LS, Vanderkuur J, Campbell GS. 1996. Signalling pathway of GH. Endocrine Journal 43: 65-70.
- Vanderkuur J, Butch E, Waters S, Pessin JE, Guan KL, Carter-Su C. 1997. Signaling molecules involved in coupling growth hormone receptor to mitogen-activated protein kinase activation. Endocrinology 138: 4301-4307.
- Tartaglia M, Kalidas K, Shaw A, Song X, Musat DL, van der Burgt I, Brunner HG, et al. 2002. PTPN11 mutations in Noonan syndrome: molecular spectrum, genotype-phenotype correlation, and phenotypic heterogeneity. Am J Hum Genet 70: 1555-1563.
- Fragale A, Tartaglia M, Wu J, Gelb BD. 2004. Noonan syndrome-associated SHP2/PTPN11 mutants cause EGF-dependent prolonged GAB1 binding and sustained ERK2/MAPK1 activation. Hum Mutat 23: 267-277.
- Keilhack H, David F, McGregor M, Cantley LC, Neel BG. 2005. Diverse biochemical properties of Shp2 mutants. Implications for disease phenotype. J Biol Chem 280: 30984-30993.
- Oishi K, Gaengel K, Krishnamoorthy S, Kamiya K, Kim IK, Ying HW, Weber U, et al. 2006. Transgenic Drosophila models of Noonan syndrome causing PTPN11 gain-of-function mutations. Hum Mol Genet 15: 543-553.
- Nishimura T, Nakatake Y, Konishi, Itoh N. 2000. Identification of a novel FGF, FGF-21, preferentially expressed in the liver. Biochim Biophys Acta 1492: 203-206.
- Kharitonenkov A, Shiyanova TL, Koester A, Ford AM, Micanovic R, Galbreath EJ, Sandusky GE, et al. 2005. FGF-21as a novel metabolic regulator. J Clin Invest 115: 1627-1635.
- Ming A, Yoo A, Vorontsov E, Altamentova SM, Kilkenny DM, Rocheleau JV. 2009. Dynamics and distribution of Klotho (KLB) and Fibroblast Growth Factor Receptor-1 (FGFR1) in living cells reveal the Fibroblast Growth Factor-21 (FGF21)-induced receptor Comple. J Biol Chem 287: 19997-20006.
- Inagaki T, Lin VY, Goetz, Mohammadi M, Mangelsdorf DJ, Kliewer SA. 2008. Inhibition of Growth Hormone signaling by the fasting-induced Hormone FGF21. Cell Metab 8: 77-83.
- Kubicky RA, Wu S, Kharitonenkov A, De Luca F. 2012. Role of Fibroblast Growth Factor 21 (FGF21) in undernutrition-related attenuation of growth in mice. Endocrinology 153: 2287-95.
- Wu S, Levenson M, Kharitonenkov A, De Luca F. 2012. Fibroblast Growth Factor 21 (FGF21) inhibits chondrocyte function and Growth Hormone (GH) action directly at the growth plate. J Biol Chem 287: 26060-7.
- Hatanaka K, Lanahan A, Murakami M, Simons M. 2012. Fibroblast growth factor signaling potentiates VEcadherin stability at adherents junctions by regulating SHP2. PlosOne 7: e37600.
- Kliewer SA, Mangelsdorf DJ. 2010. Fibroblast growth factor 21: from pharmacology to physiology. Am J Clin Nutr 91: 254S-257S.
- Ito S, Kinoshita S, Shiraishi N, Nakagawa S, Sekine S, Fujimori T, Nabeshima YI. 2000. Molecular cloning and expression analyses of mouse betaklotho, which encodes a novel Klotho family protein. Mech Dev 98: 115-9.
- Liu L, Xie H, Chen X, Shi W, Xiao X, Lei D, Li J. 2012. Differential response of normal human epidermal keratinocytes and HaCaT cells to hydrogen peroxide-induced oxidative stress. Clin Exp Dermatol 37: 772-780.