Detección de cortisol salival nocturno en una muestra
de sujetos de Santiago de Chile, mediante la técnica de electroquimioluminicencia
Maritza Garrido P.1,a, Carmen Romero O.1,a, María Pía Cid R.2,b y A. Verónica Araya Q.2
Night salivary cortisol measurement in a sample of volunteers from Santiago using an electroquimioluminicence technique
1Laboratorio de Endocrinología
y Biología de la Reproducción,
Hospital Clínico Universidad de
Chile.
2Sección Endocrinología y Diabetes,
Hospital Clínico Universidad de
Chile.
aBioquímico.
bBecada de subespecialidad
Endocrinología.
Correspondencia a:
Maritza Garrido P.
Fono/Fax: 22 978 8460
E mail: mgarrido@hcuch.cl
Recibido: 29-05-2015
Aceptado: 10-06-2015
Cortisol is a glucocorticoid hormone with circadian cycle, it shows high levels in the morning and lower in the night. The salivary cortisol is the biologically active fraction and night measurement has been very useful for improving the diagnosis of Cushing’s syndrome, an endocrine disorder characterized by high levels of cortisol and loss of their circadian cycle. A disadvantage of this measurement is the establishment of reference ranges, which depends on the population and technique. Therefore the night salivary cortisol values were determined in a sample of 75 healthy volunteers, aged 18-75 years old. Each volunteer collects two samples in consecutive days and these samples were analyzed by electrochemiluminescence. The average of night salivary cortisol of volunteers was 0.165 ± 0.059 ug/dL with a range from 0.082 to 0.352 ug/dL and no significant differences were found between two samples of cortisol in day 1 and 2. Our results suggest that the proposed cut-off limit 0.32 ug/dL between patients with and without Cushing Syndrome would be suitable for this technique and in our population.
Key words:
El cortisol es una hormona de la familia de los glucocorticoides, sintetizada en la corteza de la glándula suprarrenal. Entre un 70-80% es transportado en sangre unida a la globulina transportadora de cortisol (CGB), un 15% se encuentra unido a albúmina y entre un 5-10% circula libre, y es la fracción biológicamente activa. Además, esta fracción libre es capaz de traspasar la barrera endotelial, acumulándose en otro tipo de fluidos biológicos, como la orina o saliva1-3.
Fisiológicamente el cortisol presenta variaciones en su concentración plasmática durante el día. Posee un ritmo circadiano, donde los valores más altos de esta hormona se encuentran entre las 7:00-8:00 AM y decrecen durante el día hasta llegar a los valores mínimos entre las 23:00-24:00 h. Debido a estas variaciones es esencial estandarizar un horario de toma de muestras, y tener rangos de referencia según el momento del día en que se toma dicha muestra4,5.
Existen diferentes técnicas para medir cortisol pero la medición de la fracción de cortisol libre presente en el plasma refleja el cortisol biológicamente activo y por lo tanto, es una mejor aproximación que medir el cortisol total sanguíneo. Además, al presentar los valores más bajos durante la noche (23 a 24 h) la medición de cortisol nocturno permite detectar la pérdida del ciclo circadiano tempranamente, por lo que sería el mejor examen para evaluar si un paciente presenta alteraciones en su ciclo circadiano3,6,7.
Los exámenes de laboratorio que miden la fracción de cortisol libre son: cortisol libre en orina de 24 h (CLU) y el cortisol libre en saliva8-11. La medición de CLU es de mucha utilidad en el diagnóstico de SC, estima la producción de cortisol en 24 h, pero involucra la recolección de orina durante todo un día, por lo tanto, depende de la adecuada recolección por parte del paciente y de la diuresis final. En el laboratorio se realiza una extracción y posterior concentración del cortisol libre presente en la muestra. En contraste, la medición del cortisol en saliva tiene muchas ventajas, principalmente su fácil recolección y transporte al laboratorio; no involucra la extracción de sangre venosa, y por consiguiente, se evita el estrés que puede elevar el resultado. El paciente puede recolectar su saliva mediante un instructivo en su hogar, los dispositivos permiten obtener un volumen adecuado de muestra y mayor comodidad para su procesamiento y almacenamiento en el Laboratorio.
El síndrome de Cushing (SC) es un trastorno endocrino caracterizado por altos niveles de cortisol, ya sea endógeno o por administración de corticoides. Uno de los primeros hallazgos en los pacientes que padecen SC endógeno es la pérdida del ciclo circadiano del cortisol. Los valores en sangre de los pacientes tienden a ser constantes durante el día, o bien no disminuyen significativamente6. La utilización del cortisol salival nocturno, ha resultado muy útil en el diagnóstico de SC independientemente de la etiología; enfermedad de Cushing, SC adrenal o tumores ectópicos12,13.
A pesar de que la concentración de cortisol en saliva es 10 veces más baja que en el plasma14, estudios muestran que existe una estrecha correlación entre el cortisol libre en saliva y el cortisol sérico15-17, así como el cortisol libre urinario11,15,18. Zhang y colaboradores realizaron una recopilación de datos publicados entre el año 1998-201219. Se estimó una sensibilidad promedio para el diagnóstico de SC de 95,3% y especificidad de 91,62%, demostrando mucha utilidad diagnóstica.
Por otra parte, los límites de referencia son muy variados dependiendo de la población y técnica en que se usa16,19-23. Según distintos autores internacionales, los valores de 0,52 ug/dL (14,2 nmol/l); 0,4 ug/dL (11,0 nmol/L) y 0,31 ng/dL (8,56 nmol/L) este último de un estudio local, podrían con alta probabilidad, discriminar entre sujetos sanos y con Síndrome de Cushing15,21. Estas diferencias hacen necesario evaluar los rangos referenciales según el método y población en el laboratorio de diagnóstico.
Para la cuantificación de cortisol libre en saliva se han utilizado diferentes técnicas: radioinmunoensayo (RIA), Enzimoinmunoensayo (EIA)2,24, cromatografía líquida acoplada a espectrometría de masa (Gold standard) 25-28 y más recientemente electroquimioluminiscencia (ECLIA)15,18,20,26.
Entre las ventajas del ECLIA se encuentran la automatización, el bajo volumen de muestra a utilizar y un menor costo por determinación. Actualmente el equipo Cobas e411 de la empresa Roche tiene en el mercado kits para determinar cortisol en saliva. Por lo tanto, el objetivo del presente trabajo fue determinar cuál de los valores de corte descritos en la literatura, es representativo de nuestra población.
Sujetos y Métodos
El estudio se realizó en el Laboratorio de Endocrinología y Biología de la Reproducción del Hospital Clínico Universidad de Chile. Se reclutó a 75 voluntarios de ambos sexos, entre 18-75 años, con los siguientes criterios de exclusión: índice de masa corporal mayor a 35 kg/m2, padecer enfermedades crónicas como diabetes, enfermedad hepática o renal crónica, epilepsia, cáncer; o enfermedades psiquiátricas como depresión, bipolaridad, crisis de pánico, etc.; fumar más de 3 cigarrillos al día o padecer alcoholismo, embarazo, uso de antimicóticos orales los últimos 3 meses o tratamiento con corticoides en el último año, cualquier enfermedad aguda en las últimas dos semanas y turnos o actividades nocturnas en la última semana.
Además, se contó con 5 muestras de individuos diagnosticados con Síndrome de Cushing. Todos los voluntarios firmaron un consentimiento informado aprobado por el Comité de Ética del Hospital Clínico Universidad de Chile y recolectaron dos muestras de saliva durante dos días consecutivos entre las 23:00 y 24:00 h, mediante los dispositivos Salivette®. Se entregó a cada voluntario un instructivo que contenía los requisitos para una toma de muestra adecuada: enjuagar boca y manos con agua fría antes de manipular el dispositivo Salivette®, no realizar ejercicios vigorosos durante dos horas previas a la toma de muestra, comer y cepillar los dientes hasta una hora antes de ésta y mantener las muestras de saliva a 4°C hasta su transporte al Laboratorio. Las muestras se centrifugaron a 2.500 rpm por 10 min y se congelaron a -20°C hasta su procesamiento por el equipo automatizado de electroquimioluminiscencia Cobas e411 (Roche). El rango dinámico de la técnica va desde 0,018 hasta 63,4 ug/dL de cortisol y se utilizó el suero control Preci-control universal (Roche) como control de calidad interno.
Se excluyeron los valores de una voluntaria a quien se le diagnosticó embarazo ectópico reciente, y cuyos valores se encontraban notoriamente alterados, con respecto al resto de los voluntarios. Los datos se presentan como promedio ± desviación estándar. Para estos cálculos se consideró el promedio de las dos tomas de muestras de los sujetos y se utilizó t-test para comparar los valores de cortisol salival nocturno tomados el día 1 y 2 por los voluntarios.
Resultados
Participaron 75 voluntarios de entre 18 y 61 años; 41 de sexo femenino (34,5 ± 13,2 años e IMC 24,8 ± 3,9) y 34 de sexo masculino (31,4 ± 9,5 años e IMC 25,4 ± 3,8) que cumplieron con los criterios de inclusión. El promedio de valor de cortisol libre salival nocturno de los voluntarios fue de 0,165 ± 0,059 ug/dL con un rango de 0,082-0,352 ug/dL (Figura 1). Además, en el estudio se contó con la medición de cortisol salival nocturno de 5 individuos diagnosticados con Síndrome de Cushing, los que tuvieron un promedio de 3,94 ± 6,94 ug/dL con un rango de 0,343-16,335 ug/dL.
No se encontraron diferencias significativas al analizar los valores de cortisol entre día 1 y día 2 de los individuos controles. El valor promedio de cortisol salival 23 h de los voluntarios el día 1 fue 0,165 ± 0,076 y el día 2 fue 0,163 ± 0,068. Las diferencias entre el valor del día 1 y 2 se agruparon (Figura 2) y resultó que en el 88,9% de los individuos, los valores fueron similares (con diferencias menores a 0,059 ug/dL o bien menores a una desviación estándar del grupo), sólo en el 2,8% de los casos existieron diferencias mayores a 0,177 ug/dL.
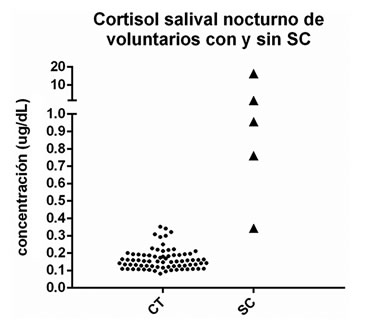
Figura 1. Valores de cortisol salival 23:00 h de voluntarios sanos y pacientes con Síndrome de Cushing. Cada punto representa el valor promedio de cortisol salival 23:00 h de un voluntario. Además, se incluyen los valores obtenidos por 5 pacientes que padecen Síndrome de Cushing (triángulos).
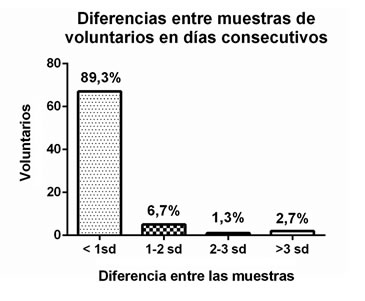
Figura 2. Diferencia entre las muestras de cortisol salival nocturno en un mismo voluntario control y en días consecutivos. El 88,9% de los participantes, presentan diferencias menores a 0,059 ug/dL (equivalentes a 1 desviación estándar).
Discusión
El cortisol en saliva nocturno es una determinación fácil y no invasiva que apoya al diagnóstico y seguimiento del Síndrome de Cushing8,9,15,18,25,29,30. También ha demostrado ser útil para el seguimiento de pacientes con SC episódico o cíclico y en incidentalomas suprarrenales12, donde los pacientes presentan alzas de cortisol episódicas. La ventaja del cortisol salival en estos casos radica en que se pueden tomar muestras durante varios días o un período de tiempo prolongado, lo que permite monitorear fácilmente las variaciones de cortisol libre2. Existen además, evidencias que promueven la medición de cortisol libre para discriminar entre pacientes con SC y pacientes pseudo-cushing y también en el seguimiento de pacientes post-terapia31.
Sin embargo, el rango de normalidad para el cortisol salival es técnica-dependiente y población dependiente20. Existen diversos rangos de referencias y límites de cortes en la literatura internacional, por lo que es necesario establecerlo para cada población y para la técnica utilizada en la detección.
Los valores de cortisol salival nocturno obtenidos en esta muestra de voluntarios concuerdan con los resultados publicados previamente por nuestro grupo21. En dicho trabajo se sugiere un límite de corte para cortisol saliva nocturno de 0,31 ug/dL y los resultados del actual trabajo refuerzan este planteamiento. A pesar de que el número de pacientes con Síndrome de Cushing mostrados en este trabajo es bajo, todos presentaron valores elevados y sobre 0,31 ng/dL, diferenciándose claramente del grupo control. La literatura propone diferentes puntos de corte para la determinación de cortisol salival nocturno. La Tabla 1 muestra algunos límites de corte publicados, y la especificidad que tendrían si se aplicaran a la muestra de nuestra población.
Tabla 1. Resumen de cortes propuestos en la literatura para el cortisol salival nocturno entre pacientes con y sin SC. Estos datos se comparan con los obtenidos en este estudio usando el equipo Cobas e411
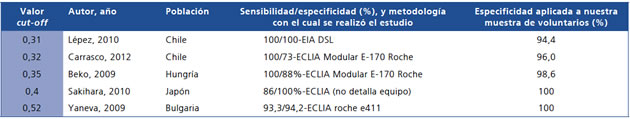
Para Chile el rango sería concordante con los estudios de Lépez y Carrasco, por lo que se podría proponer un rango de normalidad de hasta 0,32 ug/dL, ya que al aumentar el valor de corte a 0,35 ug/dL, alcanza el valor que registró uno de los cinco voluntarios con SC (0,342 ug/dL). Sería interesante contar con más pacientes con SC para establecer la zona gris entre éstos y los voluntarios sin SC.
Según nuestros resultados, a pesar de que la mayoría de los participantes no tienen diferencias significativas entre las mediciones del día 1 y 2, un 20,7% presenta diferencias entre las dos mediciones mayores a 1 desviación estándar, principalmente por la toma de muestra inadecuada. Por lo que tomar 2 mediciones, sería útil para descartar que un aumento se deba a errores en el procedimiento de toma de muestra o no seguimiento de las instrucciones. Existen muchos factores que pueden alterar la concentración de cortisol plasmático o bien su ritmo circadiano. Entre estos están el estrés, ejercicio, medicamentos, dieta, alteraciones prolongadas del sueño o de ciclos de luz-oscuridad11. Otro factor es la globulina transportadora de cortisol (CBG) que en ciertas situaciones (pacientes con terapia estrogénica o embarazo11 aumenta y por consiguiente, aumenta el cortisol total medido en sangre. Esto puede llevar a interpretaciones equivocadas frente a la sospecha de hipercortisolismo, por lo que es necesario para el correcto diagnóstico, contar con la medición de la fracción libre del cortisol, cuyos niveles se mantienen constantes.
Es importante considerar además, que aparte de la variación circadiana del cortisol, existe evidencia de variaciones en su concentración sérica asociadas a edad y sexo. Estas diferencias fluctuarían entre 20-50% del valor de cortisol plasmático entre los 20 y 80 años de edad. También se ha descrito que las mujeres pre-menopásusicas tienen en promedio niveles más bajos que los hombres de su mismo grupo etario4.
Las principales desventajas de la toma de muestra de saliva son que el paciente no recolecte una cantidad adecuada de la muestra, que no siga las instrucciones o pueda alterar la matriz de la muestra: ingerir alimentos en el momento de la toma de muestra, realizar ejercicios vigorosos o fumar, pueden alterar los niveles de cortisol, o que al enjuagar la boca previo a la toma de muestras, no salive lo suficiente y exista efecto de dilución. En cuanto al almacenamiento de la muestra, luego de ser recolectada la saliva en el dispositivo se debe mantener a 4°C hasta su transporte al Laboratorio (Se recomienda transportar con cadena de frío). Como el cortisol, es una hormona esteroidal, de mucha estabilidad química, no es sensible a la degradación por cambios de temperatura ambiental. No se han registrado variaciones en los valores de muestras almacenadas a 4°C hasta por 3 meses32, pero sí existe una disminución cercana al 10% por mes, cuando las muestras son mantenidas a temperatura ambiente. Sin embargo, se sugiere que la muestra sea almacenada a -20ºC si no es procesada inmediatamente33 hasta por 28 días. En el caso de querer almacenar las muestras por un tiempo prolongado, existen trabajos que describen que no hay cambios significativos en la concentración de cortisol en las muestras almacenadas a -20°C o -80°C hasta por un año32.
El kit de EIA Salimetrics es bastante usado en la literatura disponible para medir cortisol en saliva15,34, pero al ser un kit de medición ultrasensible, tiene la desventaja de cuantificar sólo hasta 3 ug/dL de cortisol (valor correspondiente al estándar de concentración más alta) dificultando el informe de resultados en el laboratorio asistencial, ya que habría que realizar diluciones de los valores más altos para ser informados. Por otro lado, la cromatografía líquida acoplada a espectrometría de masa es la técnica gold-estándar para la medición del cortisol libre en diferentes fluidos, incluyendo la saliva26,35,36. Un estudio norteamericano28 sugiere que el límite de corte para discriminar individuos sanos y con Síndrome de Cushing es 0,107 ug/dl (2,95 nmol/L) (Zerikly et al. 2010). Este punto de corte es mucho más bajo que los obtenidos a través de las otras técnicas, reforzando la idea que los resultados son técnica-dependiente. Lamentablemente, no todos los laboratorios cuentan con esta técnica analítica, debido a los elevados costos del equipamiento y funcionamiento. El método de ECLIA tiene una buena correlación con los métodos manuales antes descritos y la técnica gold-standard, cromatografía líquida acoplada a espectrometría de masa37. Un estudio Tailandés16 determinó que los resultados de cortisol salival nocturno en individuos sanos, obtenidos mediante ECLIA tienen una estrecha correlación con los resultados obtenidos a través del kit de EIA Salimetrics: 0,34 ± 0,016 ug/dL en comparación a 0,38 ± 0,018 ug/dL por EIA. Además, el método de ECLIA fue más preciso que el método manual, ya que éste obtuvo un coeficiente de variación inter-ensayo de 6,48% en comparación al 14,36% EIA.
En conclusión, podemos decir que la medición de cortisol en saliva es una herramienta útil para el diagnóstico de SC, siempre que el paciente siga adecuadamente las instrucciones de toma de muestra. El límite de corte entre pacientes con y sin SC de 0,32 ug/dL sería adecuado para esta técnica y en nuestra población.
Referencias bibliográficas
- Brien TG. 1988. Pathophysiology of free cortisol in plasma. Ann N Y Acad Sci 538: 130-136.
- Maidana P, Bruno OD, Mesch V. 2013. Medición de cortisol y sus fracciones: Una puesta al día. Medicina (Buenos Aires) 73: 579-584.
- Gallagher TF, Yoshida K, Roffwarg HD, Fukushima DK, Weitzman ED, Hellman L. 1973. ACTH and cortisol secretory patterns in man. J Clin Endocrinol Metab 36: 1058-1068.
- Van Cauter E, Leproult R, Kupfer DJ. 1996. Effects of gender and age on the levels and circadian rhythmicity of plasma cortisol. J Clin Endocrinol Metab 81: 2468-2473.
- Carrasco CA, García M, Goycoolea M, Cerda J, Bertherat J, Padilla O, et al. 2012. Reproducibility and performance of one or two samples of salivary cortisol in the diagnosis of Cushing ’s syndrome using an automated immunoassay system. Endocrine 41: 487-493.
- Vagnucci AI, Hesser ME, Kozak GP, Pauk GL, Lauler DP,
Thorn GW. 1965. Circadian cycle of urinary cortisol in healthy
subjects and in Cushing’s syndrome. J Clin Endocrinol Metab 25: 1331-1339. - Castro M, Elias PC, Quidute AR, Halah FP, Moreira AC. 1999. Out-patient screening for Cushing’s syndrome: the sensitivity o f the combination of circadian rhythm and overnight dexamethasone suppression salivary cortisol tests. J Clin Endocrinol Metab 84 : 878-882.
- Arnaldi G, Angeli A, Atkinson AB, Bertagna X, Cavagnini F, Chrousos GP, et al. 2003. Diagnosis and complications of Cushing’s syndrome: a consensus statement. J Clin Endocrinol Metab 88: 5593-5602.
- Nieman LK, Biller BM, Findling JW, Newell-Price J, Savage MO, Stewart PM, et al. 2008. The diagnosis of Cushing’s syndrome: a n Endocrine Society Clinical Practice Guideline. J Clin Endocrino l Metab 93: 1526-1540.
- Pecori Giraldi F, Ambrogio AG, De Martin M, Fatti LM, Scacchi M, et al. 2007. Specificity of first-line tests for the diagnosis of Cushing’s syndrome: assessment in a large series. J Clin Endocrinol Metab 92: 4123-4129.
- Viardot A, Huber P, Puder JJ, Zulewski H, Keller U, Muller B. 2005. Reproducibility of nighttime salivary cortisol and its us e in the diagnosis of hypercortisolism compared with urinary free cortisol and overnight dexamethasone suppression test. J Clin Endocrinol Metab 90: 5730-5736.
- Ceccato F, Barbot M, Zilio M, Ferasin S, Occhi G, Daniele A, et al. 2013. Performance of salivary cortisol in the diagnosis of Cushing’s syndrome, adrenal incidentaloma and adrenal insufficiency. Eur J Endocrinol 169: 31-36.
- Yaneva M, Mosnier-Pudar H, Dugue MA, Grabar S, Fulla Y, Bertagna X. 2004. Midnight salivary cortisol for the initial diagnosis of Cushing’s syndrome of various causes. J Clin Endocrinol Metab 89: 3345-3351.
- Aardal E, Holm AC. 1995. Cortisol in saliva-reference ranges an d relation to cortisol in serum. Eur J Clin Chem Clin Biochem 33: 927-932.
- Sakihara S, Kageyama K, Oki Y, Doi M, Iwasaki Y, Takayasu S, et al. 2010. Evaluation of plasma, salivary, and urinary cortisol levels for diagnosis of Cushing’s syndrome. Endocr J 57: 331-337.
- Somrudee S, Pongwut S, Therdkiat T, Surangrat S. 2010. Comparison between ECL and ELISA for the detection of salivary cortisol and determination of the relationship between cortisol in saliva and serum measured by ECL. Science Asia 36: 169-171.
- Zukowski L, Mysliwiec J, Gorska M. 2013. Diagnostics of hypercortisolism-comparison between the clinical usefulness of salivary and serum cortisol measurements. Endokrynol Pol 64: 263-267.
- Yaneva M, Kirilov G, Zacharieva S. 2009. Midnight salivary cortisol, measured by highly sensitive electrochemiluminescence immunoassay, for the diagnosis of Cushing´s syndrome. Central European Journal of Medicine 4: 59-64.
- Zhang Q, Dou J, Gu W, Yang G, Lu J. 2013. Reassessing the reliability of the salivary cortisol assay for the diagnosis of Cushing syndrome. J Int Med Res 41: 1387-1394.
- Beko G, Varga I, Glaz E, Sereg M, Feldman K, Toth M, et al . 2009. Cutoff values of midnight salivary cortisol for the diagn osis of overt hypercortisolism are highly influenced by methods. Clin Chim Acta 411: 364-367.
- Lépez M, Caamaño E, Romero C, Fiedler J, Araya V. 2010. Determinación de los niveles de cortisol salival en una muestra de sujetos de Santiago de Chile. Rev Med Chile 138: 168-174.
- Mert M, Tanakol R, Karpuzoglu H, Abbasoglu S, Yarman S,, Boztepe H. 2013. Spectral effect: each population must have its own normal midnight salivary cortisol reference values determined. Arch Med Sci 9.
- Miller R, Plessow F, Rauh M, Groschl M, Kirschbaum C. 2013. Comparison of salivary cortisol as measured by different immunoassays and tandem mass spectrometry. Psychoneuroendocrinology 38: 50-57.
- Gatti R, Antonelli G, Prearo M, Spinella P, Cappellin E, De Palo EF. 2009. Cortisol assays and diagnostic laboratory procedures in human biological fluids. Clin Biochem 42: 1205-1217.
- Inder WJ, Dimeski G, Russell A. 2012. Measurement of salivary cortisol in 2012-laboratory techniques and clinical indications . Clin Endocrinol (Oxf) 77: 645-651.
- Matsui F, Koh E, Yamamoto K, Sugimoto K, Sin HS, Maeda Y, et al. 2009. Liquid chromatography-tandem mass spectrometry (LC-MS/MS) assay for simultaneous measurement of salivary testosterone and cortisol in healthy men for utilization in the diagnosis of late-onset hypogonadism in males. Endocr J 56: 1083-1093.
- Palmieri S, Morelli V, Polledri E, Fustinoni S, Mercadante R, Olgiati L, et al. 2013. The role of salivary cortisol measured by liquid chromatography-tandem mass spectrometry in the diagnosis of subclinical hypercortisolism. Eur J Endocrinol 168 : 289-296.
- Zerikly RK, Amiri L, Faiman C, Gupta M, Singh RJ, Nutter B,
et al. 2010. Diagnostic characteristics of late-night salivary
cortisol using liquid chromatography-tandem mass spectrometry. J Clin Endocrinol Metab 95: 4555-4559. - Papanicolaou DA, Mullen N, Kyrou I, Nieman LK. 2002. Nighttime salivary cortisol: a useful test for the diagnosis of Cushing’s syndrome. J Clin Endocrinol Metab 87: 4515-4521.
- Raff H, Raff JL, Findling JW. 1998. Late-night salivary cortiso l as a screening test for Cushing’s syndrome. J Clin Endocrinol Meta b 83: 2681-2686.
- Mosnier-Pudar H, Thomopoulos P, Bertagna X, Fournier C, Guiban D, Luton JP. 1995. Long-distance and long-term follow-up of a patient with intermittent Cushing’s disease by salivary cortisol measurements. Eur J Endocrinol 133: 313-316.
- Garde AH, Hansen AM. 2005. Long-term stability of salivary cortisol. Scand J Clin Lab Invest 65: 433-436.
- Toone RJ, Peacock OJ, Smith AA, Thompson D, Drawer S, Cook C, Stokes KA. 2013. Measurement of steroid hormones in saliva: Effects of sample storage condition. Scand J Clin Lab Invest 73 : 615-621.
- Raff H, Homar PJ, Skoner DP. 2003. New enzyme immunoassay for salivary cortisol. Clin Chem 49: 203-204.
- Huang W, Kalhorn TF, Baillie M, Shen DD, Thummel KE. 2007. Determination of free and total cortisol in plasma and urine by liquid chromatography-tandem mass spectrometry. Ther Drug Monit 29: 215-224.
- Taylor RL, Machacek D, Singh RJ. 2002. Validation of a high-throughput liquid chromatography-tandem mass spectrometry method for urinary cortisol and cortisone. Clin Chem 48: 1511-1519.
- Vogeser M, Durner J, Seliger E, Auernhammer C. 2006. Measurement of late-night salivary cortisol with an automated immunoassay system. Clin Chem Lab Med 44: 1441-1445.