¿Como optimizar el diagnóstico funcional de los incidentalomas suprrarenales? Importancia de un estudio protocolizado
Roberto Olmos1, Javiera Gutiérreza, Francisco Guarda1, Fidel Allende1,2, Álvaro Huete2,3, Ignacio San Francisco2,4, René Baudrand1,2
How to optimize the functional diagnosis of suprarenal incidentalomas? Importance of a protocolized study
1Departamento de Endocrinología, Facultad de Medicina, Pontificia Universidad Católica de Chile.
2Programa de Enfermedades Suprarrenales. Red de Salud UC . Pontificia Universidad Católica de Chile.
3Departamento de Radiología, Facultad de Medicina. Pontificia Universidad Católica de Chile.
4Departamento de Urología, Facultad de Medicina. Pontificia Universidad Católica de Chile.
aEscuela de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia:
René Baudrand Biggs
Av. Diagonal Paraguay 362
baudrandrene@gmail.com
Financiamiento: Proyecto SOCHED “Nuevos Métodos para el diagnóstico de Hipercortisolismo subclínico de origen
suprarrenal”
Conflictos de interés: No
Recibido: 08-05-2018
Aceptado: 15-06-2018
Abstract: Adrenal incidentalomas are an increasingly common pathology. Although historically they have been considered largely non-functioning, recent evidence suggests that the usually performed study is incomplete and/or not sensitive enough. In the last decade the clinical spectrum of adrenal hypercortisolism has expanded considerably, including milder cases which are also associated with cardiovascular morbidity and even mortality. Furthermore, primary aldosteronism has also expanded beyond the classic phenotype with advanced vascular damage, resistant hypertension and hypokalemia, currently including asymptomatic, normotensive and normokalemic patients. For this reason, a correct protocolized study is essential in all adrenal incidentalomas, including a precise radiological characterization, as well as a systematic hormonal evaluation using more sensitive cut points. The findings of this workup are relevant, because they allow a more individualized approach to the medical and surgical management of these patients.
Key words: Adrenal incidentaloma; Hypercortisolism; Primary aldosteronism; Adenoma.
Resumen: Los incidentalomas suprarrenales son una patología cada vez más frecuente. Si bien históricamente han sido considerados no funcionantes en su gran mayoría, evidencia reciente sugiere que el estudio habitual es incompleto y/o poco sensible. En la última década el espectro clínico del hipercortisolismo de origen adrenal se ha ampliado de forma considerable, incluyendo casos leves que también se asocian a morbilidad cardiovascular e incluso mortalidad. Por otro lado, el hiperaldosteronismo primario también ha expandido su fenotipo más allá del clásicamente descrito con daño vascular avanzado, hipertensión resistente e hipokalemia, abarcando en la actualidad a pacientes asintomáticos, normotensos y normokalemicos. Por esta razón es imprescindible un correcto estudio protocolizado en todo incidentaloma suprarrenal, incluyendo una precisa caracterización radiológica, así como una evaluación hormonal sistemática utilizando puntos de corte más sensibles. Los hallazgos de este estudio son relevantes, pues permiten guiar de forma más individualizada el manejo médico y quirúrgico de estos pacientes. Palabras clave: Incidentaloma suprarrenal; Hipercortisolismo; Hiperaldosteronismo primario; Adenoma.
Introducción
Los incidentalomas suprarrenales se definen como masas adrenales descubiertas de forma incidental en contexto de estudio imagenológico solicitado por otra sospecha diagnóstica. Son frecuentes y su prevalencia aumenta con la edad, llegando hasta un 10% en mayores de 70 años, sin diferencias por género. En su mayoría son lesiones unilaterales (85%), con tamaño promedio de 25mm. La masificación del uso de imágenes abdominales de alta resolución para estudio de diversas patologías ha convertido a los incidentalomas suprarrenales en hallazgos cada vez más frecuentes en la práctica médica habitual1.
Al enfrentarse al hallazgo de un incidentaloma son dos las preguntas a responder. Primero, ¿se trata de una lesión benigna o maligna?, y segundo, ¿presenta hiperfunción hormonal o se trata de una lesión “no funcionante”? Respecto a la primera pregunta, la inmensa mayoría de los tumores suprarrenales son benignos y las imágenes actuales evaluadas por un radiólogo experto son altamente sensibles y especificas para detectar malignidad2. Es la pregunta respecto a la funcionalidad del tumor la que ha generado mayor controversia en la última década y la que habitualmente más dificultad conlleva para el clínico. No hay duda que un exceso patológico clínicamente evidente en la producción de catecolaminas, cortisol o aldosterona tiene efectos deletéreos, por lo que su detección a tiempo es de suma importancia. Cohortes clásicas describen hiperfunción en no más del 20-25% de los incidentalomas3. Sin embargo, evidencia reciente de buena calidad ha puesto en duda esta afirmación4. La glándula suprarrenal es por lejos la de mayor producción hormonal del organismo, tanto en número de hormonas como en cantidad de ellas (basta recordar que el cortisol circula en concentraciones 1000 veces mayor a la ACTH). Por lo mismo resulta a lo menos intrigante que la gran mayoría de los nódulos sólidos inmersos en esta maquinaria enzimática tan activa sean catalogados como “no funcionantes”. Por otro lado, estudios recientes han asociando la presencia de incidentalomas aparentemente “no funcionantes” a mayor prevalenvia de sindrome metabólico, hipertensión arterial (HTA), diabetes mellitus y morbilidad cardiovascular5,6. Esto hace pensar que los estudios funcionales utilizados en el pasado eran poco sensibles o los puntos de corte muy exigentes. Presentamos en esta revisión nuestra meditada opinión del tema sobre cómo optimizar el diagnóstico funcional de los incidentalomas suprrarenales mediante un un estudio protocolizado.
Importancia del estudio radiológico
La tomografía axial computarizada (TAC) es el estudio de primera elección y debe realizarse en todo paciente en que se diagnostique un incidentaloma suprarrenal, incluso si fue diagnosticado utilizando métodos menos sensibles como la ecografía. Requiere idealmente, y para su correcta caracterización, de un protocolo específico, con imágenes pre y post contraste yodado para evaluación de unidades de Hounsfield y porcentaje de lavado de contraste. Su interpretación por radiólogo experto tiene sensibilidad (S) 97% y especificidad (E) 100% para adenoma, mientras que para feocromocitoma alcanza S de 98% y E de 85%7. Su mayor importancia radica en que sus hallazgos permiten orientar el estudio y dirigir el algoritmo diagnóstico.
En un extremo del espectro radiológico se encuentran las lesiones mayores de 4 cm, en las que se sugiere resolución quirúrgica independiente del resultado del estudio hormonal, dado un elevado riesgo de malignidad (25%)8. En el extremo opuesto se encuentra el adenoma, por lejos la lesión más frecuente (80%), con un patrón radiológico habitual altamente específico (tamaño menor a 3 cm, homogéneo, menos de 10 unidades de Hounsfield pre contraste, lavado de contraste mayor al 50% a los 10 minutos) y cuyo riesgo de tratarse de un feocromocitoma o lesión maligna es cercano a cero9. Por esta razón, la decisión de resolución quirúrgica sólo depende del resultado del estudio funcional y es en este gran subgrupo de adenomas donde la evaluación hormonal protocolizada tiene la mayor relevancia pronóstica y terapéutica.
Evaluación de hipersecreción autónoma
Si bien la TAC es muy útil para caracterizar el tipo histológico de la lesión adrenal, su utilidad para predicción de funcionalidad es muy limitada10, por lo que TODO incidentaloma requiere evaluación endocrina. }
En los últimos 10 años han sido publicados múltiples estudios prospectivos de pacientes con incidentalomas suprarrenales, permitiéndonos una aproximación más cercana a la historia natural de estos tumores5,6. Como se describió previamente, el hecho que estos casos “no funcionantes” se asocien a mayor riesgo cardiovascular, HTA y DM2 sugiere que muchos de ellos serían en realidad falsos negativos, lo cual implica que el estudio actual recomendado es poco sensible y/o incompleto.
A. Tamizaje para feocromocitoma
A pesar de tratarse de una patología muy poco frecuente en población general, la prevalencia de feocromocitoma puede llegar al 5% en incidentalomas suprarrenales3, con importante morbilidad y mortalidad asociada en caso de no ser diagnosticado. Históricamente se ha recomendado su tamizaje (generalmente mediante medición de metanefrinas fraccionadas en orina de 24 horas) en todos los casos. Sin embargo, y como se mencionó previamente, en caso que un radiólogo experto confirme el fenotipo radiológico de la lesión como un adenoma, su probabilidad de ser realmente un feocromocitoma es lo suficientemente baja como para no realizar la medición de metanefrinas, disminuyendo significativamente los costos del estudio, así como también la incomodidad que implica para el paciente la recolección de orina de 24 horas9. Recientemente la guía europea de incidentaloma también sugiere que podría no realizarse estudio de metanefrinas en adenoma confirmado por radiólogo experto y ausencia de clínica sugerente11.
B. Hipercortisolismo
El hipercortisolismo es la alteración endocrina más frecuente en incidentalomas suprarrenales, descrita en 10-20%3. A diferencia del cuadro clásico de la enfermedad de Cushing, el hipercortisolismo de origen adrenal se caracteriza por un fenotipo habitualmente más leve y menos sintomático, fenómeno aún más notorio en el contexto de lesiones incidentales, que por definición no presentan clínica sospechosa. El test de supresión con dexametasona 1mg (TSD) es considerado de primera elección en incidentalomas, el cual debe ser realizado sin uso de fármacos confundentes (principalmente estrógenos y anticonvulsivantes)11. Si bien un TSD <1,8 descarta con certeza el hipercortisolismo, la discusión se ha centrado en el punto de corte superior para considerarlo patológico. Clásicamente se ha considerado francamente patológico un TSD >5 ug/dL, con especificidad cercana a 100% para hipercortisolismo. Sin embargo y de forma similar a lo que ocurre con el HAP, el espectro clínico del hipercortisolismo adrenal se ha expandido hacia fenotipos más leves, pero que conservan sus efectos deletéreos metabólicos, asociándose de forma consistente a mayor morbilidad y mortalidad cardiovascular. Dentro de los estudios más reconocidos, destaca el publicado por Di Dalmazi et al. en 2014, que siguió de forma prospectiva una cohorte de 198 pacientes con incidentalomas, categorizándolos en 3 fenotipos según TSD en no secretores (TSD< 1,8), secretores intermedios (TSD 1,8-5,0) e hipercortisolismo confirmado (TSD> 5). Tras una mediana de seguimiento de 7,5 años, ambos fenotipos secretores (es decir, aquellos con TSD> 1,8) se asociaron de forma significativa a un mayor número de eventos cardiovasculares vs fenotipo no secretor (16% vs 6%), así como también a una mayor mortalidad tanto CV como global. El valor absoluto del TSD, tomado como un continuo y no como variable dicotómica, se asoció de forma lineal y directa con todas las variables evaluadas12.
Con múltiples definiciones, este “hipercortisolismo subclínico” representa un desafío diagnóstico, dado su amplio espectro de presentación, baja especificidad de comorbilidades asociada y a la ausencia de un examen único ideal, por lo que habitualmente se requieren otras evidencias bioquímicas además del TSD para avalar su diagnóstico.
- ACTH: Considerando su fisiopatología, la medición de ACTH es cada vez más utilizada dentro de la evaluación hormonal de incidentalomas adrenales. Si bien su rendimiento como examen único es bastante limitado (S 64% y E 38%), su uso en combinación con TSD +/- CLU permiten mejorar considerablemente la especificidad del diagnóstico. El punto de corte es materia de discusión, con la mayoría de estudios considerando sugerente un valor menor a 10 pg/ml (siempre en conjunto con un TSD alterado). Sin embargo, se han descrito múltiples casos de hipercotisolismo adrenal confirmado con ACTH de hasta 15 pg/ml13.
- Cortisol salival nocturno: su sensibilidad en incidentalomas es limitado salvo en casos moderados a graves, ya que en el hipercortisolismo de origen adrenal el ritmo circadiano de secreción habitualmente se encuentra conservado14.
- Cortisol libre urinario (CLU): elevaciones significativas (sobre 2 veces el límite superior normal) son altamente específicas para hipercortisolismo. Sin embargo, su muy baja sensibilidad (20-30%) para detección de hipercortisolismo adrena lo convierten en un examen poco útil en la evaluación de incidentalomas15.
- DHEAS: es un precursor androgénico secretado únicamente por la zona reticular suprarrenal, bajo control exclusivo de ACTH y con niveles plasmáticos estables, por lo que se ha vuelto un marcador atractivo para detección de hipercortisolismo ACTH independiente. Si bien la evidencia es aún limitada, estudios recientes sugieren que una DHEAS suprimida podría mejorar sensibilidad del estudio de hipercortisolismo en incidentalomas16. Se debe tener en cuenta además la disminución fisiológica de su secreción con la edad, por lo que podría perder valor diagnóstico en pacientes mayores.
- Cortisol sérico de media noche: Se trata de un examen técnicamente complejo, pero que según un estudio es el test único con mejor S (64%) y E (81%) para predecir insuficiencia suprarrenal postoperatoria (lo que podría considerarse patrón de oro para diagnóstico de hipercortisolismo), usando punto de corte >5,4ug/dL17.
En resumen, y según la evidencia actual, un TSD >1,8ug/ dL en el contexto de un incidentaloma suprarrenal debería gatillar la búsqueda dirigida de otros elementos bioquímicos de hipercortisolismo, así como también de comorbilidades asociadas. El uso racional y protocolizado de test diagnóstico (en especial TSD y ACTH), junto a la evaluación individualizada de comorbilidades, permiten sospechar el diagnóstico y guiar la conducta en la mayoría de los casos.
C. Hiperaldosteronismo
El hiperaldosteronismo primario (HAP) es la causa más frecuente de hipertensión secundaria, con una prevalencia estimada de 5-10% del total de hipertensos y hasta 20% en hipertensos resistentes18. Llama la atención, entonces, que el HAP haya sido históricamente descrito en un muy bajo porcentaje de incidentalomas (2-6%)3. Esto parece obedecer a un sesgo de selección negativo, ya que las guías internacionales aún limitan el tamizaje de esta patología a pacientes hipertensos o con hipokalemia11, logrando diagnosticar únicamente al espectro más grave de la enfermedad. Esto no ocurre con el tamizaje de hipercortisolismo donde no se exige diabetes o fenotipo clínico para realizarlo. Nuestro grupo ha publicado recientemente nueva evidencia que ha cuestionado la antigua concepción del HAP como una enfermedad dicotómica, expandiendo su fenotipo hacia un continuo de secreción autónoma de aldosterona independiente de renina, desde una fase inicial subclínica prolongada con normotensión y normokalemia hasta el cuadro clásico con hipertensión resistente e hipokalemia19,20. Lamentablemente, el elevado riesgo cardiovascular asociado a la sobreactivación crónica del receptor mineralocorticoide es independiente de la presión arterial, por lo que la fase subclínica sigue siendo deletérea. Se ha demostrado que incluso en sujetos normotensos, los niveles elevados de aldosterona se asocian de forma consistente con mayor riesgo de HTA futura21.
La medición de aldosterona plasmática, renina (de forma directa o indirecta mediante la actividad de renina plasmática) y el cálculo de la relación entre ambas (ARR) sigue siendo considerado el tamizaje de primera línea, con el punto de corte de aldosterona plasmática de 15ng/dL y un ARR de >30 los más utilizados para detectar casos moderados-graves de HAP. Considerando el amplio espectro de esta patología, recientemente se han propuesto puntos de corte más sensibles (aldosterona >6-9ng/dL en conjunto con renina suprimida y ARR >20) para maximizar la detección de casos más leves18.
Si bien el punto de corte aún es materia de discusión, hay una serie de consideraciones técnicas muy importantes a la hora de solicitar el estudio:
- Debe realizarse en reposo y en posición sentada.
- En caso de mujeres en edad fértil, debe ser realizado en fase folicular y sin el uso de anticonceptivos combinados, para evitar efecto antimineralocorticoide de la progesterona y sus derivados.
- Respecto a factores dietarios, evidencia reciente sugiere que la restricción salina disminuye sensibilidad para detección de HAP leves, por lo que debería recomendarse al menos ingesta libre de sodio 24-48 horas previo a la toma de muestra22.
- Si bien son muchos los fármacos que pueden alterar el ARR y producir falsos positivos o negativos (por lo que se sugiere en lo posible el cambio a antihipertensivos neutros como amlodipino o doxazosina), en la mayoría de los casos su uso en dosis bajas no es una contraindicación para el estudio de HAP, siempre y cuando los hallazgos se interpreten de forma adecuada. Mención aparte la tienen los antagonistas del receptor mineralocorticoide (espironolactona y eplerenona), así como los diuréticos ahorradores de potasio (amiloride, triamterene), que por su profundo efecto en el eje renina-angiotensina-aldosterona deben ser suspendidos 4 semanas previo al estudio.
En suma, considerando al HAP una patología mórbida con un amplio fenotipo y prevalencia mucho mayor a la previamente estimada, parece razonable plantear su tamizaje en todo paciente con incidentaloma suprarrenal, independiente de la presión arterial. La protocolización adecuada del estudio y el uso de puntos de corte más sensible permiten optimizar la detección de casos leves, disminuyendo al máximo posible la tasa de falsos negativos. Para evitar el aumento de test confirmatorios de alto costo y asumiendo que estos pacientes ya tienen el estudio radiológico, en casos leves o dudosos se ha planteado realizar una prueba terapéutica con un antagonista del MR como espironolactona, tomando como evidencia de hiperaldosteronismo primario la normalización de presión arterial y de renina23.
3. Manejo de incidentalomas funcionantes
Hipercortisolismo
Como suele suceder con otras patologías endocrinas, si bien se conoce el efecto deletéreo del hipercortisolismo subclínico sobre morbimortalidad cardiovascular y salud ósea, aún no se tiene certeza si el manejo agresivo con adrenalectomía beneficia a estos pacientes por sobre un manejo más conservador (con uso de antagonistas del receptor de mineralocorticoides). La evidencia al respecto es muy escasa, siendo la revisión sistemática de Bancos et al de 2016 la más completa y reciente publicada a la fecha. Su objetivo era evaluar beneficio en FRCV de adrenalectomía vs manejo conservador en pacientes con incidentalomas SR e hipercortisolismo subclínico (definido de forma variable con TSD entre 1,8 y 5,0 asociado a algún otro elemento bioquímico compatible). Su análisis sugiere beneficio de adrenalectomía en control de HTA y DM2 vs manejo conservador en esta patología, incluso en pacientes con TSD <3ug/dL. Lamentablemente los estudios en que se basa son de calidad moderada-baja, heterogéneos y con escaso seguimiento24.
La guía más reciente de la Sociedad Europea de Endocrinología plantea sus recomendaciones en base al valor del TSD, sugiriendo optar por cirugía por sobre manejo médico sólo en casos confirmados de secreción autónoma de cortisol ACTH independiente (definido por TSD> 5ug/ dL + ACTH baja) que presenten dos o más comorbilidades potencialmente asociadas a hipercortisolismo (HTA, DM2, DLP, osteoporosis), en especial si no pueden ser manejadas adecuadamente con tratamiento médico. En los casos con TSD entre 1,8 y 5,0 se sugiere evaluación periódica y manejo enérgico de comorbilidades (incluyendo osteoporosis), con evaluación de progresión bioquímica con ACTH y TSD en 3-12 meses11.
Para responder de mejor forma a la interrogante del beneficio quirúrgico en esta patología en todo su espectro bioquímico, incluyendo los casos más “leves”, se encuentra en curso un estudio que compara adrenalectomía vs manejo médico en hipercortisolismo subclínico definido por TSD> 1,825.
Hiperaldosteronismo
No hay duda que frente a casos confirmados de HAP con fenotipo clásico y en presencia de un adenoma suprarrenal único (previa confirmación de hipersecreción) la suprarrenalectomía es el tratamiento de elección, especialmente en sujetos menores de 40 años y de sexo femenino26.
Frente a casos de HAP clásico con adenomas autónomos bilaterales las opciones terapéuticas incluyen adrenalectomía bilateral con preservación cortical o manejo médico con antagonistas del receptor mineralocorticoide. Estos últimos han demostrado beneficio en control de presión arterial y en disminución de eventos cardiovasculares cuando se cumple el objetivo terapéutico de normalización de renina, tal como siguiere estudio con mayor seguimiento de tratamiento médico de HAP a la fecha23.
La identificación del hiperaldosteronismo subclínico o normotensivo ha abierto la interrogante respecto a cómo debe ser manejado. A la fecha no existen estudios que comparen manejo médico o quirúrgico ni tampoco evidencia prospectiva que evalúe beneficio cardiovascular de manejo médico en este subgrupo de pacientes. Sin embargo, considerando que muchas de las complicaciones sistémicas del HAP son independientes de la presión arterial, parece razonable el uso de antagonistas MR en estos casos, con la normalización de renina como objetivo bioquímico.
De lo anterior se puede desprender que el objetivo de mejorar la sensibilidad del estudio funcional de incidentalomas NO es aumentar la tasa de cirugías, sino que obtener un diagnóstico certero que permita ofrecer un tratamiento y seguimiento individualizado para cada paciente. La decisión quirúrgica debe ser tomada de forma multidisciplinaria con endocrinólogos, urólogos y radiólogos en base a evolución clínica, bioquímica e imagenológica.
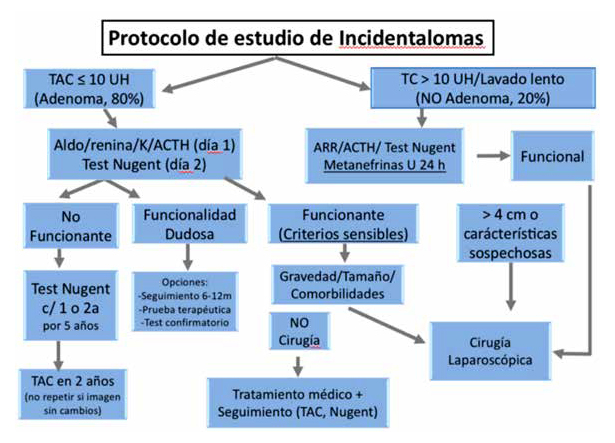 Figura 1. Propuesta de protocolo de estudio y seguimiento de incidentalomas suprarrenales. Programa de Enfermedades Suprarrenales UC. Adaptado de
Ioachimescu, Endocrinol metab Clin North Am 2015; 44(2): 335-354.
Figura 1. Propuesta de protocolo de estudio y seguimiento de incidentalomas suprarrenales. Programa de Enfermedades Suprarrenales UC. Adaptado de
Ioachimescu, Endocrinol metab Clin North Am 2015; 44(2): 335-354.
Conclusiones
Los incidentalomas suprarrenales son un hallazgo frecuente en la práctica médica.
Todos los casos requieren evaluación radiológica y hormonal para descartar malignidad e hiperfunción endocrina. Tanto el hipercortisolismo como el hiperaldsteronismo han expandido sus formas de presentación clínica hacia fenotipos más leves, pero manteniendo una elevada morbilidad en caso de no ser tratados. Por esta razón es de suma importancia una correcta protocolización del estudio funcional, el cual debería balancear por una parte una buena sensibilidad que evite morbilidad futura, pero evitando a la vez un sobrediagnóstico que exponga al paciente a riesgos y costos innecesarios. Un buen ejemplo del éxito de esta aproximación multidisciplinaria es la caracterización de un incidentaloma como adenoma genuinamente no funcionante, el cual no tiene riesgo de malignización, así como tampoco un riesgo de crecimiento significativo o de hiperfunción a largo plazo, lo cual permite simplificar su manejo y seguimiento.
Un correcto estudio y seguimiento permite optimizar el manejo de estos pacientes, el cual NO siempre es quirúrgico.
Referencias bibliográficas
- Hanna F, Issa B, Sim J, Keevil B, Fryer A. Management of incidental adrenal tumours. British Medical Journal 2018; 360: j5674.
- Garret R, Nepule J, El Hayek M, Albert S. Adrenal incidentalomas: clinical controversies and modified recommendations. American Journal of Roentgenology 2016; 206: 1170-1178.
- Mantero F, Terzolo M, Arnaldi G, Osella G, Masini AM, Ali A, Giovagnetti M, Opocher G & Angeli A. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. Journal of Clinical Endocrinology and Metabolism 2000; 85: 637-644.
- Arlt W, Biehl M, Taylor A, Hahner S, Libe R, Hughes B, et al. Urine steroid metabolomics as a biomarker tool for detecting malignancy in adrenal tumors. J. Clin. Endocrinol. Metab 2011; 96: 3775-3784.
- Lopes D, Luque-Fernandez M, Steele A, Adler G, Turchin A, Vaidya A. “Nonfunctional” adrenal tumors and the risk for incident diabetes and cardiovascular outcomes: a cohort study. Ann Intern Med 2016; 165: 533-542.
- Androulakis I, Kaltsas G, Kollias G, Markou A, Gouli A, Thomas D, et al. Patients with apparently nonfunctioning adrenal incidentalomas may be at increased cardiovascular risk due to excessive cortisol secretion. J Clin Endocrinol Metab 2014; 99(8): 2754-2762.
- Ioachimescu A, Remer E, Hamrahian A. Adrenal incidentalomas: a disease of modern technology offering opportunities for improved patient care. Endocrinol metab Clin North Am 2015; 44(2): 335-354.
- Terzolo M, Ali A, Osella G, Mazza E. Prevalence of adrenal carcinoma among incidentally discovered adrenal masses. A retrospective study from 1989 to 1994. Arch Surg 1997; 132(8): 914-919.
- Buitenwerf E, Korteweg T, Visser A, Haag C, Feelders R, Timmers H, et al. Unenhanced CT imaging is highly sensitive to exclude pheochromocytoma: a multicenter study. Eur J Endocrinol 2018 Feb 21. Epub ahead of print.
- Barzon L, Sonino N, Fallo F, Palu G, Boscaro M. Prevalence and natural history of adrenal incidentalomas. European Jurnal of Endocrinology, 2002; 149: 273-285.
- Fassnacht M, Arlt W, Bancos I, Dralle H, Newell-Price J, Sahdev A, et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guidelines in collaboration wit the European Network for the Study of Adrenal Tumors. Eur J Endocrin 2016; 175: 1-34.
- Di Dalmazi G, Vicennati V, Garelli S, Casadio E, Rinaldi E, Giampalma E, et al. Cardiovascular events and mortality in patients with adrenal incidentalomas that are either non-secreting or associated with intermediate phenotype or subclinical cushing`s syndrome: a 15 year retrospective study. Lancet Diabetes Endocrinology 2014; 2: 396-405.
- Terzolo M, Pia A, Reimondo G. Subclinical Cushing´s syndrome: definition and management. Clinical Endocrinology 2012; 76(1); 12-18.
- Nunes M, Vattaut S, Corcuff J, Rault A, Loiseau H, Gatta B, et al. Late-night salivary cortisol for diagnosis of overt and subclinical cushing´s syndrome in hospitalized and ambulatory patients. J Clin Endocrinol Metab 2009; 94: 456-462.
- Emral R, Uysal AR, Asik M, et al. Prevalence of subclinical Cushing’s syndrome in 70 patients with adrenal incidentaloma: clinical, biochemical and surgical outcomes. Endocr J 2003; 50: 399-408.
- Connal M, Annamalai A, Prankerd-Smith O, Freeman N, Vengopal K, Graggaber J, et al. Low DHEAS: a sensitive and specific test for the detection of subclinical hypercortisolism in adrenal incidentalomas. The Journal of Clinical Endocrinology and Metabolism 2012; 102(3): 786-792.
- Eller-Vainicher C, Morelli V, Salcuni AS, Torlontano M, Coletti F, Iorio L, et al. Post-surgical hypocortisolism after removal of an adrenal incidentaloma: is it predictable by an accurate endocrinological work-up before surgery? Eur J Endocrinol 2010; 162(1): 91-99.
- Funder J, Carey R, Mantero F, Hassan M, Reincke M, Shibata H, et al. The Management of primary aldosteronism: case detection, diagnosis and treatment: an Endocrine Socierty Clinical Practice Guideline. J Clin Endocrinol Metabl 2016; 101(5): 1889-1916.
- Baudrand R, Guarda F, Fardella C, Hundemer G, Brown J, Williams G, Vaidya A. Continuum of renin-independent aldosteronism in normotension. Hypertension 2017; 69: 950-956.
- Brown J, Robinson-Cohen C, Luque-Fernandez M, Allison M, Baudrand R, Vaidya A, et al. The spectrum of subclinical primary aldosteronism and incident hypertension. A cohort study. Ann Intern Med 2017; 167: 630-641.
- Vasan R, Evans J, Larson M, Wilson P, Meigs J, Fifai N, et al. Serum aldosterone and the incidence of hyprtension in nohypertensive persons. New England Journal of Medicine 2004; 351(1): 33-41.
- Baudrand R, Guarda F, Torrey J, Williams G, Vaidya A. Dietary sodium restriction increases the risk of misinterpreting mild cases of primary aldosteronism. J Clin Endocrinol Metab 2016; 101: 3989-3996.
- Hundemer G, Curhan G, Yozamp N, Wang M, Vaidya A. Cardiometabolic outcomes and mortality in medically treated primary aldosteronism: a retrospective cohort study. Lancet Diab Endoc 2017; 6: 51-59.
- Bancos I, Alahdab F, Crowley R, Chortis V, Delivais D, Erickson D, et al. Improvement of cardiovascular risk factors after adrenalectomy in patients with adrenal tumors and subclinical Cushing´s syndrome: a systematic review and meta-analysis. European Journal of Endocrinology 2016; 175(6): 283-295.
- Adrenalectomy versus follow-up in patients with subclinical cushing syndrome. Clinical Trials NCT01246739.
- Williams T, Lenders J, Mulatero P, Burello J, Rottenkolber M, Adolf C, et al. Outcomes after adrenalectomy for unilateral primary aldosteronism: an international consensus on outcome measures and analysis of remission rates in an international cohort. Lancet Diabetes Endocrinol 2017; 5(9): 689-699.