Fernando Carrasco1, Gabriel Cavada2.
1Departamento de Nutrición, Facultad de Medicina,
Universidad de Chile.
2Facultad de Medicina. Escuela de Salud Pública. Universidad de Chile.
Correspondencia: fcarrasc@med.uchile.cl
Los niveles plasmáticos de glicentina en ayuno son mayores en pacientes con bypass gástrico en Y de Roux que presentan hipoglicemia post prandial durante una comida test
Fasting levels of glicentin are higher in Roux-en-Y gastric bypass patients exhibiting postprandial hypoglycemia during a meal test.
La aplicación de cirugía bariátrica para el tratamiento de la obesidad ha experimentado un progresivo incremento a nivel mundial en lo últimos 20 años. En la última encuesta internacional publicada en 2015, el bypass gástrico en Y de Roux (BPGYR) ocupaba el primer lugar con un 45% del total de cirugías y la gastrectomía vertical en manga (GVM), el segundo lugar con un 37%. En Chile la situación es distinta ya que la manga gástrica se aplica en la mayoría de los pacientes (72%), aunque el bypass gástrico, como técnica gold standard, sigue siendo desarrollado en cerca de un 23% de los pacientes1.
Entre los efectos adversos observables a largo plazo después del BPGYR está la hipoglicemia post prandial (HPP), que se manifiesta después del primer año de la cirugía, con síntomas que aparecen 1-3 horas después de una comida habitualmente rica en carbohidratos de alto índice glicémico-insulinémico y que se diagnostica con la tríada de Whipple. La frecuencia de HPP en su manifestación más severa (con síntomas de neuroglucopenia) se estima en hasta un 2% de los pacientes, siendo más frecuentes (hasta 1/3 de los pacientes) los cuadros más leves acompañados sólo de síntomas adrenérgicos2. Aunque se tiende a pensar que este cuadro es menos frecuente después de GVM, se ha observado HPP en un 33% de los pacientes al año de la cirugía3. Se ha observado que los pacientes sin diabetes tipo 2 previo al BPGYR tienen un mayor riesgo de desarrollar HPP4,5. Como factores etiológicos se postula que la llegada rápida de alimentos al yeyuno genera una respuesta insulínica postprandial exacerbada mediada, en parte, por una mayor secreción de péptido 1 glucagón-símil (GLP-1) por las células enteroendocrinas o células L. Estas células intestinales también producen otros péptidos derivados del proglucagón, como GLP-2 y glicentina, después de la acción de las proconvertasas 1 y 3; esto en contraste con la conversión a glucagón observada en las células alfa pancreáticas por acción de la proconvertasa 2. La secreción de glicentina es estimulada por la ingesta de alimentos y nutrientes específicos que acceden al duodeno (glucosa, lípidos y aminoácidos)6. Estudios en animales han mostrado que glicentina estimula la contractilidad del músculo liso del tubo digestivo, y en plasma incrementa la insulina y disminuye el glucagón. En sujetos gastrectomizados se ha observado una correlación negativa entre la secreción post prandial de glicentina y el nadir de glicemia durante el test de tolerancia oral a glucosa7.
Poitou et al, reclutaron a 20 pacientes adultos que habían sido sometidos a bypass gástrico aproximadamente entre 2 y 4 años antes del estudio (IMC preoperatorio 45,6 kg/m2, 30% con diabetes tipo 2; 16 mujeres y 4 hombres) y que reportaban síntomas sugerentes de HPP, para realizar un test de comida (dieta líquida de Fresubin Drink: 800 kcal, 20, 35 y 45% de calorías como proteínas, lípidos y carbohidratos, respectivamente) y medir tanto en ayuno como a los 30, 60, 90, 120 y 150 minutos las concentraciones plasmáticas de glucosa, GLP-1, glucagón, péptido C y glicentina. Al momento del estudio el IMC era de 33,6±1,7 kg/m2 y la pérdida del peso inicial fue de 26,5±2,0%, la glicemia de ayuno de 90,0±3,6 mg/ dL y hemoglobina glicada de 5,6±0,2%. Según los resultados del test los pacientes fueron clasificados como NONHYPO (n= 13) o como HYPO (n= 7) según tenían un nadir de glicemia post prandial > o ≤ 54 mg/dL, respectivamente. Los sujetos del grupo HYPO presentaron un nadir PP y un área bajo la curva (ABC) de glicemia significativamente menores que el grupo NONHYPO. No hubo diferencia significativa entre las AUC de GLP-1, Péptido C, glucagón y glicentina entre ambos grupos. Un importante hallazgo del estudio fue la correlación negativa entre las concentraciones de glicentina de ayuno y el nadir de glicemia post test (R= -0,46; p=0,041). Con el análisis de curvas ROC los autores pudieron identificar como potencial punto de corte un valor de 17,2 pM/L para distinguir pacientes con hipoglicemia biológicamente demostrable con una sensibilidad de 85,7% y una especificidad de 53,8%.
Discusión sobre la metodología y resultados del estudio
El estudio tiene las fortalezas de evaluar a largo plazo (después de al menos 2 años de la cirugía), a un grupo de pacientes sometidos a una misma técnica de cirugía bariátrica (BPGYR), con un protocolo de comida test bien descrito, y con medición post prandial de parámetros de laboratorio por un periodo de hasta 3 horas. Entre las debilidades del estudio está el escaso número de pacientes por grupo de comparación, lo que dificulta la interpretación de las diferencias no significativas, especialmente entre las ABC. Otra debilidad es la heterogeneidad de la muestra reclutada ya que un 30% de los pacientes eran diabéticos tipo 2 antes del BPGYR. Esto tiene relevancia ya que, como se mencionó, estudios previos han observado que pacientes sin diabetes previa al BPGYR tienen mayor riesgo de desarrollar HPP. Aunque no se realizó curva de insulinemia post prandial para confirmar a la hipersecreción de insulina como factor diferenciador entre pacientes con y sin hipoglicemia, se realizó curva de péptido C, sin evidenciarse diferencia en el ABC entre los grupos.
Respecto de la comida test, por su consistencia líquida y su probable bajo a moderado índice glicémico-insulinémico8, podría no emular la respuesta post prandial observable en cada paciente que refiere los síntomas de HPP en respuesta a una comida sólida habitual de la vida real. Lo anterior puede estar relacionado con la baja frecuencia de hipoglicemia PP biológicamente demostrable (glicemia ≤ 54 mg/dL), que se observó sólo en 7 de 20 pacientes (35%). Otro aspecto discutible se refiere a la relevancia clínica del diagnóstico riguroso de hipoglicemia PP en base a la tríada de Whipple. Si bien este diagnóstico que incluye la demostración de una glicemia < 50 mg/dL (o < 54 en este estudio) puede ser importante como predictor de HPP asociada a neuroglucopenia, es difícil de confirmar especialmente cuando se intenta pesquisar HPP en sujetos que presentan sólo síntomas adrenérgicos. La manifestación de síntomas adrenérgicos, que se observa con mayor frecuencia en pacientes sometidos a cirugía bariátrica, y que puede afectar en forma permanente la calidad de vida de estos, se puede gatillar con valores de glicemia cercanos a 60 mg/dL9,10.
Finalmente varias preguntas surgen de los hallazgos de este estudio, una de ellas propuesta por los mismos autores:
- ¿Hay asociación entre la concentración preoperatoria de glicentina en ayuno con la observada después del BPGYR? Si fuese cierto podría establecerse esta medición como un importante predictor de HPP, de tal forma de proyectar mejor el cuidado nutricional postoperatorio de los pacientes, con estrategias para controlar las porciones de alimentos con carbohidratos de bajo índice glicémico y ajustar los tiempos de comidas y colaciones11.
- ¿Son las concentraciones de glicentina mayores también en pacientes con BPGYR que reportan HPP pero que no presentan nadir de glicemia bajo 54 mg/dL posterior a la comida test? Sería muy interesante estudiar a ese grupo de pacientes como también contar un grupo control de pacientes con similar IMC y edad pero nunca sometidos a cirugía bariátrica.
- ¿Son estos hallazgos extrapolables a pacientes sometidos a gastrectomía en manga? Pregunta muy relevante dada la creciente aplicación de esta técnica quirúrgica, y especialmente en nuestro país donde muestra las más altas tasas de aplicación del mundo1.
Análisis estadístico
Desde el punto de vista estadístico, el artículo presenta algunas inconsistencias graves:
En el primer párrafo del análisis estadístico, se menciona que las variables contínuas serán descritas mediante promedio y error estándar de la media “All values were expressed as mean ± standard error of the mean”. En general los lectores confunden el error estándar de la media con la desviación estándar, si σ es la desviación estándar el error estándar de la media está dado por:
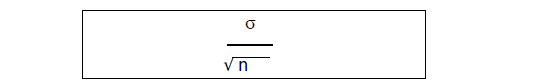
esto se hace pues se necesitan comparar los valores de GLP-1, glicemia y otros marcadores en el tiempo, como se verifica en la figura 2 (gráficos A, B, C y D). Este reporte seguramente se mantiene en los valores reportados en la tabla 1. Sin embargo, si los reportes de las estadísticas de centralización serán hechas a través de promedio y desviación estándar, lo consistente es compararlos a través de los test estadísticos adecuados cómo lo son el test t-Student en caso de no descartar la normalidad de los datos o bien a través de un modelo lineal generalizado basado en la distribución de probabilidades que sugiera la evidencia recogida. Sin embargo, a reglón seguido, en el método estadístico se lee “The following non parametric tests were used: Mann- Whitney U test to compare 2 groups, Kruskal-Wallis tests followed by Dunn’s adjusted multiple comparisons to compare >2 groups, and 2-way analysis of variance for repeated measures with Bonferroni correction for multiple comparisons during MMT”, es decir las comparaciones se hacen mediante los clásicos test no paramétricos, cuyas hipótesis nulas más bien se refieren a igualdad de medianas o percentil 50 y en el mejor de los casos a igualdad de distribución de probabilidades. De modo que: o las estadísticas descriptivas debieron haberse basado en percentiles y haber sido comparadas mediante los test no paramétricos o haber mantenido los reportes de media y desviación estándar y haber usado métodos paramétricos. Este hecho hace dudar de la prolijidad del análisis de los datos. Luego de la misma cita se desprende que las tendencias temporales fueron comparadas mediante ANOVA para medidas repetidas, cuyo sustento teórico se halla en la distribución normal de las respuestas, que es consistente con la descripción a través de promedios y desviaciones estándar, pero no con la elección de los test no paramétricos.
En consecuencia el análisis inferencial no es consistente con las estadísticas descriptivas, lo que hace dudar de la calidad de las conclusiones cuantitativas.
Referencias
- Angrisani L, Santonicola A, Iovino P, Formisano G, Buchwald H, Scopinaro N. Bariatric Surgery Worldwide 2013. Obes Surg 2015; 25(10): 1822- 1832.
- Hofman Z, van Drunen JDE, Kuipers H. The Glycemic Index of standard and diabetes-specific enteral formulas. Asia Pac J Clin Nutr 2006; 15 (3): 412-417.
- Kittah NE, Kittah AV. Pathogenesis and management of hypoglycemia. Eur J Endocrinol 2017; 177: R37-R47.
- Lee CJ, Clark JM, Schweitzer M, Magnuson T, Steele K, Koerner O, et al. Prevalence of and risk factors for hypoglycemic symptoms after gastric bypass and sleeve gastrectomy. Obesity 2015; 23(5): 1079-1084.
- Mitrakou A, Ryan C, Veneman T, Mokan M, Jenssen T, Kiss I, et al. Hierarchy of glycemic thresholds for counterregulatory hormone secretion, symptoms, and cerebral dysfunction. Am J Physiol 1991; 260: E67-E74.
- Naito H, Sasaki I, Matsuno S. Surgical aspect of enteroinsular axis after gastrointestinal surgery with reference to incretin secretion. Pancreas 1998; 16(3): 370-378.
- Papamargaritis D, Koukoulis G, Sioka E, Zachari E, Bargiota A, Zacharoulis D, et al. Dumping symptoms and incidence of hypoglycaemia after provocation test at 6 and 12 months after laparoscopic sleeve gastrectomy. Obes Surg 2012; 22: 1600-1606.
- Patti M-E, Goldfine AB. The rollercoaster of post-bariatric hypoglycaemia. Lancet Diabetes Endocrinol 2016; 4(2): 94-96.
- Raffort J, Lareyre F, Massalou D, Fénichel P, Panaïa-Ferrari P, Chinetti G. Insights on glicentin, a promising peptide of the proglucagon family. Biochem Medica 2017; 27(2): 308-324.
- Raverdy V, Baud G, Pigeyre M, Verkindt H, Torres F, Preda C, et al. Incidence and predictive factors of postprandial hyperinsulinemic hypoglycemia after Roux-en-Y gastric bypass: a five year longitudinal study. Ann Surg 2016; 264(5): 878-885.
- Suhl E, Anderson-Haynes S-E, Mulla C, Patti M-E. Medical nutrition therapy for post-bariatric hypoglycemia: practical insights. Surg Obes Relat Dis 2017; 13: 888-898.