Resultados a corto plazo del tratamiento con 131I en el bocio multinodular: valor adicional de la estimulación previa con rhTSH
Pablo Orellano1, Gerardo dos Santos2, Miguel Kapitan3, German Botto7, Jenifer Silva4, Elisa Seoane5,
Patricia Furtenbarch6.
Short-term results of treatment with 131I in multinodular goiter: additional value of previus stimulation with Recombinant human thyrotropin
1. Profesor Adjunto del Departamento de Endocrinología y Metabolismo, Facultad de Medicina, Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
2. Profesor Adjunto del Departamento de Medicina Nuclear, Facultad de Medicina, Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
3. Asistente del Departamento de Medicina Nuclear, Facultad de Medicina, Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
4. Residente del Departamento de Endocrinología y Metabolismo, Facultad de Medicina. Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
5. Residente del Departamento de Endocrinología y Metabolismo, Facultad de Medicina. Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
6. Asistente de clínica de Endocrinología y Metabolismo, Facultad de Medicina. Centro de Medicina Nuclear. Cátedra de Endocrinología y Metabolismo. Montevideo. Uruguay.
7. Profesor Adjunto. Departamento de Métodos Cuantitativos. PhD Student Fulbright Scholar Montana State University. Montevideo. Uruguay.
*Correspondencia: Pablo Orellano
porellanoc@gmail.com
Ciudad de la Costa. Canelones. Uruguay. CD 15005
Recibido:04-03-2020
Aceptado: 29-05-2020
Resumen: Objetivo: El yodo radiactivo (131I) es una opción terapeútica segura y
eficaz cuando se utiliza solo o con la estimulación previa de TSH recombinante
humana (rhTSH) en el tratamiento del bocio multinodular (BMN). En espera de ensayos
clínicos que determinen la dosis óptima, demuestren seguridad y confirmen
la eficacia, diferentes protocolos se utilizan para aplicar la dosis de 131I. Analizamos
la respuesta al tratamiento con una dosis calculada por protocolo mixto (dosis fijas
y cálculo por porcentaje de captación) en pacientes con BMN toxico y no toxico en
nuestro hospital, en el periodo 2010-2013. Materiales y Métodos: Estudio prospectivo
en pacientes con BMN no quirúrgico (BMNNQ) que requerían reducción del
volumen glandular y/o tratamiento del hipertiroidismo. Se evaluaron 134 pacientes,
14 cumplieron con los criterios de inclusión (13mujeres) de edad media 71.08 años.
Un grupo con BMN toxico, otro grupo con BMN no toxico, un tercer grupo con BMN
no toxico estimulado con 0,1 mg de rhTSH previo a la dosis. Se evaluó, función
tiroidea, captación tiroidea de 99ᵐTc, volumen tiroideo y síntomas compresivos. Se
siguió a los pacientes durante 12 meses. Resultados: Se aplicaron dosis entre 15 y
30 mCi de 131I. Remitió el hipertiroidismo en 6 de 7 pacientes. Hubo una reducción
del volumen glandular (p<0.01).Los pacientes con estímulo de 0,1 mg rhTSH,
aumentaron el porcentaje de captación de 99ᵐTc a las 24 h en un 32.43±10.61
permitiendo aplicar menor dosis de 131I. La tasa de aparición de hipotiroidismo fue
de 7.41 por cada 100 pacientes.mes, mayor en pacientes con BMN toxico tratados
con dosis bajas (p-=0.03). Hubo una mejoría subjetiva de la clínica compresiva en
todos los pacientes. No hubo eventos adversos. Conclusiones: Una dosis de 131I
calculada por protocolo mixto es efectiva y segura para la reducción del volumen
glandular y control del hipertiroidismo asociado. La estimulación con rhTSH logra
el mismo efecto con una menor dosis administrada.
Palabras clave:
Bocio multinodular; No tóxico; Radioyodo; rhTSH, Toxico.
Abstract: Objective: Radioactive iodine (131I) is a safe and effective therapeutic
option when used alone or with prior stimulation of recombinant human Thyrotropin
(rhTSH) in the treatment of multinodular goiter (MNG). In absence of clinical trials
that determine the optimal dose, demonstrate safety and confirm efficacy, different
protocols are used to apply the dose of 131I. We analyze the response to treatment
with a dose calculated by mixed protocol (fixed doses and calculation by percentage
of uptake) in patients with toxic and non-toxic MNG in our hospital, in the period
2010-2013. Materials and Methods: Prospective study in patients with non-surgical
MNG that required glandular volume reduction and / or treatment of hyperthyroidism.
134 patients were evaluated, 14 met the inclusion criteria (13 women) of average age 71.08 years. One group with toxic MNG, another group with non-toxic MNG and
a third with non-toxic multinodular goiter stimulated with 0.1 mg of rhTSH prior to the
dose. Patients were followed for 12 months. Upon following, we assessed Thyroid
function, 99ᵐTc thyroid uptake, thyroid volume and compressive symptoms. Results:
Doses between 15 and 30 mCi of 131I were applied. We observed hyperthyroidism
remission in 6 of 7 patients. There was a reduction in glandular volume (p <0.01)
considering all patients. Patients with a stimulus of 0.1 mg rhTSH, increased the
percentage of uptake of 99ᵐTc at 24 h by 32.43 ± 10.61, allowing a lower dose of 131I
to be applied. The rate of onset of hypothyroidism was 7.41 per 100 patients-month,
and was higher in patients with toxic MNG treated with low doses (p = 0.03). There
was a subjective improvement of the compression clinic in all patients. No adverse
events were observed.Conclusions: A dose of 131I calculated by a mixed protocol is
effective and safe for achieving glandular volume reduction and associated hyperthyroidism
control. Stimulation with rhTSH produces the same effect with a lower
administered dose.
Key words: Multinodular goitre; Non-toxic MNG; Radioiodine; rhTSH; Toxic MNG.
El Bocio Multi Nodular (BMN) es un trastorno común causado por factores bociogenos como la deficiencia de yodo, así como varios factores de crecimiento (incluida la TSH) que actúan en las células foliculares tiroideas, con diferentes potenciales de crecimiento y sintéticos. A menudo los antecedentes familiares de bocio sugieren un componente genético que interviene en su patogénesis. La presentación clínica varía desde pacientes asintomáticos hasta una enfermedad grave por compresión de la vía aérea. Activación de mutaciones en el receptor de TSH o proteínas G en las células foliculares determina que pueda desarrollarse un hipertiroidismo subclínico o manifiesto subyacente debido a nódulos con hiperfunción autónoma1.
Descartada la malignidad2, su enfoque terapéutico dependerá del tamaño, la ubicación del bocio, la presencia de síntomas compresivos y de la presencia o ausencia de tirotoxicosis3. Las terapias posibles incluyen levotiroxina, cirugía o radioyodo. El tratamiento se elige individualmente para cada paciente en vista de los riesgos, beneficios y disponibilidad de las diversas técnicas, la experiencia del médico tratante y las preferencias personales del paciente. Un 20% de las mujeres y el 5% de los hombres estabilizan el tamaño del bocio por lo cual la observación clínica también puede ser una opción para pacientes asintomáticos4.
En el BMN toxico la terapia con 131I es eficaz para curar el hipertiroidismo y reducir el volumen glandular (RVG). Considerada la primera línea de tratamiento aún es controvertida la forma del cálculo y la dosis óptima5.
En el BMN no toxico la ausencia de datos sólidos de estudios aleatorizados implica que las decisiones del tratamiento deban individualizarse6.
El tratamiento con Levotiroxina es ampliamente utilizado en los Estados Unidos, Europa y América Latina, como se muestra en diferentes encuestas7, tiene poca efectividad, requiere de un tratamiento permanente, con efectos indeseables potenciales en el hueso8 y el corazón, especialmente en personas mayores9.
La cirugía es el tratamiento de elección ante síntomas o signos de compresión cervical, sospecha de cáncer de tiroides, extensión retroesternal o necesidad de una rápida corrección del estado tirotóxico. Frente a una comorbilidad significativa, trastornos debilitantes o la preferencia de pacientes y familiares que rechazan la cirugía, el uso de 131I es posible como una opción médica. Se introdujo hace aproximadamente tres décadas por su efecto en la RVG en BMN no tóxicos compresivos10. Varios estudios, demostraron una RVG media del 40% después de un año10,11,12,13, y un 50-60% después de 3-5 años14, con mejoría en los síntomas obstructivos15,16,17.
Habitualmente en el BMN no toxico la captación de 131I es baja y heterogénea requiriendo dosis altas, esto puede provocar irradiación a órganos y tejidos extra tiroideos necesitando hospitalización y aislamiento en algunos casos. Sobre la base de las mediciones de la exposición a la radiación de todo el cuerpo, el riesgo teórico de por vida a desarrollar cáncer fuera de la glándula tiroides se ha calculado en un 1,6%. Para individuos de 65 años o más, el riesgo estimado es de 0.5%18.
Se han utilizado estrategias que mejoran la captación de 131I en el tejido tiroideo, como el uso de rhTSH19,20,21. Administrar 0,1 mg de rhTSH 24 h antes de una dosis de 131I fija o calculada permite proporcionar dosis más bajas22.
Analizamos los resultados al año del tratamiento con 131I en pacientes con BMN toxico y no toxico y el valor adicional del uso de rhTSH.
Objetivos primarios
Evaluar RVG luego de la administración de una dosis ambulatoria de 131I en el BMN toxico y BMN no toxico. Evaluar la remisión del hipertiroidismo en los pacientes con BMN toxico.
Evaluar la tasa de hipotiroidismo durante el primer año posterior al tratamiento.
Objetivos secundarios
Evaluar RVG en BMN no toxico estimulado con 0.1 mg de rhTSH. Cuantificar el incremento de la captación de 99mTc, 24 horas después de la administración de una dosis de rhTSH. Identificar efectos secundarios de la terapia con 131I.
Diseño y características de la población
Estudio abierto prospectivo observacional. Incluimos en forma consecutiva 14 pacientes con BMNNQ que consultaron en el Servicio de Endocrinología y Metabolismo del Hospital de Clínicas Montevideo-Uruguay, durante el período 2010-2013. Se realizó una evaluación clínica, bioquímica y ecográfica a los 1, 3, 6 y 12 meses de administrada la dosis 131I.
Criterios de inclusión
Pacientes con BMN toxico con indicación de tratamiento con 131I. Pacientes con BMN toxico y no toxico con síntomas loco regional y contraindicación quirúrgica, o aversión a la misma. Edad mayor a 18 años.
Criterios de exclusión Hipotiroidismo.
Diámetro de la tráquea menor a 7mm.
Punción aspiración con aguja fina (PAAF) que indique sanción quirúrgica3,4,5.
Para el grupo con estimulo de rhTSH: captación de 99mTc mayor de 25%.
Enfermedades graves asociadas a expectativa de vida corta.
Embarazo o deseo gestacional en los próximos 6 a 12 meses. Lactancia.
Evaluamos 134 pacientes, 14 cumplieron los criterios de inclusión.
Siete con BMN toxico: TSH menor a 0,1 uUI/ml T4L normal o alta, y centellograma tiroideo con 99mTc con nódulos hípercaptantes.
Siete con BMN no toxico: TSH dentro del rango de referencia 0,27-4,20 uUI/ml y centellograma 99mTc con captación irregular.
A 3 pacientes con BMN no toxico se les realizo estimulo con 0.1 mg de rhTSH. El VG medio al inicio del estudio fue; 67.93±60.72 cc Tres pacientes presentaron un volumen tiroideo inicial mayor a 100 cc. Cinco de siete pacientes con BMN toxico recibieron anti tiroideos de síntesis (ATS), que se suspendieron 7 días previos de la dosis de 131I. Los síntomas más frecuentes fueron: sensación de opresión en cuello, disfagia.
Métodos
Se evaluó el VG en cm3 con ecógrafo Esaote mylab 50 xvision con transductor lineal de alta frecuencia entre 7,5 a 12 mHz. La malignidad se evaluó a través de PAAF guiada por ultrasonido3,4,5.
Una TC sin contraste determino el diámetro de la luz traqueal.
La dosis de 131I administrada se obtuvo a través del cálculo de captación de 99mTc. Pertecnectato corregida para 131I, utilizando una Gamma cámara con imágenes recogidas por un ordenador a los 20 minutos de la inyección de 99mTc.
El porcentaje de captación fue calcula por la siguiente fórmula:
Recuento tiroideo-recuento del fondo x 100 Tecuento de la inyección- recuento residual. |
La captación de 131I se estimó a partir de la captación de 99mTc extrapolada a una gráfica de captación de 131I.
La dosis a administrar se calculó mediante la fórmula:
Peso en gramos de la glándula tiroides x 100-180uCi/g % de captación de 131I |
Para el cálculo de dosis se tuvo en cuenta las características clínicas del paciente y las dosis fijas empleadas para cada una de las patologías (Protocolo Mixto). Se administraron dosis comprendidas entre 15 y 30 mCi.
En el grupo con rhTSH, se calculó la dosis de 131I previo y posterior a la administración de 0,1 mg de rhTSH. La dosis se administró 24 horas después.
TSH se evaluó con método de tercera generación. Se utilizó equipo Cobas 6.000 mediante Electro quimioluminiscencia (referencia 0,27-4,20 uUI/ml). El hipotiroidismo permanente se definió como una TSH sobre el rango superior normal y una T4L menor al rango de referencia.
Se interrogó el nivel de satisfacción personal, correlacionando la RVG con el alivio de los síntomas loco-regional luego del tratamiento. El estudio fue aprobado por el Comité de Ética del Hospital de Clínicas Uruguay.
Los pacientes aceptaron voluntariamente y firmaron el consentimiento informado.
Análisis estadístico
Las medidas descriptivas fueron medias y desvíos estándar y medianas y rangos intercuartílicos. Para las correlaciones entre variables continuas se utilizaron correlaciones de Spearman, debido a la no normalidad de las variables. Para las comparaciones entre grupos se utilizó el test de Mann- Whitney-Wilcoxon para muestras independientes. Para testear la reducción en el volumen glandular (RVG), se utilizó un test de t, utilizando como hipótesis nula que no hubo cambio (H0: x=0). Todos los análisis se realizaron en R 3.6.2 (R Core Team, 2019) en RStudio 1.0.153, utilizando un nivel de significación de 5% (alpha=0.05)23.
Resultados
Incluimos 14 pacientes, 50% BMN toxico y 50% BMN no tóxico.
La media de edad de la población seleccionada fue de 71,08 años (70,82-71,33), la mayoría del sexo femenino (13 pacientes).
Los niveles basales de TSH y T4L fueron de 0,51 uUI /ml (0,04-1,86) y 1,48 ng/dl (1,15-1,54) respectivamente.
El VG al inicio del estudio fue de 67.93±60.72 (rango 18.00: 200.00; mediana 41.50, RIQ: 53).
Remisión del Hipertiroidismo en 6 de 7 pacientes con BMN tóxico.
Reducción de volumen glandular. Si se compara el cambio proporcional entre los doce meses y el principio del estudio, se encuentra una reducción significativa del VG (media = -0.388, t-test=-4.479, p-value<0.01), considerando todos los pacientes (Figuras 1, 2).
Relación entre Captación de 99mTc, dosis de 131I y RVG. Si bien parece observarse una asociación con la reducción proporcional del volumen glandular (entre el comienzo del estudio y los 12 meses), esta no es significativa a un nivel de 5% (Spearman=689.26, p-value=0.06) (Figura 3).
Lo mismo ocurre con la dosis de 131I y la reducción proporcional de volumen glandular (Spearman=234.62, p-value=0.07) (Figura 4).
Los pacientes con BMN no tóxico y estimulo con 0.1 mg de rhTSH tuvieron un cambio promedio en el porcentaje de captación de 99mTc de 32.43±10.61.
Recibieron una dosis de 131I baja y la RVG (desde el comienzo a los 12 meses) no fue significativamente diferente a la del grupo sin rhTSH (Wilcoxon=23, p-value=0.35) (Figura 5).
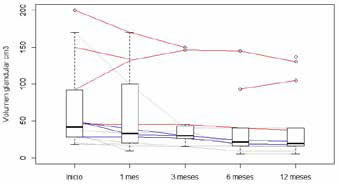 Figura 1: Evolución del volumen glandular luego del tratamiento (todos los
pacientes). Cada línea de fondo es la evolución de un paciente particular.
Gris BMN toxico, rojo BMN no tóxicos sin rhTSH, azul BMN no tóxicos con
rhTSH. Los gráficos de caja superpuestos representan a toda la muestra en
cada punto de tiempo
Figura 1: Evolución del volumen glandular luego del tratamiento (todos los
pacientes). Cada línea de fondo es la evolución de un paciente particular.
Gris BMN toxico, rojo BMN no tóxicos sin rhTSH, azul BMN no tóxicos con
rhTSH. Los gráficos de caja superpuestos representan a toda la muestra en
cada punto de tiempo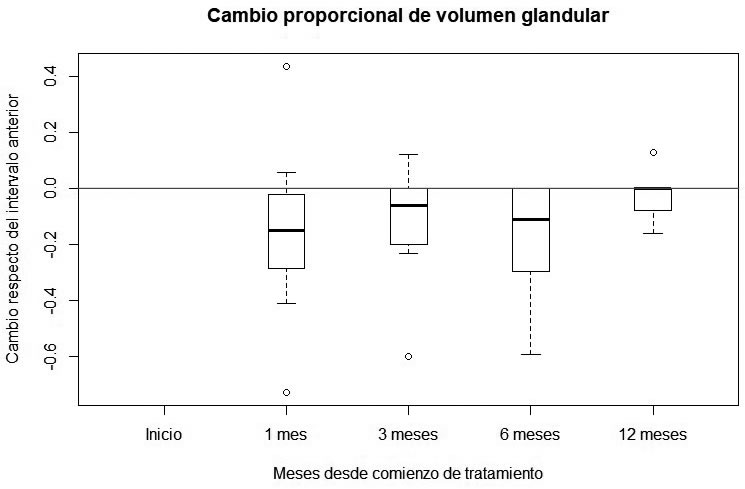 Figura 2: Reducciones proporcionales intervalo a intervalo. La caja para 1
mes muestra el resultado de:(VG_1mes-VG_incial)/VG inicial.
Figura 2: Reducciones proporcionales intervalo a intervalo. La caja para 1
mes muestra el resultado de:(VG_1mes-VG_incial)/VG inicial.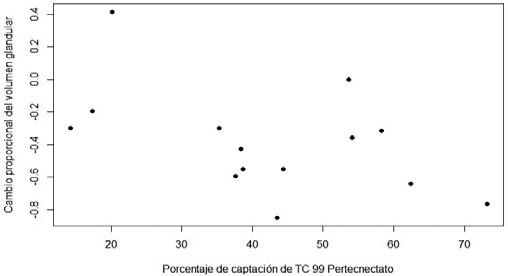 Figura 3: Relación entre la Captación de 99mTc Pertecnectato y reducción
proporcional del volumen glandular (Spearman=689.26, p-value=0.06).
Figura 3: Relación entre la Captación de 99mTc Pertecnectato y reducción
proporcional del volumen glandular (Spearman=689.26, p-value=0.06).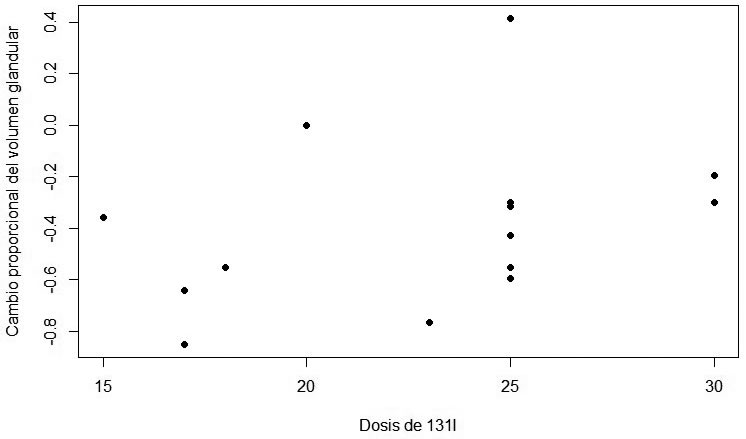 Figura 4: Relación entre la dosis de 131I y la reducción proporcional de volumen
glandular (Spearman=234.62, p-value=0.07).
Figura 4: Relación entre la dosis de 131I y la reducción proporcional de volumen
glandular (Spearman=234.62, p-value=0.07).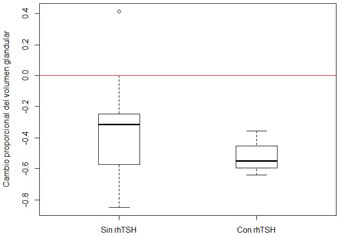 Figura 5: Cambio proporcional en la RVG en pacientes pre tratados con 0.1 mg
de rhTSH y pacientes sin pre tratamiento.
Figura 5: Cambio proporcional en la RVG en pacientes pre tratados con 0.1 mg
de rhTSH y pacientes sin pre tratamiento.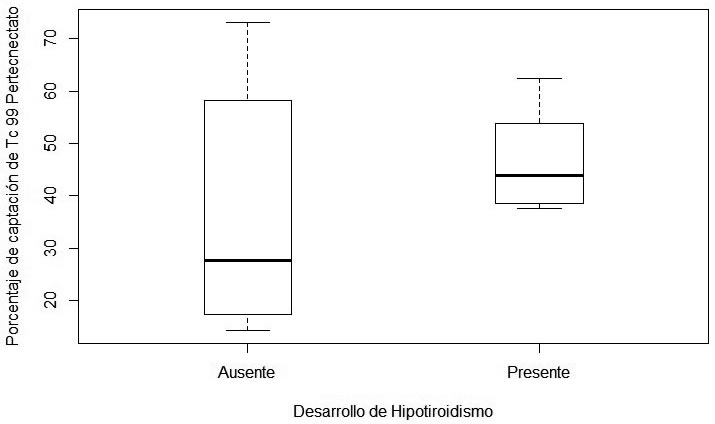 Figura 6: Relación entre el porcentaje de captación de 99mTc Pertecnectato y desarrollo de hipotiroidismo (Wilcoxon=15, p-value=0.28).
Figura 6: Relación entre el porcentaje de captación de 99mTc Pertecnectato y desarrollo de hipotiroidismo (Wilcoxon=15, p-value=0.28). Hipotiroidismo
Durante el tiempo de seguimiento; 8 pacientes presentaron hipotiroidismo.
Cinco con BMN toxico y los 3 pacientes con BMN no tóxico que fueron estimulados con rhTSH.
La tasa de aparición de hipotiroidismo fue de 7.41 por cada 100 pacientes.mes.
La mediana del tiempo de aparición del hipotiroidismo fue 6 meses.
Comparando por grupo de BMN (toxico/no toxico) las tasas específicas por grupo fueron 4.54 por cada 100 pacientes.mes (BMN no toxico) y 11.90 por cada 100 pacientes.mes (BMN tóxico).
No hubo diferencias significativas en el porcentaje de captación de 99mTc entre los que desarrollaron hipotiroidismo y los que no (Wilcoxon=15, p-value=0.28) (Figura 6).
Sin embargo ambos grupos si presentaron diferenias en las dosis de 131I administrado. Presentaron hipotiroidismo aquellos que recibieron menor dosis de 131I (Wilcoxon=15, p value=0.03) (Figura 7).
Las figuras 8 y 9 expresan el porcentaje de captación de 99mTc y la dosis de 131I en los tres grupos, en relación a la presencia o usencia de hipotiroidismo respectivamente.
Clínica compresiva y efectos adversos
Todos los pacientes refirieron desaparición del síntoma loco regional.
No observamos síntomas nuevos secundarios al tratamiento como: compresión local, síntomas de tiroiditis, arritmias u otros efectos en ningún paciente24.
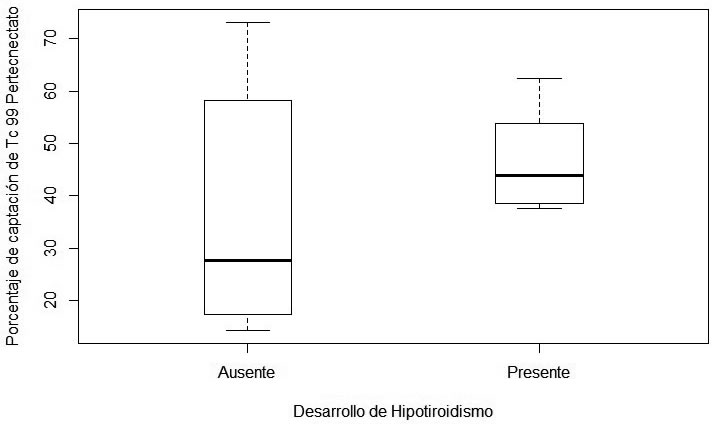 Figura 7: Relación significativa entre la dosis de 131I y la presencia de
hipotiroidismo. Wilcoxon=15, p-value=0.03
Figura 7: Relación significativa entre la dosis de 131I y la presencia de
hipotiroidismo. Wilcoxon=15, p-value=0.03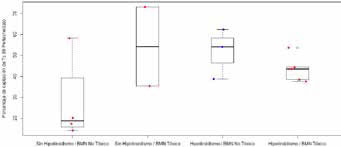
 Figura 9: Grafico considerando pacientes con hipotiroidismo por grupo (BMN
Figura 9: Grafico considerando pacientes con hipotiroidismo por grupo (BMNtóxico/no tóxico), vs dosis de 131I. Los puntos en azul tuvieron rhTSH previa.
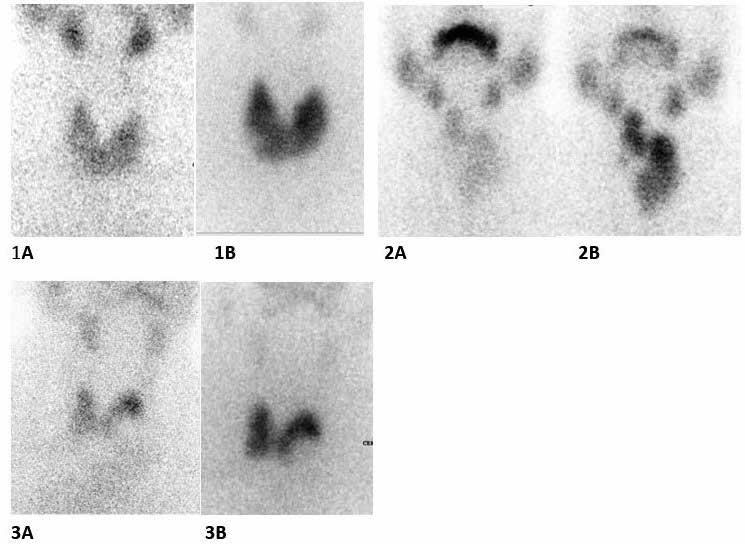 Figura 10: Centellograma tiroideo con 99mTc antes (A) y 24 h después de
la administración de 0,1 mg de rhTSH en una dosis única (B). Captación
homogénea, cambio promedio en el porcentaje de captación de 32.43±10.61.
Figura 10: Centellograma tiroideo con 99mTc antes (A) y 24 h después de
la administración de 0,1 mg de rhTSH en una dosis única (B). Captación
homogénea, cambio promedio en el porcentaje de captación de 32.43±10.61.Discusión
La naturaleza no invasiva es la principal ventaja de la terapia con 131I. Realizamos el tratamiento ambulatorio con una dosis calculada5 de 131I en 14 pacientes con BMN con características heterogéneas. Como resultado, las dosis aplicadas variaron entre 15 y 30 mCi (555 -1110 Mbq).
El daño no reparable que se produce en el ADN de las células foliculares y el proceso destructivo de la glándula conduce a los objetivos clínicos, es decir, una disminución en la función tiroidea y / o una RVG.
En la mayoría de los pacientes con BMN toxico se obtuvo remisión del hipertiroidismo, con una RVG significativa del 38% considerando todos los pacientes después de 1 año de seguimiento. Otros estudios muestran una reducción similar del 40% después de un año y un 50-60% después de 2-5 años25,26,27.
Esta RVG no se correlacionó significativamente con la captación de 99mTc ni con la dosis de 131I aplicada, debido a las diferencias estructurales y funcionales del bocio en nuestra población. El cálculo de la dosis debería contemplar: el peso del tiroides, la captación del radioisotopo y el tiempo de semivida del 131I en el tiroides28, generando una respuesta relacionada con la dosis tiroidea aplicada, sin embargo la relación dosis-respuesta no es lineal, existiendo enormes variaciones interindividuales relacionadas con la heterogeneidad del tamaño del bocio y la biocinética del yodo en la glándula29. Calcular la actividad retenida de 131I en el tiroides tendría una mejor correlación con la RVG ya que probablemente la respuesta se asocie con la dosis de radiación recibida, mayor cuanto mayor es la actividad retenida de iodo30, Esta actividad es baja en BMN no tóxicos y mayor en los BMN tóxicos.
Los ATS utilizados (5 pacientes) actúan disminuyendo el metabolismo de la célula tiroidea y la pre condiciona hacia un estado más radio sensible. Alteran el equilibrio dentro del entorno intracelular entre la generación de radicales de oxígeno libre y la capacidad de la defensa antioxidante. Sumados a la mayor actividad retenida de isotopos en los nódulos autónomos determinó una mayor eficiencia del 131I, necesitándose menor dosis con igual efecto en la RVG.
En cambio en el BMN no tóxico para lograr la misma RVG se requirieron dosis más altas (25-30 mCi) debido a una absorción del radioisótopo baja y heterogénea14 (Figuras 8 y 9). Cuando consideramos el VG para la aplicación de la dosis, se aplicaron las dosis más altas para los bocios con VG de 100 cm3 o más con el fin de equilibrar la relación inversa que existe entre el volumen tiroideo pre tratamiento31,32 y la RVG. Sabemos que la respuesta disminuye con la cantidad relativa de tejido fibroso degenerado y las células tiroideas en hibernación, que no se ven afectados por la radiación.
Diversos estudios post hoc17,26,32,33,34 que evalúan la relación de la dosis tiroidea aplicada y la respuesta en la RVG son contradictorios. Uno de ellos26 asoció una mayor respuesta con dosis más altas de 131I. Estas dosis pueden motivar el ingreso del paciente y provocan irradiación extra tiroidea. Una publicación reciente del Estudio Cooperativo de Seguimiento de la Terapia de Tirotoxicosis, muestra que el tratamiento con 131I se relacionó con un riesgo ligeramente mayor de mortalidad por cáncer sólido35.
En este sentido basado en los principios de la protección radiológica como lo estipula el principio de ALARA (As Low As Reasonably Achievable), creemos que calcular la dosis de 131I y elevar la TSH ya sea endógena36,37 o con el uso de rh TSH propicia una dosis mesurada manteniendo el beneficio clínico.
El tratamiento previo con una dosis única y baja de rhTSH ha demostrado reducir la dosis de 131I y potenciar su efecto en pacientes con BMN de escasa captacion38,39,40. Aplicamos 0,1 mg de rh TSH en nuestros pacientes aumentando el porcentaje de captación promedio en un 32.43±10.61. Una captación baja y heterogénea se volvió homogénea y aumentada (Figura 10) con efectos terapéuticos similares, que aquellos sin estimulación de rhTSH (Figura 5) permitiendo menores dosis de 131I aplicadas22,34, en un enfoque de igualdad (Figura 9).
El tratamiento determinó en nuestros pacientes una media de aparición de hipotiroidismo a los 6 meses de 7.41 por cada 100 pacientes.mes con mayor proporción en aquellos con BMN tóxico. Se han observado tasas de éxito de 75 a 95%, con un riesgo de hipotiroidismo de aproximadamente 20% a 75% en 8 años, dependiendo de la dosis de radiación tiroidea aplicada41,42.
Nuestros pacientes estimulados con rhTSH también presentaron hipotiroidismo a los 12 meses de seguimiento. Diferentes estudios que evaluaron los efectos adversos de rhTSH y la terapia con 131I muestran un aumento en la tasa de hipotiroidismo permanente11,21,24,43,44. Debemos mencionar que la terapia del BMN con rhTSH y 131I no está aprobada por la FDA de Estados Unidos ni la Agencia Europea de Medicamentos.
No se registraron otros efectos colaterales a destacar en los tres grupos, reportándose mejoría de los síntomas loco regional del bocio en la todos los pacientes45,17.
Conclusión
Según nuestros resultados: Una dosis calculada de 131I es efectiva y segura para la RVG y el control del hipertiroidismo asociado al BMNNQ. Alternativamente, la estimulación con rhTSH u otro método que aumente la captación de 131I36,37 lograría una RVG similar utilizando una menor dosis administrada. Si dosis inferiores de 131I se pueden realizar manteniendo la RVG similar, con menor efecto hipotiroideo debe ser motivo de investigaciones futuras.
Limitantes
Seguimiento de los pacientes por un año, ya que los cambios post tratamiento se extenderán más allá de este periodo de seguimiento. Mejores asociaciones se podrían establecer con un mayor número de pacientes.
Los autores declaran no tener conflictos de interés en este estudio.
Referencias
- Medeiros-Neto G. Multinodular Goiter. [Updated 2016 Sep 26]. In: Feingold KR, Anawalt B, Boyce A, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https:// www.ncbi.nlm.nih.gov/books/NBK285569/
- Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016; 26(1): 1-133. doi:10.1089/thy.2015.0020
- Knobel M. Etiopathology, clinical features, and treatment of diffuse and multinodular nontoxic goiters. J Endocrinol Invest 2016; 39: 357-73. doi:10.1007/ s40618-015-03917
- Vanderpump MP, Tunbridge WM, French JM, et al. The incidence of thyroid disorders in the community: a twenty-year follow-up of the Whickham Survey. Clin Endocrinol (Oxf) 1995; 43: 55.
- Rokni H, Sadeghi R, Moossavi Z, Treglia G, Zakavi SR. Efficacy of different protocols of radioiodine therapy for treatment of toxic nodular goiter: systematic review and meta-analysis of the literature. Int J Endocrinol Metab. 2014; 12(2): e14424. Published 2014 Apr 1. doi:10.5812/ijem.14424
- Knobel M. Which Is the Ideal Treatment for Benign Diffuse and Multinodular Non-Toxic Goiters?. Front Endocrinol (Lausanne). 2016; 7: 48. Published 2016 May 23. doi:10.3389/fendo.2016.00048.
- Diehl LA, Garcia V, Bonnema SJ, Hegedüs L, Albino CC, Graf H, et al. Management of the nontoxic multinodular goiter in Latin America: comparison with North America and Europe, an electronic survey. J Clin Endocrinol Metab. 2005; 90: 117-123. doi:10.1210/jc.2004-1722
- Uzzan B, Campos J, Cucherat M, Nony P, Boissel JP, Perret GY. Effects on bone mass of long term treatment with thyroid hormones: a metaanalysis. J Clin Endocrinol Metab. 1996; 81: 4278-4289. doi:10.1210/ jcem.81.12.8954028 14.
- Rieu M, Bekka S, Sambor B, Berrod JL, Fombeur JP. Prevalence of subclinical hyperthyroidism and relationship between thyroid hormonal status and thyroid ultrasonographic parameters in patients with non-toxic nodular goitre. Clin Endocrinol (Oxf). 1993; 39(1): 67-71. doi:10.1111/j.1365-2265.1993. tb01752.x
- egedüs L, Hansen BM, Knudsen N, Hansen JM. Reduction of size of thyroid with radioactive iodine in multinodular non-toxic goitre. BMJ. 1988; 297: 661-662. doi:10.1136/bmj.297.6649.661
- Bonnema SJ, Hegedüs L. Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome. Endocr Rev. 2012; 33: 920-980.
- Nygaard B, Hegedüs L, Gervil M, Hjalgrim H, Søe-Jensen P, Hansen JM. Radioiodine treatment of multinodular non-toxic goitre. BMJ. 1993; 307: 828-832.
- Wesche MF, Tiel-V Buul MM, Lips P, Smits NJ, Wiersinga WM. A randomized trial comparing levothyroxine with radioactive iodine in the treatment of sporadic nontoxic goiter. J Clin Endocrinol Metab. 2001; 86: 98-1005.
- Weetman AP. Radioiodine treatment for benign thyroid diseases. Clin Endocrinol (Oxf). 2007; 66: 757-764.
- Huysmans DA, Hermus AR, Corstens FH, Barentsz JO,Kloppenborg PW 1994. Large,compressive goiters treated with radioiodine. Ann Intern Med 121: 757-762.
- Bonnema SJ, Nielsen VE, Hegedu¨s L. Long-term effects of radioiodine on thyroid function, size and patient satisfaction in non-toxic diffuse goitre. Eur J Endocrinol. 2004; 150: 439-445.
- Bonnema SJ, NielsenVE,Boel-Jørgensen H, Grupe P, Andersen PB, Bastholt L, Hegedu¨s L. Improvement of goiter volume reduction after 0.3 mg recombinant human thyrotropin-stimulated radioiodine therapy in patients with a very large goiter: a double-blinded, randomized trial. J Clin Endocrinol Metab. 2007; 92: 3424-3428.
- Huysmans DA, Buijs WC, vande VenMT, vanden Broek WJ, Kloppenborg PW, Hermus AR, Corstens FH. Dosimetry and risk estimates of radioiodine therapy for large, multinodular goiters. J Nucl Med. 1996; 37: 2072-2079.
- FastS, NielsenVE, BonnemaSJ, HegedusL Time to reconsider non surgical therapy of benign non-toxic multinodular goitre: focus on recombinant human TSH augmented radioiodine therapy. Eur J Endocrinol 2009; 160: 517-528.
- Fast S., Nielsen V.E., Bonnema S.J., Hegedüs L. Dose‐dependent acute effects of recombinant human TSH (rhTSH) on thyroid size and function: comparison of 0·1, 0·3 and 0·9mg of rhTSH. Clinical Endocrinology. 2010; 72: 411-416. doi:10.1111/j.1365-2265.2009.03650.x
- Fast S, Nielsen VE, Grupe P, et al. Prestimulation with recombinant human thyrotropin (rhTSH) improves the long-term outcome of radioiodine therapy for multinodular nontoxic goiter. J Clin Endocrinol Metab. 2012; 97: 2653-2660.
- Fast S, Hegedüs L, Grupe P, Nielsen VE, Bluhme C, Bastholt L, Bonnema SJ. Recombinant Human Thyrotropin-Stimulated Radioiodine Therapy of Nodular Goiter Allows Major Reduction of the Radiation Burden with Retained Efficacy.J Clin Endocrinol Metab. 2010; 95: 3719-3725. https://doi.org/10.1210/jc.2010-0634
- Core R, Team R. A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. (2019). https:// www.R-project.org/.
- Nielsen VE, Bonnema SJ, HegedusL. Transient goiter enlargement after administration of 0.3 mg of recombinant human thyrotropin in patients with benign nontoxic nodular goiter: a randomized, doubleblind, crossover trial. Journal of Clinical Endocrinology and Metabolism. 2006; 91: 1317-1322. (doi:10.1210/jc.2005-2137).
- Verelst J, Bonnyns M, Glinoer D. Radioiodine therapy in voluminous multinodular non-toxic goitre. Acta Endocrinol (Copenh). 1990; 122: 417-421.
- Bachmann J, Kobe C, Bor S, Rahlff I, Dietlein M, Schicha H, Schmidt M. Radioiodine therapy for thyroid volume reduction of large goitres. Nucl Med Commun. 2009; 30: 466-471.
- Bonnema SJ, Hegedus L. Bocio notoxico. En: Vitti P. Hegedus L.(eds) Enfermedades de la tiroides. Endocrinología.Springer,Cham. 2017.
- Zingrillo M, Urbano N, Suriano V, Modoni S. Radioiodine treatment of Plummer and multinodular toxic and nontoxic goiter disease by the first approximation dosimetry method. Cancer Biother Radiopharm. 2007 Apr; 22(2): 256-260.
- Albino CC, Mesa CO, Olandoski M, Ueda CE, Woellner LC, Goedert CA, Souza AM, Graf H. Recombinant human thyrotropin as adjuvant in the treatment of multinodular goiters with radioiodine. Journal of Clinical Endocrinology and Metabolism 2005; 90: 2775-2780. (doi:10.1210/jc.2004-0458).
- Graf H,Therapy of Endocrine Disease: Recombinant human TSH and radioactive iodine therapy in the management of benign multinodular goiter. European Journal of Endocrinology. 2015; 172(2): R47-R52. Doi: 10.1530/ EJE-14-0608.
- Le Moli R, Wesche MF, Tiel-Van Buul MM, Wiersinga WM. Determinants of long term outcome of radioiodine therapy of sporadic non-toxic goitre.Clin Endocrinol (Oxf). 1999; 50(6): 783-789.
- Bonnema SJ, Bertelsen H, Mortensen J, Andersen PB, Knudsen DU, Bastholt L, Hegedu¨s L. The feasibility of high dose iodine131treatment as analternative to surgery in patients with a very large goiter: effect on thyroid function and size and pulmonary function. J Clin Endocrinol Metab. 1999; 84: 3636-3641.
- de Klerk JM, van Isselt JW, van Dijk A, Hakman ME, Pameijer FA, Koppeschaar HP, Zelissen PM, et al. Lodine-131therapy in sporadic non toxic goiter. J Nucl Med. 1997; 38: 372-376.
- Nielsen VE, Bonnema SJ, Boel-Jørgensen H, Grupe P, Hegedu¨sL Stimulation with 0.3-mg recombinant human thyrotropin prior to iodine 131 therapy to improve the size reduction of benign nontoxic nodular goiter: a prospective randomized double-blind trial. Arch Intern Med 2006; 166: 1476-1482.
- Kitahara C, et al. Association of Radioactive Iodine Treatment With Cancer Mortality in Patients With Hyperthyroidism. JAMA Intern Med 2019. DOI: 10.1001/jamainternmed.2019.0981.
- Albino CC, Graf H, Sampaio AP, Vigário A, Paz-Filho GJ. Thiamazole as an adjuvant to radioiodine for volume reduction of multinodular goiter. Expert Opinion on Investigational Drugs. 2008; 17: 1781-1786. (doi:10.1517/13543 780802501325).
- Flores A, Ruiz A, Lopez G, Gonzalez O. Effect of 1110 MBq radioiodine in reducing thyroid volume in multinodular goiter: a new protocol. Journal of Clinical Medicine Research. 2013; 5: 234-238.
- Nieuwlaat W-A, Huysmans DA, van den Bosch HC, Sweep CGF, Ross HA, Corstens FH, Hermus AR. Pretreatment with a single, low dose of recombinant human thyrotropin allows dose reduction of radioiodine therapy in patients with nodular goiter. J Clin Endocrinol Metab. 2003; 88: 3121-3129. (doi:10.1210/jc.2002-021554)
- Huysmans DA, Nieuwlaat WA, Erdtsieck RJ, Schellekens AP, Bus JW, Bravenboer B, Hermus AR. Administration of a single low dose of recombinant human thyrotropin significantly enhances thyroid radioiodide uptake in nontoxic nodular goiter. J Clin Endocrinol Metab. 2000; 85: 3592-3596. (doi:10.1210/jcem.85.10.6869).
- Nieuwlaat WA, Hermus AR, Sivro-PrndeljF CorstensFH HuysmansDA. Pretreatment with recombinant human TSH changes the regional distribution of radioiodine on thyroid scintigrams of nodular goiters. J Clin Endocrinol Metab. 2001; 86: 5330-5336. (doi:10.1210/jcem.86.11.8014).
- Nygaard B, Hegedu¨s L,Ulriksen P,Nielsen KG,Hansen JM. Radioiodine therapy for multinodular toxic goiter. Arch Intern Med. 1999; 159: 1364-1368 51.
- Kahraman D, Keller C, Schneider C, Eschner W, Sudbrock F, Schmidt M, Schicha H, Dietlein M, Kobe C. Development of hypothyroidism during long-term follow-up of patients with toxic nodular goitre after radioiodine therapy. Clin Endocrinol (Oxf). 2012; 76: 297-303.
- Nielsen VE, BonnemaSJ Boel-JorgensenHV ejeAHegedusL. Recombinant human thyrotropin markedly changes the 131I kinetics during 131. I therapy of patients with nodular goiter: an evaluation by a randomized double-blinded trial. J Clin Endocrinol Metab. 2005; 90: 79-83. (doi:10.1210/jc.2004-1550).
- Graf H. Multinodular goiter: pathogenesis and management. In Werner & Ingbar’s The Thyroid 10th edn pp 635-649. Eds LE Braverman & DS Cooper. Philadelphia: Lippincott 2013
- Bonnema SJ, Nielsen VE, Hegedu¨s L. Long-term effects of radioiodine on thyroid function, size and patient satisfaction in non-toxic diffuse goitre. Eur J Endocrinol. 2004; 150: 439-445.