MODY 2 causado por mutaciones en la glucoquinasa: Una aproximación a nivel molecular
Gabriel Castillo T.1*, María Ignacia Rovegno V.1, Catalina Saldaña T.1, Daniela Seelenfreund H.2*, Pilar Durruty A.3
MODY 2 caused by glucokinase mutations: A molecular approach cases
- Estudiante de Bioquímica. Facultad de Ciencias Químicas y Farmacéuticas, Universidad de Chile. Santiago, Chile.
- PhD. Departamento de Bioquímica y Biología Molecular, Facultad de Ciencias Químicas y Farmacéuticas, Universidad de Chile. Santiago, Chile.
- Bioquímico. Sección Endocrinología y Diabetes. Hospital Clínico Universidad de Chile. Unidad de Diabetes. Hospital San Juan de Dios. Santiago, Chile.
*Correspondencia:
Gabriel Castillo
gabriel.castillo.t@ug.uchile.cl
Daniela Seelenfreund
dseelen@ciq.uchile.cl
Dr. Carlos Lorca 964, Independencia,
Código postal 8380494.
Facultad de Ciencias Químicas y
Farmacéuticas. Universidad de Chile. Santiago, Chile.
Este trabajo no contó con financiamiento.
Los autores declaran no tener conflictos
de interés.
Los tres primeros autores contribuyeron de igual forma a este trabajo.
Recibido: 07-10-2020.
Aceptado: 17-03-2021.
Resumen: La diabetes MODY 2 es un tipo de diabetes monogénica producida por una mutación en la enzima glucoquinasa, generando un fenotipo hiperglicémico. Para posibles fines terapéuticos o de diagnóstico, se debe conocer esta proteína, una enzima monomérica de la familia de las hexoquinasas, encargadas de convertir glucosa en glucosa-6-fosfato, el primer paso de la glicolisis. La glucoquinasa se caracteriza por sus propiedades cinéticas únicas: tiene una afinidad mucho menor por el sustrato que las demás hexoquinasas y no es inhibida por su producto. Se encuentra principalmente en páncreas e hígado (βGK y LGK, respectivamente), donde como sensor regula los distintos estados metabólicos de estos tejidos, y controla la glicemia a nivel sistémico. Las formas βGK y LGK se diferencian a nivel transcripcional, pues el gen posee dos promotores distintos, específicos para cada tejido. A nivel hormonal, la actividad de esta enzima es regulada selectivamente de manera tejido-específica por glucosa, insulina y otras proteínas reguladoras. La isoforma hepática puede ser secuestrada hacia el núcleo por la proteína reguladora de glucoquinasa (GKRP, por su sigla en inglés). La principal característica de la enzima glucoquinasa es su inusual regulación alostérica, propiedad que le permite adoptar dos conformaciones principales, una cerrada (activa) y otra súper-abierta (inactiva). Se han desarrollado distintas drogas activadoras de glucoquinasa, las cuales se unen al sitio alostérico de la enzima y estabilizan a la proteína en su estado cerrado. En esta revisión se describen las características estructurales y propiedades regulatorias que posee la enzima glucoquinasa, relacionándolas con su rol en el desarrollo de la diabetes MODY 2. También se profundiza en las implicancias moleculares de algunas mutaciones descritas que originan MODY 2, y se abordan los efectos de moléculas activadoras de glucoquinasa.
Palabras claves: Diabetes; Glucoquinasa; MODY.
Abstract: Diabetes MODY 2 or GCK-MODY is a type of monogenic diabetes produced by a mutation in the glucokinase enzyme, generating a hyperglycemic phenotype. This protein, a monomeric enzyme of the hexokinase family, is responsible for converting glucose into glucose-6-phosphate, the first step of glycolysis. Glucokinase is characterized by its unique kinetic properties: it has a much lower affinity for its substrate than other hexokinases and is not inhibited by its product. It is found mainly in pancreas (βGK) and liver (LGK), where it acts as a sensor regulating the different metabolic states of these tissues, and ultimately, controlling systemic glycemia. The two forms βGK and LGK differ at a transcriptional level, because the gene presents two different tissue-specific promoters. The activity of glucokinase in liver and pancreas is regulated by glucose, insulin and other regulatory proteins. The liver isoform can be sequestered to the nucleus by the glucokinase regulatory protein (GKRP). The main characteristic of the enzyme is its unusual allosteric regulation, a property that allows the protein to adopt a closed (active) conformation, and a super-open (inactive) conformation. Different glucokinase activating drugs have been developed, which bind to the allosteric site of the enzyme and stabilize glucokinase in its closed state. This review describes the structural and regulatory properties of the glucokinase enzyme, and its role in the development of MODY 2 diabetes. The molecular implications of some mutations that originate MODY 2 are also described, and the effects of glucokinase activating molecules are addressed.
Keywords: Diabetes; Glucokinase; MODY.
Introducción
Es sabido que la diabetes es producida por destrucción de las células beta del páncreas (diabetes tipo 1), disminución de la secreción de insulina o resistencia del receptor reduciendo la capacidad de los tejidos para responder a la hormona (diabetes tipo 2). Existe un conjunto de diabetes originadas por mutaciones en solo un gen (diabetes monogénicas), correspondientes a la diabetes neonatal, a las diabetes MODY (Maturity Onset Diabetes of the Young)1 y a la diabetes mitocondrial que afectan a alrededor del 1-5% de los pacientes diabéticos2. Las diabetes MODY generalmente se manifiestan a temprana edad, antes de los 25 años, a veces incluso en recién nacidos y su diagnóstico es confirmado mediante análisis genéticos. Se han descrito 14 subtipos de MODY2, con mutaciones en distintos genes (Tabla 1) involucrados en el desarrollo del páncreas o en la liberación de insulina en respuesta a glucosa. Uno de los subtipos comunes de MODY es la MODY 2 o MODY GK, que afecta a aproximadamente al 50% de los pacientes con MODY, en donde se ve alterado el gen de la glucoquinasa (GK). Los pacientes MODY 2 pueden ser mal diagnosticados por su presentación parecida con la diabetes tipo 22.
La GK es una enzima perteneciente a la familia de las hexoquinasas, denominada hexoquinasa D o de tipo IV. Las hexoquinasas catalizan la fosforilación de la D-glucosa en presencia de ATP, generando D-glucosa-6-fosfato y ADP. Este es el primer paso de la vía glicolítica, por lo que es fundamental en la homeostasis de la glucosa1. La GK ha sido caracterizada principalmente en hepatocitos y células β-pancreáticas, siendo esta última la de mayor importancia en patologías asociadas a su malfuncionamiento. En el metabolismo de las células β de los islotes de Langerhans, la GK actúa como sensor de glucosa e inicia la vía de secreción de insulina inducida por glucosa, que se puede producir de forma dependiente (triggering pathway) o independiente (amplifying pathway) de los canales K+ ATP en la membrana de las células β1.
La GK se distingue de otras hexoquinasas por sus propiedades cinéticas. Posee una constante de saturación media (S0.5) equivalente a la constante de Michaelis (KM), mucho más alta que otras hexoquinasas, cercana a 6 mM, en tanto que las hexoquinasas I a III poseen una KM en el rango de concentraciones micromolares. Esto se traduce en una afinidad mucho menor por la glucosa que las otras hexoquinasas, ocurriendo la reacción sólo cuando la concentración de glucosa es superior a la glicemia normal, es decir entre 70 y 100 mg/dl. La GK también posee algunas diferencias estructurales con las demás hexoquinasas, como la existencia de distintas formas enzimáticas3, difiriendo estas últimas en su actividad catalítica. La interacción entre los dos dominios principales que conforman la estructura de la GK son fundamentales al comparar las características cinéticas de esta con otras enzimas de la misma familia3. En conjunto le confieren la posibilidad de actuar como un “sensor” de glucosa en organismos superiores. Al ser el regulador de la secreción de insulina, entender su funcionamiento, regulación y estructura es fundamental en el tratamiento de MODY 2.
Se han encontrado distintos compuestos sintéticos que alteran la estructura de la GK3,4, como por ejemplo el N-tiazol-2-il-2-amino- 4-fluoro-5-(1-metilimidazol-2-il) tiobenzamida, un compuesto heterocíclico que actúa principalmente aumentando la actividad de la GK3. Así, la descripción de activadores enzimáticos (GKAs) abre una nueva ventana de posibilidades de tratamiento de este tipo de diabetes y otras similares.
MODY 2
A la fecha, se han reportado más de 600 mutaciones5, ya sea activadoras o inhibidoras de la actividad de GK2. En general corresponden a mutaciones privadas, es decir, mutaciones que se encontraron en poblaciones de tamaño reducido, que en muchas ocasiones afectan a una familia. Aunque no se han encontrado hot spots (regiones de DNA con altas tasas de mutación) en el gen de GK, la mayoría de las mutaciones activadoras se agrupan en torno a una región discreta de esta proteína, distinto a su centro catalítico, es decir en un sitio de activación alostérica6 capaz de regular la actividad de la proteína.
Los casos de MODY 2 con mutaciones homocigotas causan un fenotipo más severo, denominado Permanent Neonatal Diabetes Mellitus (PNDM), con una GK totalmente inactiva desde el nacimiento2,5.
La clasificación de los MODY se basa en las mutaciones encontradas en los diferentes genes afectados (Tabla 2). La gran mayoría de éstas corresponde a modificaciones de una sola base o SNPs (por Single Nucleotide Polymorphisms) que provocan un cambio de un aminoácido por otro (mutaciones missense o no sinónimas), aunque también se han descrito mutaciones que provocan un corrimiento del marco de lectura o un término prematuro de la proteína5. A modo de ejemplo, la investigación de 35 familias francesas que presentan MODY 2 permitió identificar 16 mutaciones diferentes, de las cuales 14 no se habían descrito anteriormente7. De estas 14 nuevas mutaciones, se encontraron nueve cambios no sinónimos o missense. Por ejemplo, en la mutación A53S, la alanina en la posición 53 de la proteína es cambiada por serina, y en la mutación V367M la valina en la posición 367 cambia a metionina. También se encontraron dos mutaciones sin sentido o nonsense, en que se genera un cambio de un codón por una señal de término de la traducción (X), generando proteínas aberrantes (E248X y S360X). Otras mutaciones encontradas corresponden a una deleción de un nucleótido que provocó un cambio en el marco de lectura (V401del1) y otra generó la eliminación de 20 pares de bases con pérdida de 8 nucleótidos intrónicos (K161 + 2del10). Finalmente, otra mutación descrita generó una sustitución de un nucleótido conservado en un sitio aceptor de empalme durante el procesamiento del transcrito (L122-1G → T, en que la guanina del exón anterior a la leucina 122 es reemplazada por timina), generando un mRNA maduro distinto al nativo7.
Otro ejemplo es el hallazgo de una nueva mutación en una familia chilena con diabetes monogénica8. Mediante el estudio del gen GK del caso índice y de algunos de sus familiares, se identificó una variante que genera un cambio no sinónimo en la posición 448 de la enzima, modificando una glicina a ácido aspártico (G448D). A pesar de que no se ha modelado la estructura resultante, se puede postular que el cambio de un aminoácido apolar por uno cargado negativamente conlleva alteraciones en la estructura de la GK, lo que modificaría su actividad y explicaría la presencia de MODY 28. En todos estos casos, la mutación se presenta en individuos heterocigotos para la mutación5.
Para comprender a cabalidad el efecto que generan estas mutaciones en la actividad de la enzima GK, es necesario entender cómo ésta es regulada a nivel sistémico y celular, y cómo sus particularidades estructurales y funcionales se ven afectadas por las mutaciones encontradas.
Expresión del gen de la glucoquinasa
Los primeros estudios de Iynedjian et al. (1986) detectaron la presencia de la enzima sólo en hígado e islotes pancreáticos, utilizando anticuerpos específicos, y luego corroboraron que ambos tejidos expresan el mRNA de GK6. Además, se encontró que ambos tejidos presentan formas distintas de la enzima, pues el mRNA de estos tiene una diferencia de ~400 nucleótidos, debido a que el gen de GK posee promotores alternativos. Dichos promotores son específicos para cada tejido9, por lo que el primer exón es distinto en hígado y páncreas. Ambas formas solo difieren en los primeros 15 aminoácidos de su secuencia y sus características cinéticas son indistinguibles10. Sin embargo, mientras la expresión génica de la GK hepática (LGK) es regulada en respuesta a insulina luego de un aumento de la glicemia postprandial, la isoforma pancreática (βGK) es regulada a nivel de la transcripción en respuesta a glucosa1,11, es decir, su expresión aumenta para cumplir su rol como sensor de ésta y así iniciar el mecanismo de liberación de insulina (triggering pathway)1.
Rol sistémico y regulación postraduccional
Durante muchos años se consideró que la GK era débilmente regulada. Sin embargo, ahora sabemos que es altamente regulada y existe evidencia de una regulación diferencial postraduccional entre hepatocitos y células β pancreáticas. La LGK regula la fosforilación de la glucosa postprandial, necesaria para la síntesis de glicógeno, mientras que la βGK está involucrada en la generación de señales metabólicas necesarias para la secreción de insulina estimulada por glucosa. Así, luego de periodos de inanición largos, una proporción baja de la actividad de βGK está inmediatamente disponible, permitiendo vincular el aumento de la glicemia con la fosforilación de glucosa. Posterior a la ingesta, la secreción de insulina puede suministrar inmediatamente glucosa al organismo; de modo que los órganos sensibles a la insulina reciben abundante energía a través de la absorción de glucosa mediante el transportador GLUT4. El exceso de glucosa es almacenado como glicógeno en el hígado. Por lo tanto, una restauración retardada de la expresión y actividad de LGK durante la reposición de energía después de la inanición resulta fisiológicamente favorable1.
La GK posee sitios de regulación alostérica, es decir, sitios de unión a ligandos distintos a los sustratos y cofactores necesarios para la reacción que cataliza la enzima. Uno de los reguladores alostéricos más importantes de la GK es la fructosa- 2,6-bifosfato (FBP), sintetizada y degradada por la enzima bifuncional 6-fosfofructo-2-quinasa/fructosa-2,6-bisfosfatasa (PFK2/FBPasa)12, la cual es un importante regulador de la glicolisis. Estudios con proteínas recombinantes muestran que PFK2/FBPasa duplica la actividad de la GK sin alterar su afinidad por glucosa13. Igualmente, en ensayos celulares se ha demostrado que la interacción entre GK y PFK2/FBPasa aumenta a concentraciones altas de glucosa, tanto en células β14 como en hepatocitos15.
Estructura
La GK es una enzima monomérica de ~53 kDa. Se compone de un dominio mayor y otro menor, ambos unidos por un interdominio en forma de hendidura, región donde se ubica el sitio de unión a glucosa. Estos dominios pueden formar dos estructuras, conocidas como “cerrada” y “super-abierta”3 (Figura 1). Entre estos dominios se identifica una región denominada “conectora” o “loop I”16, la cual se presenta como una estructura relajada y flexible, en contraste con la estructura rígida que presenta la hexoquinasa I. La GK posee un segundo sitio de regulación alostérica para la unión de activadores, el cual se ubica a 20 Å del sitio de unión a sustrato, y se forma sólo cuando la GK se encuentra en su estado activo3.
Propiedades cinéticas, cambios conformacionales y cooperatividad
A diferencia de los otros miembros de la familia de las hexoquinasas, la cinética de la actividad enzimática de la GK posee un comportamiento de curva sigmoidea, con respecto a la concentración de glucosa. Lo anterior da cuenta del efecto de cooperatividad positiva que presenta la GK con respecto a la glucosa, es decir, a una mayor concentración de glucosa la actividad de la enzima aumenta de manera exponencial y no lineal; a una mayor concentración de glucosa se observa un incremento de la afinidad de la enzima por este sustrato. Se han propuesto distintos modelos para explicar la propiedad alostérica en enzimas monoméricas (proteínas conformadas por una sola cadena polipeptídica), con sólo un sitio de unión, y con cooperatividad homotrópica (el ligando cuya unión tiene un efecto de cooperatividad corresponde también al sustrato de la enzima), como es el caso de la GK3,17,18. Uno de estos modelos propone un mecanismo basado en la existencia de dos especies enzimáticas, una de alta y otra de baja afinidad por el sustrato. La especie enzimática de baja afinidad estaría representada por dos estructuras, correspondientes a una conformación transitoria abierta y otra súper abierta, ambas inactivas. Además, se atribuye el fenómeno de cooperatividad a cambios conformacionales lentos entre estas especies, inducidos por la unión y liberación del sustrato3,17,18.
La cinética sigmoidea es atribuible a los cambios conformacionales que sufre la GK al interactuar con glucosa. Estos pasos son lentos, pues involucran alteraciones estructurales importantes. Los cambios conformacionales dictan la transición desde un estado “súper-abierto” y un estado de transición abierto, correspondientes a las formas inactivas de la GK, a un estado enzimático activo de conformación “cerrada”3,17. Así, la regulación alostérica inherente a la estructura de la enzima permite una respuesta adecuada según la disponibilidad de glucosa, lo que se traduce en un control fino de la glicemia.
Las estructuras secundarias de la enzima protagonistas de estos cambios conformacionales son el loop I y el dominio menor. Un loop es un tipo de estructura secundaria compuesta por regiones no repetitivas. El loop I posiblemente cumple el rol de determinar el rango de movimiento y rotación que se observa durante el ciclo catalítico de la GK16. Además, este loop forma parte de un sitio alostérico para la unión de moléculas activadoras de glucoquinasa (GKAs), las cuales estabilizan la forma activa de la enzima3,16,19. La orientación y organización del dominio menor difieren trascendentalmente en las formas activa e inactiva de la GK. Se observa una rotación de 99° de gran parte del dominio menor en la forma súper-abierta, en comparación con la forma cerrada de la GK. Dicha rotación, en conjunto con la variación en el desorden de ciertos residuos, conllevan a que el sitio de unión de glucosa se vea expuesto al solvente en la forma inactiva súper-abierta3 (Figura 1).
Activadores de GK
Conociendo la importancia de la GK en la regulación de la glicemia, no resulta extraño que una alteración en el gen de esta enzima pueda llevar a un estado hipoglicémico por la sobreactividad de ésta, o por el contrario, que su inactivación conduzca a un estado de hiperglicemia, como es la diabetes MODY 2 o MODY GK. Considerando lo anterior, los activadores de la GK (GKAs) y su mecanismo de acción cobran relevancia debido a su potencial como agentes terapéuticos en las patologías relacionadas con la desregulación en la actividad de la GK19, por lo que es importante comprender la interacción entre la GK y los GKAs. Las estructuras de estos complejos, GK-GKA, han sido descritas mediante cristalografía de rayos X3,4. Otra forma de estudio es el uso de métodos de acoplamiento molecular (técnica computacional de mecánica molecular utilizada para predecir energías y enlaces entre proteínas y sus ligandos), donde se comprobó la capacidad de los programas de docking (modelamiento que simula computacionalmente el reconocimiento entre moléculas) para predecir con exactitud las posiciones de los ligandos en las estructuras cristalizadas y conformaciones de la enzima19.
A grandes rasgos, los GKAs promueven la activación de GK mediante el cambio de sus constantes cinéticas, aumentando la velocidad máxima (Vmax) y disminuyendo S0,5. De este modo cambia el comportamiento sigmoidal de su curva cinética hacia una forma más hiperbólica, similar al de las otras hexoquinasas, debido a que la unión de los GKAs al sitio alostérico de la enzima provoca la estabilización de la forma cerrada o activa de la GK3,19.
Proyecciones
El conocimiento de las características y regulación de la enzima GK significa un avance en la búsqueda del tratamiento en enfermedades relacionadas con la GK, como es la diabetes monogénica MODY 2, que tiene su origen en mutaciones del gen que codifica esta enzima. Además, la caracterización de la enfermedad permite buscar posibles blancos terapéuticos. Se han creado algoritmos predictivos de los efectos de sustituciones no sinónimas de aminoácidos en la GK20, implicando que la bioinformática puede ser parte de los diagnósticos médicos en un futuro cercano. Igualmente se deben explorar soluciones en la biología traduccional y la investigación genómica integrativa, para caracterizar mejor las diabetes monogénicas y evitar los diagnósticos inexactos que actualmente ocurren2,7.
Tabla 1. Clasificación de MODY: Genes cuyas mutaciones ocasionan MODY y su ubicación cromosomal.
Se indican los 14 tipos de MODY que se conocen actualmente, el gen donde se ubica la mutación y el locus o ubicación cromosómica del gen afectado.
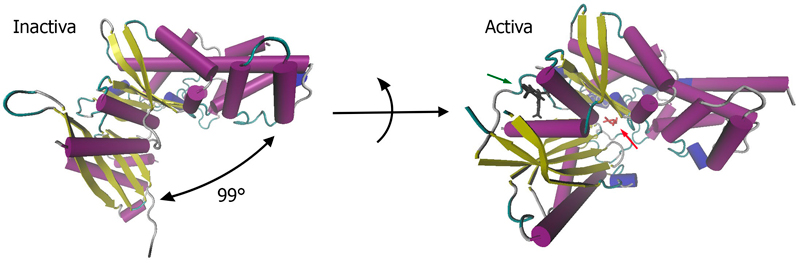
Figura 1: Porcentaje de actividad física moderada a vigorosa (AFMV) y porcentaje en conducta sedentaria (CS) por día según condiciones clínicas y dislipidemias. La media y desvío estándar del porcentaje de actividad física o conducta sedentaria es representado en columnas y fueron comparadas por prueba t o Mann-Whitney para variables con distribución paramétrica y no paramétrica, respectivamente. (A) Porcentaje de AFMV según estado nutricional, Dislipidemia, Insulinoresistencia y Síndrome metabólico. (B) Porcentaje de CS. según estado nutricional, Dislipidemia, Insulinoresistencia y Síndrome metabólico. (C) Porcentaje de AFMV de acuerdo a tipo de alteración del perfil lipídico (D) Porcentaje de CS de acuerdo a tipo de alteración del perfil lipídico. NP: normopeso, SP: sobrepeso, OB: obesidad, DLP: con dislipidemia, noDLP: sin dislipidemia, RI: resistente a la insulina, noRI: no resistente a la insulina, SM: con síndrome metabólico, noSM: sin síndrome metabólico, LDL: lipoproteína de baja densidad, HDL: lipoproteína de alta densidad.
Tabla 2. Mutaciones en la Glucoquinasa y sus posibles efectos.
Se describen las posibles alteraciones a nivel de parámetros cinéticos y de fenotipo, según si las mutaciones de la glucoquinasa provocan una activación o inactivación en su actividad enzimática. Se indican los efectos sobre la constante catalítica (Kcat), parámetro indicativo de la velocidad de reacción, y sobre el punto medio de respuesta cinética (S0,5), el que da cuenta del nivel de saturación de la enzima. Las diferentes mutaciones pueden modificar ambos o solo uno de estos parámetros cinéticos. Debido a que afectan la actividad y/o afinidad de la enzima por la glucosa, derivan usualmente en un fenotipo determinado, tal como se detalla en la tabla.
Referencias
- Lenzen S. A fresh view of glycolysis and glucokinase regulation: History and current status. J Biol Chem. 2014; 289(18): 12189-12194.
- Firdous P, Nissar K, Ali S, Ganai BA, Shabir U, Hassan T, et al. Genetic testing of maturity-onset diabetes of the young current status and future Perspectives. Front Endocrinol (Lausanne). 2018; 9: 253.
- Kamata K, Mitsuya M, Nishimura T, Eiki J, Nagata Y. Structural basis for allosteric regulation of the monomeric allosteric enzyme human glucokinase. Structure. 2004; 12(3): 429-438.
- Liu S, Ammirati MJ, Song X, Knafels JD, Zhang J, Greasley SE, et al. Insights into mechanism of glucokinase activation: observation of multiple distinct protein conformations. J Biol Chem. 2012; 287(17): 13598-13610.
- Osbak KK, Colclough K, Saint-Martin C, Beer NL, Bellanné-Chantelot C, Ellard S, Gloyn AL. Update on mutations in glucokinase (GCK), which cause maturity- onset diabetes of the young, permanent neonatal diabetes, and hyperinsulinemic hypoglycemia. Hum Mutat. 2009; 30(11): 1512-1526.
- Iynedjian P, Möbius G, Seitz HJ, Wollheim CB y Renold AE. Tissue-specific expression of glucokinase: Identification of the gene product in liver and pancreatic islets. Proc Natl Acad Sci USA. 1986; 83(7): 1998-2001.
- Velho G, Blanche H, Vaxillaire M, Bellanné-Chantelot C, Pardini V, et al. Identification of 14 new glucokinase mutations and description of the clinical profile of 42 MODY-2 families. Diabetologia. 1997; 40: 217-224.
- Estica M, Seelenfreund D, Durruty P, Briones G. Hallazgo de una nueva mutación en una familia chilena con diabetes monogénica. Caso clínico. Rev Med Chile. 2018; 146: 929-932.
- Magnuson MA, Shelton KD. An alternate promoter in the glucokinase gene is active in the pancreatic beta cell. J Biol Chem. 1989; 264(27): 15936-15942.
- Iynedjian P. Mammalian glucokinase and its gene. Biochem J. 1993; 293(1): 1-13.
- Tiedge M, Lenzen S. Effects of glucose refeeding and glibenclamide treatment on glucokinase and GLUT2 gene expression in pancreatic B-cells and liver from rats. Biochem J. 1995; 308(Pt 1): 139-144.
- Okar DA, Wu C y Lange AJ. Regulation of the regulatory enzyme, 6-phosphofructo-2- kinase/fructose-2,6-bisphosphatase. Adv Enzyme Regul. 2004; 44: 123-154.
- Baltrusch S, Schmitt H, Brix A, Langer S, Lenzen S. Additive activation of glucokinase by the bifunctional enzyme 6-phosphofructo-2-kinase/ fructose-2,6- bisphosphatase and the chemical activator LY2121260. Biochem Pharmacol. 2012; 83(9): 1300-1306.
- Langer S, Kaminski MT, Lenzen S, Baltrusch S. Endogenous activation of glucokinase by 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase is glucose dependent. Mol Endocrinol 2010; 24(10): 1988-1997.
- Cullen KS, Al-Oanzi ZH, O’Harte FP, Agius L, Arden C. Glucagon induces translocation of glucokinase from the cytoplasm to the nucleus of hepatocytes by transfer between 6-phosphofructo-2-kinase/fructose- 2,6-bisphosphatase-2 and the glucokinase regulatory protein. Biochim Biophys Acta. 2014; 1843(6): 1123-1134.
- Martínez JA, Larion M, Conejo MS, Porter CM, Miller BG. Role of connecting loop I in catalysis and allosteric regulation of human glucokinase. Protein Sci. 2014; 23(7): 915-922.
- Larion M, Miller BG. Homotropic allosteric regulation in monomeric mammalian glucokinase. Arch Biochem Biophys. 2012; 519(2): 103-111.
- Whittington AC, Larion M, Bowler JM, Ramsey KM, Brüschweiler R, Millera BG. Dual allosteric activation mechanisms in monomeric human glucokinase. Proc Natl Acad Sci USA. 2015; 112(37): 11553-11558.
- Ermakova E. Structural insight into the glucokinase-ligands interactions. Molecular docking study. Comput Biol Chem. 2016; 64: 281-296.
- Šimčíková D, Kocková L, Vackářová K, Těšínský M y Heneberg P. Evidencebased tailoring of bioinformatics approaches to optimize methods that predict the effects of nonsynonymous amino acid substitutions in glucokinase. Sci Rep. 2017; 7(1): 94-99.