Efectos de los opioides en endocrinología
Nicole Lustig F1*, María Paz Parodi C2, Pedro Donoso L3, Francisco Muñoz O.4
Opioids effects in Endocrinology
- Médico Endocrinólogo. Departamento de Endocrinología y CETREN UC. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile.
- Interna de medicina. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile.
- Interno de medicina. Facultad de Medicina. Pontificia Universidad Católica de Chile. Santiago, Chile.
- Médico Endocrinólogo. Hospital Regional de Talca y Facultad de Medicina Universidad Católica del Maule. Talca, Chile. Juan de Dios. Santiago, Chile.
*Correspondencia:
Nicole Lustig F. / nmlustig@uc.cl
Diagonal Paraguay 362 4to piso. Santiago Centro, Chile.
Este trabajo no contó con financiamiento.
Recibido: 15-01-2021.
Aceptado: 17-04-2021.
Resumen: El uso de opioides ha aumentado en forma significativa en las últimas décadas, lo que nos ha permitido conocer sus diversos efectos en el sistema endocrino. Estos efectos están sub diagnosticados, en parte porque los síntomas se confunden con los de la misma enfermedad que lleva al uso de opioides y porque no los buscamos de forma dirigida. El hipogonadismo y la insuficiencia suprarrenal son sus efectos más establecidos, sin embargo, otros efectos como los provocados en el tejido óseo requieren de especial atención. La evaluación de los ejes gonadotropo, adrenal y de la salud ósea debe tenerse en consideración en los usuarios crónicos de opioides, particularmente frente a la presencia de síntomas. La suspensión o reducción del uso de opioides es el primer tratamiento del compromiso endocrinológico.
Palabras clave: Enfermedades endocrinas; Hipogonadismo; Insuficiencia suprarrenal; Opioides.
Abstract: The use of opioids has increased significantly in recent decades, which has allowed us to understand its effects on the endocrine system. These effects are underdiagnosed, the symptoms are confused with those of the same disease that leads to the use of opioids and we do not look for them in a targeted way. Hypogonadism and adrenal insufficiency are its most established effects, however, other effects such as the ones caused on bone tissue require special attention. Evaluation of gonadotropic and adrenal axes as well as bone health should be taken into consideration in chronic opioid users, particularly in the presence of symptoms. Stopping or reducing opioid use is the first treatment for endocrine compromise.
Keywords: Adrenal Insufficiency; Endocrine System Diseases; Hypogonadism; Opioids.
Introducción
El término “opioide” se refiere a cualquier sustancia endógena o sintética que produce efectos similares a la morfina y que se bloquea con un antagonista1. Los opiáceos derivan del opio, jugo extraído por una incisión de las cápsulas de la planta Papaver somniferum2. Su uso se conoce desde la antigüedad, citado en papiros egipcios y sumerios3. Los opioides son medicamentos analgésicos de potencia variable que se usan para el dolor agudo y crónico. Proporcionan analgesia intensa, constante y dependiente de la dosis. Estas sustancias también son sedantes, depresores del sistema respiratorio y tienen acción psicoafectiva, efectos que son comunes en todos los opioides1.
En los últimos años, ha existido un aumento en el uso de opioides como tratamiento de dolor crónico no oncológico. Las prescripciones de metadona han aumentado casi 10 veces desde 1997 hasta 20054. Datos del Reino Unido confirman alarmante aumento en uso de opioides entre el 2000 y 2010 en su mayoría en pacientes no oncológicos5. En 2018, se registraron en Estados Unidos 142 muertes al día por sobredosis de opioides6. El registro de hospitalizaciones por trastorno por uso de opioides ha aumentado 3 veces en hombres en Estados Unidos, entre los años 2000 y 20147 y en este mismo período hubo 500.000 muertos por sobredosis de opioides, llegando en 2014 a superar en 1,5 veces las cifras por accidentes automovilísticos8. Los opioides más utilizados son la metadona seguida de la morfina9. Debemos destacar que el uso de opioides involucra un grupo diverso de profesionales de la salud incluyendo médicos de cuidados paliativos, médicos familiares, traumatólogos, anestesiólogos, psiquiatras, fisiatras, entre otros.
Con respecto a la farmacología de los opioides, es importante conocer que su acción está mediada por receptores específicos: mu, kappa y delta, siendo los del receptor mu los más utilizados1,10. Los humanos tenemos nuestro propio sistema de opioides endógeno1.
Los opioides modulan el comportamiento del dolor y la nocicepción10. Entre los péptidos opioides se encuentran los opioides naturales, que son el opio y sus derivados directos como la morfina y la codeína, luego están los semi sintéticos entre los cuales se encuentra la heroína y la oxicodona y por último están los sintéticos que son por ejemplo la metadona y el fentanil11. Por otro lado tenemos los péptidos opioides endógenos: endorfinas, encefalinas, dinorfinas3.
Los efectos adversos más relevantes de los opioides son la sedación, depresión respiratoria, enlentecimiento del tránsito gastrointestinal, efectos antidiuréticos, bradicardia y euforia10,12.
Los opioides tienen efectos en múltiples niveles del sistema endocrino, los cuales dependen del uso agudo o crónico de estos, independiente de la vía de administración (Tabla 1). Todos los ejes endocrinológicos pueden verse afectados, pero sus mecanismos no están del todo claros aún1,13,14. Estos efectos pueden ocasionar alteraciones en la calidad de vida y secuelas en los pacientes de no ser diagnosticados oportunamente.
El objetivo de esta revisión es identificar y discutir los efectos de los opioides en los diferentes ejes del sistema endocrino.
Tabla 1. Efectos en uso agudo y crónico de opioides para los distintos ejes.
Ejes del sistema endocrino y opioides
Eje somatotropo
La evidencia ha mostrado que el eje somatotropo se ve afectado por la administración de opioides. En este efecto estarían involucrados los receptores mu, kappa y delta15. Se han visto posibles diferencias de los efectos según sexo, pero los datos al respecto han sido contradictorios15. Las hormonas GHRH y somatostatina se ven afectadas. Se postula que los niveles de insulina, su sensibilidad y las hormonas contrarreguladoras podrían estar involucradas en la respuesta de estas hormonas a los opioides15.
Existe un efecto agudo estimulador de los opioides sobre este eje que al parecer sería dosis dependiente15. Un estudio sobre administración aguda de morfina en pacientes acromegálicos en comparación con pacientes sanos mostró que en ambos grupos la GH se vio estimulada con respecto a los niveles basales y los aumentos fueron proporcionales a las dosis administradas en ambos grupos15.
Sin embargo, en el uso crónico se ha visto un efecto inhibidor de los opioides en la liberación de somatostatina. Los usuarios crónicos tienen niveles significativamente menores de IGF-1 y el peak de GH es más bajo15. Un estudio mostró que las personas tratadas con opioides intratecales de forma crónica mostraban niveles séricos significativamente menores de IGF-1 que los controles2. En estos pacientes, 15% mostró un peak de GH<3 ug/L durante la terapia intratecal. Esta disminución en el peak de GH también se ha visto en adictos a la heroína2. Pacientes con dolor crónico usuarios de opioides orales no mostraron alteraciones de IGF-1 o diferencias en GH en respuesta a estimulación con glucagón al ser comparados con controles que recibían analgesia no opioide16.
Eje corticotropo
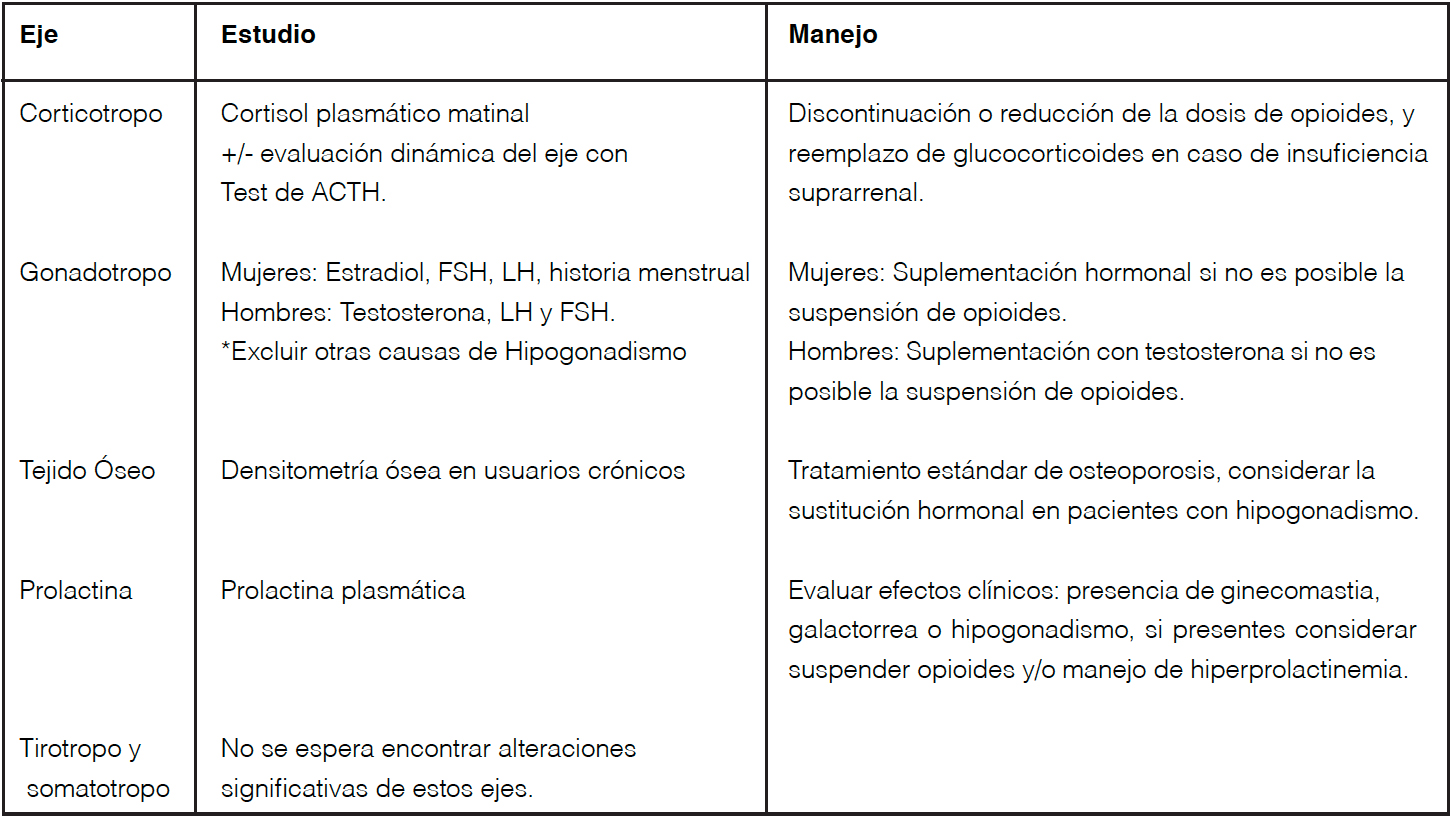
Se estima que hasta un 15% de los pacientes usuarios de opioides pueden presentarse con hipocortisolismo, valor que puede aumentar hasta un 24% si se consideran estudios que usan test de tolerancia a la insulina como método diagnóstico9.
El abuso crónico de opioides altera los sistemas sensibles al estrés. El eje hipotálamo – hipófisis – adrenal (HHA) está bajo el control inhibitorio tónico de los péptidos opioides endógenos. El hipocortisolismo puede ser adaptativo a los opioides. Se evidencia supresión del eje HHA principalmente a nivel hipotálamo hipofisario por inhibición de la hormona liberadora de corticotropina (CRH), disminuyendo la síntesis de hormona adrenocorticotrópica (ACTH) y cortisol9. Sin embargo también se ha visto efecto directo de los opioides sobre la glándula suprarrenal reversible con Naloxona aumentando niveles de cortisol pero no de ACTH17.
La respuesta está modulada por los receptores mu, kappa y delta. Los opioides tienen una acción inhibitoria de este eje a distintos niveles y sus respuestas son distintas en uso agudo y crónico18,19,20. El peak de cortisol luego de terapia intratecal es más bajo en pacientes con uso de opioides a largo plazo. También se ha visto una disminución significativa en el cortisol libre urinario en los usuarios de esta terapia21.
Hay estudios que describen casos graves de insuficiencia suprarrenal inducida por opioides. Ante sospecha de insuficiencia suprarrenal se sugiere medir cortisol matinal en todo paciente usuario crónico de opioides (Tabla 2). No se han encontrado estudios que describan las dosis, vías de administración y protocolos de retiro o suspensión de opioides2,9,13,14. Eje tirotropo Con respecto al eje tirotropo se ha visto que el efecto varía según el tipo de opioide22,23. En voluntarios sanos ante la administración aguda de algunos opioides se observa un aumento de la TSH transitorio tanto en personas sanas como hipotiroideas23, además se evidencia un aumento en la respuesta de TSH a TRH. En cambio, en el uso crónico de opioides tanto en pacientes oncológicos, como adictos a opioides no se ha visto diferencia en los niveles de TSH en relación al grupo control24,25. Existe un estudio que observó un aumento significativo de los niveles de T3 total en pacientes adictos al opio pero no hubo alteración de T4 total, T3 ni T4 libres22. Por lo anterior impresiona que el efecto neto del uso prolongado de opioides no afecta de forma significativa al eje tiroídeo, sin embargo, la evidencia es escasa.
Eje gonadotropo
Los opioides tienen un efecto bien documentado en el eje gonadotropo, un metaanálisis reciente describe la prevalencia de hipogonadismo en los usuarios de opioides en hasta un 69%, más frecuente en hombres9. Tanto los opioides endógenos como exógenos actúan inhibiendo el eje gonadotropo, actuando principalmente en receptores hipotalámicos generando disminución y alteración en la pulsatilidad de GnRH, además afectan sus respuesta hipofisiaria, lo que es concordante en múltiples estudios en animales y humanos26,27. Las alteraciones del eje gonadal se encuentran ampliamente descritas para pacientes no oncológicos, sin embargo, esto también ocurre en usuarios de opioides con diagnóstico de cáncer, sin embargo, en estos casos el origen tiende a ser multifactorial26. Se describe que los opioides conducen a hipogonadismo y este efecto sería precoz desde el inicio del fármaco. Esto tiene impacto en la vida reproductiva, sexual y salud ósea de los usuarios de estos medicamentos27,28 y se ha visto que estos pacientes tienen mayor prevalencia de síntomas depresivos29. La sintomatología es variada y va desde la falta de fuerza, fatiga, disminución de la libido en ambos sexos, disfunción eréctil, infertilidad e irregularidad menstrual.
En mujeres premenopáusicas, que consumen opioides en forma crónica, se ha visto el desarrollo de oligomenorrea y amenorrea hasta en un 50%, existiendo estudios que concuerdan que en mujeres con consumo crónico de opioides por dolor no oncológico se observaría una disminución de estradiol de un 50% y FSH y LH hasta 30% más bajas28.
En mujeres postmenopáusicas se vio una disminución significativa en los niveles de LH y FSH, encontrándose en unos de los estudios niveles 70% más bajos de FSH y LH21,28. En suma los opioides son una causa de hipogonadismo en mujeres provocando alteraciones clínicas en el patrón menstrual, vida sexual, reproductiva y salud ósea21,28.
En los pacientes de sexo masculino se han visto valores bajo el límite normal de testosterona, y LH debido al consumo crónico de opioides21,30. En un metaanálisis de 17 estudios, 10 estudios transversales y 7 cohortes, se encontró disminución significativa de testosterona en hombres, independiente del tipo de opiáceo utilizado30. En otro estudio se vio que los opioides además tienen efecto directo gonadal; disminuyendo la producción de espermios, fluido intersticial testicular y testosterona intratesticular31.
Se sugiere considerar la suplementación de testosterona como parte del manejo de usuarios crónicos de opioides si no es posible la suspensión de estos2,9. En metaanálisis previamente descrito se analizaron 6 estudios con 280 pacientes y se encontraron mejorías en función sexual, deseo sexual y calidad de vida en aquellos paciente con hipogonadismo inducido por opioides que eran suplementados con testosterona9.
Se ha observado que los déficit hormonales serían dosis dependientes32,33 y la mayoría recuperaría su función al disminuir la dosis o suspender el opioide pero no se ha estudiado cuál sería su temporalidad. Se sugiere controlar periódicamente la aparición de síntomas de hipogonadismo, en pacientes con sospecha clínica solicitar estudio hormonal y evaluar la suplementación hormonal en casos necesarios (Tabla 2).
Tejido óseo
El uso crónico de opioides se ha asociado a una disminución en la densidad mineral ósea. Existe una mayor tasa de osteopenia y osteoporosis, la que puede llegar hasta un 50% y 20% de los pacientes respectivamente26, este porcentaje sería menor en mujeres. Además estos pacientes tienen un riesgo aumentado de caídas y fracturas36, por lo que la densitometría ósea tiene un rol de tamizaje en este grupo.
Los mecanismos no han sido totalmente caracterizados, sin embargo, se reconocen algunos factores más relevantes. Se postula como primer mecanismo involucrado la acción directa de los opioides sobre el osteoblasto34,36,37. Se sabe que esta célula tiene receptores de opioides (se han identificado receptores mu, kappa y delta) y estudios experimentales en animales y humanos muestran que los opioides pueden disminuir la densidad mineral ósea al interferir directamente con la acción de los osteoblastos37. El segundo mecanismo es a través de la interferencia con procesos que regulan fisiológicamente el recambio óseo. Entre ellos el hipogonadismo hipogonadotrópico y la disminución de los andrógenos suprarrenales38. Los factores descritos no explican por sí solos la tasa de fracturas observada, estarían también involucrados otros factores como el riesgo aumentado de caídas, contextos de desnutrición, tabaquismo, VIH y otros factores asociados36,37,39. Es relevante destacar el rol de los opioides nivel del sistema nervioso central, produciendo sedación y mareos, este factor aumenta el riesgo de caídas y fracturas previamente mencionado35. Las dosis más altas de opioides de baja potencia duplican el riesgo de lesiones traumáticas en adultos mayores34,39.
Es importante considerar la suspensión de opioides en los pacientes afectados y evaluar la sustitución con testosterona en hombres con hipogonadismo y osteoporosis (Tabla 2).
Prolactina
Los opioides pueden tener un efecto estimulante sobre la secreción de prolactina mediada por receptores mu, kappa y delta2.
La administración aguda de morfina aumenta los niveles de prolactina en hombres sanos y mujeres postmenopáusicas2,13. El uso crónico de opioides ha mostrado efectos variables sobre esta hormona, si bien algunos estudios reportan aumento de prolactina en contexto de opioides en pacientes con dolor crónico, otros estudios en pacientes no oncológicos o usuarios crónicos por dependencia no han visto este aumento2. Se debe tener en consideración un posible aumento de prolactina asociado a dolor.
La hiperprolactinemia puede ocasionar ginecomastia dolorosa, galactorrea e hipogonadismo y estudio más antiguos mostraron que la bromocriptina fue utilizada con éxito como tratamiento de hiperprolactinemia por opioides2,40.
Tabla 2. Aplicación clínica: Estudio y manejo de efectos de los opioides en los distintos ejes.
Conclusiones
Los efectos de los opioides en el sistema endocrino son numerosos, en diferentes niveles e involucran múltiples mecanismos no totalmente dilucidados. Es relevante reconocer los efectos de los opioides particularmente en su uso crónico sobre el eje suprarrenal pudiendo causar insuficiencia suprarrenal, el eje gonadotropo con hipogonadismo masculino y en menor medida femenino y sobre la salud ósea de forma directa e indirecta.
Para el manejo de estas alteraciones se plantea considerar la discontinuación o reducción de la dosis de opioides y el reemplazo hormonal de los ejes afectados.
Se requieren más estudios para establecer claramente la prevalencia de anormalidades hormonales con los diferentes regímenes, dosis y rutas de opioides, asi como la mejor forma de resolver las alteraciones hormonales observadas.
Declaración de intereses: Los autores no declaran conflicto de interés alguno.
Referencias
- Harkouk H, Pares F, Daoudi K, Fletcher D. Farmacología de los opioides. EMC - Anestesia-Reanimación. 2018; 44(2): 1-24.
- Fountas A, Chai S, Kourkouti C, Karavitaki N. Mechanisms of endocrinology: Endocrinology of opioids. European Journal of Endocrinology. 2018; 179(4): R183-R196.
- Trescot A, Datta S, Lee M, Hansen H. Opioid pharmacology. Pain Physician. 2008;11(2): 133-153.
- Manchikanti L. National drug control policy and prescription drug abuse: facts and fallacies. Pain Physician. 2007; 10(3): 399-424.
- Zin CS, Chen LC, Knaggs RD. Changes in trends and pattern of strong opioid prescribing in primary care. European Journal of Pain (London, England) 2014; 18: 1343-1351.
- Overdose Death Rates. National Institute on Drug Abuse. 2020 Mar 1. Available from: https://www.drugabuse.gov/drug-topics/trends-statistics/ overdose-death-rates
- Haight S, Ko J, Tong V, Bohm M, Callaghan W. Opioid Use Disorder Documented at Delivery Hospitalization (United States), 1999-2014. MMWR Morbidity and Mortality Weekly Report. 2018; 67(31): 845-849.
- Rudd R, Aleshire N, Zibbell J, Gladden R. Increases in Drug and Opioid Overdose Deaths (United States), 2000-2014. Morbidity and mortality weekly report (MMWR). 2016; 64(50-51): 1378-1382.
- De Vries F, Bruin M, Zamanipoor Najafabadi AH. Opioids and Their Endocrine Effects: A systematic review and meta-analysis. J Clin Endocrinol Metab. 2020; 105(4): 1020-1029. doi: 10.1210/clinem/dgz022
- Al-Hasani R, Bruchas M. Molecular mechanisms of opioid receptor-dependent signaling and behavior. Anesthesiology. 2011; 115(6): 1363-1381. doi: https:// doi.org/10.1097/ALN.0b013e318238bba6
- Pathan H, Williams J. Basic opioid pharmacology: An update. British journal of pain, 2012; 6(1): 11-16. https://doi.org/10.1177/2049463712438493
- Pasternak GW, Pan YX. Mu opioids and their receptors: evolution of a concept. Pharmacol Rev. 2013; 65(4): 1257-1317. doi: 10.1124/pr.112.007138
- Katz N, Mazer NA. The impact of opioids on the endocrine system. Clin J Pain. 2009; 25(2): 170-175. doi: 10.1097/AJP.0b013e3181850df6. PMID: 19333165.
- Seyfried O, Hester J. Opioids and endocrine dysfunction. Br J Pain. 2012; 6(1): 17-24. doi:10.1177/2049463712438299
- Bhansali A, Velayutham P, Sialy R, Sethi B. Effect of opiates on growth hormone secretion in acromegaly. Horm Metab Res. 2005 Jul; 37(7): 425-7. doi: 10.1055/s-2005-870230. PMID: 16034714.
- Merza Z, Edwards N, Walters SJ, Newell-Price J, Ross RJ. Patients with chronic pain and abnormal pituitary function require investigation. Lancet 2003; 361(9376): 2203-2204. doi: 10.1016/s0140-6736(03)13775-0
- Coiro V, Volpi R, Stella A, Venturi N, Chiodera P. Stimulatory effect of naloxone on plasma cortisol in human: Possible direct stimulatory action at the adrenal cortex. Regulatory Peptides 2011; 166: 1-2.
- Roche DJO, King AC. Sex differences in acute hormonal and subjective response to naltrexone: The impact of menstrual cycle phase, Psychoneuroendocrinology 2015; 52: 59-71. https://doi.org/10.1016/j.psyne uen.2014.10.013.
- Grossman A, Moult PJ, Cunnah D, Besser M. Different opioid mechanisms are involved in the modulation of ACTH and gonadotrophin release in man. Neuroendocrinology 1986; 42: 357-360. doi: 10.1159/000124463
- Uhart M, Chong R, Oswald L, Lin P, Wand G. Gender differences in hypothalamic– pituitary–adrenal (HPA) axis reactivity. Psychoneuroendocrinology. 2006; 31(5): 642-652. doi: https://doi.org/10.1016/j.psyneuen.2006.02.003.
- Abs R, Verhelst J, Maeyaert J, Van Buyten JP, Opsomer F, Adriaensen H, et al. Endocrine consequences of long-term intrathecal administration of opioids. J Clin Endocrinol Metab. 2000 Jun; 85(6): 2215-2222. doi: 10.1210/ jcem.85.6.6615. PMID: 10852454.
- Gozashti MH, Mohammadzadeh E, Divsalar K, Shokoohi M. The effect of opium addiction on thyroid function tests. J Diabetes Metab Disord. 2014; 13(1): 5. doi: 10.1186/2251-6581-13-5
- Devilla L, Pende A, Morgano A, Giusti M, Musso NR, Lotti G. Morphineinduced TSH release in normal and hypothyroid subjects. Neuroendocrinology 1985; 40: 303-308. doi: 10.1159/000124091
- Brambilla F, Nobile P, Zanoboni A, Zanoboni-Muciaccia W, Meroni PL. Effects of chronic heroin addiction on pituitary-thyroid function in man. Journal of Endocrinological Investigation. 1980; 3: 251-255.
- Merdin A, Merdin FA, Gunduz S, Bozcuk H, Coskun HS. Opioid endocrinopathy: A clinical problem in patients with cancer pain. Experimental and Therapeutic Medicine 2016; 11: 1819-1822.
- Fountas A, Van Uum S, Karavitaki N. Opioid-induced endocrinopathies. The Lancet Diabetes & Endocrinology. 2020; 8: 68-80. https://doi.org/10.1016/ S2213-8587(19)30254-2.
- Smith HS, Elliott JA. Opioid-Induced Androgen Deficiency (OPIAD) Pain Physician 2012; 15: ES145-ES156.
- Kim CH, Garcia R, Stover J, Ritchie K, Whealton T, Ata MA. Androgen deficiency in long-term intrathecal opioid administration. Pain Physician. 2014; 17(4): E543-E548.
- Daniell HW. Opioid endocrinopathy in women consuming prescribed sustained-action opioids for control of nonmalignant pain. J Pain. 2008; 9(1): 28-36. doi: 10.1016/j.jpain.2007.08.005. Epub 2007 Nov 1. PMID: 17936076.
- Bawor M, Bami H, Dennis BB, Plater C, Worster A, Varenbut M, et al. Testosterone suppression in opioid users: a systematic review and meta-analysis. Drug Alcohol Depend 2015; 149: 1-9.
- Ragni G, De Lauretis L, Bestetti O, Sghedoni D, Gambaro V. Gonadal function in male heroin and methadone addicts. International Journal of Andrology 1988; 11: 93-100.
- Roberts LJ, Finch PM, Pullan PT, Bhagat CI, Price LM. Sex hormone suppression by intrathecal opioids: a prospective study. Clinical Journal of Pain 2002; 18: 144-148.
- Rubinstein A, Carpenter DM. Elucidating risk factors for androgen deficiency associated with daily opioid use. American Journal of Medicine 2014; 127: 1195-1201.
- Coluzzi F, Pergolizzi J, Raffa RB, Mattia C. The unsolved case of “bone-impairing analgesics”: the endocrine effects of opioids on bone metabolism. Ther Clin Risk Manag. 2015; 11: 515-523. https://doi. org/10.2147/TCRM.S79409
- Vestergaard P, Rejnmark L, Mosekilde L. Fracture risk associated with the use of morphine and opiates. J Intern Med. 2006; 260(1): 76-87. doi: 10.1111/j.1365-2796.2006.01667.x. PMID: 16789982.
- Duarte RV, Raphael JH, Southall JL, Labib MH, Whallett AJ, Ashford RL. Hypogonadism and low bone mineral density in patients on longterm intrathecal opioid delivery therapy. BMJ Open 2013; 3: e002856. doi: 10.1136/bmjopen-2013-002856
- Ensrud KE. Opioid Osteoporosis Reply. Arch Intern Med. 2004; 164(3): 338. doi:10.1001/archinte.164.3.338-b
- Grey A, Rix-Trott K, Horne A, Gamble G, Bolland M, Reid IR. Decreased bone density in men on methadone maintenance therapy. Addiction. 2011; 106(2): 349-354. doi: 10.1111/j.1360-0443.2010.03159.x. Epub 2010 Oct 18. PMID: 20955216.
- Buckeridge D, Huang, A, Hanley J, Kelome A, Reidel K, Verma A, et al. Risk of injury associated with opioid use in older adults. Journal of the American Geriatrics Society 2010; 58(9): 1664-1670. doi:10.1111/j.1532- 5415.2010.03015.x
- Hejazian SH, Dashti MH, Rafati A. The effect of opium on serum LH, FSH and testosterone concentration in addicted men. Iranian Journal of Reproductive Medicine. 2007; 5: 35-38.