Tratamiento quirúrgico del hiperparatiroidismo secundario a insuficiencia renal crónica
Marisol García M.3, Carolina Martínez C.3, Raúl Claure S.2 y Gilberto González V.1
Surgical treatment of secondary hyperparathyroidism in hemodialysis. Report of one case
1Departamento de Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile.
2Departamento de Cirugía. Facultad de Medicina, Pontificia Universidad Católica de Chile.
3Residente Becario de Endocrinología. Escuela de Medicina, Pontificia Universidad Católica de Chile
Correspondencia a: Marisol García M. Departamento de Endocrinología. Facultad de Medicina, P. Universidad Católica de Chile. Lira 85, 5º piso. Santiago, Chile. e-mail: sol.garcia77@gmail.com
Recibido el 22 de agosto, 2008.
Aceptado el 05 de septiembre, 2008.
Hyperparathyroidim secondary to chronic renal failure is a common form of presentation of renal osteodystrophy in patients on chronic hemodialysis. Treatment is based on the maintenance of adequate serum calcium and phosphate levels. However, when hyperparathyroid hyperplasia acquires a nodular form, it becomes refractory to medical treatment and total parathyroidectomy is indicated. We report a 37 years old male on hemodialysis, with a progressive secondary hyperparathyroidism that required the excision of the two superior parathyroid glands at the age of 29. Hyperparathyroidsm was not modified, serum PTH remained excessively high and the patient had a non traumatic femoral fracture. Therefore he was subjected to the excision of the two remaining parathyroid glands. During the postoperative period he had a severe hungry bone syndrome, but was discharged in good conditions, 15 days after the operation.
Introducción
La insuficiencia renal crónica (IRC) es una patología frecuente en Chile; el año 2007 la prevalencia de pacientes en hemodiálisis fue de 2.641 personas. La IRC es producida por variadas enfermedades y su evolución es irreversible y larga. El trastorno del metabolismo del fósforo y del calcio, que le es distintivo y que incluye a las hormonas que lo regulan, conduce a una serie de cambios óseos patológicos que en conjunto constituyen la osteodistrofia renal. Los constituyentes clínicos de la osteodistrofia renal son la osteítis fibrosa quística, la osteomalacia y la osteopatía adinámica, que se conjugan entre sí con distinta predominancia.
La osteitis fibrosa quística se origina en el Hiperparatiroidismo Secundario (HPT 2°) que es uno de los elementos habituales de la IRC. En este contexto de falla renal, cuando la disminución de la filtración glomerular es importante (<40 mL/min) ocurre disminución del calcio iónico sérico, retención de fosfatos y disminución de la hidroxilación renal necesaria para la síntesis de 1,25 (OH)2D3. La hipocalcemia es consecuencia de la disminución de 1,25 (OH)2D3, con baja absorción intestinal de calcio, y del aumento del producto calcio-fósforo que puede generar calcificaciones a nivel de arterias, articulaciones, tejidos blandos y vísceras; a lo anterior se agrega la menor ingesta alimentaria de calcio. Como respuesta a la hiperfosfemia e hipocalcemia aumenta la síntesis y secreción de PTH y dado que el estímulo es crónico se produce hiperplasia de las glándulas paratiroideas1.
Comunicamos el caso de un paciente con HPT 2° a IRC de larga evolución, con complicaciones esqueléticas graves que fue tratado quirúrgicamente. Se discuten los elementos clínicos diagnósticos y terapéuticos más sustantivos.
Caso clínico
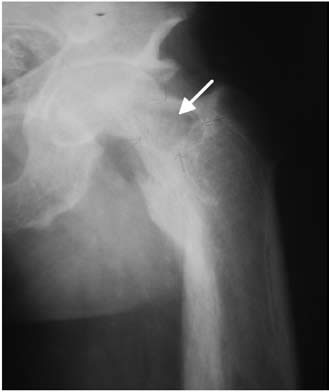
Hombre de 37 años de edad, con insuficiencia renal crónica por enfermedad de Berger, en hemodiálisis trisemanal desde los 20 años de edad. A los 21 años se efectúa trasplante renal de donante vivo. Reingresó a hemodiálisis por rechazo del injerto a los 24 años de edad. Evolucionó con HPT 2° progresivo (PTH: 4414 pg/mL), por lo que en otro centro asistencial se efectuó, a los 29 años, paratiroidectomía de las dos glándulas superiores. A pesar de esto, el HPT 2° no se modificó, presentando a los 34 años de edad fractura no traumática de fémur izquierdo. En mayo de 2008, es visto en nuestro servicio con intenso dolor en la cadera izquierda; el estudio radiológico evidenció un gran tumor pardo en el cuello femoral izquierdo de 5 cm de diámetro (Figura 1). La concentración de PTH era 4658 pg/mL.
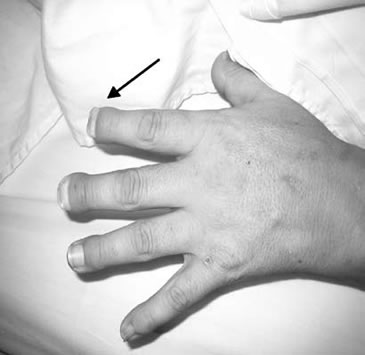
Al examen físico destacaba que la talla corporal era 5 cm menor que la registrada 10 años antes; presión arterial 150/90 mmHg; además, desaparición parcial con acortamiento notorio de las segundas y terceras falanges terminales de ambas manos (Figura 2). La extensión de ambos brazos estaba notoriamente disminuida, generando dolor, sin evidencia de otras deformidades óseas.
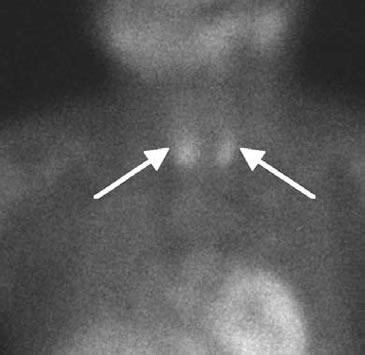
El cintigrama de paratiroides con Tc99m Sesta MIBI mostró hipercaptación de las dos paratiroides inferiores remanentes, tanto en las imágenes precoces como tardías sin evidencia de captación ectópica (Figura 3). Con estos antecedentes se realizó resección quirúrgica de las 2 paratiroides residuales con implante de 7 láminas de una de ellas en el antebrazo izquierdo. A los 10 minutos de completada la resección de las paratiroides la concentración sanguínea de PTH disminuyó en 85% de su valor basal. El estudio histopatológico confirmó que el tejido extraído correspondía a dos paratiroides, la derecha de 2.680 mg y la izquierda de 1.820 mg.
En el postoperatorio inmediato evolucionó con hipocalcemia sintomática (parestesia peri bucales y de extremidades, calcio plasmático corregido: 6,4 mg/dL). Al examen físico se encontraba hemodinámicamente estable, con signos clínicos de hipocalcemia, la cual fue de difícil manejo requiriendo infusión endovenosa continua de gluconato de calcio (2.160 mg Ca elemental/día), aporte de carbonato de calcio oral (2.250 mg/día), calcitriol 3 ug/día y refuerzo de calcio en el liquido dialítico; con ello se asistió a mejoría de la hipocalcemia que se reinstala al décimo día del postoperatorio; es dado de alta en buenas condiciones a los 15 días de realizada la paratiroidectomía residual con calcemia corregida de 7,6 mg/dL.
Discusión
El presente caso representa un ejemplo grave de HPT 2°, persistente a pesar del tratamiento médico y quirúrgico inicial, que incluyó la extirpación de 2 glándulas paratiroideas.
El substrato anatómico del HPT 2° de la insuficiencia renal crónica es la hiperplasia de las glándulas paratiroides. Sin embargo, el estímulo mantenido por tiempo prolongado puede dar origen a multiplicación celular de tipo monoclonal, que se manifiesta por áreas nodulares. La hipocalcemia y el déficit de vitamina 1,25 (OH)2D3, actúan reduciendo el control inhibitorio de la proliferación de las células paratiroideas y también disminuyen los receptores de vitamina D. Por su parte, la hiperfosfemia estimula la proliferación celular y aumenta la resistencia a calcitriol y calcio. Por último, la sensibilidad del sensor de calcio disminuye, elevándose su punto de equilibrio y umbral de respuesta. En la etapa de hiperplasia difusa, las células paratiroideas responden a medidas terapéuticas dirigidas a la corrección de la hiperfosfemia, de la hipocalcemia y del déficit de calcitriol. Por ello, estas indicaciones deben ser hechas precozmente. En la etapa de hiperplasia nodular, la secreción de PTH adquiere autonomía y, por lo tanto, se hace refractaria al tratamiento médico, como ocurrió en nuestro paciente1,3.
Una avance en la progresión del HPT 2° es cuando la hiperplasia en fase nodular autónoma, capaz de mantener normal el nivel de calcio (30% de los pacientes), pasa a una etapa de hipercalcemia, situación conocida como Hiperparatiroidismo Terciario (5 % de los casos)3.
En ambas circunstancias de autonomía, el tratamiento de elección es quirúrgico. Se recomienda efectuar paratiroidectomía total cuando los niveles de PTH son persistentemente >800 pg/mL, junto a hipercalcemia y/o hiperfosfemia refractarias al tratamiento médico. También constituye una indicación de paratiroidectomía la presencia de calcifilaxis asociada o no a PTH >500 pg/mL4.
Para una paratiroidectomía exitosa se recomienda el estudio preoperatorio de imágenes para localizar las 4 paratiroides y, eventualmente, una supernumeraria o ectópica, situación que puede darse hasta en el 14% de los casos5. Las ubicaciones ectópicas más frecuentemente descritas son las áreas retrotiroidea superior y retrotiroidea inferior; más inhabitual es encontrarlas en posición intratiroidea, retroesternal, en el surco traqueo esofágico, retro esofágico o para esofágico6.
Para este fin localizatorio de las paratiroides, la ecografía de alta resolución tiene una sensibilidad de 60% y especificidad de 91%. El cintigrama de paratiroides con Tc-99m Sesta-MIBI tiene una sensibilidad de 60% y especificidad de 87%7 y tiene que ser realizado con imágenes precoces y tardías para aumentar el rendimiento8.
La cirugía recomendada en estas etapas de autonomía es la extirpación completa de las cuatro glándulas más las posibles en posiciones ectópicas, seguida de autoinjerto en el antebrazo libre de fístula arteriovenosa. Es importante que el injerto corresponda a tejido hiperplásico, ya que si se elige una zona nodular el riesgo de recurrencia aumenta de 1% a 25%9. Se espera que el autoinjerto funcione a las 2 a 3 semanas, disminuyendo así la hipocalcemia postoperatoria producida por la confluencia del hipoparatiroidismo y el síndrome de hueso hambriento.
Para certificar intraoperatoriamente el carácter total de la extirpación quirúrgica es necesario medir PTH, que a los 20 minutos de concluida debería haber bajado no menos de 80% de su valor basal. En nuestro paciente esta baja fue de 85%.
En el postoperatorio es importante estar atento a la hipocalcemia, consecuencia del hipoparatiroidismo y del síndrome hueso hambriento que se produce por la brusca suspensión de la acción ósea de PTH, con pasaje de calcio, fósforo y magnesio hacia el hueso. Este síndrome puede alcanzar en algunos pacientes magnitudes muy grandes e incluso ser atentatorio contra la vida. La recuperación dependerá del déficit de calcio acumulado por el hueso, lo que en casos extremos puede representar una ganancia del 30% de la masa esquelética en plazos tan cortos como 45 días10.
Tienen mayor riesgo de desarrollar el síndrome de hueso hambriento grave los pacientes con hiperparatiroidismo en etapa autónoma por IRC, los de sexo masculino, edad avanzada, los con nódulo de tamaño grande, fosfatasas alcalinas elevadas y tiempo de evolución prolongado. Si las fosfatasas alcalinas son > 500 U/L el síndrome puede ser grave. Nuestro paciente cumplió con las condiciones de ser hombre, tener una evolución muy larga y fosfatasas alcalinas de 556 U/L; así fue que presentó hipocalcemia grave prolongada de difícil manejo que postergó su alta por dos semanas. Si existen esos elementos de sospecha de hueso hambriento la medición de calcemia debe ser cada 4 a 6 horas, al menos durante los primeros 2 a 3 días siguientes de la cirugía. Cuando la calcemia es <7,2 mg/dL o inferior al 10% de aquella medida inmediatamente antes de la cirugía se recomienda tratamiento con gluconato de calcio en infusión venosa continua e iniciar precozmente la administración oral de carbonato de calcio y calcitriol11.
El diagnóstico diferencial entre hipoparatiroidismo y síndrome de hueso hambriento del hiperparatiroidismo primario está sustentado por el nivel de fosfemia postoperatoria, que en el caso del hipoparatiroidismo tiende a subir, mientras ella baja en el síndrome de hueso hambriento. Esta clave diferencial es más difusa en los pacientes con IRC, donde la fosfemia es producto en gran medida de la falla renal y de la cercanía de la diálisis depuradora. Aún así, en nuestro paciente es posible ver este hecho diferenciador con disminución conjunta de la calcemia y la fosfemia avalando el síndrome de hueso hambriento.
El caso comunicado muestra las graves complicaciones de la enfermedad ósea de la IRC: fractura, deformación y osteolisis. Señala también el carácter refractario que puede adquirir esta patología si las medidas médicas o quirúrgicas son parciales. Por otro lado, subraya que la paratiroidectomia total requiere un efectivo estudio preoperatorio de imágenes y luego la medición intraoperatoria de PTH que certifique el buen resultado de la extirpación en términos de PTH12. La técnica de autoinjerto de tejido paratiroideo requiere evitar hacerla con tejido de tipo nodular.
Este caso también expone la magnitud que puede alcanzar el síndrome de hueso hambriento y las medidas preventivas y terapéuticas recomendadas.
Tabla 1. Exámenes pre y post paratiroidectomía total.
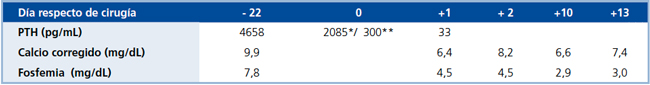 *Basal
*Basal** 10 min post paratiroidectomía
Referencias
- Sakhaee K. y González GB. 1999. Update on renal Osteodystrophy: Pathogenesis and Clinical Management. Am J Med Sci. 317: 251-260.
- Schömig M. y Ritz E. 2000. Management of disturbed calcium metabolism in uraemic patients:2. Indications for parathyroidectomy. Nephrol Dial Transplant 15: 25–29.
- Indridason OS. y Quarles LD., 4ta edición. Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism. Filadelfia, Lippincott Williams & Wilkins, 198-202.
- K/DOQI Clinical Practice Guidelines for Bone Metabolism and Disease in Chronic Kidney Disease .http://www.kidney.org/Professional/kdoqi/ guidelines_bone/index.htm
- Tominaga Y. 2006. Surgical Treatment of Secondary Hyperparathyroidism due to Chronic Kidney Disease Upsala J Med Sci. 111: 277-292.
- Reyes C., Chamorro A., Arteaga E., Rodríguez JA., López JM., Soto J., Fardella C. 1989. Hiperparatiroidismo primario: utilidad de la ecografía de alta resolución en el diagnóstico localizatorio. Rev. Med. Chile;117: 411-415.
- Sukan A., Reyhan M. , Aydin M., Yapar AF., Yasar S., Canpolat T. et al. 2008. Preoperative evaluation of hyperparathyroidism: the role of dual-phase parathyroid scintigraphy and ultrasound imaging. Ann Nucl Med 22:123–131.
- González VG., Orellana BP., López JM., Jiménez MM., Quintana YJ. 2008. Early parathyroid MIBI SPECT imaging in the diagnosis of persistent hyperparathyroidism. Clin Nucl Med. 33: 475-478.
- Tanaka Y., Sato K., Numano M., Uchida K. Falkmer U., Grimelius L., Johansson H., Takagi H. 1992. Recurrent renal hyperparathyroidism and DNA analysis of autografted parathyroid tissue. World J Surg.16:595-602.
- Campusano CM., López JM. 2003. Completa recuperación de grave síndrome de hueso hambriento usando infusión crónica ambulatorio de calcio intravenoso. Caso Clínico. Rev. Med: Chile 131:779-784.
- Cozzolino M., Gallieni M. Corsi C., Bastagli A, Brancaccio D. 2004 . Management of calcium refilling post-parathyroidectomy in end-stage renal disease. J Nephrol 17:3-8.
- Gómez MC, Riquelme P, Sirandoni G, Sapunar J, Princic E, Lee B. 2003. Tumores pardos en múltiples localizaciones: manifestaciones de osteodistrofia renal severa. Rev. Méd. Chile. 131: 1183-1187.