Hiperparatiroidismo normocalcémico asociado a hipovitaminosis D, hipercalciuria renal y nódulo paratiroideo. Caso Clínico
Carolina Martínez C.1, Marisol García M.1 , Francisco Cruz O.2 y José M. López M3.
Normocalcemic hyperparathyroidism secondary to vitamin D deficiency and renal hypercalciuria. Report of one case
1Residente Becario de Endocrinología. Escuela de Medicina, Pontificia Universidad Católica de Chile
2Departamento de Radiología. Facultad de Medicina, Pontificia Universidad Católica de Chile.
3Departamento de Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia a: Carolina Martínez C. Departamento de Endocrinología. Facultad de Medicina, Pontificia Universidad Católica de Chile. Lira 85, 5º piso. Santiago, Chile. e-mail: kalumartinez@gmail.com
Recibido el 22 de agosto, 2008.
Aceptado el 09 de septiembre, 2008.
We report a 77 years old woman with osteoporosis in whom a hyperparathyroidism secondary vitamin D deficiency and renal hypercalciuria was diagnosed. Serum calcium was normal. During the diagnostic work up, a parathyroid nodule was discovered and subjected to a fine needle aspiration biopsy, that showed normal parathyroid cells. The patient was treated with calcitriol, cholecalciferol, hydrochlorothiazide and intravenous zolendronic acid. There was a reduction in urinary calcium and serum PTH levels and improvement of serum 25 hydroxy vitamin D levels. (Keywords: Hyperparathyroidism, vitamin D deficiency, renal hypercalciuria, parathyroid nodule, osteoporosis)
Introducción
El déficit de vitamina D es frecuente en la población general. Se estima que entre el 40% y el 100% de los adultos mayores lo tienen1. En Chile, un 40% de las mujeres posmenopáusicas presentan concentraciones de vitamina D menores a 15 ng/dL. Esta cifra se eleva a 60% si el límite inferior de la normalidad se sitúa en 20 ng/dL; el área entre ambos puntos de corte corresponde a la insuficiencia de vitamina D2,3. La carencia de 25OHD produce, por disminución del sustrato que ella constituye, déficit de 1,25OHD, lo que se expresa como menor absorción intestinal de calcio y disminución de la calcemia, la que estimula la secreción de PTH para compensar desde el hueso el bajo aporte de calcio, constituyendo un hiperparatiroidismo secundario1,2. Si este estímulo se mantiene por largo tiempo se genera hiperplasia paratiroidea. El alza de PTH estimula el recambio óseo con pérdida neta de masa ósea (principalmente hueso cortical), osteopenia u osteoporosis1,4. Igual secuencia de hechos, con calcemia baja pero dentro de límites normales, y aumento de PTH puede suceder si existe una alteración renal que impida selectivamente conservar el calcio, patología conocida como hipercalciuria renal. Comunicamos el caso de una paciente postmenopáusica con osteoporosis grave, e hiperparatiroidismo secundario originado en una doble causal etiopatogénica, déficit de vitamina D e hipercalciuria renal, y en la cual además se debió dilucidar la significación patológica de un nódulo paratiroideo.
Caso Clínico
Mujer de 77 años con osteoporosis en cadera diagnosticada a los 66 años (densitómetro Norland, “score” T de cuello femoral -2,6). Su historia señalaba aplastamiento vertebral dorsal antiguo y a los 71 años fractura de platillo tibial derecho. No tenía antecedentes de litiasis urinaria. Además, ooforectomía a los 36 años con terapia hormonal (TH) por no más de 6 años, y antecedente familiar de madre con fractura de cadera. Presentaba reflujo gastroesofágico importante, que contraindicó el uso de bisfosfonatos. El seguimiento con densitometría, medida en el mismo equipo Norland (Tabla 1) mostró el curso espontáneo y progresivo de la enfermedad durante los primeros 6 años y cuyo mayor impacto fue predominante en hueso compacto. Luego certifica el efecto beneficioso del tratamiento con ácido zoledrónico endovenoso (Figuras 1a y 1b).
Desde el punto de vista bioquímico sus controles en los últimos 10 años mostraban normalidad de la calcemia y fosfemia. A los 76 años es estudiada en nuestro servicio donde se constata hiperparatiroidismo secundario de doble etiología: hipovitaminosis D e hipercalciuria renal. Sus exámenes de sangre, sin mediar tratamiento, eran: Ca: 9,3 mg/dL; P: 3,5 mg/dL; albúmina: 4,4 g/dL; fosfatasas alcalinas: 78 U/L; PTH: 90,9 pg/mL (VN: 15-65 pg/mL); 25OHD: 10 ng/mL (VN: 20-40ng/ml) y creatinina normal. En orina: Ca: 326 mg/24h; creatinina: 0,92g/24h; Ca/Creat: 0,35. La paciente había sido tratada con dosis bajas de levotiroxina (50 ug/d) y controlada con ecografías cervicales debido a hipotiroidismo subclínico (TSH: 7,1 uUI/mL) detectado a los 69 años, con varios nódulos tiroideos en ambos lóbulos de características coloideas y estables. El mayor de ellos estaba en el polo inferior del lóbulo derecho y medía 8 x 6,5 x 4 mm. Repetido el estudio 1 mes después con un ecógrafo de 12,5 MHz se agrega a la descripción anterior, bajo maniobra de compresión zonal, un nódulo ovalado, de 7,8 mm de diámetro mayor, hipoecogénico, homogéneo, de limites difusos, ubicado en posición retrotiroidea del polo inferior derecho, visualizándose al doppler vasos de entrada y salida con abundante circulación intranodal (Figura 2a). Se efectuó punción con aguja fina (PAF) obteniendo buena muestra, pero el procedimiento se complica con sangramiento (Figura 2b). El informe histopatológico certifica células paratiroideas de aspecto normal,lo que se corrobora con la positividad de la tinción inmunohistoquímica con anticuerpos monoclonales para PTH, según técnica S-ABC.
Dos meses después de la PAF se efectúa cintigrama paratiroideo con 99mTc-MIBI, que señala, en las placas tempranas (+10 min), un área de hipercaptación del isótopo a nivel del polo inferior derecho, coincidente con la localización ecográfica del nódulo biopsiado, señal que desaparece en las placas tardías (Figuras 3a y 3b).
El tratamiento estuvo dirigido a las causas que generaban el hiperparatiroidismo secundario, indicándose calcitriol 0,5 mcg/d, calcio 500 mg/d, colecalciferol 800 U/d e hidroclorotiazida 25 mg cada 12 h y además ácido zoledrónico endovenoso en dos ocasiones (4 mg cada 18 meses), con disminución de la pérdida urinaria de calcio en 2 mediciones: 252 y 267 mg/24 hrs. (Ca/creat 0.30 y 0.32, respectivamente), normalización de la PTH (64,8 pg/mL) y mejoría parcial de 25OHD (17,5ng/mL). En consonancia con la mejoría bioquímica, se certificó ganancia de masa ósea a nivel de hueso trabecular (12%) y compacto en ambas caderas (promedio 8%).
Tabla 1. Densidad mineral ósea según evolución en el tiempo.
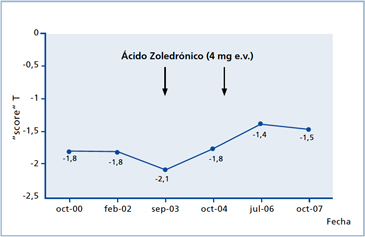
Figura 1a. Densidad ósea en columna lumbar (L2 – L4).
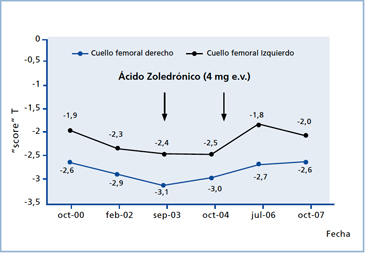
Figura 1b. Densidad ósea en cuello femoral.
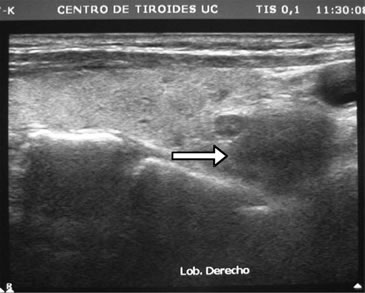
Figura 2a. Ecografía cervical que muestra nódulo paratiroideo derecho (indicado con flecha).
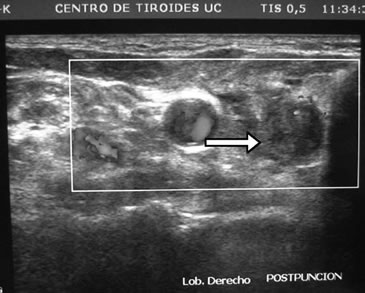
Figura 2a. Ecografía cervical que muestra nódulo paratiroideo derecho (indicado con flecha).
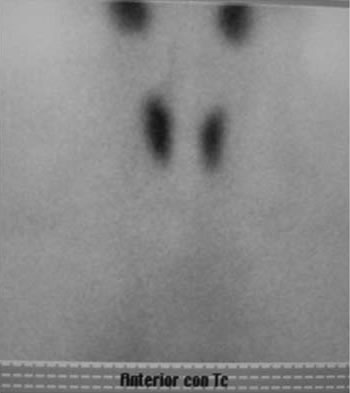
a) Imagen tiroidea con tecnecio.
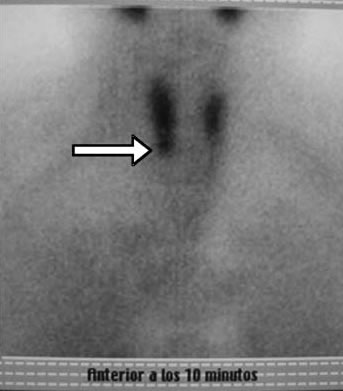
b) Hipercaptación a nivel del polo inferior derecho (flecha).
Discusión
El caso clínico que comunicamos muestra la importancia de la búsqueda de eventuales causas secundarias reversibles en la osteoporosis grave de una persona de edad avanzada. Así, la explicación de una menopausia quirúrgica sucedida a los 36 años sin TH prolongada, en el contexto del antecedente familiar de osteoporosis, pareciera bastar para explicar la secuencia fisiopatológica; sin embargo, el hecho de que el mayor impacto de pérdida ósea estuviese a nivel del hueso cortical, crea un elemento de sospecha de la concomitancia de una u otras causas. El solo control de calcemias y fosfemias es insuficiente para detectar un hiperparatiroidismo secundario. Así ocurrió en esta paciente durante 6 años. La medición de una PTH elevada con calcemia normal certificó la presencia de un estímulo para la secreción de PTH, situación que prolongada en el tiempo explica la repercusión predominante sobre el hueso cortical. Las causas más frecuentes de hiperparatiroidismo secundario son el déficit de vitamina D y la pérdida renal de calcio. Ambas situaciones estaban presentes en nuestro paciente y explican la dificultad de entender una excreción urinaria elevada de calcio en presencia de un déficit marcado de vitamina D, situación en la cual habitualmente la calciuria no excede de 50 mg/d. Este hecho apuntaba a un componente renal agregado. La reversión del hiperparatiroidismo con normalización (aunque en límite alto) de PTH y mejoría de la calciuria con hidroclorotiazida y vitamina D avala la doble condición patológica. La recuperación sólo parcial de los niveles de 25OHD se explica por las dosis relativamente bajas de colecalciferol (800 U/d); sin embargo, el efecto positivo sobre el organismo es superior al esperable por esas dosis y lo cuantificado en sangre (17,5 ng/mL), ya que la paciente recibió calcitriol (1,25OHD) que no es detectable por las mediciones hechas en términos de 25OHD.
Un punto de discusión antes de conocer los resultados terapéuticos lo constituyó la posibilidad de que se tratase de un hiperparatiroidismo primario enmascarado por el déficit de vitamina D; esta situación, caracterizada por PTH elevada y calcemia en límite normal alto se devela en toda su intensidad (ascenso de la calcemia y la calciuria) al aportar vitamina D. Si esto lo agregamos a la presencia de un nódulo paratiroideo, refrendado por el estudio histológico y la capacidad funcional de captar selectivamente 99mTc-MIBI, ese diagnóstico presuntivo parece atractivo. Sin embargo, la respuesta al tratamiento fue la inversa: normalización de PTH, mantención de la normalidad de la calcemia (9.9 mg/dL) y aunque leve, disminución de la calciuria, alejando la posibilidad de que se tratase de un adenoma paratiroideo. El perfil de seguimiento futuro, si objetiva acentuación de la normalización de PTH, mantención de la calcemia y mayor reducción de la calciuria, en condiciones de recuperación plena de los niveles de 25OHD, descartaría que el nódulo paratiroideo identificado representara ya una forma terciaria de un hiperparatiroidismo secundario de muy larga evolución.
El hiperparatiroidismo primario con calcemias normales puede ocurrir cuando la pérdida de calcio esquelético ha sido de tal magnitud que impide que la PTH en exceso demuestre sin restricciones su efecto hipercalcemiante. Las mediciones densitométricas no avalan esta posibilidad, ya que la pérdida de masa ósea en el peor período es importante, pero no al nivel de sustentar esa explicación.
La hiperplasia paratiroidea que normalmente compromete a las cuatro glándulas, no es necesariamente equivalente para cada una de ellas, pudiendo una o dos comandar el crecimiento, como creemos que sucedió en nuestro caso en que la ecografía y la cintigrafía paratiroidea lo demuestran.
Comentario especial merece el estudio ecográfico de las glándulas paratiroideas, en que la técnica no corresponde a la simple extensión de la usada en el diagnóstico de nódulo tiroideo. Para el estudio ecográfico de las glándulas paratiroides es importante ejercer presión con el transductor sobre los tejidos cervicales, para acercar las glándulas paratiroides al foco del transductor, y así poder obtener imágenes de ellas. De lo contrario, la distancia habitual entre transductor y glándula paratiroidea es tal que disminuye notoriamente la sensibilidad de la búsqueda. Otra forma de optimizar la visión ecográfica es agregando un baño de agua, dado que la conducción acústica es óptima en medio líquido; en nuestro caso, el hematoma derivado de la PAF generó espontáneamente un medio acuoso, lográndose una clara visualización de la glándula paratiroides, desapercibida en los exámenes anteriores (Figura 2b).
Respecto al tratamiento, aun corrigiendo las causales que llevaron al hiperparatiroidismo secundario de larga data, queda el sustrato de una osteoporosis grave con al menos dos fracturas detectadas en la evolución. Junto a lo anterior, la imposibilidad de indicar bisfosfonatos orales por su patología gastroesofágica, hizo necesario iniciar tratamiento con ácido zoledrónico, medicamento con el cual ha completado 2 ciclos de 4 mg cada uno, cada 18 meses. Esta medicación unida al aporte de calcio y vitamina D logró la reversión de la caída de la masa ósea con ganancias que en ese periodo ascienden a 11,3% en columna y 8,8% y 7% en el cuello femoral derecho e izquierdo, respectivamente (Figuras 1a y 1b).
El ácido zoledrónico es un potente bisfosfonato de administración endovenosa que, en sus inicios, en dosis de 4mg, fue utilizado para el tratamiento de la hipercalcemia grave producida por neoplasias malignas. Estudios han demostrado que el tratamiento con ácido zoledrónico, en dosis de 5 mg/año, reduce en mujeres postmenopáusicas el riesgo de fractura vertebral y de cadera hasta en 70% y 41%, respectivamente, con relación a placebo5. La FDA aprobó recientemente el uso de este fármaco para el tratamiento de la osteoporosis en pacientes posmenopáusicas, en la dosis endovenosa anual de 5 mg.
Aunque no hay consenso en los niveles séricos óptimos de 25OHD, la mayoría de los expertos define como deficientes las concentraciones plasmáticas menores de 15 ng/mL y como insuficientes a las comprendidas entre 15 y 20 ng/mL. Los determinantes más importantes del nivel de vitamina D son la producción cutánea de colecalciferol, estimulada por la radiación solar, y la ingesta dietética de vitamina D1,2. Entre las distintas causas que influencian la producción cutánea de colecalciferol está la exposición corporal a la luz solar, la edad y la estación del año. En relación con la edad, disminuye la capacidad de la piel para producir vitamina D. González et al.2 comunicaron que existe una correlación negativa entre la edad y los niveles de 25OHD, de modo que por cada año de vida, disminuye en 0,15 ng/mL el nivel sanguíneo de 25OHD. En relación con la estación del año, existe variación significativa de los valores de vitamina D, con aumento de PTH y de la resorción ósea durante el invierno tanto en mujeres pre como posmenopáusicas; contrariamente, durante el verano aumenta hasta en un 50% el nivel de vitamina D, en comparación con el invierno. Además de las complicaciones señaladas, el déficit de vitamina D podría estar asociado a aumento de la mortalidad general6.
El presente caso clínico expone las complejidades del metabolismo fosfocálcico cuando varias causales juegan concomitantemente. Sin embargo, un atento análisis de los elementos diferenciales permite avanzar en el estudio, explicar los hechos y lograr un buen resultado terapéutico7. La evolución a largo plazo permitirá refrendar o impugnar las consideraciones discutidas.
Referencias
- Holick, M.F. 2007. Vitamin D deficiency N Engl J Med 357: 266-281.
- González, G., Alvarado, J.N., Rojas, A., Navarrete, C., Velásquez, C.G. y Arteaga, E. 2007. High prevalence of vitamin D deficiency in Chilean healthy postmenopausal women with normal sun exposure: additional evidence for a worldwide concern. Menopause 14: 455-461.
- Rodríguez J. A., Valdivia G., Trincado P. 2007. Fracturas vertebrales, osteoporosis y vitamina D en la posmenopausia. Estudio en 555 mujeres en Chile. Rev Méd Chile 135: 31-36.
- Lips, P. 2001. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev, 22: 477-501. a) Imagen tiroidea con tecnecio.
- Black, D.M., Delmas, P.D., Eastell, R., Reid, I.R., Boonen, S., Cauley, J.A., Cosman, F., Lakatos, P., Leung, P.C., Man, Z., Mautalen, C., Mesenbrink, P., Hu, H., Caminis, J., Tong, K., Rosario-Jansen, T., Krasnow, J., Hue, T.F., Sellmeyer, D., Eriksen, E.F. & Cummings, S.R. 2007. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med, 356: 1809-1822.
- Melamed, M.L., Michos, E.D., Post, W. & Astor, B. 2008. 25-hydroxyvitamin D levels and the risk of mortality in the general population. Arch Intern Med, 168: 1629-1637.
- Arteaga, E. & González, G. 2003. Errores en el diagnóstico de hiperparatiroidismo primario. Rev Méd Chile, 131: 573-575.