Expresión de marcadores de proliferación celular e invasión tisular en cáncer papilar del tiroides y su asociación con metástasis ganglionares
Pedro Pineda B.1, Verónica Tapia P.2, Cristina Fernández F.3, Patricio Gac E.4, Patricio Cabané T.4 y Alejandra Lanas M.1
Expression of proliferation and invasion markers in papilary thyroid carcinoma with and without lymph node involvement
Hospital Clínico Universidad de Chile
1Sección Endocrinología.
2Laboratorio Endocrinología y Biología de la Reproducción.
3Departamento de Anatomía Patológica.
4Departamento de Cirugía.
Financiamiento: Proyecto de Investigación Sociedad Chilena Endocrinología y Diabetes, 2007
No hubo influencia de SOCHED en ninguna de las etapas del trabajo ni en la confección del manuscrito.
Correspondencia: Dr. Pedro Pineda Bravo Sección Endocrinología Departamento de Medicina Hospital Clínico Universidad de Chile. Santos Dumont 999, Independencia Santiago, Chile FAX: 56-2-7776891 E-mail: ppineda@redclinicauchile.cl
Recibido: 05 Junio de 2009
Aceptado: 14 Agosto de 2009
Background: Several molecules that may have a role in tumor proliferation, differentiation and invasion, have been detected in thyroid carcinoma. Some of these molecules are NIS, c- MET, TIMP1 an ephrinB2. Aim: To detect the presence of these molecules in tissue samples of thyroid carcinoma and relate their expression to the biological behavior of the tumor. Material and Methods: Tissue samples were prospectively obtained from 35 patients operated for a papillary thyroid carcinoma. Twelve patients had regional lymph node involvement. NIS, c-MET, TIMP1 and EphrinB2 were detected by real time polymerase chain reaction (RT-PCR) and immunohistochemistry. Results: The expression of markers by RT-PCR was non significantly higher among tumors with lymph node involvement. Immunohistochemistry showed a significantly lower nuclear expression and a higher cytoplasmatic expression of EphrinB2 in tumors with lymph node involvement. Conclusions: Immunohistochemical expression of EphrinB2 could be useful for the initial staging of papillary thyroid carcinoma.
Keywords: Papilary thyroid carcinoma, molecular markers, ephrin B2, RT-PCR, immunohistochemical expression.
El cáncer papilar de tiroides es la neoplasia endocrina más frecuente con una incidencia en el año 2003 en USA de 10 x 100.000 habitantes1. En Chile, no existen estudios, pero diversos grupos han mostrado un aumento en la casuística de esta enfermedad2, lo que ha sido atribuido a factores aún no bien caracterizados.
El pronóstico de esta neoplasia maligna es en general favorable, con una mortalidad acumulada de 5 a 6 casos por millón de habitantes3. Se han elaborado diversos sistemas de clasificación pronóstica (TNM, AMES, MACIS, etc) que pretenden establecer un pronóstico de sobreviva global y de quedar libre de enfermedad4,5. Sin embargo, existen casos de tumores inicialmente considerados de bajo riesgo, por tamaño o variante histológica, que pueden tener gran agresividad, con invasión de tejidos vecinos y metástasis a distancia. El proceso de invasión y metástasis tiene múltiples etapas que implican la invasión de la cápsula tumoral, el compromiso de tejidos vecinos, la penetración a vasos sanguíneos y linfáticos y su posterior diseminación a distancia. En la literatura se ha descrito un gran número de macromoléculas que intervienen en los procesos de proliferación, invasión y angiogénesis que podrían explicar este comportamiento.
La mayoría de los estudios se han realizado detectando la expresión del mRNA a través de transcripción reversa asociada a reacción en cadena de la polimerasa (RT-PCR) o del uso de técnicas de mayor complejidad y costo (Microarrays y PCR en tiempo real). Además, es posible detectar la expresión de la proteína en las células tumorales por inmunohistoquímica, a través del uso de anticuerpos monoclonales específicos6-8. Sin embargo, los resultados se han expresado en general en forma individual para cada marcador o en forma masiva con múltiples mRNA simultáneamente, especialmente para la discriminación de patología benigna de maligna9. Hasta la fecha no existe una modalidad de detección rutinaria y clínicamente aplicable de estos marcadores, ni estudios de relevancia comparativa entre ellos en relación al pronóstico de la enfermedad.
Dentro de las proteínas estudiadas, NIS (cotransportador de Na/I), regula la entrada de yodo al tirocito, paso fundamental en la síntesis de hormonas tiroideas. Ha sido ampliamente estudiado en tejido tiroideo normal, y se ha observado una disminución de su expresión en tejido tiroideo tumoral10,11.
La sigla c-MET identifica al receptor del factor producido por las células mesenquimáticas que estimula la proliferación y morfogénesis de las células epiteliales (HGF/ SF). Estudios con inmunohistoquímica han mostrado resultados contradictorios ya que su expresión se ha descrito aumentada o también disminuida en el cáncer de tiroides12,13.
TIMP1 es el inhibidor tisular de la metaloproteasa 1, enzima involucrada en la degradación de membranas basales y matriz extracelular, proceso fundamental en la invasión tisular y angiogénesis. TIMP1 se encuentra sobreexpresado en diversas neoplasias, y recientemente ha sido detectado en tejido tiroideo tumoral14,15.
Ephrin B2 es el ligando transmembrana de una proteína con actividad tirosina kinasa (EphR). Recientemente ha sido detectado sobre-expresado en numerosos tumores, entre ellos tiroideos16,17 y estaría involucrado en procesos de angiogénesis.
También se ha descrito la presencia de mutaciones en la isoforma B de la Ser/Thr kinasa RAF (B-RAF) asociadas a la génesis del cáncer papilar de tiroides, con una frecuencia de 30-58%; sin embargo, los datos respecto a la asociación de esta mutación con fenotipos tumorales de mayor agresividad son contradictorios18,19, y las técnicas principales de detección son de complejidad significativa (SSCP o secuenciación).
Nuestra hipótesis es que el nivel de expresión de un panel de marcadores moleculares detectados en el cáncer papilar de tiroides (NIS, c-MET, TIMP1 y EphrinB2) puede tener una asociación significativa con criterios clásicamente descritos para agresividad histológica, y así poder utilizarlos con fines pronósticos en el manejo postoperatorio de estos pacientes.
Estos marcadores fueron elegidos por su relación con los mecanismos de regulación de la función del tirocito y de su proliferación tumoral, además de existir la posibilidad de estudiarlos a través de RT-PCR e inmunohistoquímica en forma simultánea.
El objetivo general del estudio fue detectar la presencia de marcadores previamente asociados al cáncer papilar de tiroides y correlacionar su nivel de expresión con criterios de agresividad histológica, en un grupo de pacientes portadores de esta enfermedad.
Los objetivos específicos fueron determinar a través de RT-PCR e inmunohistoquímica la expresión del mRNA y proteínas de NIS, c-MET, TIMP1 y EphrinB2 en muestras de cáncer papilar de tiroides con metástasis ganglionares y comparar su expresión con muestras de carcinoma papilar de tiroides de pacientes sin evidencia de metástasis.
Sujetos y Métodos
Los pacientes fueron sometidos a la cirugía de tiroides indicada por sus médicos tratantes, e informados de las características del estudio previamente a la operación, firmando una carta de consentimiento informado aprobada por el Comité de Ética de nuestro centro. La pieza operatoria fue destinada al análisis anátomo e histopatológico de rutina y parte de ella se almacenó a -80 oC en el Banco de Tumores del Hospital Clínico de la Universidad de Chile hasta realizar el estudio molecular e inmunohistoquímico.
RT-PCR
La extracción de RNA se realizó con Trizol (Invitrogen Corp, EE UU). El RNA de las muestras seleccionadas para estudio fue sometido a transcripción reversa en un volumen final de 20 mL utilizando random-hexámeros como partidores. Posteriormente, 2 mL del cDNA obtenido se utilizaron para llevar a cabo una reacción de PCR con partidores específicos para los marcadores a estudiar. Se incluyó a 18S como control de amplificación.
Las secuencias de partidores utilizados fueron:
| NIS | TCTCTCAGTCAACGCCTCT ATCCAGGATGGCCACTTCTT |
| c-MET | ACAGTGGCATGTCAACATCGCT GCTCGGTAGTCTACAGATTC |
| TIMP1 | GGGGCTTCACCAAGACCTACAC AAGAAAGATGGGAGTGGGAACA |
| EphrinB2 | GCAAGTTCTGCTGGATCAAC AGGATGTTGTTCCCCGAATG |
| 18S | GTAACCCGTTGAACCCCATT CCATCCAATCGGTAGTAGCG |
La intensidad de la expresión de mRNA de los distintos marcadores se comparó con la del control de amplificación 18S, estableciendo una razón de expresión: marcador/18S para cada caso. Dicha razón fue cuantificada utilizando el programa computacional UN-SCAN IT gel (Silk Scientific Inc, EUA).
Inmunohistoquímica
Se utilizaron anticuerpos monoclonales específicos para NIS, c-MET, TIMP1 y EphrinB2 (Santa Cruz Biotechnology, EE UU) en cortes histológicos de los casos estudiados. La presencia e intensidad de la expresión de dichas proteínas fue analizada en forma ciega por el mismo observador, estableciendo un puntaje objetivo en unidades arbitrarias de intensidad de tinción (U.A.) para el análisis de cada caso, similar al realizado en otros estudios20.
| 1 punto | negativo | Sin tinción |
| 2 puntos | ± focal | Tinción mínima focal |
| 3 puntos | ± | Tinción mínima difusa (< 10% células) |
| 4 puntos | + focal | Tinción leve focal |
| 5 puntos | + | Tinción leve difusa (10-25% células) |
| 6 puntos | ++ | Tinción moderada (25-50% células) |
| 7 puntos | +++ | Tinción intensa (> 50% células) |
Una vez obtenida la intensidad de expresión por RTPCR e inmunohistoquímica para cada marcador, se comparó ésta entre los casos con y sin metástasis ganglionares utilizando test de t de 2 colas.
Resultados
Pacientes
Un total de 35 pacientes fue sometido a tiroidectomía total por patología nodular de la glándula. Se efectuó disección ganglionar en los casos en que el estudio preoperatorio o los hallazgos intraoperatorios demostraron adenopatías. Ninguno de los casos catalogados como sin metástasis tenía adenopatías en la ecografía cervical preoperatoria, ni tampoco ha requerido reexploración cervical durante el seguimiento.
Análisis histológico
En el período del estudio se obtuvieron 35 piezas quirúrgicas de cáncer papilar de tiroides mayores de 1 cm, 12 con metástasis y 23 sin metástasis ganglionares, identificadas con técnicas de análisis histológico habitual (hematoxilina- eosina).
El tamaño promedio de los tumores con metástasis fue 2,3 cm (dispersión 1 a 4,5 cm), distribuyéndose, según la clasificación TNM, en seis casos T1 N1 M0, dos T2 N1 M0, dos T3 N1 M0 y dos T4 N1 M0.
El tamaño promedio de los tumores sin metástasis fue 1,9 cm (dispersión 1 a 3,5 cm). Correspondieron a 14 casos T1 N0 M0 y nueve T2 N0 M0. En 12 de las piezas quirúrgicas catalogadas como sin metástasis se obtuvieron ganglios cervicales, pero todos ellos fueron normotípicos.
RT-PCR
Se logró obtener una adecuada cantidad de cDNA en 25 muestras (10 con metástasis y 15 sin metástasis) para realizar la PCR con los partidores específicos para cada marcador (Figura 1).
Como puede observarse en la Figura 2, la expresión normalizada de todos los marcadores fue mayor en los tumores que presentaban metástasis ganglionares, comparados con los tumores sin metástasis; sin embargo, dicha expresión no alcanzó a ser diferente estadísticamente.
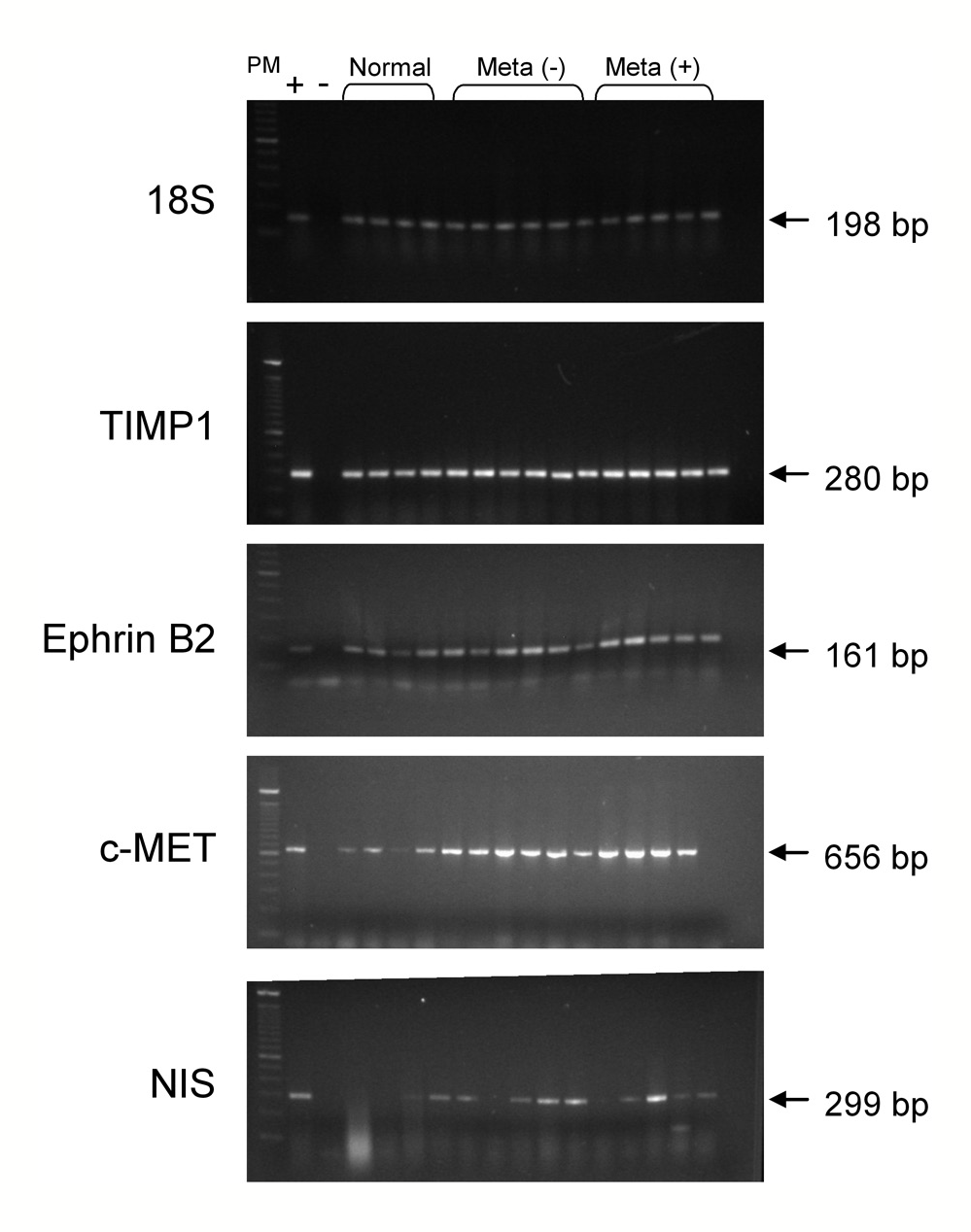
+: Control de amplificación positivo.
-: Control de amplificación negativo.
Normal: Tejido tiroideo normal.
Meta (-): Cáncer papilar sin metástasis ganglionar.
Meta (+) Cáncer papilar con metástasis ganglionar.
bp: Pares de bases.
Figura 1. Gel agarosa 1% con bandas de amplificación obtenidas por PCR de los marcadores estudiados. PM: Marcador de peso molecular.
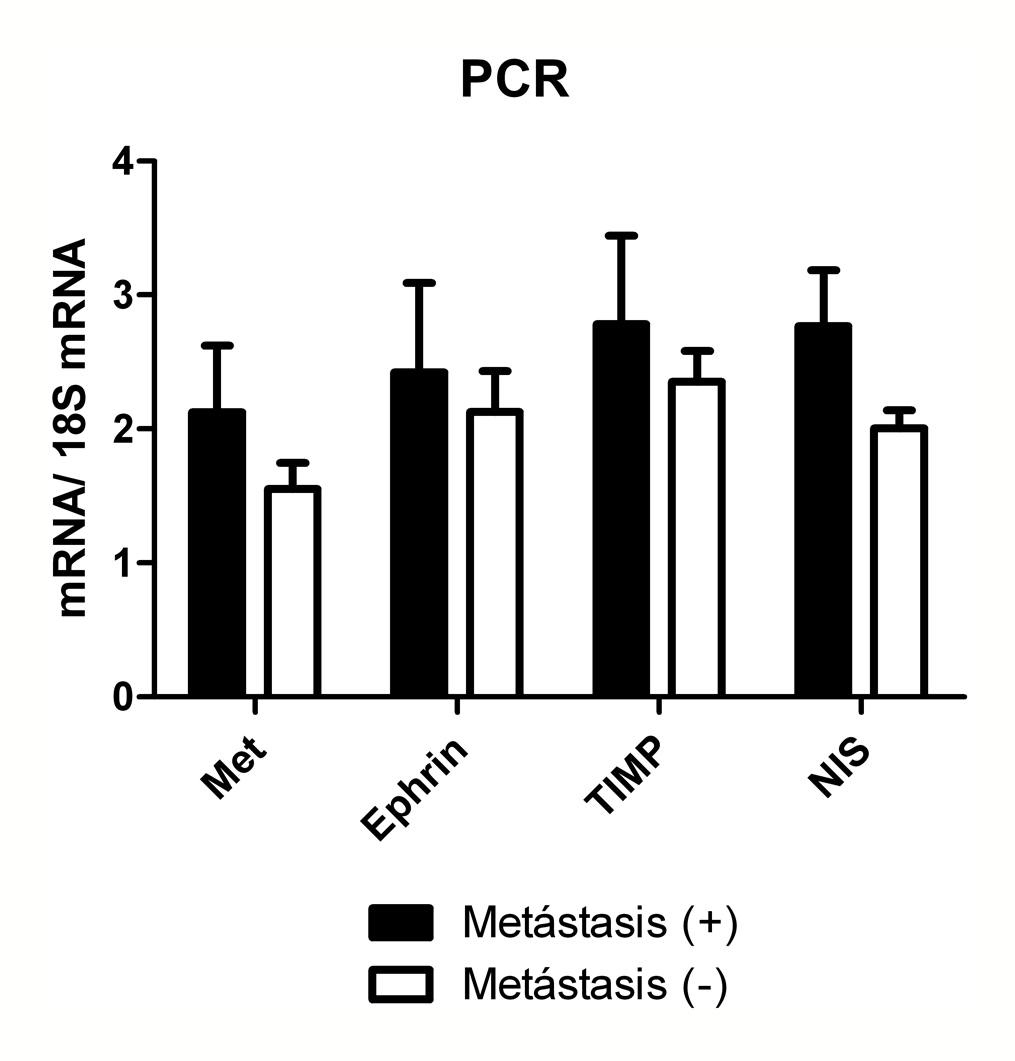
Figura 2. Expresión de mRNA de los marcadores estudiados, normalizados con la expresión del marcador constitutivo 18S (marcador/18S).
Inmunohistoquímica
La intensidad de expresión proteica de los distintos marcadores en los cortes histológicos estudiados fue variable, detectándose algunas diferencias importantes en la expresión de ellos en el núcleo y en el citoplasma de las células tumorales (Figura 3).
En el caso de la tinción nuclear, no hubo diferencias en la expresión de NIS, cMet y TIMP; sin embargo, EphrinB2 se expresó con significativa menor intensidad (p < 0,05) en el grupo de tumores sin metástasis ganglionares (Figura 4).
Al analizar los resultados de expresión en citoplasma, se observó una leve menor expresión de NIS y TIMP, sin alcanzar significación estadística (p = 0,13 y 0,15, respectivamente) en el grupo de tumores con metástasis, pero se objetivó una mayor expresión (p < 0,05) de ephrinB2 en este grupo (Figura 5).
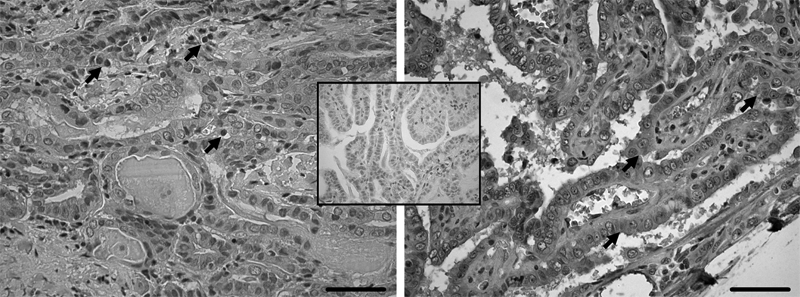 Figura 3. Corte histológico con aumento 40x de pieza operatoria de cáncer papilar de tiroides, con tinción inmunohistoquímica para EphrinB2 de predominio nuclear (flechas en foto izquierda) y citoplasmático (flechas en foto derecha). El recuadro central muestra el control negativo. Barras = 50 mm.
Figura 3. Corte histológico con aumento 40x de pieza operatoria de cáncer papilar de tiroides, con tinción inmunohistoquímica para EphrinB2 de predominio nuclear (flechas en foto izquierda) y citoplasmático (flechas en foto derecha). El recuadro central muestra el control negativo. Barras = 50 mm.
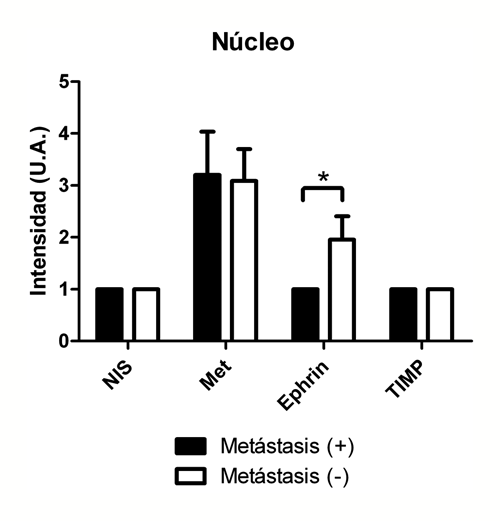
Figura 4. Expresión proteica evaluada por inmunohistoquímica en el núcleo celular de los marcadores estudiados (U.A: Unidades arbitrarias de intensidad de tinción). *p < 0,05.
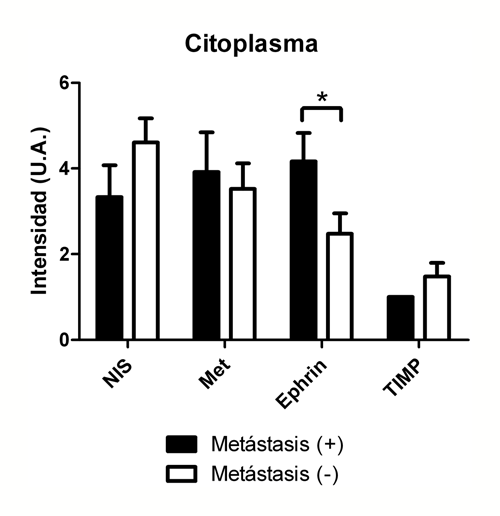
Figura 5. Expresión proteica evaluada por inmunohistoquímica en el citoplasma celular de los marcadores estudiados. (UA: Unidades arbitrarias de intensidad de tinción). *p < 0,05.
Discusión
El estudio de marcadores pronósticos en cáncer tiroideo se ha limitado a detectar criterios de malignidad en el estudio pre y postoperatorio de los nódulos tiroideos. Sin embargo, la detección precoz de factores que influyan en el comportamiento biológico del cáncer papilar de tiroides parece de primera importancia para establecer categorías de agresividad independientes de los factores de riesgo tradicionales.
Este trabajo permitió, por primera vez en Chile, realizar estudios de RT-PCR en muestras de tiroides preservadas en frío en un banco de tumores, obteniendo cantidades de cDNA adecuadas para su análisis en la mayoría de los casos. La mayor expresión comparativa de los marcadores estudiados por RT-PCR en las muestras provenientes de tumores con metástasis ganglionares, si bien no alcanzó significancia estadística, fue un hallazgo constante para todos los marcadores analizados, lo cual se relaciona con los mecanismos de regulación que estas macromoléculas pueden ejercer sobre distintas etapas de la proliferación tumoral. Entre ellas, destaca la mayor expresión de NIS, hallazgo que en otros trabajos no se ha relacionado necesariamente con mayor agresividad tumoral21.
Es probable que un número mayor de casos estudiados se pudiera mostrar diferencias significativas con esta técnica.
En los 4 marcadores estudiados no se observaron diferencias significativas en la intensidad de la expresión inmunohistoquímica de las proteínas analizadas (NIS, cMET, TIMP1 y ephrinB2); sin embargo, hay una diferencia significativa en la localización intracelular del marcador ephrinB2, la que en los tumores con metástasis ganglionares, y por tanto con mayor agresividad, se localiza en mayor cuantía en el citoplasma y en menor cantidad en el núcleo celular. Este fenómeno podría traducir diferencias en los mecanismos postransduccionales de control de la proliferación que regularían la migración de esta proteína a la membrana celular para interactuar con su receptor de membrana (EphR) y potenciar su actividad tirosin-kinasa.
Las técnicas de inmunohistoquímica utilizadas en este estudio son fácilmente reproducibles en la práctica clínica habitual, por lo que la detección de ephrinB2 con predominancia en el citoplasma de células tumorales en muestras histológicas de cáncer papilar de tiroides, podría utilizarse como método complementario a los clásicos de etapificación en el estudio de esta neoplasia.
Referencias
- U.S. Department of Health and Human Services. United States Cancer Statistics 2003 incidence and mortality. Diciembre 2006 www.cancer.gov.
- Mosso L, Cardona B, Castillo C, Campusano C, Solar A, et al. 2007. Cambios en la presentación del cáncer papilar de tiroides en un período de 15 años en el Hospital Clínico de la Pontificia Universidad Católica de Chile. Libro Resúmenes XII Congreso de la Sociedad Latinoamericana de Tiroides Santiago, Abril 2007.
- Hundahl SA, Fleming ID, Fremgen AM, Menck HR. 1998. A National Cancer Data Base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995. Cancer 83: 2638-2634.
- Shaha AR. 2007. TNM Classification of Thyroid Carcinoma. World J Surgery 31 (5): 879-887.
- Wada N, Nakayama H, Suganuma N, Masudo Y, Rino Y, et al. 2007. Prognostic value of the sixth edition AJCC/UICC. TNM classification for differentiated thyroid carcinoma with extrathyroid extension. J Clin Endocrinol Metab 92(1); 215-218.
- Kebebew E, Peng M, Reiff E, McMillan A. 2006. Diagnostic and extent of disease multigene assay for malignant thyroid neoplasms. Cancer 106 (12): 2592-2597.
- Hamada A, Mankovskaya S, Saenko V, Rogounovitch T, Mine M, et al. 2005. Diagnostic usefulness of PCR profiling of the differentially expressed marker genes in thyroid papillary carcinomas. Cancer Letter 224(2): 289-301.
- Faggiano A, Caillou B, Lacroix L, Talbot M, Filetti S, Bidart JM, et al. 2007. Functional characterization of human thyroid tissue with immunohistochemistry. Thyroid 17 (3): 203-211.
- Griffith OL, Melck A, Jones SJ, Wiseman SM. 2006. Metaanalysis and meta-review of thyroid cancer gene expression profiling studies identifies important diagnostic biomarkers. J Clin Oncol 24: 5043-5051.
- Arturi F, Russo D, Giuffrida D, Sclumberger M, Filetti S. 2000. Sodium-iodide symporter (NIS) gene expression in lymphnode metastases of papillary thyroid carcinomas. Eur J Endocrinol 143 (5): 623-637.
- Patel A, Jhiang S, Dogra S, Terrell R, Powers PA, Fenton C, et al. 2002. Differentiated thyroid carcinoma that express sodiumiodide symporter have a lower risk of recurrence for children and adolescents. Pediatr Res 52 (5): 737-744.
- Belfiore A, Gangemi P, Constantino A, Russo G, Santonocimo GM, et al. 1997. Negative/Low Expression of the Met/Hepatocyte Growth Factor Receptor Identifies Papillary Thyroid Carcinomas with High Risk of Distant Metastases. J Clin Endocrinol Metab 82 (7): 2322-2328.
- Ramírez R, Hsu D, Patel A, Fenton C, Dinauer C, et al. 2000. Over-expression of hepatocyte growth factor/scatter factor (HGF/ SF) and the HGF/SF receptor (cMET) are associated with a high risk of metastasis and recurrence for children and young adults with papillary thyroid carcinoma. Clin Endocrinol 53: 635-644.
- Shil Y, Parharl RS, Zoul M, Hammami MM, Akhtar M, et al. 1999. Tissue inhibitor of metalloproteinases-1 (TIMP-1) mRNA is elevated in advanced stages of thyroid carcinoma. Br J Cancer 79: 1234-1239.
- Wasenius VM, Hemmer S, Kettunen E, Knuutila S, Franssila K, et al. 2003. Hepatocyte Growth Factor Receptor, Matrix Metalloproteinase-11, Tissue Inhibitor of Metalloproteinase-1, and Fibronectin Are Up-Regulated in Papillary Thyroid Carcinoma: A cDNA and Tissue Microarray Study. Clin Cancer Res; 9: 68-75.
- . Kebebew E, Peng M, Reiff E, Duh QY,Clark OH, et al. 2005. Diagnostic and prognostic value of angiogenesis-modulating genes in malignant thyroid neoplasms. Surgery 138 (6): 1102-1109.
- . Liu W, Ahmad SA, Jung YD, Reinmuth N, Fan F, et al. 2002. Coexpression of Ephrin-Bs and their Receptors in Colon Carcinoma. Cance; 94; 934-939.
- Kim TY, Kim WB, Rhee YS, Song JY, Kim JM, et al. 2006. The BRAF mutation is useful for prediction of clinical recurrence in low-risk patients with conventional papillary thyroid carcinoma. Clin Endocrinol 65 (3): 364-368.
- Fugazzola L, Puxeddu E, Avenia N, Romei C, Cirello V, et al. 2006. Correlation between B-RAFV600E mutation and clinicopathologic parameters in papillary thyroid carcinoma: data from a multicentric Italian study and review of the literature. Endocr Relat Cancer 13(2): 455-464.
- Flanagan JN, Pineda P, Knapp PE, Pena S, De Las Morenas A, Lee SL, et al. 2008. Expression of cytokeratin 19 in the diagnosis of thyroid papillary carcinoma by real-time quantitative polymerase chain reaction. Endocr Pract 14 (2): 168-174.
- Tosiek M, Pomorski L, Balcerczak E, Mirowski M, Csyz W. 2005. Estimation of sodium/iodide symporter gene expressión (NIS) in thyroid cancers by RT-PCR technique (preliminary study). Endokrynol Pol 56 (1): 25-29.