Hígado graso no alcohólico: una entidad relevante para el endocrinólogo
Carolina Ramírez C.1, Juan Pablo Arab V.1, Arnoldo Riquelme P.1 y Marco Arrese J.1
The relevance of non-alcoholic fatty liver for endocrinologists
1Departamento de Gastroenterología. Escuela de Medicina, Pontificia Universidad Católica de Chile.
Correspondencia a: Dr. Marco Arrese J. Departamento de Gastroenterología Facultad de Medicina Pontificia Universidad Católica de Chile. Marcoleta #367 833-0024 Santiago-Chile Fono/Fax: 56-2-6397780
E-mail: marrese@med.puc.cl
Recibido: 25 Agosto de 2009
Aceptado: 27 Agosto de 2009
Non-alcoholic fatty liver disease (NAFLD) is emerging as a leading cause of chronic liver disease worldwide. Although its pathophysiology is not completely understood, insulin resistance has been identified as a central event involved in both pathogenesis and progression of the disease. Due to its asymptomatic nature and its benign evolution in the majority of cases, awareness about the possibility of progression of NAFLD among non-hepatologists is limited. Different studies indicate that non-alcoholic steatohepatitis, the inflammatory form of NAFLD, can progress to more advanced stages of chronic liver disease including cirrhosis in up to 25% of cases in a decade. Furthermore, recent data show that NAFLD is an important risk factor for developing cardiovascular events and diabetes. This article briefly reviews current concepts on NAFLD. As endocrinologists frequently face patients with insulin resistance, the identification of patients with NAFLD and the assessment of prognosis acquires significant clinical relevance.
Keywords: Hígado graso, esteatohepatitis no alchólica, insulino resistencia, endocrinología.
El hígado graso no alcohólico (HGNA) es actualmente considerada la enfermedad hepática más común en países occidentales1,2. La caracterización del HGNA como una entidad nosológica es relativamente reciente y el estudio sistemático de su epidemiología, patogenia, clínica e historia natural ha determinado un aumento explosivo de publicaciones en el campo de la hepatología en las últimas décadas. El HGNA es hoy considerado una causa relevante de cirrosis y en consecuencia, su detección, caracterización y manejo es de alta relevancia. Aún cuando el HGNA se pesquisa con elevada frecuencia en pacientes obesos y diabéticos y a que hoy se le considera como la manifestación hepática del síndrome metabólico, la valoración de su trascendencia por parte de médicos no especialistas es limitada3. El presente artículo revisa en forma sucinta los conceptos actuales sobre el HGNA para la audiencia endocrinológica que frecuentemente enfrenta pacientes con esta condición.
HGNA: Concepto, epidemiología e historia natural
El HGNA se define como una entidad clínico-patológica caracterizada por la ocurrencia de cambios histológicos hepáticos similares a los observados en sujetos con consumo crónico de alcohol, pero detectados en individuos que no ingieren etanol en forma significativa (menos de 20-30 g de alcohol al día)4-6. El HGNA comprende un espectro patológico amplio (Figura 1) que incluye, como característica básica, la presencia de esteatosis en al menos el 5% de los hepatocitos, asociada o no a la presencia de cambios inflamatorios y fibrosis pericelular y/o sinusoidal en las regiones centrolobulillares del acino hepático7,8. La presencia de elementos histológicos de inflamación o fibrosis define la llamada esteatohepatitis no alcohólica (EHNA), considerada una forma más agresiva de la enfermedad y cuya trascendencia radica en su potencial progresión a cirrosis hepática9,10.
La prevalencia del HGNA ha sido estimada en hasta un 30% de la población general11,12. Ello está estrechamente relacionado con la epidemia de la obesidad. En Chile, un estudio con ultrasonografía abdominal comunicó una prevalencia de 22% de la población estudiada13. Estimaciones basadas en estudios de series de casos indican que un tercio de los pacientes con HGNA pueden ser portadores de EHNA y estar potencialmente en riesgo de desarrollar formas más avanzadas de enfermedad hepática14.
Los principales factores de riesgos asociados a la presencia de HGNA son el sobrepeso corporal y la obesidad, especialmente el fenotipo de obesidad central, la diabetes mellitus tipo 2 (DM2) y los componentes del síndrome metabólico (SMET), en particular la insulino resistencia (IR)5,15. Estos factores están fuertemente asociados al HGNA tanto en población occidental como en no occidental15,16. Datos recientes indican que existe una significativa agregación familiar del HGNA posiblemente asociada a factores genéticos y ambientales vinculados estos últimos al estilo de vida sedentario17.
Los datos sobre la historia natural son limitados aunque se ha estimado que un 20-25% de los pacientes con EHNA pueden desarrollar cirrosis en una década10. En consecuencia, varios autores sugieren que esta condición es una de las principales etiologías de la cirrosis en la actualidad18,19. Con relación a ello, un porcentaje aún desconocido desarrollará un carcinoma hepatocelular (Figura 1)5,6. El desarrollo de cirrosis y cáncer hepático posiblemente explica los hallazgos de estudios poblacionales que indican que el HGNA se asocia a aumento de la mortalidad por causa hepática20.
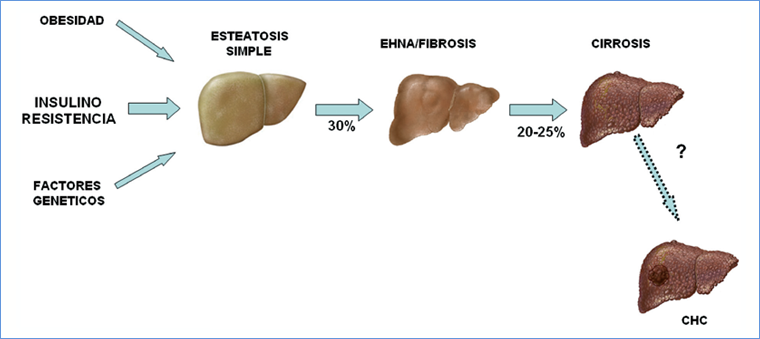
Figura 1. Espectro del hígado graso no alcohólico (HGNA). La obesidad, factores genéticos y sobre todo la resistencia a la insulina contribuyen al depósito anormal de grasa en el hígado. Alrededor del 30% de los pacientes con HGNA son portadores de esteatohepatitis no alcohólica (EHNA), que se caracteriza por la presencia de diversos grados de inflamación y la fibrosis y que puede progresar a cirrosis en el 20- 25% de los pacientes después de 20 años. Un porcentaje desconocido de los pacientes puede desarrollar carcinoma hepatocelular (CHC).
Patogenia del HGNA: De la esteatosis a la cirrosis
El sello distintivo de HGNA es la acumulación de triglicéridos (TG) en los hepatocitos. La patogenia exacta de este fenómeno es compleja y multifactorial y no se conoce con precisión21. Los mecanismos por los cuales se produce un depósito excesivo de grasa en el hígado no están completamente comprendidos, en parte por las limitaciones metodológicas y éticas para realizar estudios de causalidad en humanos. El conocimiento actual deriva de estudios en modelos animales de validez limitada y de observaciones clínicas con limitaciones metodológicas. Sin embargo, es ampliamente aceptado que la IR tiene un papel central en el desarrollo y la progresión de la enfermedad. Los pacientes con HGNA exhiben IR a nivel de músculo, tejido adiposo y del hígado22. En condiciones normales, la insulina suprime la producción hepática de glucosa, la que se ve alterada en paciente con HGNA, revelando la presencia de IR a nivel hepático. Además, estos pacientes muestran una reducción de hasta un 50% en la utilización de glucosa y presentan un defecto en la supresión de la lipólisis mediada tanpor insulina, lo que revela IR periferica y en el adipocito, respectivamente21,23,24. La evidencia disponible no permite discriminar cual es el principal lugar de IR en el HGNA, pero la recurrencia de la enfermedad despues del trasplante sugiere que la IR periferica es un hecho primario25. La IR periferica determina la ocurrencia de lipolisis no regulada a nivel del tejido adiposo, particularmente en el tejido adiposo visceral que a su vez resulta en un aumento del influjo de acidos grasos (AG) hacia el higado. Por otra parte, la IR se asocia a hiperinsulinemia compensadora que aumenta la lipogenesis hepatica de novo26. Estos dos factores son fundamentales en la genesis de la acumulacion hepatica de TG (Figura 2). Otras rutas como una insuficiente oxidacion hepatica de AG y/o alteracion de la sintesis o secrecion de lipoproteinas de muy baja densidad (VLDL) parecen tener menos importancia21.
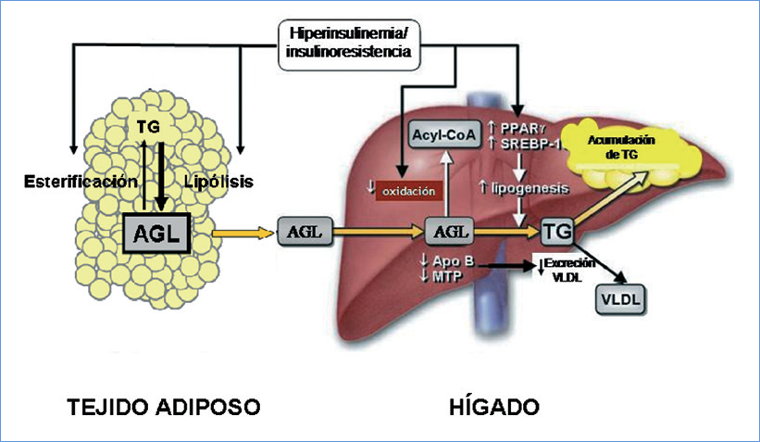
Figura 2. Mecanismos involucrados en el depósito de grasa [en forma de triglicéridos, (TG)] en el HGNA. El aumento de la oferta de ácidos grasos libres (AGL) al hepatocito es consecuencia de un aumento de la lipólisis en el tejido adiposo. El aumento de la síntesis hepática de lípidos es consecuencia de la hiperinsulinemia compensatoria de la insulinoresistencia así como la disminución de la secreción hepática de lipoproteínas de muy baja densidad (VLDL). La eventual ocurrencia de una disminución de la beta oxidación mitocondrial de ácidos grasos es controvertida. Acetyl coenzima A (AcylCo-A), Microsomal trigliceride transfer protein (MTP), Peroxisome proliferatoractivated receptor (PPAR) Sterol-regulatory element- binding protein (SREBP) Triglicéridos (TG) [Adaptado de Adams y cols6].
El papel de las hormonas secretadas por el tejido adiposo (colectivamente llamadas adipoquinas o adipocitoquinas) en la patogenesis de HGNA ha ganado recientemente una gran atencion27. El tejido adiposo, hoy considerado como el organo mas grande del sistema endocrino, secreta al menos una docena de proteinas capaces de influir en la sensibilidad a la insulina. Existe abundante informacion sobre el posible papel de la adiponectina, la leptina y el factor de necrosis tumoral a (TNF-α) en HGNA y la EHNA. La evidencia actual indica que un desequilibrio en la accion de diferentes adipoquinas (basicamente una disminucion de los niveles de adiponectina, aumento de los niveles de TNF-α y una resistencia a la leptina) pueden contribuir a la acumulacion de TG hepaticos. Otros adipoquinas como resistina, visfatina y apelina pueden estar tambien implicadas, pero los datos son aun insuficientes28. Por ultimo, los factores dieteticos tambien pueden influir en el desarrollo de la esteatosis29. Datos generados en modelos animales muestran que los hidratos de carbono, en particular hidratos de carbono simples, como la fructosa, pueden estimular la lipogénesis hepática de novo y reducir la oxidación de los lípidos, lo que conduce a esteatosis26. Sin embargo, existen pocos datos disponibles en humanos. Interesantemente, el consumo excesivo de fructosa de la dieta ha sido recientemente demostrado ser un factor de riesgo para el HGNA30.
La progresión desde la esteatosis simple a formas inflamatorias de la enfermedad es un tema clave en el campo del HGNA (Figura 1)31. No se sabe por qué algunas personas con HGNA desarrollan una forma agresiva de la enfermedad (es decir, EHNA) y otros no28. Ello probablemente involucra una interacción de factores genéticos y ambientales, pero la secuencia de acontecimientos no se conoce. Las consecuencias de la acumulación de AG en el hepatocito son múltiples. Entre otros efectos, los AG pueden determinar la activación de vías de apoptosis, alteraciones en la señalización celular, aumento en la producción de factor de necrosis tumoral (TNF), inducción del citocromo P450-2E1 y eventualmente, la inducción del llamado estrés del retículo endoplásmico. Todos estos efectos forman parte del fenómeno “lipotoxicidad” que conducen a muerte celular32. La llamada “teoría de los dos golpes” (“two-hit hypothesis”) postula una evolución secuencial desde la esteatosis a EHNA en la que IR es un primer hecho capaz de inducir la acumulación de grasa en los hepatocitos, lo que haría a estas células más vulnerables a otras injurias (isquemia, citoquinas, toxinas, etc). La exposición del hígado a una segunda noxa (“segundo golpe”) favorecería la generación de especies reactivas de oxígeno y la peroxidación de lípidos, lo que a su vez condiciona daño mitocondrial y estimula una mayor producción de radicales libres. Por otra parte, la existencia de efectos sinérgicos entre el estrés oxidativo y la IR exacerba los fenómenos celulares adversos para el hepatocito y configura un círculo vicioso que determina daño y muerte celular por necrosis o apoptosis. A su vez, la estimulación de las células de Küpffer y la acción de citoquinas pro-inflamatorias determinan la activación tanto de las células estrelladas como de los fenómenos relacionados con la fibrogénesis hepática. La teoría de los dos golpes ha sido reformulada por sus propios autores, pues la progresión puede ocurrir aún en ausencia de un “segundo golpe” identificable. Es además posible que los individuos con EHNA y los pacientes con esteatosis simple correspondan a poblaciones diferentes desde el inicio y no representen un fenómeno verdaderamente secuencial. Dichas diferencias, podrían estar vinculadas a diferencias genéticas que modulen la inflamación, fibrosis, estrés oxidativo y/o IR21,23,24. Datos recientes sugieren que la capacidad de acumular grasa en los hepatocitos puede ser relevante. Así, se ha planteado la existencia de “buenos almacenadores de grasa”, que son capaces de gestionar el flujo de AG desde la periferia hacia el hígado y otro grupo de “malos almacenadores de grasa” cuya capacidad de almacenamiento de AG es limitada y llegan a tener EHNA como resultado de lipotoxicidad hepática directa. Los “buenos almacenadores de grasa” pueden desarrollar una enfermedad progresiva si enfrentan una injuria concurrente (ej: hepatitis viral, alcohol, drogas, etc). La observación de diferencias interindividuales, genéticamente determinadas, respecto del contenido de grasa hepática33 es consistente con el concepto de que existen individuos con capacidades diferente de almacenamiento. Si esta determina o no la posibilidad de progresión no está aclarado34.
Evaluación clínica y valoración pronóstica del paciente con hígado graso
La evaluación clínica del paciente con HGNA debe estar dirigida a precisar el diagnóstico, excluyendo mediante la historia y exámenes de laboratorio otras formas de enfermedad hepática, y a intentar precisar el pronóstico del paciente35,36. Los datos publicados respecto de la historia natural indican que la histología hepática está relacionada con el pronóstico. Así, la esteatosis simple parece tener un curso benigno mientras que la presencia de cambios necroinflamatorios o EHNA se asocia a un riesgo significativo de desarrollar cirrosis que ha sido estimado en un 20-25% a 10 años10. Es por lo tanto relevante distinguir entre pacientes con esteatosis simple de aquellos con EHNA. Si bien corrientemente se emplean los niveles de aminotransferasas séricas como indicador de benignidad, debe tenerse en cuenta que dichos niveles pueden ser oscilantes en el tiempo y que algunos pacientes pueden tener enfermedad hepática significativa aún con niveles de aminotransferasas normales37. La mejor forma de hacer dicha distinción es mediante el estudio histológico del hígado (biopsia hepática). Sin embargo, dicho procedimiento tiene un costo significativo y un riesgo clínico que aconseja su uso racional. Algunos factores clínicos que han sido identificados como predictores de fibrosis en la biopsia hepática son la presencia de obesidad o diabetes y una edad mayor a 50 años36. Se está trabajando intensamente en el desarrollo de herramientas no invasivas para pesquisar enfermedad hepática significativa en pacientes con EHNA. Entre ellas, destaca el empleo de nuevas técnicas de ultrasonido como la elastografía y, en forma más preliminar, de paneles diagnósticos que incluyen los niveles de adipoquinas plasmáticas38. En el intertanto, los médicos que evalúan pacientes con HGNA deben mantener un grado de alerta a la posibilidad de que un subgrupo de ellos pueda estar expuesto o haber ya desarrollado una enfermedad hepática significativa. Los médicos endocrinólogos enfrentan con frecuencia pacientes con IR. Muchos de ellos son portadores de HGNA y requieren una adecuada valoración de su condición. Ello es particularmente válido para pacientes con obesidad y diabetes3,39, pero también para otras patologías particulares como el síndrome de ovario poliquístico. Recientemente, un estudio ultrasonográfico demostró una frecuencia significativa de HGNA (41,5%) en pacientes chilenas con SOP. La mitad de éstas presentaba alteración de las pruebas hepáticas que sugería la presencia de EHNA40. El trabajo conjunto con el hepatólogo en la evaluación de estos pacientes adquiere entonces relevancia clínica.
Finalmente, el hallazgo de HGNA parece tener también importancia no hepatológica. Estudios recientes indican que la presencia de HGNA constituye un factor de riesgo para el desarrollo de diabetes41,42. Una investigación reciente conducida en Australia, determinó que cerca del 17% de los pacientes con HGNA desarrollan diabetes luego de poco más de una década, comparado con sujetos sin HGNA41. También se ha vinculado la presencia de HGNA como un factor de riesgo de desarrollar eventos cardiovasculares y ateroesclerosis43,44. En consecuencia, la pesquisa de HGNA no debe ser considerado un hallazgo intrascendente pues tiene implicancias hepáticas y no hepáticas significativas.
Aspectos terapéuticos35,36
Dado que el mecanismo central que subyace al HGNA es la IR, la modulación de la misma es central en el manejo clínico. Aun cuando no ha sido evaluada en estudios con adecuado poder estadístico la recomendación inicial debe incluir dieta y ejercicio físico regular. La baja de peso debe ser gradual y tener como objetivo alcanzar al menos el 10% del peso inicial. Dietas bajas en carbohidratos se han asociado a mayor reducción del contenido de triglicéridos hepáticos y de transaminasas séricas. Si existe obesidad mórbida la cirugía bariátrica puede asociarse a regresión de la inflamación e infiltración grasa hepática por lo que podría considerarse como una opción en casos seleccionados, aunque sus efectos a largo plazo no han sido estudiados45. El ejercicio físico mejora la resistencia a la insulina y puede modificar el contenido de grasa hepática46. Se debe recomendar un ejercicio físico moderado a intenso (trotar o caminar) de duración mínima de 30 minutos, entre 3 a 5 veces a la semana.
El tratamiento farmacológico para reducción de peso debe ser usado idealmente en combinación con un programa dietético y físico para alcanzar la pérdida de peso fijada. Un estudio reciente, que evaluó los efectos del Orlistat en HGNA, demostró mejoría en los niveles de transaminasas y en la esteatosis hepática, objetivada por ecografía abdominal, por sobre sus efectos en la reducción de peso. La Sibutramina ha sido evaluada sólo en un estudio pequeño con reducción de los niveles de transaminasas y de grasa en la ecografía hepática35.
El empleo de drogas que mejoren la acción de insulina como la metformina y las tiazolidinedionas (pioglitazona, rosiglitazona) ha sido evaluado en varios estudios. Sin embargo, problemas de poder estadístico insuficiente o ausencia de evaluación histológica no permiten alcanzar conclusiones sobre su utilidad. El trabajo más sólido en este sentido es el estudio aleatorio de Belfort et al47, que demostró eficacia de la pioglitazona sobre la histología hepática en pacientes con EHNA. Basados en este estudio, la pioglitazona podría ser indicada en pacientes con EHNA.
La presencia de inflamación y de stress oxidativo, descrito previamente, ha impulsado a autores a evaluar el beneficio de drogas antioxidantes en el manejo del HGNA. Las vitaminas C y E y la betaina no han demostrado claros efectos benéficos, con relevancia clínica, y se encuentran aún en evaluación.
El acido ursodeoxicólico ha sido evaluado en estudios cuyos resultados han sido contradictorios; actualmente no existe evidencia sólida que permita recomendar su uso rutinario.
Otros fármacos ensayados han sido gemfibrozilo, clofibrato, estatinas, pentoxifilina, acido fólico y losartán. Los trabajos en su mayoría no son controlados e incluyen un número reducido de pacientes, lo que limita llegar a conclusiones válidas.
En conclusión, en la actualidad no hay terapias probadamente efectivas para la EHNA y se están llevando a cabo estudios con poder estadístico suficiente, con buen diseño metodológico, que incluyen la histología hepática obtenida por biopsia, como parámetro confiable de mejoría. La información disponible en la actualidad apunta a que la baja de peso, las modificaciones dietéticas, la actividad física regular y los fármacos sensibilizadores de insulina son medidas que en su conjunto pueden modificar la historia natural de pacientes con HGNA.
Conclusión
El HGNA ha emergido como una de las principales causas de enfermedad hepática crónica. La resistencia a la insulina ha sido identificada como un hecho central involucrado tanto en la génesis como en la progresión de la enfermedad. Diferentes estudios indican que la EHNA, la forma inflamatoria del HGNA, puede progresar a estadios más avanzados de enfermedad hepática crónica incluyendo la cirrosis en hasta un 25% de los casos en una o dos décadas. Además, datos recientes han identificado al HGNA como un factor de riesgo relevante para el desarrollo de eventos cardiovasculares y diabetes. Dado que los endocrinólogos enfrentan corrientemente pacientes portadores de resistencia a la insulina, la identificación de aquellos individuos con HGNA y la valoración de su pronóstico adquieren una relevancia clínica significativa.
Agradecimiento: El presente manuscrito fue parcialmente apoyado por el proyecto Fondecyt #1050780.
Referencias
- Younossi ZM. 2008. Review article: current management of nonalcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol Ther 28; 2-12
- Oh MK, et al. 2008. Review article: diagnosis and treatment of non-alcoholic fatty liver disease. Aliment Pharmacol Ther 28; 503- 522.
- Cusi K. 2009. Nonalcoholic fatty liver disease in type 2 diabetes mellitus. Curr Opin Endocrinol Diabetes Obes 16; 141-149.
- Angulo P. 2002. Nonalcoholic fatty liver disease. N Engl J Med 346; 1221-1231.
- . Adams LA, Angulo P. 2005. Recent concepts in non-alcoholic fatty liver disease. Diabet Med 22; 1129-1133.
- Adams LA, et al. 2005. Nonalcoholic fatty liver disease. Cmaj 172; 899-905.
- Larter CZ, Farrell GC. 2006. Insulin resistance, adiponectin, cytokines in NASH: Which is the best target to treat? J Hepatol 44; 253-261.
- Brunt EM. 2007. Pathology of fatty liver disease. Mod Pathol 20 Suppl 1; S40-48.
- Miele L, et al. 2005. The natural history and risk factors for progression of non-alcoholic fatty liver disease and steatohepatitis. Eur Rev Med Pharmacol Sci 9; 273-277.
- Matteoni CA, et al. 1999. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology 116; 1413-1419.
- Angulo P. 2007. GI epidemiology: nonalcoholic fatty liver disease. Aliment Pharmacol Ther 25; 883-889.
- Clark JM. 2006. The epidemiology of nonalcoholic fatty liver disease in adults. J Clin Gastroenterol 40 Suppl 1; S5-10.
- Riquelme A, et al. 2009. Non-alcoholic fatty liver disease and its association with obesity, insulin resistance and increased serum levels of C-reactive protein in Hispanics. Liver Int 29; 82-88.
- Ong JP, Younossi ZM. 2007. Epidemiology and natural history of NAFLD and NASH. Clin Liver Dis 11; 1-16, vii.
- Rector RS, et al. 2008. Non-alcoholic fatty liver disease and the metabolic syndrome: an update. World J Gastroenterol 14; 185- 192.
- Fan JG, Farrell GC. 2009. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol 50; 204-210.
- Schwimmer JB, et al. 2009. Heritability of nonalcoholic fatty liver disease. Gastroenterology 136; 1585-1592.
- Clark JM, Diehl AM. 2003. Nonalcoholic fatty liver disease: an underrecognized cause of cryptogenic cirrhosis. Jama 289; 3000- 3004.
- Caldwell SH, Crespo DM. 2004. The spectrum expanded: cryptogenic cirrhosis and the natural history of non-alcoholic fatty liver disease. J Hepatol 40; 578-584.
- Adams LA, et al. 2005. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 129; 113-121.
- Méndez-Sánchez N, et al. 2007. Current concepts in the pathogenesis of nonalcoholic fatty liver disease. Liver Int 27; 423- 433.
- Utzschneider KM, Kahn SE. 2006. Review: The role of insulin resistance in nonalcoholic fatty liver disease. J Clin Endocrinol Metab 91; 4753-4761.
- Perlemuter G, et al. 2007. Nonalcoholic fatty liver disease: from pathogenesis to patient care. Nat Clin Pract Endocrinol Metab 3; 458-469.
- Agarwal N, Sharma BC. 2005. Insulin resistance and clinical aspects of non-alcoholic steatohepatitis (NASH). Hepatol Res 33; 92-96.
- Angulo P. 2006. Nonalcoholic fatty liver disease and liver transplantation. Liver Transpl 12; 523-534.
- Anderson N, Borlak J. 2008. Molecular mechanisms and therapeutic targets in steatosis and steatohepatitis. Pharmacol Rev 60; 311-357.
- Marra F, Bertolani C. 2009. Adipokines in liver diseases. Hepatology 50 (3): 957-969
- Marra F, et al. 2008. Molecular basis and mechanisms of progression of non-alcoholic steatohepatitis. Trends Mol Med 14; 72-81.
- Le KA, Bortolotti M. 2008. Role of dietary carbohydrates and macronutrients in the pathogenesis of nonalcoholic fatty liver disease. Curr Opin Clin Nutr Metab Care 11; 477-482.
- Ouyang X, et al. 2008. Fructose consumption as a risk factor for non-alcoholic fatty liver disease. J Hepatol 48; 993-999.
- Erickson SK. 2009. Nonalcoholic fatty liver disease. J Lipid Res 50 Suppl, S412-416.
- Malhi H, Gores GJ. 2008. Molecular mechanisms of lipotoxicity in nonalcoholic fatty liver disease. Semin Liver Dis 28; 360-369.
- Romeo S, et al. 2008. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet 40; 1461-1465.
- Arrese M. 2009. Burning hepatic fat: therapeutic potential for liver-specific thyromimetics in the treatment of nonalcoholic fatty liver disease. Hepatology 49; 348-351.
- Méndez-Sánchez N, et al. 2007. Treating nonalcoholic fatty liver disease. Liver Int 27; 1157-1165.
- Vuppalanchi R, Chalasani, N. 2009. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: Selected practical issues in their evaluation and management. Hepatology 49; 306-317.
- Fracanzani AL, et al. 2008. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: a role for insulin resistance and diabetes. Hepatology 48; 792-798.
- Arrese M, Riquelme A. 2009. The value of serum adipokine measurement in non-alcoholic fatty liver disease. Liver Int (in press).
- Leite NC, et al. 2009. Prevalence and associated factors of nonalcoholic fatty liver disease in patients with type-2 diabetes mellitus. Liver Int 29; 113-119.
- Cerda C, et al. 2007. Nonalcoholic fatty liver disease in women with polycystic ovary syndrome. J Hepatol 47; 412-417.
- Adams LA, et al. 2009. NAFLD as a risk factor for the development of diabetes and the metabolic syndrome: an elevenyear follow-up study. Am J Gastroenterol 104; 861-867.
- Arase Y, et al. 2009. Multivariate analysis of risk factors for the development of type 2 diabetes in nonalcoholic fatty liver disease. J Gastroenterol. (in press).
- Edens MA, et al. 2009. Non-alcoholic fatty liver disease is associated with cardiovascular disease risk markers. Obes Rev 10; 412-419.
- Sookoian S, Pirola CJ. 2008. Non-alcoholic fatty liver disease is strongly associated with carotid atherosclerosis: a systematic review. J Hepatol 49; 600-607.
- Mummadi RR, et al. 2008. Effect of bariatric surgery on nonalcoholic fatty liver disease: systematic review and metaanalysis. Clin Gastroenterol Hepatol 6; 1396-1402.
- Spassiani NA, Kuk JL. 2008. Exercise and the fatty liver. Appl Physiol Nutr Metab 33; 802-807.
- Belfort R, et al. 2006. A placebo-controlled trial of pioglitazone in subjects with nonalcoholic steatohepatitis. N Engl J Med 355; 2297-2307.