Rev. chil. endocrinol. diabetes 2010; 3 (4) Volver a Índice
La revista Chilena de Endocrinología y Diabetes inicia con este número la publicación de una serie de artículos, en que prestigiosos médicos radiólogos darán a conocer su experiencia en el estudio de imágenes de patología endocrinológica. Esta serie está diseñado para exponer y ofrecer a los lectores una amplia galería de imágenes que sustenten en forma práctica y docente el contenido del texto escrito. Se inicia la serie con la contribución del Dr. Francisco Cruz O. sobre el estudio ecográfico de los nódulos tiroideos.
El Editor
Artículo por Invitación
Estudio ecográfico del nódulo tiroideo:
Diagnóstico por reconocimiento de patrones
Francisco Cruz O.1
Ultrasonography of the thyroid nodule:
Diagnosis by pattern recognition
1Departamento de Radiología, Pontificia Universidad Católica de Chile.
Introducción
El uso rutinario de la ecografía cervical ha traído, como consecuencia, el hallazgo incidental en la población general de un gran número de nódulos tiroideos que puede variar entre 13% y 67%1,2, muchos de ellos insospechados clínicamente (“incidentalomas”). La prevalencia de nódulos tiroideos depende de la edad, sexo, lugar geográfico y otros factores bien establecidos. La gran mayoría de estos nódulos tiroideos son benignos, secundarios a hiperplasia folicular, también llamados coloideos o adenomatosos. El cáncer tiroideo, sin embargo, es poco común (4%-10%), y la mortalidad es muy baja, por lo que se considera un cáncer de bajo riesgo3.
Esta verdadera epidemia de nódulos tiroideos ha creado problemas en el manejo clínico de estos pacientes, y ha dado lugar a un debate que aún no concluye, reflejado en la literatura en forma de recomendaciones basadas en la experiencia y la evidencia, pero con bastante variabilidad en los resultados; por ello ha sido necesario elaborar pautas por consenso4.
Las normas actuales recomiendan el uso combinado de ecografía y punción aspirativa con aguja fina (PAAF) en el manejo de los nódulos tiroideos. Ningún examen no invasivo puede confiablemente distinguir los nódulos malignos de los benignos, dado la inconsistencia de los signos ecográficos para predecir malignidad, de manera que el desafío es lograr diagnosticar los pocos pacientes portadores de nódulos malignos entre este gran número de pacientes con nódulos benignos, para lo cual ha sido necesario diseñar estrategias que sugieran que nódulos debieran ir necesariamente a biopsia y cuales sólo necesitarían de seguimiento clínico y ecográfico.
Se han descrito varias características ecográficas de los nódulos tiroideos, que es necesario reconocer porque constituyen la semiología fundamental para el diagnóstico, lo que será el primer objetivo de esta revisión. Numerosos son los artículos en la literatura que describen los hallazgos ecográficos más significativos que permitirían categorizar los nódulos en benignos o malignos5,6, pero el grado de sobreposición en la apariencia ecográfica es lo suficientemente alto como para que la PAAF sea habitualmente necesaria para hacer el diagnóstico; aún no está claro si alguna vez estos signos serán lo suficientemente prácticos y certeros como para evitar una biopsia. Algo común en estos estudios es la limitación constante de la sensibilidad o de la especificidad de los hallazgos ecográficos para predecir malignidad. Es por esto que varios autores recomiendan abordar el diagnóstico ecográfico por patrones morfológicos clásicos7-9, combinando signos ecográficos que por sí solos no serian lo suficientemente sensibles y específicos; la descripción de estos patrones será el otro objetivo de este artículo.
El tumor maligno más frecuente de la tiroides es el cáncer papilar (75%-80%), seguido del cáncer folicular (10%- 20%). Menos frecuentes son el cáncer medular y el cáncer anaplástico, que en general son más agresivos que los mencionados primero.
La mayoría de los autores, para efectos de clasificación, divide los nódulos tiroideos en lesiones benignas, lesiones foliculares y lesiones malignas.
Como el cáncer papilar es la variedad más frecuente de carcinoma tiroideo, los signos ecográficos de malignidad se aplican preferentemente a este tumor. Aunque ninguna característica es patognomónica de cáncer papilar del tiroides, algunos signos, pueden sugerir el diagnóstico con bastante certeza.
Características ecográficas de los nódulos tiroideos
Se han estudiado varias características ecográficas como potenciales signos predictores de malignidad o benignidad; detallaremos las más importantes.
1. Tamaño
Los nódulos tiroideos se hacen palpables cuando alcanzan aproximadamente 10 mm de tamaño, dependiendo de su localización. Cuando la palpación era la principal manera de identificar nódulos, este diámetro era el límite para realizar una biopsia. Aunque las normas de la Asociación Americana de Endocrinólogos Clínicos (AACE) y la Asociación Americana de Tiroides (ATA) continúan usando 10 a 15 mm como el umbral práctico9,10 para seleccionar nódulos que necesitan de una PAAF, se ha demostrado que el tamaño no es un buen indicador para predecir malignidad. Son varios los trabajos que muestran que la prevalencia de cáncer es similar en nódulos mayores o menores de 10 mm11. La Sociedad de Radiólogos en Ultrasonido recientemente llegó al consenso de que, más que fijar un umbral de tamaño, debe usarse el aspecto ecográfico del nódulo como criterio de selección, tanto en el nódulo solitario como en la glándula multinodular4. En nódulos mayores de 10 mm no habría una diferencia significativa en el porcentaje de malignidad, aunque hay una tendencia que indicaría que la tasa de malignidad es más alta en nódulos mayores de 30-40 mm. El cáncer papilar menor de 10 mm se ha definido como microcarcinoma (Figura 1) y su frecuencia ha aumentado gradualmente en los últimos años12. Persiste el debate si este aumento es real o simplemente se debe al uso masivo de la ecografía cervical y la PAAF guiada por ecografía, lo que permite identificarlos precozmente. La presencia de múltiples nódulos no disminuye la probabilidad de cáncer tiroideo por paciente y el nódulo dominante por mayor tamaño no es necesariamente el que contiene el cáncer, ya que en aproximadamente un 30% el cáncer está en el nódulo no dominante4. Independiente del tamaño los nódulos casi completamente quísticos, sin otras características sospechosas, probablemente no requieren de biopsia.
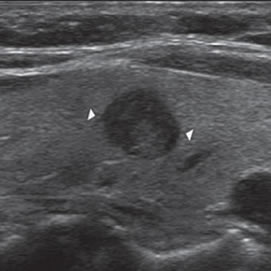
Figura 1. Microcarcinoma de 8 mm.
2. Contenido o arquitectura
Los nódulos tiroideos pueden ser quísticos, sólidos o mixtos. Dentro de los mixtos pueden ser predominantemente quísticos (mayor de 50%) o predominantemente sólidos.
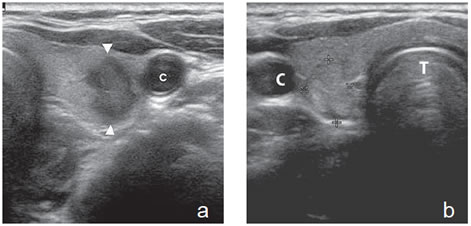
Un nódulo que tiene un componente quístico significativo, usualmente es un nódulo benigno hiperplástico, que ha acumulado abundante coloide (Figura 2a) o bien, un nódulo sólido que ha experimentado un proceso de degeneración colicuativa o hemorragia (Figura 2b). El coloide o el contenido líquido de un nódulo se ve anecogénico (negro en la imagen ecográfica) y las estructuras sólidas se ven ecogénicas (distintos tonos de grises), siendo la ecogenicidad similar al del parénquima tiroideo. En un nódulo sólido la ecoestructura y la ecogenicidad pueden ser variables. En general, la frecuencia de carcinoma es muy baja en nódulos quísticos13 y la mayoría de los carcinomas se presentan como nódulos sólidos (Figura 2c).
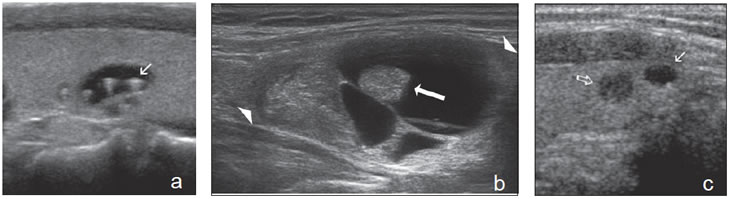
Figura 2. a) Quiste coloideo anecogénico y focos ecogénicos (flecha) con artefacto en cola de cometa; b) Nódulo mixto sólido-quístico (cabezas de flechas). Imagen vegetante (flecha) adherida a un tabique que se proyecta al lumen; c) Comparación entre el aspecto ecográfico de un cáncer papilar sólido (flecha abierta) y un quiste coloideo anecogénico.
3. Ecogenicidad
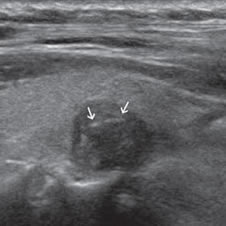
El parénquima tiroideo normal es de mayor ecogenicidad que los músculos pre-tiroideos. Los nódulos tiroideos pueden ser de menor ecogenicidad que el tejido glandular (hipoecogénicos), de ecogenicidad similar (isoecogénicos) o de mayor ecogenicidad (hiperecogénicos). La ecogenicidad de un nódulo se refiere al nivel de blanco, gris y negro que muestran en la imagen ecográfica (Figura 3a, b y c). La mayoría de los carcinomas papilares (75%-85%) son hipoecogénicos13. La hipoecogenicidad es un signo sensible pero inespecífico, ya que un 30% a 50% de los nódulos benignos14 también son hipoecogenicos (Figura 4). Sin embargo, si la hipoecogenicidad es acentuada (menor que la de los músculos pretiroideos), aumenta la sospecha de carcinoma (Figura 5). Los nódulos hiperecogénicos o isoecogenicos tienen mayor grado de asociación con lesiones hiperplásticas o foliculares benignas, y en mucho menor proporción con el cáncer papilar. Los nódulos puramente quísticos se definen como anecogénicos independiente de si muestran uno que otro fino septo aislado. Cuando el coloide se espesa, se forman microcristales que se ven como focos hiperecogénicos que contrastan con el fondo de coloide anecogénico, y generan un artefacto ultrasonográfico por reverberación, que produce una imagen posterior similar a la cola de un cometa (Figura 2a). La presencia de estos focos hiperecogénicos en un nódulo quístico indican la presencia de abundante coloide y se correlaciona con benignidad; prácticamente están ausentes en un nódulo maligno15.
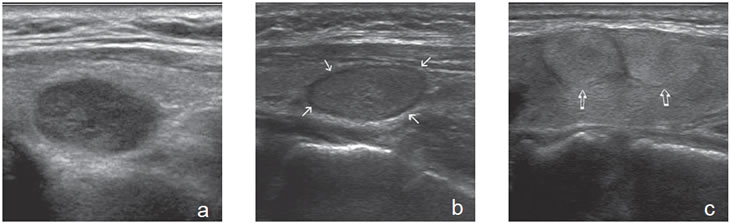
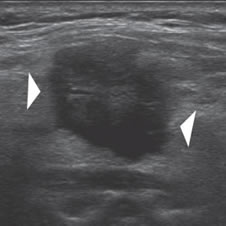
4. Forma y márgenes
Los nódulos esféricos tiene mayor incidencia de carcinoma que los francamente ovoideos (18% versus 5%), pero estos dos signos son poco sensibles. En un estudio en que se analizó la forma de los nódulos comprobados como cáncer tiroideo se encontró que la forma “más alta que ancha” (diámetro antero posterior mayor que el diámetro transversal) tenía una especificidad de 92,5% (Figura 6a) pero una sensibilidad de 32,7%16. Esto no ha sido confirmado en otros estudios17 en que nódulos con esta forma han resultado benignos (Figura 6b).
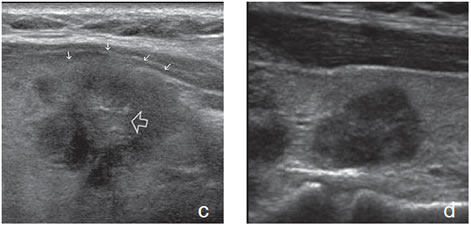
El margen se refiere al borde que separa el nódulo del parénquima tiroideo circundante. El signo del halo aparece como un fino borde hipoecogénico rodeando al nódulo en toda su extensión (Figura 3b). Se piensa que es una pseudocápsula formada por tejido fibroso conectivo, parénquima tiroideo comprimido, o infiltrado inflamatorio crónico. La presencia de vasos perinodulares también puede formar un halo, lo que se hace evidente al “doppler color”. La presencia de un halo hipoecogénico ha sido tradicionalmente considerado un signo de benignidad, y en la mayoría de los casos así ocurre, pero en series grandes se ha demostrado que también puede estar presente en 10% a 24% de los nódulos malignos13 y estar ausente en al menos la mitad de los nódulos benignos.
El margen irregular, mal definido, lobulado o determinado por un halo grueso hipoecogénico es un signo de malignidad, pero tiene una sensibilidad muy variable (10%-97%), y la mayor variabilidad inter observador de todos los signos ecográficos, especialmente cuando los estudios son retrospectivos, y los equipos son de diferente calidad. En todo caso, un margen mal definido e irregular, de aspecto infiltrativo, indica con alta probabilidad que el nódulo es maligno (Figura 7 a y b).
5. Calcificaciones
Pueden ser detectadas en aproximadamente un 10% a 15% de todos los nódulos tiroideos, pero lo más importante es el tipo y patrón de calcificación para distinguir lesiones malignas de lesiones benignas. Se clasifican en microcalcificaciones, calcificaciones gruesas y calcificaciones periféricas.
Las microcalcificaciones aparecen en la ecografía como focos ecogénicos puntiformes, sin sombra acústica y sin artefacto por reverberación, en el espesor del tejido sólido (Figura 8a). Desde el punto de vista histológico corresponden a conglomerados de cuerpos de psammoma, que son esférulas microscópicas laminarmente calcificadas. Se originan a partir de células necróticas, a menudo en las puntas de las papilas, que forman el nido sobre el cual se depositan las láminas de calcio. Se encuentran principalmente en carcinomas papilares (29% a 59%), pero pueden estar presentes en carcinomas medulares y anaplásticos11,16.
Las macrocalcificaciones aparecen como placas ecogénicas fragmentadas, o depósitos granulares amorfos que determinan sombra acústica hacia los planos profundos (Figura 8b). Patológicamente corresponden a calcificaciones distróficas secundarias a necrosis y fibrosis. La distribución puede ser central o periférica y ocurrir tanto en nódulos malignos como nódulos benignos de larga data. En el cáncer papilar pueden coexistir microcalcificaciones con calcificaciones gruesas, que se depositan en áreas de fibrosis y degeneración; las calcificaciones granulares centrales son el tipo más frecuente en el cáncer medular.
El patrón de calcificación periférica anular se consideró alguna vez que representaba un hallazgo benigno, pero un estudio demostró asociación con malignidad en 18,5% de los casos17. En ese estudio hubo una tendencia hacia un mayor riesgo de malignidad si el patrón periférico de calcificación era discontinuo (Figura 9) y un menor riesgo de malignidad si el patrón periférico de calcificación era liso y curvilíneo, en forma de cáscara de huevo (Figura 10).
De todos los signos ecográficos asociados a malignidad, las microcalcificaciones es el más específico (85-95%). La presencia de microcalcificaciones en un nódulo predominantemente sólido aumenta el riesgo de cáncer en tres veces y la presencia de calcificaciones gruesas aumenta el riesgo de cáncer en dos veces. El valor predictivo de las microcalcificaciones varía entre 42% a 94% y la sensibilidad entre 26% a 59%5.
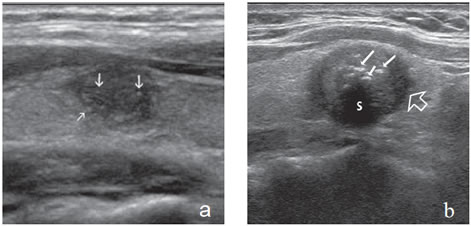
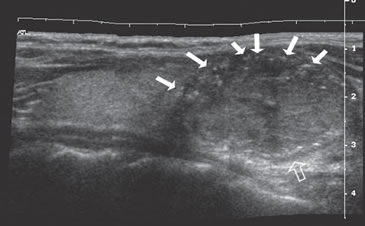 Figura 9. Cáncer papilar, de forma redondeada, de 30 mm de diámetro,
hipoecogénico, con microcalcificaciones periféricas y discontinuas
(flechas). En el aspecto posterior las microcalcificaciones
forman un contorno lineal (flecha abierta).
Figura 9. Cáncer papilar, de forma redondeada, de 30 mm de diámetro,
hipoecogénico, con microcalcificaciones periféricas y discontinuas
(flechas). En el aspecto posterior las microcalcificaciones
forman un contorno lineal (flecha abierta).
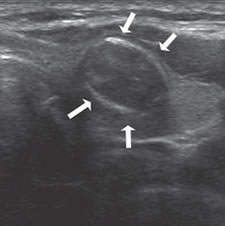
Figura 10. Corte transversal: nódulo coloideo delimitado por una calcificación en “cascara de huevo” (flechas).
6. Vascularización
Según la distribución de los vasos sanguíneos, los nódulos tiroideos se describen como hipovasculares (Figura 11), isovasculares (los menos frecuentes) e hipervasculares. En los hipervascularizados, se describen dos patrones. Un patrón de vascularización periférica (Figura 12) tiende a ser una característica de lesiones benignas (80-95% de nódulos hiperplásticos y adenomatosos) y un patrón de vascularización central o interna (Figura 13a), con o sin un componente periférico (Figura 13b) se observa en 70%- 90% de los nódulos malignos, aunque hay una considerable sobreposición, por lo que el optimismo inicial de que el “Doppler color” podía diferenciar nódulos benignos de malignos (Figura 13c) se ha ido esfumando gradualmente a medida que han ido apareciendo estudios con mayor número de pacientes18. Es necesario precisar que la mayoría de los nódulos hipervasculares son benignos, debido a que los nódulos hiperplásticos son mucho más frecuentes que los nódulos malignos (Figura 13d). El flujo vascular exclusivamente periférico en un nódulo bien delimitado, es frecuente de observar en nódulos hiperplásticos, y se le ha denominado el signo del “anillo de fuego” al “Doppler color”. Cerca de un 20% de los carcinomas papilares pueden ser hipovasculares (Figura 14a). Un nódulo avascular raramente corresponde a un tumor maligno (Figura 14b).
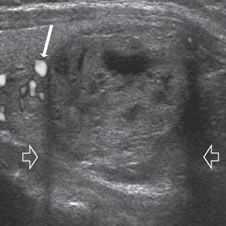
Figura 11. Nódulo coloideo sólido con áreas quísticas, hipovascularizado. El parénquima tiroideo se observa con vascularización normal (flecha). Dos sombras lineales a cada lado en los bordes de la lesión, que corresponden a un artefacto por refracción (flechas abiertas).
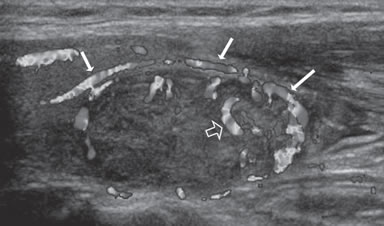 Figura 12. Nódulo coloideo, patrón de vascularización de predominio
periférico (flechas), con algunos vasos que se descuelgan hacia
el centro (flecha abierta).
Figura 12. Nódulo coloideo, patrón de vascularización de predominio
periférico (flechas), con algunos vasos que se descuelgan hacia
el centro (flecha abierta).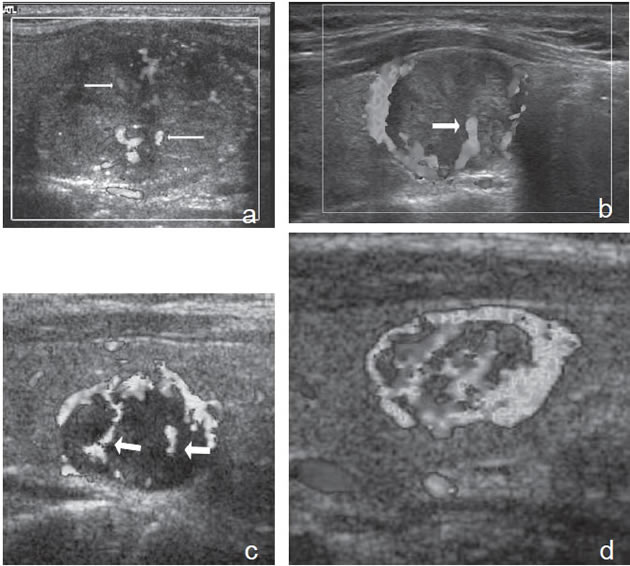 Figura 13. a) Cáncer papilar sólido,
con vascularización central (flecha) con
vasos intranodulares desorganizados;
b) Cáncer papilar sólido delimitado por
vasos periféricos y un vaso central penetrante
de mayor tamaño (flecha); c)
Nódulo coloideo con un patrón de flujo
mixto, periférico y vasos centrales desorganizados
(flechas) que simulan un
patrón maligno; d) Hiperplasia folicular
que muestra un nódulo bien delimitado
con vascularización aumentada,
central y periférica
Figura 13. a) Cáncer papilar sólido,
con vascularización central (flecha) con
vasos intranodulares desorganizados;
b) Cáncer papilar sólido delimitado por
vasos periféricos y un vaso central penetrante
de mayor tamaño (flecha); c)
Nódulo coloideo con un patrón de flujo
mixto, periférico y vasos centrales desorganizados
(flechas) que simulan un
patrón maligno; d) Hiperplasia folicular
que muestra un nódulo bien delimitado
con vascularización aumentada,
central y periférica
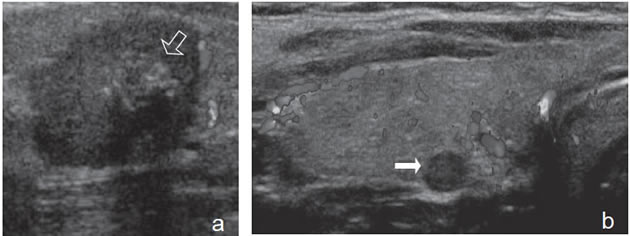 Figura 14. a) Cáncer papilar
hipoecogénico de
bordes irregulares y lobulados,
no encapsulado,
hipovascular, que muestra
un grupo de micro y
macrocalcificaciones centrales
(flecha abierta) con
sombra acústica; b) Nódulo
coloideo avascular
(flecha) marcadamente hipoecogenico.
Figura 14. a) Cáncer papilar
hipoecogénico de
bordes irregulares y lobulados,
no encapsulado,
hipovascular, que muestra
un grupo de micro y
macrocalcificaciones centrales
(flecha abierta) con
sombra acústica; b) Nódulo
coloideo avascular
(flecha) marcadamente hipoecogenico.
7. Invasión local y adenopatías
La extensión de la masa fuera de la cápsula, la infiltración de la tráquea o de los músculos pretiroideos es muy sugerente de malignidad (Figura 15a). Asímismo, la presencia de adenopatías con características típicas, debe hacer sospechar que el nódulo tiroideo es maligno. Los cánceres papilares de la tiroides son propensos a dar metástasis precozmente a los linfonodos cervicales y hasta la mitad de todos los pacientes pueden presentar adenopatías concomitantes. En 15% de los pacientes, el único signo de un cáncer tiroideo papilar oculto puede ser la detección de adenopatías. La mayoría de las metástasis ocurren ipsilateralmente al tumor primario en los grupos III y IV de la cadena yugular interna y del grupo VI del compartimiento central. En la ecografía, los linfonodos metastáticos pueden tener una forma redondeada o globular, una arquitectura con elementos sólidos o quísticos, con o sin microcalcificaciones y pérdida del hilio (Figura 15b y c). El “Doppler color” puede demostrar vasos capsulares de distribución caótica en reemplazo de los vasos hiliares normales (Figura 15d). Las adenopatías hiperecogénicas son sospechosas de cáncer papilar (Figura 16a). Los linfonodos normales en algunos grupos como el VI y el VII no se ven ecograficamente, de manera que si se hacen visibles, en el mismo lado del tumor, independiente del tamaño que tengan hay que considerarlos como adenopatías metastásicas (Figura 16b)
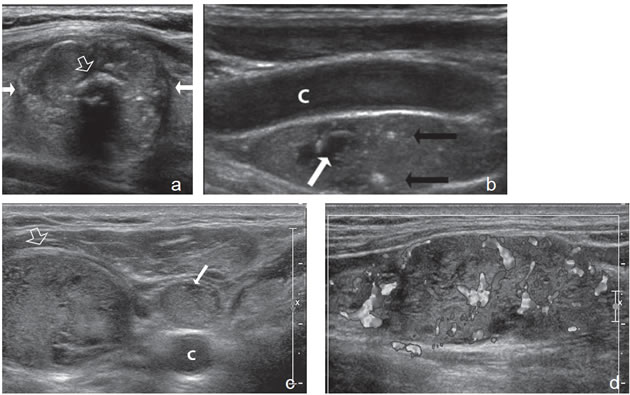 Figura 15. a) Cáncer papilar sólido de bordes lobulados (flechas) que muestra una gruesa calcificación central (flecha abierta) y múltiples
microcalcificaciones; b) Adenopatía cervical del grupo IV del mismo paciente (figura 15 a), hiperecogénica, con elementos quísticos (flecha
blanca) y microcalcificaciones agrupadas (flechas negras), típica de cáncer papilar; c) Adenopatías de grupo IV de un cáncer papilar, de
forma redondeada, hiperecogénicas, con pérdida del hilio, una anterior a la arteria carótida común (flecha) y otra lateral a la vena yugular
interna (flecha abierta); d) Corte sagital de la adenopatía lateral de la imagen 15 c), que en “doppler color” muestra vascularización patológica
y pérdida del hilio.
Figura 15. a) Cáncer papilar sólido de bordes lobulados (flechas) que muestra una gruesa calcificación central (flecha abierta) y múltiples
microcalcificaciones; b) Adenopatía cervical del grupo IV del mismo paciente (figura 15 a), hiperecogénica, con elementos quísticos (flecha
blanca) y microcalcificaciones agrupadas (flechas negras), típica de cáncer papilar; c) Adenopatías de grupo IV de un cáncer papilar, de
forma redondeada, hiperecogénicas, con pérdida del hilio, una anterior a la arteria carótida común (flecha) y otra lateral a la vena yugular
interna (flecha abierta); d) Corte sagital de la adenopatía lateral de la imagen 15 c), que en “doppler color” muestra vascularización patológica
y pérdida del hilio.
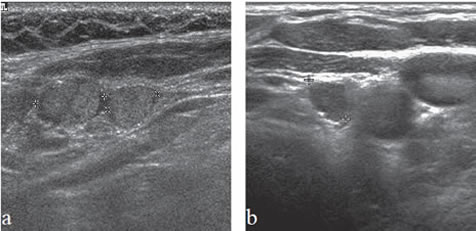
La apariencia ecográfica de los linfonodos metastásicos puede ser distinta a las del tumor primario y mostrar elementos quísticos y microcalcificaciones en mayor proporción que en el primario. En pacientes más jóvenes, las adenopatías puramente quísticas son relativamente comunes y cuando son solitarias pueden simular un quiste branquial o un quiste del conducto tirogloso.
De la descripción anterior se desprende, que ningún signo ecográfico por si solo puede predecir o descartar malignidad, pero la combinación de varios signos en un mismo nódulo, permite definir ciertos patrones que se repiten frecuentemente.
Las características ecográficas que mejor predicen malignidad incluyen composición sólida, microcalcificaciones, hipoecogenicidad (especialmente si es acentuada), márgenes irregulares, ausencia de un halo, forma más alta que ancha, y vascularización intranodular. Esto se aplica particularmente para el cáncer papilar que es el más frecuente de los carcinomas.
Esta aproximación diagnóstica por patrones7,8 tiene la ventaja de poder identificar aquellos nódulos que tienen altísima probabilidad de ser benignos y que sólo necesitan seguimiento ecográfico, y por otro lado, aquellos nódulos cuyo aspecto morfológico hace necesario indicar una PAAF para descartar o confirmar malignidad. Es recomendable entonces familiarizarse con el aspecto ecográfico típico de algunos nódulos benignos, malignos e indeterminados. Recientemente se ha publicado un sistema estandarizado para describir e informar las características ecográficas de los nódulos tiroideos denominado TIRADS (Thyroid Imaging Reporting an Data System) basado en un sistema similar usado para la descripción de nódulos mamarios conocido como BIRADS desarrollado por el American College of Radiology19. Otra nueva publicación sistematiza el reconocimiento ecográfico de los nódulos tiroideos y asigna un valor predictivo respecto del riesgo de cáncer20.
Dentro de los patrones morfológicos que se describirán no caben todas las posibles presentaciones de un nódulo tiroideo, pero son los más frecuentes que se encuentran en la práctica diaria.
Patrones típicos de nódulos benignos
Se conoce también como patrón coloideo, ya que la gran mayoría corresponden a nódulos coloideos de diferente apariencia ecográfica, predominantemente quísticos, secundarios a hiperplasia folicular y no corresponden a quistes verdaderos.
Cuando lo que predomina es el coloide, pueden presentarse como nódulos quísticos pequeños, anecogénicos, habitualmente menores de 10-15 mm (Figura 2a y 17) que a menudo contienen pequeños focos hiperecogénicos con el característico artefacto en “cola de cometa”, (a diferencia de las microcalcificaciones que no lo tienen). Para efectos de descripción es más adecuado referirse a estos nódulos como quistes coloideos, ya que traduce mejor la naturaleza de la lesión y hace evidente que no es necesaria la PAAF8.
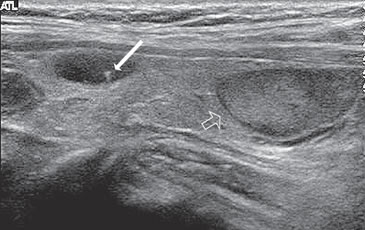 Figura 17. Quiste coloideo que muestra un foco ecogénico con
artefacto en cola de cometa (flecha) y adenoma tiroideo típico bien
encapsulado (flecha abierta).
Figura 17. Quiste coloideo que muestra un foco ecogénico con
artefacto en cola de cometa (flecha) y adenoma tiroideo típico bien
encapsulado (flecha abierta). Otra apariencia típica es la de un nódulo no encapsulado, que contiene múltiples espacios anecogénicos (coloide), separados por finos septos, que le da un aspecto espongiforme (Figura 18a) o en “panal de abejas”7. Los espacios quísticos pueden ser de tamaño variable, y observarse focos hiperecogénicos en las aéreas quísticas que contienen coloide o focos ecogénicos lineales en las interfases entre los espacios quísticos y los tabiques o la pared; pueden ser hipo, iso o hipervasculares.
Los componentes quísticos pueden ser muy pequeños y sólo detectarse con equipos de alta resolución. Este aspecto espongiforme puede aparecer más acentuado cuando los espacios quísticos son de mayor tamaño; si aparece hipervascularizado, a simple vista puede simular una neoplasia quística (Figura 18b y c). Puede predominar el componente quístico, y sin embargo, el componente sólido conservar el aspecto espongiforme (Figura 18d).
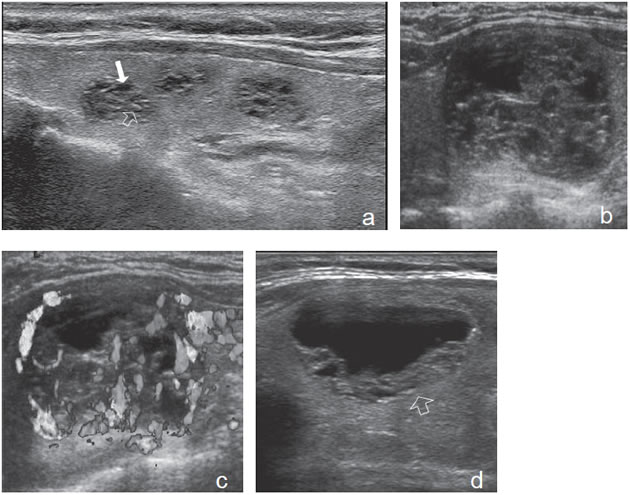 Figura 18. a) Tres nódulos coloideos, con aspecto
espongiforme, isovasculares al “doppler color”.
La flecha indica un espacio quístico y la flecha
abierta indica un pequeño tabique hiperecogénico.
La alternancia de ambos, forma este aspecto
en “panal de abeja”; b) y c) Nódulo coloideo
con aspecto espongiforme, con espacios quísticos
de mayor tamaño, de forma redondeada, que
aparece hipervascularizado en las áreas sólidas;
d) Nódulo coloideo mixto, predominantemente
quístico, en que el componente sólido conserva el
aspecto espongiforme (flecha abierta).
Figura 18. a) Tres nódulos coloideos, con aspecto
espongiforme, isovasculares al “doppler color”.
La flecha indica un espacio quístico y la flecha
abierta indica un pequeño tabique hiperecogénico.
La alternancia de ambos, forma este aspecto
en “panal de abeja”; b) y c) Nódulo coloideo
con aspecto espongiforme, con espacios quísticos
de mayor tamaño, de forma redondeada, que
aparece hipervascularizado en las áreas sólidas;
d) Nódulo coloideo mixto, predominantemente
quístico, en que el componente sólido conserva el
aspecto espongiforme (flecha abierta).
Un nódulo coloideo mixto puede aparecer como un quiste con un nódulo mural isoecogénico, excéntrico, que protruye hacia el lumen simulando una formación papilar, habitualmente vascularizado, que no corresponde a tejido neoplásico (Figura 19a). Si el componente sólido está rodeado por fluido, separado de la pared, y además tiene focos hiperecogénicos, es más difícil confundirlo con un tumor quístico (Figura 19b y c).
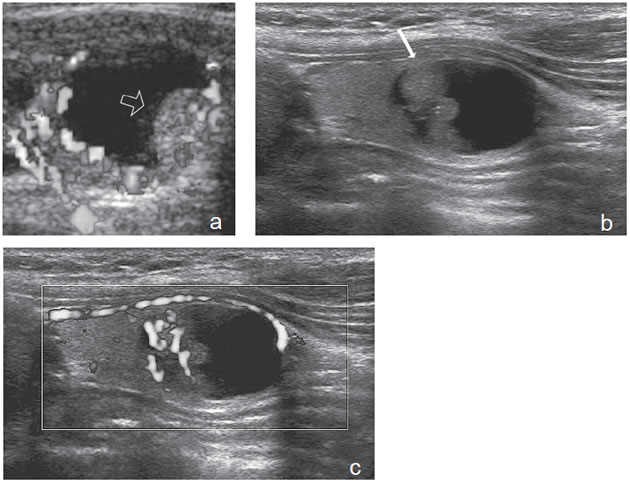 Figura 19. a) Nódulo coloideo, que muestra
una proyección de aspecto papilar hacia
el lumen, que corresponde a tejido no
neoplásico, igualmente vascularizado que
el resto del componente sólido del nódulo
(flecha abierta); b) y c) Nódulo coloideo,
predominantemente quístico, con componente
sólido (flecha), que muestra una forma
vegetante completamente rodeada de
coloide, con dos focos puntiformes en el
área más central.
Figura 19. a) Nódulo coloideo, que muestra
una proyección de aspecto papilar hacia
el lumen, que corresponde a tejido no
neoplásico, igualmente vascularizado que
el resto del componente sólido del nódulo
(flecha abierta); b) y c) Nódulo coloideo,
predominantemente quístico, con componente
sólido (flecha), que muestra una forma
vegetante completamente rodeada de
coloide, con dos focos puntiformes en el
área más central.
En nódulos coloideos de mayor tamaño, sobre 20 mm- 25 mm, el contenido suele ser mixto, predominando el componente líquido, con espacios quísticos de tamaño variable y asimétricos, separados por finos septos que corresponden a bandas de tejido tiroideo (Figura 20a), que le dan típicamente un aspecto multiloculado, o áreas quísticas entremezcladas con elementos sólidos de tejido hiperplástico y tejido granulatorio reactivo, de distinto espesor y forma, con imágenes pseudo nodulares o vegetantes, de ecogenicidad similar al parénquima tiroideo, que protruyen hacia los espacios quísticos (Figura 2b). Las áreas sólidas generalmente aparecen hipervascularizadas al “doppler color” (Figura 20b y c), pero a medida que aumenta el tamaño del nódulo la vascularización va disminuyendo.
Este tipo de patrón mixto genera confusión porque se asimila a la apariencia de un tumor quístico, como, por ejemplo, ocurre en el ovario y en el riñón, y muchas veces hace recomendar apresuradamente una PAAF (Figura 21).
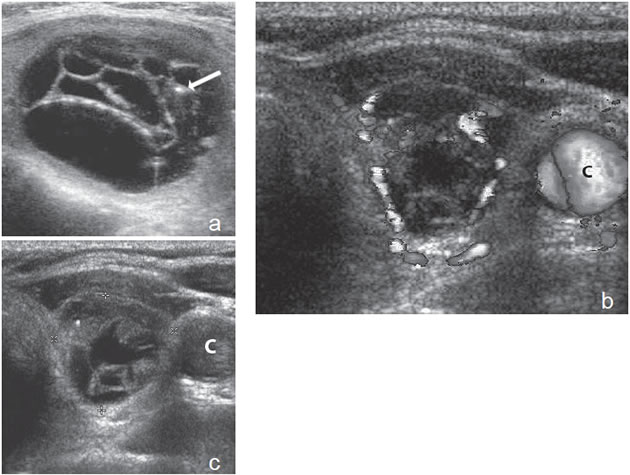 Figura 20. a) Nódulo coloideo de forma redondeada, con múltiples
tabiques finos de aspecto multiloculado. Adosado a uno de
los tabiques se observa un foco hiperecogénico que corresponde a
coloide espeso (flecha); b) y c) Nódulo coloideo, mixto, que muestra
que las áreas sólidas aparecen hiperevascularizadas. C: carótida
común izquierda.
Figura 20. a) Nódulo coloideo de forma redondeada, con múltiples
tabiques finos de aspecto multiloculado. Adosado a uno de
los tabiques se observa un foco hiperecogénico que corresponde a
coloide espeso (flecha); b) y c) Nódulo coloideo, mixto, que muestra
que las áreas sólidas aparecen hiperevascularizadas. C: carótida
común izquierda.
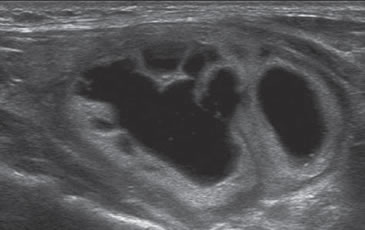 Figura 21. Nódulo coloideo, de forma ovoidea, de 35 mm, que
muestra un aspecto multiloculado, predominantemente quístico.
Figura 21. Nódulo coloideo, de forma ovoidea, de 35 mm, que
muestra un aspecto multiloculado, predominantemente quístico.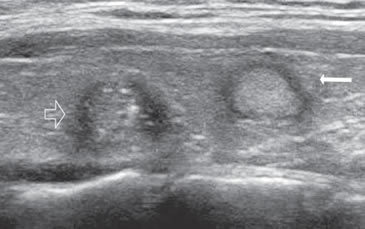 Figura 22. Nódulo hiperecogénico, con borde hipoecogénico, bien
delimitado (flecha) que corresponde a un pseudo nódulo en un paciente
con tiroiditis. A modo de comparación se muestra un cáncer
papilar en el mismo lóbulo (flecha abierta), rodeado de una pared
gruesa y un área isoecogénica central con múltiples microcalcificaciones.
Figura 22. Nódulo hiperecogénico, con borde hipoecogénico, bien
delimitado (flecha) que corresponde a un pseudo nódulo en un paciente
con tiroiditis. A modo de comparación se muestra un cáncer
papilar en el mismo lóbulo (flecha abierta), rodeado de una pared
gruesa y un área isoecogénica central con múltiples microcalcificaciones.
Otro tipo de lesión que se asocia a alta probabilidad de benignidad es un nódulo hiperecogénico8, parcialmente encapsulado, habitualmente un pseudo nódulo, que aparece en una glándula con cambios morfológicos por tiroiditis de Hashimoto (Figura 22). Hay que tener presente que la concomitancia de tiroiditis de Hashimoto y bocio nodular no es un argumento a favor de benignidad, de manera que si el nódulo muestra características sospechosas o ha crecido, debe considerarse el realizar una PAAF12. La tiroiditis de Hashimoto puede presentarse con un patrón benigno clásico, de múltiples pequeños pseudo nódulos, relativamente hipoecogénicos, uniformemente distribuidos (Figura 23a y b), en una glándula aumentada de volumen, de superficie lobulada, hipoecogénica e hipervasularizada. Es frecuente encontrar adenopatías infratiroideas bilaterales de aspecto muy característico.
Estos patrones benignos son muy sensibles y específicos, por lo que la asociación con neoplasia maligna es muy baja o inexistente. Si en el estudio ecográfico se reconocen adecuadamente, la PAAF puede evitarse en aproximadamente un 60-67% de los nódulos con estas características8,19,20.
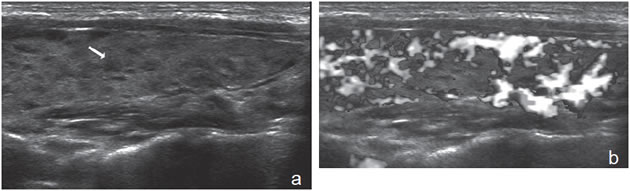 Figura 23. a) y b) Aspecto típico de tiroiditis de Hashimoto con múltiples pseudo-nódulos hipoecogénicos (flecha) y aumento de la vascularización
del tejido.
Figura 23. a) y b) Aspecto típico de tiroiditis de Hashimoto con múltiples pseudo-nódulos hipoecogénicos (flecha) y aumento de la vascularización
del tejido.
Patrones típicos de nódulos malignos
Un nódulo sólido, único, hipoecogénico, no encapsulado, con microcalcificaciones y vascularización intranodular corresponde con alta probabilidad a un carcinoma papilar (Figura 8). Este es un patrón clásico de malignidad y los signos pueden estar en diferentes proporciones o aparecer otros adicionales.
La mayoría de los cánceres papilares11,13 son hipoecogénicos (63%-90%) pero la hipoecogenicidad por sí sola no es un signo especifico, por lo que es importante que estén presentes otros hallazgos, especialmente microcalcificaciones (Figura 24). Las microcalcificaciones si están agrupadas pueden producir una sombra acústica y no deben confundirse con calcificaciones granulares gruesas (Figura 25).
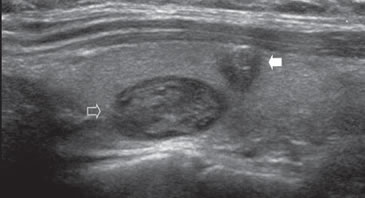 Figura 24. Comparación entre un nódulo coloideo de aspecto espongiforme
(flecha abierta) con un carcinoma papilar (flecha) hipoecogénico
de bordes infiltrativos con micro y macrocalcificaciones,
de forma más alta que ancha.
Figura 24. Comparación entre un nódulo coloideo de aspecto espongiforme
(flecha abierta) con un carcinoma papilar (flecha) hipoecogénico
de bordes infiltrativos con micro y macrocalcificaciones,
de forma más alta que ancha.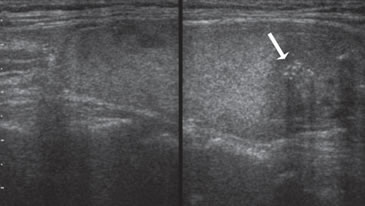 Figura 25. Cáncer papilar de forma ovoidea, isoecogénico, con
áreas hipoecogénicas excéntricas, que muestra un grupo de microcalcificaciones
(flecha), que determinan sombra acústica.
Figura 25. Cáncer papilar de forma ovoidea, isoecogénico, con
áreas hipoecogénicas excéntricas, que muestra un grupo de microcalcificaciones
(flecha), que determinan sombra acústica.Otro patrón muy sugerente de malignidad es el de un nódulo sólido, hipoecogénico con calcificaciones gruesas, agrupadas en el centro del nódulo, frecuente de ver en el carcinoma papilar (Figura 8b, Figura 14a) y que también es una manifestación característica del carcinoma medular7, pero menos frecuente. Las calcificaciones tienden a ser más centrales que en el cáncer papilar y aparentemente están en relación a depósitos de amiloide. Las microcalcificaciones son mucho menos frecuentes que en el cáncer papilar.
Una o varias calcificaciones centrales también pueden verse en nódulos benignos, y la incidencia parece aumentar con la duración del bocio, pero generalmente no van acompañadas de otros signos de malignidad (Figura 26). Una gruesa calcificación periférica con sombra acústica neta es muy raro que se presente en una neoplasia maligna e indica en la práctica una lesión hiperplástica, que a lo largo del tiempo ha experimentado en forma repetida fenómenos de necrosis, fibrosis y hemorragia (Figura 27). En estos nódulos es prácticamente imposible realizar una PAAF debido a que es muy difícil lograr penetrar en la lesión con la aguja, y generalmente no se obtiene material celular para diagnóstico.
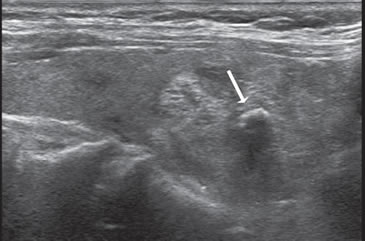 Figura 26. Nódulo coloideo, de bordes bien delimitados, no encapsulado,
de ecogenicidad heterogénea, que muestra una calcificación
central (flecha).
Figura 26. Nódulo coloideo, de bordes bien delimitados, no encapsulado,
de ecogenicidad heterogénea, que muestra una calcificación
central (flecha).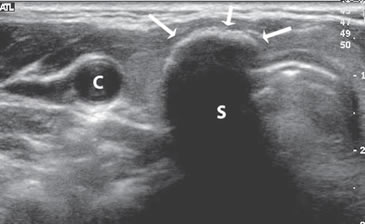 Figura 27. Nódulo coloideo calcificado (flecha) que muestra un
contorno ecogénico anterior y una sombra acústica neta. S: sombra
acústica C: carótida común derecha.
Figura 27. Nódulo coloideo calcificado (flecha) que muestra un
contorno ecogénico anterior y una sombra acústica neta. S: sombra
acústica C: carótida común derecha.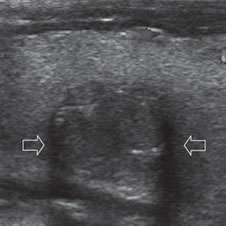
Figura 28. Cáncer papilar hipoecogénico con microcalcificaciones y una sombra por refracción bilateral, simétrica (flechas abiertas).
Un nódulo sólido, que en el borde muestra sombras por refracción es sospechoso de malignidad (Figura 28). Macroscópicamente, el cáncer papilar frecuentemente (56%) contiene abundante cantidad de tejido conectivo fibroso reactivo,particularmente en la periferia del tumor7. Es posible que esta reacción fibrótica sea la causante de la sombra refractiva, aunque esto no ha sido probado hasta el momento. La refracción ocurre cuando el haz de ultrasonido pasa por tejidos con diferente velocidad de propagación, lo que cambia la dirección de la onda ultrasónica. Esto causa una sombra en los bordes de la lesión que se proyecta hacia los planos profundos. Esta sombra por refracción también puede ocurrir en lesiones predominantemente quísticos, pero en el contexto de una lesión benigna no es preocupante (Figura 11).
Otro aspecto con muy alta probabilidad de malignidad21 es el de un nódulo sólido relativamente hipoecogénico, con margen mal definido e infiltrativo, con múltiples microcalcificaciones periféricas (Figura 29) y/o microcalcificaciones difusas que aumentan la ecogenicidad de la lesión (Figura 30).
La tiroiditis subaguda de De Quervain, inhabitualmente puede producir un área hipoecogénica que se confunde con una forma infiltrativa de cáncer papilar (Figura 31b), especialmente si no es dolorosa a la palpación y no hay sospecha clínica. Hay algunas lesiones benignas que también pueden mostrar un patrón similar al descrito, pero la mayor parte de las veces son marcadamente hipovascularizadas, a diferencia de la tiroiditis subaguda y el cáncer papilar (Figura 31b) que muestran vasos en la lesión.
En nódulos tiroideos con patrón maligno la PAAF es casi obligatoria, y el resultado del examen citológico debe interpretarse con cautela, de manera que si no hay debida correlación entre el aspecto del nódulo y los hallazgos citológicos, puede ser necesario repetir la PAAF o bien realizar una biopsia quirúrgica para un examen de la lesión completa.
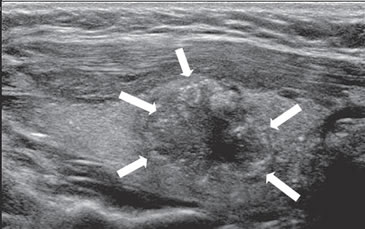 Figura 29. Cáncer papilar de bordes infiltrativos hipoecogénico con
múltiples microcalcificaciones en la zona periférica (flechas).
Figura 29. Cáncer papilar de bordes infiltrativos hipoecogénico con
múltiples microcalcificaciones en la zona periférica (flechas).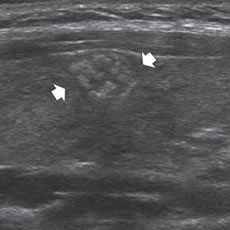
Figura 30. Cáncer papilar hiperecogénico (flechas), con abundantes microcalcificaciones.
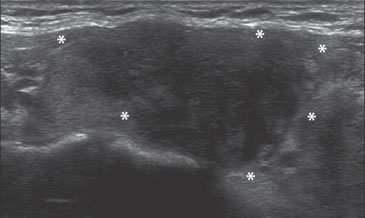 Figura 31. Área hipoecogénica en el lóbulo tiroideo aumentado de
volumen (asteriscos) que corresponde a un foco de tiroiditis de De
Quervain, que simula un tumor maligno.
Figura 31. Área hipoecogénica en el lóbulo tiroideo aumentado de
volumen (asteriscos) que corresponde a un foco de tiroiditis de De
Quervain, que simula un tumor maligno.
Patrón indeterminado o neoplásico
Son tumores sólidos, únicos, iso o hiperecogénicos, muy homogéneos, encapsulados, de contornos lisos, de forma ovoidea, sin microcalcificaciones (Figura 3b). En el 80% de los casos se puede observar un halo hipoecogénico. Ocasionalmente pueden ser discretamente hipoecogénicos. La vascularización habitualmente esta aumentada en la periferia con vasos que se descuelgan hacia el centro de la lesión (Figura 12). A diferencia de los nódulos coloideos generalmente no se observan imágenes quísticas (Figura 32).
En este grupo se encuentran principalmente las neoplasias foliculares benignas (adenomas) o malignas (carcinomas). Están compuestos de células foliculares o células de Hurthle en distinta proporción, y son encapsuladas. La mayoría (85%) corresponden a adenomas foliculares. Sin embargo, con el mismo patrón se puede presentar el carcinoma folicular bien diferenciado, aunque este suele ser de mayor tamaño, hipoecogénico, de contenido más heterogéneo, la capsula de mayor espesor (Figura 33a y b) y el aumento de la vascularización es difuso22. La presencia de calcificaciones intranodulares conlleva mayor riesgo de malignidad.
En la práctica, todos los nódulos con patrón neoplásico van a ir necesariamente a PAAF para poder determinar su etiología. De estos, al menos 50% van a ser benignos y entre 5%-15% van a ser carcinomas foliculares. Dentro de este grupo, un porcentaje menor va a corresponder a cáncer papilar variedad folicular21.
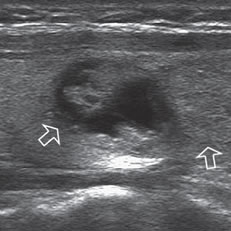
Figura 32. Comparación entre un nódulo coloideo y un adenoma (flechas abiertas), que estan contiguos. El nódulo coloideo muestra áreas quísticas y el adenoma aparece de ecogenicidad uniforme, bien encapsulado, isoecogénico con el parénquima tiroideo.
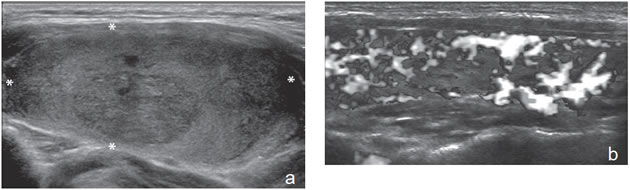 Figura 33. a) y b) Cáncer folicular de 45 mm (asteriscos), que muestra una ecogenicidad heterogénea con formación de nódulos dentro un
nódulo, y que tiene un patrón de vascularización aumentado difusamente y desorganizado.
Figura 33. a) y b) Cáncer folicular de 45 mm (asteriscos), que muestra una ecogenicidad heterogénea con formación de nódulos dentro un
nódulo, y que tiene un patrón de vascularización aumentado difusamente y desorganizado.
Perspectiva actual del uso de patrones ecográficos
Los nódulos tiroideos se originan de una gran variedad de procesos patológicos que incluyen enfermedades hiperplásticas, neoplásicas e inflamatorias. Todas estas patologías producen nódulos con una apariencia ecográfica de amplio espectro que obviamente se superponen unas con otras. Sin embargo, algunos patrones clásicos reflejan con bastante fidelidad la naturaleza de la lesión, y permite aproximarse al manejo de los nódulos tiroideos en una forma más racional, identificando principalmente los nódulos benignos, que por lejos constituyen la mayoría de las lesiones nodulares, y evitar el uso indiscriminado de la PAAF. Esta perspectiva ciertamente tiene que incluir no solamente el costo de no diagnosticar un cáncer, sino también el costo de manejar agresivamente una gran cantidad de nódulos que finalmente serán benignos.
Actualmente, el uso de la PAAF es necesario en el diagnóstico de los nódulos tiroideos14 que muestren un patrón neoplásico o maligno, o si el patrón es benigno, pero existe una condición clínica que aumente el riesgo de cáncer tiroideo, o bien experimenten un aumento inesperado de tamaño con o sin terapia supresiva con levotiroxina.
De los datos extraídos de las grandes series publicadas referente a este tema, la mayoría de los nódulos sometidos a una PAAF son benignos. La principal causa es el hecho de que muchos nódulos benignos se presentan con una o varias características ecográficas sospechosas. Un tercio de los nódulos coloideos simula la apariencia de nódulos neoplásicos o malignos21. A la inversa, algunos nódulos malignos ocasionalmente simulan las características de un nódulo benigno, especialmente si miden menos de 10 mm. Para reforzar estos conceptos es útil mostrar una galería de imágenes ecográficas que ilustre mejor el problema de los nódulos tiroideos con apariencia semejante pero de distinta etiología, los nódulos de la misma etiología con distinta apariencia, y que incluya el aspecto atípico del cáncer papilar del tiroides y el aspecto atípico de los nódulos coloideos.
Patrón indeterminado o neoplasia simple
En nódulos con esta apariencia la etiología es impredecible, y las posibles etiologías abarcan un espectro que va desde la hiperplasia folicular (Figura 34), hasta el cáncer papilar (Figura 35a y b) y el cáncer medular (Figura 36). La probabilidad de malignidad en estas lesiones varía entre 5% a 15% en distintas series7,19-21.
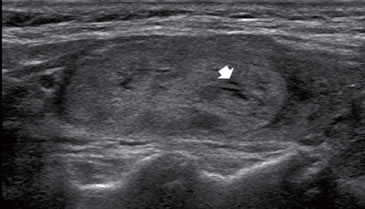 Figura 34. Nódulo isoecogénico, bien delimitado, que corresponde
a una hiperplasia folicular. La ecogenicidad no es bien homogénea
y muestra algunas áreas quísticas (flecha).
Figura 34. Nódulo isoecogénico, bien delimitado, que corresponde
a una hiperplasia folicular. La ecogenicidad no es bien homogénea
y muestra algunas áreas quísticas (flecha).
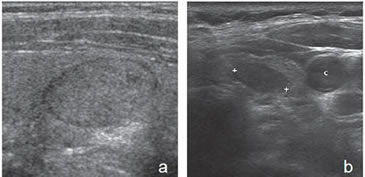
Figura 35. a) Cáncer papilar isoecogénico, uniforme, delimitado por un halo fino hipoecogénico, que simula un adenoma; b) Nódulo sólido, hipoecogénico, bien delimitado (entre marcas), que corresponde a un cáncer papilar variedad folicular. C: carótida común izquierda.
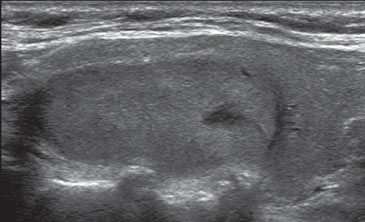 Figura 36. Cáncer medular, de forma ovoidea, de bordes bien delimitados,
de ecogenicidad relativamente uniforme, con un área
quística pequeña excéntrica, que simula una lesión folicular.
Figura 36. Cáncer medular, de forma ovoidea, de bordes bien delimitados,
de ecogenicidad relativamente uniforme, con un área
quística pequeña excéntrica, que simula una lesión folicular.
La PAAF no permite diferenciar con certeza entre hiperplasia o neoplasia folicular, ni tampoco una neoplasia folicular benigna de una neoplasia folicular maligna bien diferenciada; por ello los citopatólogos han acuñado el término “lesión folicular”, como alternativa al de neoplasia folicular ya que el término “neoplasia” puede malinterpretarse como lesión maligna. Frecuentemente es necesario recurrir a una biopsia quirúrgica, debido a que la diferencia está en observar invasión capsular o vascular, característica del cáncer folicular, para lo cual es necesario examinar histológicamente todo el contorno de la lesión. Mientras mayor es el tamaño de la neoplasia folicular mayor es la probabilidad de malignidad.
En contraste con las neoplasias foliculares, la hiperplasia folicular es la causa más común de nódulos tiroideos, que tienden a ser menos encapsulados, por lo que sus contornos se mezclan con el tejido tiroideo adyacente, y con mayor frecuencia tienen elementos quísticos en el espesor del tejido nodular. Sin embargo, un número no despreciable de nódulos hiperplásticos benignos pueden aparecer con un aspecto muy similar al de un adenoma, y simularlo patológica y ecográficamente.
No es posible diferenciar ecográficamente los subtipos patológicos de adenoma como son el macrofolicular, el microfolicular y el de células de Hurthle.
Ocasionalmente la PAAF de un nódulo con aspecto típico de lesión folicular en la ecografía va a ser interpretada como carcinoma papilar. Esto se debe a una forma de neoplasia que se conoce como variante folicular del cáncer papilar (Figura 35). Esta variante, es a menudo encapsulada y está compuesta casi enteramente por folículos.
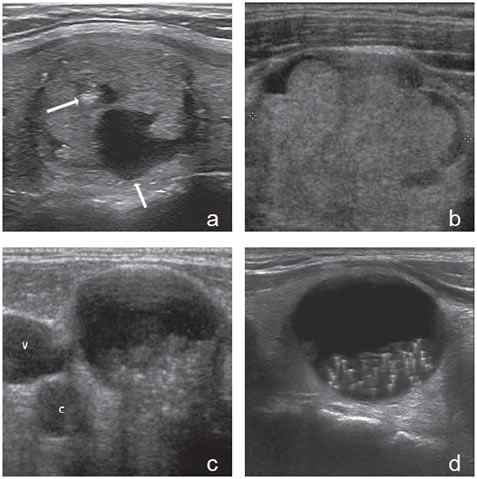
Cáncer papilar quístico
Los cánceres papilares pueden presentarse ecográficamente con un patrón sólido-quístico que puede confundirse con un nódulo coloideo23, pero es raro que los carcinomas tengan un componente quístico significativo de más de un 50%, y casi invariablemente tienen además tienen otros hallazgos ecográficos sospechosos que son evidentes en el componente sólido, principalmente microcalcificaciones, forma esférica y expansiva, una cápsula gruesa y vascularización patológica (Figura 37a). De utilidad es también el hallazgo de adenopatías cervicales ipsilaterales y signos de invasión capsular.
La presencia de una masa lobulada intraquística es otra presentación del cáncer papilar quístico. El componente sólido habitualmente tiene microcalcificaciones y el contorno del nódulo se borra en el sitio de implante del tumor (Figura 37b). Existen formas quísticas que son muy parecidas a la de un nódulo coloideo mixto, debido a que predomina el componente quístico, de manera que la parte sólida se ubica excéntricamente en la cavidad del quiste (Figura 37c) y las microcalcificaciones pueden simular focos hiperecogénicos propios del coloide (Figura 37d).
Patrón atípico del cáncer papilar
La apariencia más común del cáncer papilar es un nódulo sólido, único, hipoecogénico, no encapsulado, con microcalcificaciones y vascularización interna.
La variedad folicular del cáncer papilar puede aparecer muy semejante a una neoplasia folicular, pero la presencia de microcalcificaciones difusas orienta a esta variedad (Figura 38). Se ha descrito un patrón casi patognomónico de esta variante, que es un nódulo sólido, encapsulado, hipervascularizado, que se caracteriza por la presencia de áreas hipoecogénicas e hiperecogénicas que le dan un “aspecto en mosaico”.
Ocasionalmente se presenta con un aspecto muy similar al de un nódulo coloideo, no encapsulado en que no se distinguen fácilmente las microcalcificaciones de los focos hiperecogénicos por coloide espeso, cuando no aparece el artefacto en cola de cometa característico que define a estos últimos (Figura 39a y b).
En la tiroiditis de Hashimoto el cáncer papilar puede presentarse en forma similar a un nódulo benigno, pero la ecogenicidad es algo más heterogénea, la capsula es de espesor variable y los márgenes mal delimitados (Figura 40).
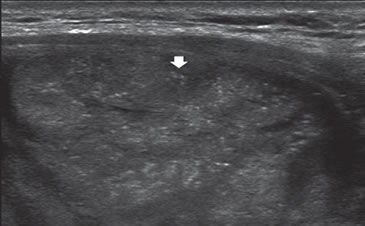 Figura 38. Cáncer papilar (asteriscos), que muestra un patrón similar
a una lesión folicular, pero con innumerables microcalcificaciones
(flecha).
Figura 38. Cáncer papilar (asteriscos), que muestra un patrón similar
a una lesión folicular, pero con innumerables microcalcificaciones
(flecha). 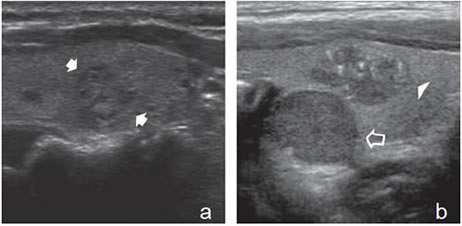
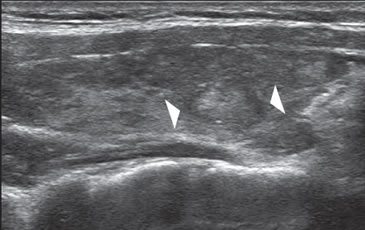 Figura 40. Cáncer papilar en un paciente con tiroiditis de Hashimoto
(cabezas de flechas). La lesión es hiperecogénica con respecto
al parénquima tiroideo que es hipoecogénico, y tiene una cápsula
gruesa (cabeza de flecha). Nódulo coloideo hipocogénico, que
muestra áreas en el centro, que simula una lesión maligna.
Figura 40. Cáncer papilar en un paciente con tiroiditis de Hashimoto
(cabezas de flechas). La lesión es hiperecogénica con respecto
al parénquima tiroideo que es hipoecogénico, y tiene una cápsula
gruesa (cabeza de flecha). Nódulo coloideo hipocogénico, que
muestra áreas en el centro, que simula una lesión maligna.
Patrón atípico de nódulos coloideos
Hasta un 30% de los nódulos coloideos pueden mostrar un aspecto similar al de las neoplasias, ya sea con un patrón maligno, un patrón intermedio o un patrón neoplásico.
Con menos frecuencia, un nódulo coloideo puede apare cer muy hipoecogénico, con calcificaciones granulares, con o sin sombra acústica, de contornos lobulados y avascular (Figura 41a y b). Se piensa que es el remanente de un quiste coloideo, compuesto por coloide deshidratado, tejido fibroso y calcio, que ha involucionado espontáneamente o se ha aspirado. Ocasionalmente pueden tener vasos intralesionales, y simular del todo un nódulo maligno. La comparación con exámenes anteriores puede ayudar a resolver parcialmente el problema, si se evidencia en estudios previos un nódulo coloideo típico en el mismo sitio. Por otra parte, un nódulo coloideo puede verse hiperecogénico y simular un cáncer papilar con abundantes microcalcificaciones (Figura 41c).
Puede presentarse con un patrón más confuso, con algunos signos menos específicos de malignidad, no siendo posible precisar ecográficamente su naturaleza (Figura 42a, b y c) o bien con una apariencia muy semejante al de una lesión folicular (Figura 43 a y b).
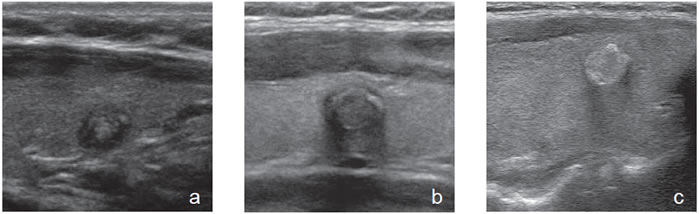 Figura 41. a) Nódulo coloideo de aspecto atípico; b) Nódulo coloideo con signos de involución, que aparece hipoecogénico y calcificado;
c) Nódulo hiperecogénico discretamente lobulado, que determina sombra acústica, y que simula ser un cáncer papilar con microcalcificaciones
difusas.
Figura 41. a) Nódulo coloideo de aspecto atípico; b) Nódulo coloideo con signos de involución, que aparece hipoecogénico y calcificado;
c) Nódulo hiperecogénico discretamente lobulado, que determina sombra acústica, y que simula ser un cáncer papilar con microcalcificaciones
difusas. 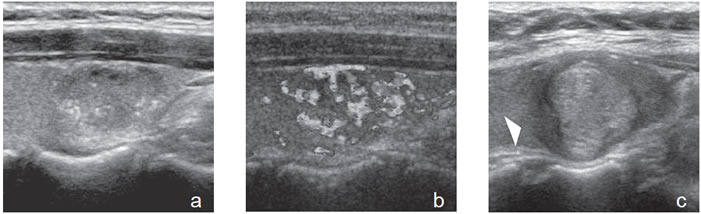 Figura 42. a) y b) Nódulo coloideo con áreas iso e hipoecogénicas, no encapsulado, hipervascularizado, con múltiples focos puntiformes,
difícil de diferenciar de microcalcificaciones; c) Nódulo coloideo, hiperecogénico, relativamente uniforme, cápsula hipoecogénica (cabeza
de flecha).
Figura 42. a) y b) Nódulo coloideo con áreas iso e hipoecogénicas, no encapsulado, hipervascularizado, con múltiples focos puntiformes,
difícil de diferenciar de microcalcificaciones; c) Nódulo coloideo, hiperecogénico, relativamente uniforme, cápsula hipoecogénica (cabeza
de flecha).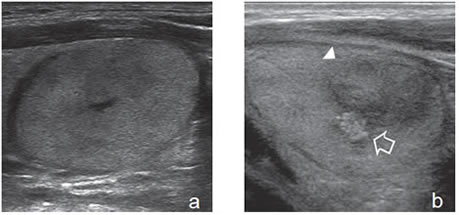
Figura 43. a) Nódulo coloideo, isoecogénico, encapsulado que simula una lesión folicular; b) Nódulo coloideo bien delimitado por un fino halo hipoecogénico, que muestra un nódulo hipoecogénico excéntrico (cabeza de flecha) y un foco que simula microcalcificaciones y que corresponde a coloide espeso (flecha abierta).
Patrones semejantes de distinta etiología
En un 15 a 20% de los casos la apariencia de los nódulos benignos y malignos es muy parecida, y prácticamente imposible de diferenciar, de manera que es inevitable recurrir a la PAAF (Figura 44). Muy excepcionalmente un nódulo con un patrón clásico de benignidad resultará ser un cáncer papilar (Figura 45a, b, c y d). En estos casos la única clave puede ser la presencia de adenopatías, motivo por el cual la exploración del cuello debe ser completa.
 Figura 44. Nódulo coloideo, hipoecogénico,
en el polo inferior del lóbulo, de
bordes no encapsulados de ecogenicidad
heterogénea, sin microcalcificaciones.
Figura 44. Nódulo coloideo, hipoecogénico,
en el polo inferior del lóbulo, de
bordes no encapsulados de ecogenicidad
heterogénea, sin microcalcificaciones. 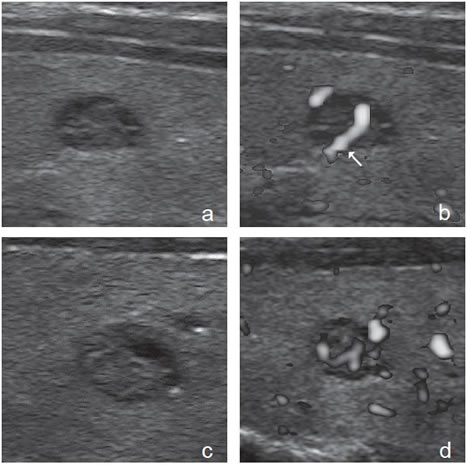 Figura 45. a) y b) Cáncer papilar que simula un
nódulo coloideo de apariencia benigna, que al
“doppler color” muestra un vaso penetrante (flecha);
c) y d) Nódulo coloideo de similares características
al de la figuras 45 a) y 45 b), que también
muestra vascularización central
Figura 45. a) y b) Cáncer papilar que simula un
nódulo coloideo de apariencia benigna, que al
“doppler color” muestra un vaso penetrante (flecha);
c) y d) Nódulo coloideo de similares características
al de la figuras 45 a) y 45 b), que también
muestra vascularización central Por último, existe una variedad de cáncer papilar esclerosante, que no se presenta como un nódulo, sino como un aumento de tamaño difuso de la glándula, con una estructura gruesa, heterogénea, hipoecogénica con abundantes microcalcificaciones difusas (Figura 46a y b). Es frecuente el compromiso metastático de los linfonodos cervicales y ocurre en pacientes jóvenes24.
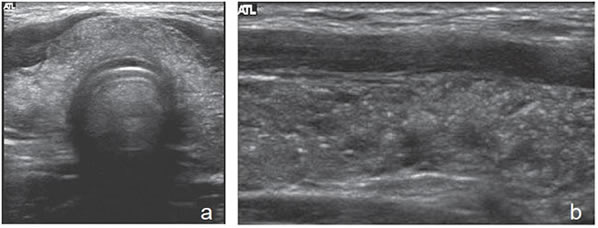 Figura 46. a) y b) Cáncer
papilar esclerosante. Aumento
de volumen generalizado
de la glándula
con extensas microcalcificaciones
difusas.
Figura 46. a) y b) Cáncer
papilar esclerosante. Aumento
de volumen generalizado
de la glándula
con extensas microcalcificaciones
difusas.
En resumen, la ecografía permite identificar un número importante de nódulos que tienen un patrón característicamente benigno. Es por esto, que se hace tan necesario familiarizarse con el aspecto de estos nódulos, que por lo demás son los más frecuentemente encontrados, y en los que sólo se necesita seguimiento ecográfico.
Los nódulos benignos crecen aproximadamente 15% al año, y los nódulos bajo terapia supresiva con levotiroxina crecen en menor porcentaje25.
Si hay factores de riesgo asociados, o hallazgos clínicos relevantes de malignidad, el uso de estos patrones debe usarse con cautela en la toma de decisiones.
Las microcalcificaciones es el signo más específico de malignidad. La calcificación anular de un nódulo tiroideo en “cáscara de huevo”, considerada como signo de benignidad, puede ocurrir excepcionalmente en neoplasias malignas25.
Prácticamente todos los nódulos con patrón neoplásico y maligno necesitan de una PAAF bajo visión ecográfica para precisar el diagnóstico, ya que es la técnica preoperatoria más confiable en el estudio del nódulo tiroideo.
La búsqueda de adenopatías cervicales características puede ser un hallazgo importante para dirimir sobre la benignidad o malignidad en un nódulo.
Referencias
- Brander AE, Viikinkoski VP, Nickels JI, Kivisaari LM. 2000. Importance of thyroid abnormalities detected at US screening: a 5-year follow-up. Radiology 215: 801-806.
- Mazzaferri EL. 2006. Managing small thyroid cancers. JAMA 295 (18): 2179-2182.
- Papini E, Guglielmi R, Bianchini A, Crescenzi A, Taccogna S, Nardi F, et al. 2002. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 87: 1941-1946.
- Frates MC, Benson CB, Charboneau JW, et al. 2005. Management of thyroid nodules detected at US: Society of Radiologists in Ultrasound consensus conference statement. Radiology 237: 794-800.
- Moon WJ, Jung SL, Lee JH, et al. 2008. Benign and malignant thyroid nodules: US differentiation - multicenter retrospective study. Radiology 247 (3): 762-770.
- Koike E, Noguchi S, Yamashita H, et al. 2001. Ultrasonographic characteristics of thyroid nodules: prediction of malignancy. Arch Surg 136: 334-337.
- Reading CC, Charboneau JW, Hay ID, et al. 2005. Sonography of thyroid nodules: a ‘‘classic pattern’’ diagnostic approach. Ultrasound Q 21: 157-165.
- Bonavita J, Mayo J, Babb J et al. 2009. Pattern recognition of benign nodules at ultrasound of the thyroid: which nodules can be left alone? AJR Am J Roentgenol 193: 207-213.
- Cooper DS, Doherty GM, Haugen BR, et al. 2006. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 16: 109-142.
- Gharib H, Papini E, Baskin H, et al. 2006. American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocr Pract 12: 63-78.
- Papini E, Guglielmi R, Bianchini A, 2002. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 87: 1941-1946.
- Fardella C, Jiménez M, González H, et al. 2005. Características de presentación del microcarcinoma papilar del tiroides: Experiencia retrospectiva de los últimos 12 años en la Pontificia Universidad Católica de Chile. Rev Med Chile 133: 1305-1310.
- Chan BK, Desser TS, McDougall IR, et al. 2003. Common and uncommon sonographic features of papillary thyroid carcinoma. J Ultrasound Med 22: 1083-1090.
- Iannuccilli JD, Cronan JJ, Monchik JM. 2004. Risk for malignancy of thyroid nodules asassessed by sonographic criteria: the need for biopsy. J Ultrasound Med 23: 1455-1464.
- Ahuja A, Chick W, King W, et al. 1996. Clinical significance of the comet-tail artifact in thyroid ultrasound. J Clin Ultrasound 24: 129-133.
- Kim EK, Park CS, Chung WY, et al. 2002. New sonographic criteria for recommending fine-needle aspiration biopsy of nonpalpable solid nodules of the thyroid. AJR Am J Roentgenol 178: 687-691.
- Yoon DY, Lee JW, Chang SK, et al. 2007. Peripheral calcification
in thyroid nodules. J Ultrasound Med 26: 1349-1355.
- Frates MC, Benson CB, Doubilet PM, et al. 2003. Can color Doppler sonography aid in the prediction of malignancy of thyroid nodules? J Ultrasound Med 22: 127-131.
- Horvath E, Majlis S, Rossi R, et al. 2009.An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab; 90 (5): 1748-1751.
- Domínguez JM, Baudraud R, Cerda J, Campusano C, Fardella C, et al. 2010. Ultra sound model to discriminate the risk of thyroid carcinoma. Academic Radiology (aceptado para publicación).
- Ahuja AT, Metreweli C. 2000. Ultrasound of thyroid nodules. Ultrasound Q 16: 111-121.
- Miyakawa M, Onoda N, Etoh M, Fukuda I, Takano K, Okamoto T, et al. 2005. Diagnosis of thyroid follicular carcinoma by the vascular pattern and velocimetric parameters using high resolution pulsed and power Doppler ultrasonography. Endocr J 52 (2): 207-212.
- Bellantone R, Lombardi CP, Raffaelli M, Traini E, De Crea C, Rossi ED, et al. 2004. Management of cystic or predominantly cystic thyroid nodules: the role of ultrasound-guided fine-needle aspiration biopsy. Thyroid 14 (1): 43-47.
- Lam AK, Lo CY. 2006. Diffuse sclerosing variant of papillary carcinoma of the thyroid: A 35-year comparative study at a single institution.Ann Surg Oncol 13: 176-181.
- Alexander EK, Hurwitz S, Heering JP, Benson CB, Frates MC, Doubilet PM, et al. 2003. Natural history of benign solid and cystic thyroid nodule Ann Intern Med 138 (4): 315-318.
- Park CH, Rothermel FJ, Judge DM. 1976. Unusual calcification in mixed papillary and follicular carcinoma of the thyroid gland. Radiology 119 (3): 554.